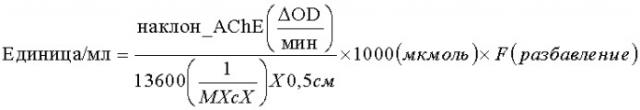Одноразовое устройство для культивирования и сбора растительной ткани и/или клеток, способ и система культивирования и сбора растительной ткани и/или растительных клеток
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии, в частности, для культивирования клеток/тканей, а также клеток растений. Одноразовое устройство для культивирования и сбора растительной ткани и/или клеток содержит нежесткую емкость объемом не менее 400 л, имеющую каналы газообмена и канал сбора. Устройство выполнено с возможностью использования непрерывно в течение по меньшей мере двух последовательных циклов культивирования/сбора при значении или диапазона значений параметров, выбираемых по меньшей мере из одних следующих значений или диапазонов значений: отношение высоты к объему приблизительно от 0,06 до 1 см/л; давление газа на входе приблизительно от 1 бар до 5 бар; плотность газовых входов на площадь поперечного сечения приблизительно от 20 входов на кв.м до 70 входов на кв.м; скорость аэрации на входе приблизительно от 0,05 до 0,12 объема газа на объем среды в минуту; объем пузыря газа на входе приблизительно от 20 куб.мм до 1800 куб.мм. В способе и системе культивирования и сбора растительной ткани и/или растительных клеток использовано одноразовое устройство. Изобретения позволяют обеспечить повышенный выход целевого продукта при одновременном снижении стоимости. 3 н. и 18 з.п. ф-лы, 7 табл., 17 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к большому одноразовому биореактору для культивирования клеток/тканей и, в частности, к большому биореактору для культивирования клеток растений.
УРОВЕНЬ ТЕХНИКИ
Культуры клеток и тканей обычно используют для коммерческого производства различных соединений, включая, например, гормоны, ферменты, белки, антигены, пищевые добавки и натуральные пестициды.
Технология, в настоящее время используемая для производства культур клеток и/или тканей в промышленном масштабе, основана на повторном использовании биореакторных систем из стекла или нержавеющей стали, которые требуют больших расходов на создание и техническое обслуживание. Такие биореакторные системы требуют очистки и дезинфекции после производства каждой партии и более интенсивной очистки при замене продукта из-за необходимости дорогостоящего и затратного по времени подтверждения чистоты и присутствия остатка чистящего агента после очистки.
Кроме того, эти типы промышленных биореакторных систем используют сложные и дорогостоящие технологии смешивания, например мешалками с дорогостоящими и сложными стерильными уплотнениями; некоторые дорогостоящие биореакторы содержат сложную эрлифтную конструкцию, предназначенную для перемешивания и насыщения газом среды посредством подачи газа в биореактор. Однако давление газа, размер пузырей и создание нежелательных сдвиговых сил в среде обуславливают необходимость применения сложных технологий аэрации. Кроме того, такие биореакторы разработаны по пиковому объему, который необходим в данное время. Таким образом возникают проблемы при переходе от пилотного биореактора к большому биореактору, или когда возникает необходимость увеличить объем производства до величины, превышающей вместимость существующих биореакторов. Текущая альтернатива большому биореактору заключается в объединении некоторого количества небольших модульных биореакторов из стекла или нержавеющей стали, совокупный объем которых соответствует требованиям, и при некоторой степени гибкости для увеличения или уменьшения совокупной вместимости. Однако использование нескольких небольших биореакторов увеличивает стоимость установки и время технического обслуживания, и таким образом использование нескольких небольших биореакторов требует больше расходов и трудозатрат, чем использование одного более вместительного биореактора. Из-за этих ограничений культивирование клеток растений в известных биореакторах приводит к относительно дорогостоящим извлекаемым продуктам, включая как вторичные метаболиты, так и рекомбинантные белки, которые не могут конкурировать в продаже с такими же продуктами, полученными с использованием альтернативных производственных систем.
В настоящее время единственным фармацевтическим веществом из рекомбинантного белка на основе культуры, производимым в биореакторах из клеток растений, является коммерческая противовирусная вакцина для использования ветеринарами при лечении атипичной чумы птиц. Кроме этой вакцины в настоящее время существуют только немного продуктов из вторичных метаболитов, производимых из культур клеток в биореакторах, например, растительные метаболиты паклитаксел (Таксол) и Шиконин.
В коммерческом масштабе в биореакторных системах традиционно используют камеры роста с постоянными или полупостоянными условиями. Хотя из уровня техники широко известны одноразовые камеры роста, их обычно используют для мелкомасштабного производства, например при домашнем пивоварении и при лабораторных экспериментах. В небольших биореакторах обычно используется одноразовый мешок, который может быть использован в лабораторных условиях.
Также были предложены одноразовые биореакторы, подходящие для использования при повышенных объемах. Требования к перемешиванию и аэрации питательной среды, которые становятся все более жесткими с увеличением объема реактора, решены различными способами в известных системах. Компании Applikon Biotechnology (Нидерланды) и Stedim Inc. (Франция) предлагают одноразовую биореакторную систему Appliflex®, в которой используются 50-литровые гибкие мешки для культур, которые рассчитаны на размещение на моторизованной платформе, которая покачивает мешок для обеспечения аэрации и перемешивания питательной среды. Сходный одноразовый биореактор предлагается компанией Wave Biotech, LLD (Сомерсет, штат Нью-Джерси, США), в котором используются мешки для культур объемом до 1000 л, которые также аэрируются и перемешиваются с помощью моторизованной платформы. Компания Ну-clone Inc. (Логан, штат Юта, США) в сотрудничестве с компанией Baxter Biosciences предлагает одноразовый мешок для культуры (одноразовый биореактор "SUB"), предназначенный для культуры животных клеток объемом до 250 л, который предназначен для модернизации биореакторных сосудов из нержавеющей стали. Аэрация и перемешивание обеспечиваются неодноразовым лопастным рабочим колесом, прикрепленным к сложному приводному устройству, введенному мешок с культурой. В патентной заявке США №2005/0272146 на имя Ходжа и др. (Hodge et al.) раскрыт одноразовый биореактор вместимостью 150 л, имеющий лопастное рабочее колесо или другое механическое средство для перемешивания. Еще один тип одноразового биореактора имеет U-образный мешок и устройство, подобное крану, для перемешивания и аэрации питательной среды посредством возвратно-поступательного подъема сторон. Еще одно техническое решение основано на находящемся под давлением обруча, окружающего гибкий мешок с культурой, который надувается и сдувается через регулярные интервалы времени, обеспечивая перемешивающее движение сжимающего типа.
Во всех вышеупомянутых системах системы опоры и аэрации/перемешивания сложные, дорогостоящие, узконаправленные и ограниченные по мощности. Так, хотя сам реакторный сосуд может быть одноразовым, использование этих систем требует дорогостоящей наладки и технического обслуживания.
Также были предложены одноразовые биореакторные устройства, в которых для перемешивания и аэрации культуры используется воздух, но проблема заключается в адаптации аэрации и перемешивания воздушными пузырями к большим объемам. Многие биореакторы меньшего объема обеспечивают достаточную аэрацию при одном входе для газа и рассекателе или другом типе диффузора для пузырей газа (см., например, биореактор «Зета» (Zeta), предлагаемый компанией Osmotec, Израиль (Agritech Israel, выпуск №1, Осень 1997 г., стр.19)). Одним недостатком таких систем является то, что аэрация осуществляется путем введения очень мелких пузырей воздуха (от диффузора), что приводит к повреждению клеток, особенно в случае культур клеток растений, которые особенно чувствительны к сдвиговым силам.
Белки для использования в фармацевтике традиционно производят в системах экспрессии животных клеток или бактерий. Однако из-за относительной простоты внедрения генов в растения и клетки растений для массового производства белков и пептидов с использованием, например, систем молекулярной биологии растений, таких как способ Agrobacterium, технология клеток растений становится все более популярной как альтернативная система экспрессии белков (Ма, J. K. С., Drake, P.M.W., and Christou, P. (2003) Nature reviews 4, 794-805).
Культура клеток растений отличается от культуры клеток бактерий или млекопитающих не только требованиями к метаболизму, но и как функция исключительной хрупкости в общем крупных клеток растений при сдвиговых силах, возникающих в традиционном промышленном биореакторе. Так, с одной стороны, важно обеспечивать адекватное перемешивание культур клеток растений, чтобы добиться достаточной аэрации всех аспектов культуры клеток растений, а с другой стороны, это необходимо делать с учетом хрупких клеток растений, выращенных на культуре.
Таким образом, существует постоянная потребность в усовершенствовании существующих систем и устройств для одноразовой культуры клеток/тканей, чтобы получить повышенный выход при улучшенном качестве продукта, а также повысить эффективность по стоимости. Настоящее изобретение предлагает одноразовый биореактор большого объема, но с функцией повторного использования, эффективный при использовании с различными клетками и культурами клеток для производства рекомбинантного белка, которое решает задачи, относящиеся к увеличению объема одноразового реактора.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно одному аспекту настоящего изобретения предложено одноразовое устройство для культивирования и сбора растительной ткани и/или клеток, которое содержит нежесткую емкость, имеющую объем по меньшей мере 400 л и снабженную каналами для газообмена и каналом для сбора, позволяющими использовать это устройство непрерывно в течение по меньшей мере двух последовательных циклов культивирования/сбора, причем устройство рассчитано и выполнено так, чтобы сохранять насыщение кислородом и сдвиговые силы, подходящие для культивирования растительной ткани и/или клеток.
Согласно другому аспекту настоящего изобретения предложен способ культивирования и сбора растительной ткани и/или растительных клеток в объеме больше 400 л, причем этот способ включает: (а) предоставление одноразовой нежесткой емкости, имеющей объем по меньшей мере 400 л и снабженной каналами для газообмена и каналом для сбора, позволяющими использовать упомянутое устройство непрерывно в течение по меньшей мере двух последовательных циклов культивирования/сбора, причем устройство рассчитано и выполнено так, чтобы сохранять насыщение кислородом и сдвиговые силы, подходящие для культивирования растительной ткани и/или клеток; (b) подачу инокулянта через упомянутый канал для сбора; (с) предоставление стерильной питательной среды и/или стерильных добавок; (d) по желанию, освещение упомянутой емкости наружным источником света и (е) выращивания упомянутых клеток и/или ткани в упомянутой среде до требуемого объема выхода. Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, насыщение кислородом и сдвиговые силы, подходящие для культивирования растительной ткани и/или клеток, поддерживаются сочетанием значений или диапазонов значений следующих параметров:
a) отношение высоты к объему;
b) давление газа на входе;
c) плотность газовых входов на площадь поперечного сечения;
d) скорость аэрации на входе и
e) объем пузырей газа на входе.
Согласно другому аспекту настоящего изобретения предложена система культивирования растительных клеток, включающая одноразовое устройство для культивирования и сбора растительной ткани и/или клеток и питательную среду для культивирования упомянутой растительной ткани и/или клеток.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, система, кроме того, включает суспензию растительных клеток или культуру ткани, выращиваемую на упомянутой среде.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, культура растительных клеток содержит растительные клетки, полученные из корня растения.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, растительные клетки выбирают из группы, состоящей из клеток корня, клеток сельдерея, клеток имбиря, клеток хрена и клеток моркови, трансформированных Agrobacterium rihzogenes.
Согласно другим признакам некоторых вариантов осуществления настоящего изобретения, растительными клетками являются клетки табака, более предпочтительно клетками Nicotiana tabaccum.
Согласно другим признакам некоторых вариантов осуществления настоящего изобретения, клетки табака экспрессируют человеческую рекомбинантную ацетилхолинэстеразу. Человеческой рекомбинантной ацетилхолинэстеразой может быть ацетилхолинэстераза-R. Ацетилхолинэстераза-R может иметь аминокислотную последовательность SEQ ID NO: 9.
Согласно другим признакам некоторых вариантов осуществления настоящего изобретения клетки табака содержат последовательность нуклеиновой кислоты SEQ ID NO: 9, кодирующую полипептид.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, значения или диапазон значений параметров выбирают по меньшей мере из одного из следующих значений или диапазонов значений:
a) отношение высоты к объему: приблизительно 0,06-1 см/л;
b) давление газа на входе: приблизительно 1-5 бар;
c) плотность газовых входов на площадь поперечного сечения: приблизительно 20-70 входов на кв. метр;
d) скорость аэрации на входе: приблизительно 0,05-0,12 объемов газа на объем среды в минуту;
e) объем пузырей газа на входе: приблизительно 20-1800 куб. мм.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, насыщение кислородом составляет по меньшей мере 15% объема на объем в жидкости, содержащейся в емкости.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, указанным сочетанием является отношение высоты к объему приблизительно от 0,06 до 1 см/л и давление газа на входе приблизительно от 1 до 5 бар.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетанием является отношение высоты к объему приблизительно от 0,06 до 1 см/л и плотность газовых входов на площадь поперечного сечения приблизительно от 20 входов на кв. м до 70 входов на кв. м.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетанием является отношение высоты к объему приблизительно от 0,06 до 1 см/л и скорость аэрации на входе приблизительно от 0,05 до 0,12 объемов газа на объем среды в минуту.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетанием является отношение высоты к объему приблизительно от 0,06 до 1 см/л и объем пузырей газа на входе приблизительно от 20 куб. мм до 1800 куб. мм.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже сочетание кроме того имеет параметр объема пузырей газа на входе приблизительно от 20 куб. мм до 1800 куб. мм.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетание, кроме того, имеет параметр давления газа на входе приблизительно от 1 до 5 бар.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетание, кроме того, имеет параметр плотности газовых входов на площадь поперечного сечения приблизительно от 20 входов на кв. м до 70 входов на кв. м.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетание, кроме того, имеет параметр скорости аэрации на входе приблизительно от 0,05 до 0,12 объемов газа на объем среды в минуту.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетание включает отношение высоты к объему приблизительно от 0,06 до 1 см/л, давление газа на входе приблизительно от 1 бар до 5 бар, плотность газовых входов на площадь поперечного сечения приблизительно от 20 входов на кв. м до 70 входов на кв. м и объем пузырей газа на входе приблизительно от 20 мм до 1800 куб. мм.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетанием является отношение высоты к объему приблизительно от 0,06 до 1 см/л, давление газа на входе приблизительно от 1 бар до 5 бар, плотность газовых входов на площадь поперечного сечения приблизительно от 20 входов на кв. м до 70 входов на кв. м, скорость аэрации на входе приблизительно от 0,05 до 0,12 объемов газа на объем среды в минуту и объем пузырей газа на входе приблизительно от 20 куб. мм до 1800 куб. мм.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, отношение высоты к объему составляет приблизительно от 0,1 см/л до 0,5 см/л.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже отношение высоты к объему составляет приблизительно 0,44 см/л.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, давление газа на входе составляет приблизительно от 1,5 бар до 4 бар.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, давление газа на входе составляет приблизительно от 1,5 бар до 2,5 бар.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, плотность газовых входов на площадь поперечного сечения составляет приблизительно от 40 на 1 кв. м до 60 на 1 кв. м.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, плотность газовых входов на площадь поперечного сечения составляет 55 на 1 кв. м.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, расход газа при барботаже составляет приблизительно от 20 л/мин до 50 л/мин, более предпочтительно 30 л/мин.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, объем пузырей газа на входе составляет приблизительно 300 куб. мм.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, одноразовая емкость является прозрачной.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, емкость изготовлена из материала, выбираемого из группы, состоящей из полиэтилена, поликарбоната, сополимера полиэтилена и нейлона, ПВХ и ЭВА.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, емкость изготовлена из ламината, содержащего более одного слоя упомянутых материалов.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, устройство, кроме того, содержит опорную конструкцию для поддержки упомянутого устройства.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, опорная конструкция содержит жесткую цилиндрическую раму, имеющую коническое основание.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, канал сбора расположен на днище емкости.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, упомянутый канал сбора расположен рядом с днищем емкости так, что в конце каждого цикла сбора остатки среды, содержащей клетки и/или ткань, автоматически остается на днище емкости до уровня, ниже уровня устройства сбора.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, упомянутое днище является в сущности коническим.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, упомянутое днище имеет форму усеченного конуса.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, емкость имеет внутренний наполняемый объем приблизительно от 400 л до 30000 л, предпочтительно от 500 л до 8000 л и наиболее предпочтительно около 1000 л.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, способ, кроме того, включает проверку на загрязняющие вещества и/или проверку качества клеток/тканей, которые произведены в упомянутой емкости.
Если найдены загрязнители, или если клетки/ткани имеют невысокое качество, устройство и его содержимое утилизируют; если загрязнители не найдены, осуществляют сбор части среды, содержащей клетки и/или ткань.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, при сборе упомянутой части в емкости оставляют остаток среды, содержащей клетки и/или ткань, причем упомянутый остаток среды служит в качестве инокулянта для следующего цикла культивирования/сбора.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, способ, кроме того, включает: предоставление стерильной питательной среды и/или стерильных добавок для следующего цикла культивирования/сбора и повтор цикла выращивания до тех пор, пока не будут найдены загрязняющие вещества, или пока производимые клетки/ткани не будут иметь плохое качество, после чего устройство и его содержимое утилизируют.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, стерильный воздух подают через упомянутые каналы газообмена непрерывно в течение по меньшей мере одного цикла культивирования/сбора.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, стерильный воздух подают через некоторое количество газовых входов импульсами в течение по меньшей мере одного цикла культивирования/сбора.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, устройство не имеет механических средств для перемешивания и аэрации питательной среды.
Настоящее изобретение успешно решает недостатки известных конфигураций путем обеспечения большого объема, одноразового биореактора, но с возможностью повторного использования, эффективного для работы с различными культурами клеток для производства рекомбинантного белка, а также предлагает способы и системы его использования.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Теперь изобретение будет описано только для примера со ссылками на прилагаемые чертежи. При конкретной ссылке на подробные чертежи подчеркивается, что приведенные данные показаны только для примера и для иллюстративного описания предпочтительных вариантов осуществления настоящего изобретения, и представлены таким образом, который считается наиболее полезным и легко понятным описанием принципов и концептуальных аспектов изобретения. В этой связи не делается попыток показать конструктивные детали изобретения более подробно, чем это необходимо для базового понимания изобретения, причем такое описание, взятое вместе с чертежами, делает понятным для специалистов в данной области, как несколько форм изобретения могут быть осуществлены на практике.
На чертежах:
на ФИГ.1 показаны основные компоненты иллюстративного варианта осуществления устройства настоящего изобретения в поперечном разрезе;
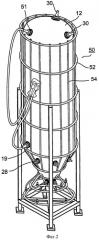
на ФИГ.2 показан вид спереди основных компонентов иллюстративного варианта осуществления устройства настоящего изобретения и иллюстративной опорной конструкции;
на ФИГ.3 показана гистограмма превосходного насыщения кислородом культур растительных клеток при использовании большого одноразового биореактора. Клетки моркови инокулировали в питательные среды в биореакторы разного объема: колбы Эрленмейера (синие колонки), 10-литровые реакторы (РХ-10, красные колонки); 100-литровые реакторы (РХ-100, белые колонки) и 400-литровые реакторы (РХ-400, оранжевые колонки) и культивировали в течение 3-4 суток при оптимальных условиях для каждой системы (см. раздел "Материалы и способы" ниже). Каждый реактор оснащен стерильным кремниевым чипом [(каталожный номер SFPST3YOPSUP (компания Presens Presision Sensing GmbH)] для определения насыщения O2 в указанные дни [O2 измеряли, используя Fibox 3 (компания Presens Presision Sensing GmbH)]. Отметьте, превосходные уровни насыщения O2 в больших (РХ-100 и РХ-400) биореакторах;
на ФИГ.4 показана фотография вестернблоттинга производства рекомбинантной GCD с использованием большого одноразового биореактора. По 5 мкл проб сырых экстрактов культур клеток на 4 или 7 день взяли из биореакторов разного объема, подготовили как сказано ниже (см. раздел "Материалы и способы"), разделили электрофорезом в ПААГ, нанесли на нитроцеллюлозную блоттинг-мембрану и подвергли реакции со специфическим поликлональным антителом кролика против GCD. Полосы визуализировали с помощью хемилюминисцентного субстрата SuperSignal West Pico. Дорожка 1 - 10-литровый реактор с барботированием; Дорожка 2 - 10-литровый реактор с проходным отверстием 8 мм; Дорожка 3 - 10-литровый реактор с 100% кислорода, добавленного с дня 4; Дорожки 4 и 5 - 400-литровый реактор, день 4; Дорожка 6 - 400-литровый реактор, день 7; Дорожки 7 и 8 - 100-литровый реактор, день 7; Дорожки 9 и 10 - prGCD стандарт 25 нг. Отметьте значительный выход GCD в большом одноразовом биореакторе по сравнению с 10- и 100-литровыми реакторами;
на ФИГ.5а-5b показаны результаты обращенно-фазной хроматографии (ОФХ), показывающие устранение Antifoam-C с использованием ионообменной хроматографии. 0,075% эмульсию Antifoam С (Dow Corning®, Корнинг, штат Нью-Йорк) загрузили в 15-мл катионообменную колонку (компания Bio Rad, США), и пробы протекающего, промывочного и солево-градиентного элюата (0,2 М NaCl; 1,2 М NaCl и 12% EtOH в 1,2 М NaCl) контролировали при 262 нм для детектирования Antifoam-C. На Фиг.5а показано детектирование Antifoam-C в растворе, загруженном в колонку. На Фиг.5b показано детектирование Antifoam-C при протекании через колонку. Отметьте отсутствие удерживания Antifoam-C в колонке;
на ФИГ.6 показаны результаты анализа в ДСН-ПААГ, показывающие идентичность GCD, произведенной в больших одноразовых биореакторах. Пробы GCD из 400-литровых реакторов (Дорожка 1,10 мкг), 80-литровых реакторов (дорожки 2 и 3, 10 мкг и 20 мкг соответственно), и коммерчески приготовленный глюкоцереброзидазы Cerezyme® (10 нг и 20 нг) (дорожки 4 и 5, 10 мкг и 20 мкг соответственно) разделили в геле ДСН-ПААГ. Полосы визуализировали путем окрашивания кумасси бриллиантовым голубым. Дорожка 6 представляет маркеры молекулярной массы. Отметьте электрофорезную идентичность GCD из больших биореакторов, малых биореакторов и препарата коммерческой глюкоцереброзидазы;
на ФИГ.7 показаны результаты вестерн-блоттинга, показывающие идентичность GCD, произведенной в больших одноразовых биореакторах. Пробы GCD из 400-литровых реакторов (Дорожки 1 и 2, 50 нг и 100 нг соответственно), 80-литровых реакторов (дорожки 3 и 4, 50 нг и 100 нг соответственно) и коммерчески приготовленной глюкоцереброзидазы Cerezyme® (дорожки 5 и 6, 50 нг и 100 нг соответственно) разделили в ДСН-ПААГ, нанесли на нитроцеллюлозную блоттинг-мембрану и провели реакцию со специфическим поликлональным антителом кролика против GCD. Полосы визуализировали с помощью хемилюминисцентного субстрата SuperSignal West Pico. Отметьте электрофорезную и иммунологическую идентичность GCD из больших реакторов, малых реакторов и коммерческого препарата глюкоцереброзидазы Cerezyme®);
на ФИГ.8a-8d приведены графики, показывающие пептидное картирование (триптический гидролизат) глюкоцереброзидазы, полученной в больших одноразовых биореакторах. Пробы глюкоцереброзидазы, собранные из малых одноразовых биореакторов (80-литровых) и больших одноразовых биореакторов (400-литровых), гидролизовали с протеазой, отделяли в колонке Jupiter 4u Proteo 90A для ОФХ (Phenomenex, 00G-4396-E0) для получения "пептидной карты", и фрагменты контролировали при 214 нм и 280 нм. На Фиг.8а и 8b приведены профили глюкоцереброзидазы, полученной в 10-литровых биореакторах (8а, детектирование при 214 нм; 8b, детектирование при 280 нм). На Фиг.8c и 8d приведены профили глюкоцереброзидазы, полученной в 400-литровых биореакторах (Фиг.8c - детектирование при 214 нм, Фиг 8d - детектирование при 280 нм). Отметьте идентичность продукта, полученного в больших и малых биореакторах;
на Фиг.9а-9b приведены графики, показывающие результаты ОФХ-анализа глюкоцереброзидазы, полученной в больших одноразовых биореакторах. Глюкоцереброзидазу, собранную из больших одноразовых биореакторов (400-литровых), очищали, как сказано ниже, анализировали в колонке С-4 ОФХ и контролировали при 214 нм (Фиг.9а) и 280 нм (Фиг.9b). Отметьте, что prGCD проявляется как одиночный пик с временем выдержки 64,12 минуты, подобно пику стандартной prGCD (64,70 минуты);
на ФИГ.10 приведена фотография геля для ИЭФ, показывающая превосходную чистоту prGCD, полученной в большом одноразовом биореакторе. Пробы prGCD, полученные в большом одноразовом биореакторе (400-литровом) и очищенные в 5-колонном процессе очистки, описанном ниже, разделяли в геле для изоэлектрического фокусирования вместе с prGCD из малого одноразового биореактора (10-литрового). Дорожка 2 - большой биореактор, 3-я ступень очистки; Дорожка 3 - большой биореактор, 4-я ступень очистки; Дорожка 4 - большой биореактор, 5-я ступень очистки; Дорожка 5 - малый биореактор; Дорожки 1 и 6, стандарты для изоэлектрических точек при ИЭФ. Отметьте идентичность и высокий уровень чистоты prGCD из большого одноразового биореактора на всех ступенях очистки;
на ФИГ.11 приведены анализы вестерн-блоттинга, показывающие чистоту prGCD, полученной в большом одноразовом биореакторе. Пробы GCD из 400-литровых реакторов (дорожки 1 и 2, 50 нг и 100 нг соответственно), 80-литровых реакторов (дорожки 3 и 4, 50 нг и 100 нг соответственно), коммерчески приготовленной глюкоцереброзидазы Cerezyme (дорожки 5 и 6, 50 нг и 100 нг соответственно) и хост-белки моркови (CHP) (дорожки 7 и 8, 50 нг и 100 нг соответственно) разделяли на ДСН-ПААГ, блотировали и проводили реакцию со специфическим поликлональным антителом против СНР. Полосы визуализировали с использованием хемилюминисцентного субстрата SuperSignal West Pico. Отметьте отсутствие примесей в большом одноразовом биореакторе, как и во всех остальных препаратах prGCD;
на ФИГ.12 приведена фотография донного конца иллюстративного одноразового биореактора настоящего изобретения, показывающая многочисленные газовые входы для аэрации и перемешивания питательной среды и иллюстративную жесткую коническую опорную конструкцию;
на ФИГ.13 приведена фотография батареи иллюстративных больших одноразовых биореакторов настоящего изобретения;
на ФИГ.14 приведена фотография иллюстративного биореактора настоящего изобретения, показывающая повторно используемый канал сбора;
на ФИГ.15 приведена фотография вестерн-блоттинга, показывающая иммунодетектирование рекомбинантной человеческой рекомбинантной ацетилхолинэстеразы (AChE), экспрессированной в растении. 50 (дорожки 3 и 7), 100 (дорожки 2 и 6) и 200 нг (дорожки 1 и 5) рекомбинантной человеческой AChE-R, полученной в большом одноразовом биореакторе согласно одному варианту осуществления настоящего изобретения (дорожки 1-3) и коммерчески доступной рекомбинантной человеческой AChE-S (дорожки 4-6) были детектированы с использованием аффинно-очищенного козьего поликлонального антитела против пептида на N-конце AChE человеческого происхождения (компания Santa-Cruz Biotechnology, Санта-Круз, штат Калифорния) (идентично в AChE-R и AChE-S). Дорожка 4 является стандартами молекулярной массы. Сильное связывание антитела очевидно во всех пробах;
на ФИГ.16 приведена фотография окрашивания неспецифического белка Flamingo™ с помощью ДСН-ПААГ геля в человеческой рекомбинантной AChE-R, экспрессированной в растении, которая была получена в большом одноразовом биореакторе согласно одному варианту осуществления настоящего изобретения, по сравнению с профилем коммерчески доступной AChE-S. Экспрессированная в растении AChE-R (дорожки 1-3) и произведенная из клеток млекопитающего AChE-S (дорожки 5-7) были разделены, как показано на Фиг.13, и окрашены реагентами Flamingo™. Отметьте, что профиль миграции AChE-R соответствует профилю миграции AChE-R, детектированному иммунологическим анализом с использованием антител против AChE (Фиг.13, выше). Кроме того, одиночная полоса на геле, показанная на Фиг.13, указывает на эффективность очистки;
на ФИГ.17 показаны результаты анализа по Карновски с окрашиванием гелем для детектирования каталитической активности ацетилхолинэстеразы в растительных клетках, культивированных в большом одноразовом биореакторе. Каталитически активная ацетилхолинэстераза-R была очищена от клеток BY-2, собранных из посеянных партий клеток, культивированных в 400-литровом большом одноразовом биореакторе согласно одному варианту осуществления настоящего изобретения. Убывающие количества белка из клеток (дорожки 1 и 4=200 нг; дорожки 2 и 5=100 нг, дорожки 3 и 6=50 нг) были разделены на 10% нативном полиакриламидном геле в неденатурирующих условиях, промыты и обработаны для выявления каталитической активности ацетилхолина (окрашивание по Карновски). Соответствующие количества ацетилхолина-S (дорожки 4-6) были включены в качестве контрольных. Электрофорез AChE-R и AChE-S выполняли в 10% нативном полиакриламидном геле в неденатурирующих условиях. Гели были проведены при 4°С, промыты 3 раза водой и инкубированы в течение 1 часа при перемешивании в буферном растворе, содержащем ацетилтиохолин (0,5 мг/мл; Sigma), ацетате натрия (65 мМ, рН 6,0; Sigma), цитрате натрия (5 мМ; Sigma), сульфате меди (3 мМ; Sigma) и феррицианиде калия (0,5 мМ; Riedel De Haen). Каталитическую активность детектировали визуально. Верхняя стрелка указывает миграцию тетрамера AChE-S. Нижняя стрелка указывает миграцию мономерной AChE.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к одноразовому устройству с возможностью повторного использования для культивирования растительных тканей или клеток. В частности, устройство настоящего изобретения включает нежесткую емкость, имеющую некоторые размеры и каналы газообмена, предназначенные для поддержания концентрации растворенного кислорода и сдвиговых сил, подходящих для культивирования растительных тканей или клеток в объеме 400 л или больше питательной среды. Такое устройство может быть использовано для культивирования трансформированных растительных клеток с целью производства рекомбинантных, полученных из растений, биологически активных материалов (например, фармацевтических средств) из клеток и/или питательной среды. Также предложена система культивирования растительных клеток с использованием устройства настоящего изобретения.
Принципы и работу настоящего изобретения можно лучше понять со ссылками на чертежи и описания.
Перед объяснением по меньшей мере одного варианта осуществления в деталях необходимо понять, что изобретение не ограничено в его применении подробностями, изложенными в последующем описании или Примерах. Изобретение может иметь другие варианты осуществления и может быть осуществлено на практике разными способами. Кроме того, необходимо понимать, что используемые в настоящем описании фразеология и терминология предназначены только для описания и не должны рассматриваться как ограничительные.
Как сказано выше, увеличение объемов одноразовых биореакторов требует уникальных решений проблем аэрации и перемешивания. В некоторых известных биореакторах для этой цели используется газ. В патентной заявке США №2005/0282269, поданной Проулксом и др. (Proulx et al.) раскрыт одноразовый биореактор, имеющий многочисленные газовые входы с встроенными диффузорами и фильтрами на входных каналах в нижней части емкости для обеспечения аэрации и перемешивания. Такая конфигурация имеет ограничения в том, что фильтры, находящиеся в контакте с жидкой средой, проявляют тенденцию к забиванию и не обеспечивают требуемой подачи газа. Не раскрыты ни объем, ни размеры биореактора. Еще один тип одноразового биореактора с использованием газа для аэрации и перемешивания предложен компанией Cellexus Biosystems, PCC (Кембридж, Англия). Этот биореактор представляет собой гибкий мешок, имеющий неразъемную трубку барботера, прикрепленную вдоль внутреннего нижнего конца устройства и предназначенную для подачи воздуха или газа для аэрации и перемешивания. Биореакторные мешки Cellexus отличаются уникальной асимметричной геометрией, в которой большинство объема жидкости в мешке концентрируется в верхней половине биореактора. Эта конструкция требует специально разработанного опорного кожуха (Cellmaker Lite™) для работы.
В патенте США №6432698, выданном Гоглеру и др. (Gaugler et al.) раскрыт гибкий одноразовый мешок для культивирования нематод. Этот мешок снабжен газовым входом и диффузором в форме трубки для аэрации и перемешивания питательной среды. Предусмотрены объемы до 200 л, хотя практическое осуществление не предложено. Конкретные размеры не раскрыты.
В патентной заявке США №2005/0272146, поданной Хеджем и др. (Hodge et al.) раскрыт 150-литровый одноразовый биореактор, имеющий интегрированные в него лопасти крыльчатки для перемешивания. Перемешивание питательной среды в биореакторах крыльчаткой, как известно, создает сдвиговые силы, неподхо