Рекомбинантная плазмида pbi121-esat6-cfp10-gifn, кодирующая белки esat6 и cfp10 mycobacterium tuberculosis и гамма-интерферон человека в трансгенных растениях
Иллюстрации
Показать всеИзобретение относится к генной инженерии, биохимии, биотехнологии и иммунологии. Сконструирована рекомбинантная плазмида pBi121-ESAT6-CFP10-gIFN размером 15796 п.н., содержащая следующие конструктивные элементы: фрагмент ДНК векторной плазмиды рBi121 размером 14726 п.н.; XbaI - BamHI фрагмент, кодирующий химерный ген, состоящий из двух генов esat6 и cfp10 M. tuberculosis и γ-интерферон человека; 5'UTR область из генома вируса гравировки табака; двойной 35S CaMV промотор из генома вируса мозаики цветной капусты; 3'UTR область из генома вируса мозаики цветной капусты. Сконструированная плазмида обеспечивает перенос нуклеотидной последовательности химерного гена cfp10-esat6-gIFN в геномную ДНК растений. Изобретение может быть применено для получения противотуберкулезных вакцин нового поколения. 3 ил., 2 пр.
Реферат
Изобретение относится к генной инженерии, биохимии, биотехнологии и иммунологии. Описана рекомбинантная плазмида pBi121-ESAT6-CFP10-gIFN, включающая химерный ген, кодирующий белки ESAT6 и CFP10 Mycobacterium tuberculosis и γ-интерферон человека под управлением 35S-промотра гена мозаики цветной капусты для экспрессии в тканях трансгенных растений.
Одним из направлений в создании противотуберкулезных вакцин нового поколения является использование основных белков М. tuberculosis.
Полученные к настоящему времени субъединичные вакцины показали протективный, но сильно варьирующий и, в ряде случаев, непредсказуемый эффект. Для преодоления этих недостатков актуальной задачей является создание и использование конструкций, обеспечивающих коэкспрессию рекомбинантных антигенов с цитокинами (Sharma, Khuller // J. Exp.Biol, 2001, V.39, P.1214-1219). Центральное место среди групп антигенов с протективной активностью занимает группа секретируемых белков (Mustafa et al. // Mol. Immunol., 2002, V.39, P.113-119), среди которых особое внимание уделяется белкам ESAT6 и CFP10.
Секретируемые белки ESAT6 и CFP10 являются иммунодоминантными Т-клеточными антигенами (Okkels et al. // Infection and Immunity, 2003, V.71, P.6148-6150). Высокая иммуногенность и специфичность ESAT6 и CFP10 подтверждается высоким уровнем синтеза γ-интерферона мононуклеарными клетками периферийной крови доноров в ответ на контакт с этими антигенами (Skjot et al. // Infection and Immunity, 2000, V.68, P.214-220).
Известно, что действие адъювантов, используемых в вакцинах для повышения иммуногенной активности, опосредуется через действие цитокинов (Gursel, Gregoriadis // J. Drug Target, 1998, V.5, P.93-98). Использование γ-интерферона и его аналогов, обладающих свойствами иммунономодуляторов, позволит направленно стимулировать иммунный ответ при вакцинации.
Использование трансгенных растений, коэкспрессирующих специфические антигены возбудителя туберкулеза и γ-интерферон для пероральной доставки в организм теплокровных, позволит создать более эффективные, дешевые и безопасные средства иммунизации против М. tuberculosis по сравнению с традиционными системами.
Наиболее близким к заявляемой плазмиде - прототипом является рекомбинантный вектор экспрессии на основе плазмиды pET22b(+), кодирующий гибридный белок CFP10-ESAT6 из М. tuberculosis (Патент RU С1 2360926, оп. 10.07.2009). Данный вектор разработан для экспрессии в клетках E.coli штамма BL21 (DE3) и наработки в них гибридного белка.
Недостатком прототипа является то, что используемая плазмида создана для продукции белка в прокариотических клетках, в которых не обеспечивается посттрансляционная модификация рекомбинантного белка, характерная для эукариотических клеток, а также его сборка и фолдинг. При этом возможна также контаминация целевого белка бактериальными токсинами.
Технической задачей изобретения является создание рекомбинантной плазмиды, обеспечивающей продукцию химерного белка, включающего эпитопы антигенов ESAT6 и CFP10 М. tuberculosis и γ-интерферона человека в качестве иммуномодулирующего медиатора в трансгенных растениях.
Поставленная техническая задача достигается новой сконструированной плазмидой pBi121-ESAT6-CFP10-gIFN размером 15796 н.п., обеспечивающей перенос целевой последовательности ДНК в геном растений и экспрессию химерного гена.
Способ конструирования плазмиды заключается в синтезе полноразмерного гена, состоящего из двух отдельных генов esat6 и cfp10 М. tuberculosis и γ-IFN человека в одной рамке трансляции, между которыми нет стоп-кодонов, но присутствует «шарнир» из трех аминокислотных остатков - «gly-ala-gly» для гибкой связи между доменами гибридного белка. Сначала при помощи ПЦР получают химерный ген. Праймеры для ПЦР, специфичные к генам cfp10, esat6 и γ-IFN, были разработаны так, чтобы они перекрывались друг с другом и, таким образом, позволяли синтезировать один непрерывный синтетический «химерный» ген из отдельных фрагментов ДНК. Внутренние праймеры имеют на 5'конце взаимокомплементарные последовательности, позволяющие ввести «gly-ala-gly» - шарнир. В ограничивающие химерный ген олигонуклеотиды вводят сайты узнавания для эндонуклеаз рестрикции BamHI и HindIII, позволяющие на следующем этапе получать экспрессирующую конструкцию в Е.coli. Для получения на завершающем этапе рекомбинантной плазмиды в структуру праймеров вводят сайты XbaI и BamHI, позволяющие клонировать химерный ген в бинарный вектор pBi121. В результате получают рекомбинантную плазмиду размером 15796 п.н., обеспечивающую перенос целевой последовательности в геном растений и экспрессию химерного белка.
Заявляемая плазмида состоит из следующих элементов:
ДНК векторной плазмиды pBi121 размером 15796. п.н.;
- XbaI-BamHI фрагмента, кодирующего химерный ген, состоящий из двух генов esat6 и cfp10 М. tuberculosis и γ-IFN человека;
- 5'UTR области из генома вируса гравировки табака;
- Двойного 35S CaMV промотора из генома вируса мозаики цветной капусты;
- 3'UTR области из генома вируса мозаики цветной капусты.
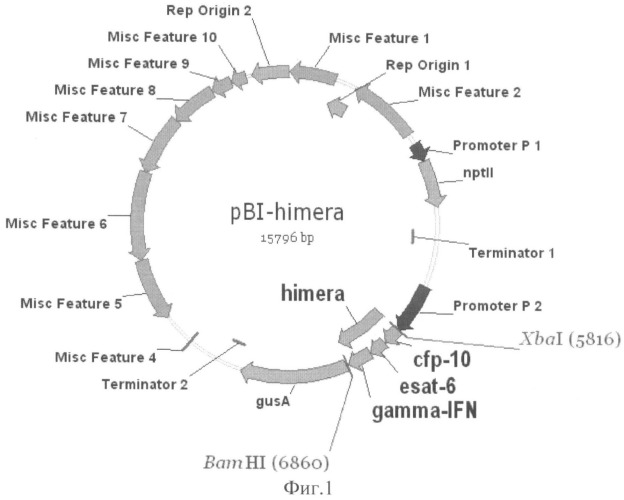
Физическая карта плазмиды pBi121-ESAT6-CFP10-gIFN с указанием генетических маркеров приведена на фиг.1, где cfp10-esat6-gIFN - нуклеотидная последовательность, химерного гена, PI - промотор гена нопалинсинтазы из Ti-плазмиды Agrobacterium tumefaciens; nptII-ген неомицинфосфотрансферазы II; Terminator 1 - терминатор гена нопалинсинтетазы; Promoter 2 - двойной промотор гена 35S РНК вируса мозаики цветной капусты; gusA - нуклеотидная последовательность бета-глюкуронидазы E.coli, Terminator 2 - терминатор гена 35S РНК вируса мозаики цветной капусты.
Отличием предлагаемой плазмиды от прототипа является наличие в ее составе гена, кодирующего синтез γ-интерферона человека, являющегося иммуномодулятором.
Сущность изобретения поясняется следующими примерами конкретного выполнения изобретения.
Пример 1. Конструирование плазмиды pBi121-ESAT6-CFP10-gIFN
Для получения химерного гена cfp10-esat6-gIFN сначала проводили дизайн самого гена и олигонуклеотидов. Был проведен дизайн шести олигонуклеотидов - праймеров, таким образом, чтобы:
1. Можно было по отдельности получить копии генов cfp10, esat6 и gIFN. Праймеры рассчитывали так, чтобы они перекрывались друг с другом и, таким образом, можно было «сшивать» в один ген три.
2. В ограничивающие химерный ген олигонуклеотиды ввели сайты узнавания для рестриктаз XbaI и BamHI, что позволило провести клонирование по этим сайтам в векторную плазмиду pBi121.
3. Были введены дополнительные нуклеотиды, формирующие кодоны для коротких «шарниров» из трех аминокислотных остатков.
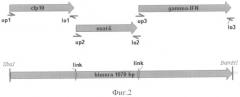
Общий дизайн химерного гена приведен на фиг.2.
Олигонуклеотиды - праймеры:
up1-Xbal CCCTCTAGAATGGCAGAGATGAAGACCGAT
up2 GCTTCGGCGCGGGGATGACAGAGCAGCAGTGGAATT
up3 TCGCAGGCGCGGGGATGCAGGACCCATATGTAAAAGAA
lo1 TGTCATCCCCGCGCCGAAGCCCATTTGCGAGGA
lo2 TGCATCCCCGCGCCTGCGAACATCCCAGTGACG
lo3-BamHI CCCGGATCCACTGGGATGCTCTTCGACCT
Для клонирования генов esat6 и cfp10 использовали геномную ДНК Mycobacterium tuberculosis, выделенную из биомассы клинического изолята М. tuberculosis, полученного от больного туберкулезом (г.Новосибирск). Гены esat6 и cfp10 были амплифицированы с геномной ДНК М. tuberculosis, а ген γ-интерферона - с плазмиды pIFN-γ-trp2-Δ. Полученные ампликоны генов esat6 и cfp10 были клонированы в промежуточные прокариотические вектора pGEX2T и эукариотический вектор pcDNA-3.1. В результате были получены рекомбинантные ДНК pGEX-2T-ESAT6, pGEX-2T-CFP10, pcDNA-ESAT6.
Синтез отдельных генов, составляющих химерный ген, осуществляли методом ПНР в течение 25 циклов при следующих условиях: денатурация 95°С-30 с, отжиг 50°С-30 с, элонгация 72°С-30 с.
Протокол реакций синтеза генов:
| А смесь | 9 мкл |
| H2O - | 105 мкл |
| В 10x буфер (производство СибЭнзим) | 15 мкл |
| dNTP (2.5 мM) | 3 мкл |
| Taq-pol | 1.5 мкл |
Состав А смеси для синтеза Cfp10:
| 1:200(plasmid pGEX-cfp10 | 1 мкл |
| up1 (10 пМ/мкл) | 4 мкл |
| lo1 (10 пМ/мкл) | 4 мкл |
Состав А смеси для синтеза Esat6
| 1:200 (plasmid pGEX-esat6) | 1 мкл |
| up2 (10 пМ/мкл) | 4 мкл |
| lo2 (10 пМ/мкл) | 4 мкл |
Состав А смеси для синтеза gIFN
| 1:200 (plasmid with gIFN) | 1 мкл |
| Up3 (10 пМ/мкл) | 4 мкл |
| Lo3 (10 пМ/мкл) | 4 мкл |
Продукты ПЦР-реакции подвергали электрофорезу в 1.5% агарозном геле, содержащем бромистый этидий. Визуализированные в УФ-свете ПЦР-фрагменты вырезали, помещали кусочки геля в пробирки, измельчали и экстрагировали ДНК в ТЕ-буфере (0,04 моль Трис-ацетат, 0,002 моль ЭДТА, рН 8,0). Центрифугировали в центрифуге при 10000 г, 5 мин. Далее 2 мкл супернатанта, содержащего амплифицированную ДНК, использовали в последующей амплификации для синтеза химерного гена.
Состав А-смеси для ПЦР
| H2O | 38 мкл |
| В 10х буфер (производство СибЭнзим) | 5 мкл |
| dNTP (2.5 мM) | 1 мкл |
| Taq-pol (производство СибЭнзим) | 0.5 мкл |
| Супер cfp-pcr | 2 мкл |
| Супер esat-pcr | 2 мкл |
| Супер gIFN-pcr | 2 мкл |
Состав В-смеси для ПЦР:
| H2O | 175 мкл |
| В 10х буфер (производство СибЭнзим) | 25 мкл |
| dNTP (2.5 мM) | 5 мкл |
| Taq-pol (производство СибЭнзим) | 2.5 мкл |
| Up1 (10 пМ/мкл) | 20 мкл |
| Lo3 (10 пМ/мкл) | 20 мкл |
Вначале проводили ПЦР-реакцию с А-смесью в течение 3 циклов при следующих условиях: 95°С - 2 мин, 50°С - 1 мин, 72°С - 2 мин.
После этого смешивали А-смесь и В-смесь, раскапывали в пробирки по 50 мкл и проводили второй раунд ПЦР в течение 25 циклов, 95°С 2 мин, 50°С - 1 мин, 72°С - 1.5 минуты, в результате которого синтезировали полный химерный ген.
Полученный полноразмерный фрагмент ДНК, соответствующий слитым генам М. tuberculosis - cfp10 и esat6, а также человеческого γ-интерферона, переосаждали добавлением 2 объемов 96% спирта и 1/10 объема 3М ацетата Na, растворяли в 1×ТЕ буфере, после чего обрабатывали эндонуклеазами рестрикции XbaI и BamHI (100 е.а.) (производство СибЭнзим) в соответствующих буферах, рекомендованных производителем, при 37°С в течение 3 часов. Очистку гидролизата от праймеров проводили с использованием набора для очистки фирмы «Sigma» GenElute PCR DNA PURIFICATION KIT.
10 мкг векторной ДНК pBi121 подвергали гидролизу рестриктазами BamHI и Xbal (100 е.а.) в соответствующих буферах при 37°С в течение 1 часа. Гидролизат разделяли электрофорезом в 1.5% агарозном геле, фрагмент ДНК элюировали из геля методом сорбции ДНК на силикагеле. Проводили лигирование 0.3 мкг полученного вектора pBi121 и 0.1 мкг фрагмента ДНК химерного гена в 10 мкл лигазного буфера, содержащего 50 мМ Nris-HCl рН7.8, 10 мМ MgCl, 10 мM DTT, 1 мM ATP, 25 мкг/мл BSA, 100 е.а. лигазы фага Т4 в течение 10 при 4°С.
После электротрансформации компетентных клеток Е.coli штамма ВН10 В и отбора клонов, несущих рекомбинатные плазмиды со встроенным геном, получали плазмиду pBi121-ESAT6-CFP10-gIFN.
Пример 2. Получение трансгенных растений моркови.
С помощью конструкции pBi121-ESAT6-CFP10-gIFN, описанной в примере 1, были получены трансгенные растения моркови (Daucus carota, сорт Нантская 4). Для агробактериальной трансформации в качестве исходных эксплантов были использованы девятинедельные каллусы, полученные из зрелых зародышей моркови. Для получения каллусов зрелые семена моркови сорта Нантская 4 стерилизовали 25% раствором Domestos в течение 10 минут. После этого семена промывали стерильной дистиллированной водой 4-5 раз, помещали в стерильную влажную камеру и оставляли на 24 часа для набухания. Набухшие семена моркови стерилизовали 50% раствором Domestos 20 мин, после чего промывали стерильной водой 4-5 раз. Выделение зародышей проводили препаровальной иглой путем надавливания на основание набухшего семени. Выделенные зародыши помещали на среду для индукции каллуса (среда MS (Murashige and Shoog, 1962) с добавлением 0,2 мг/л 2.4-Д (2,4-дихлорфеноксиуксусная кислота) и 0,2 мг/л кинетина и культивировали в темноте в течение 9-10 недель с пассажами на свежие среды того же состава каждые 3 недели.
Для трансформации использовали ночную культуру агробактерии Agrobacterium tumefaciens, плотностью 1 о.е. при 600 нм, предварительно разведенную средой MS в соотношении 1:3. Каллус 9-10-недельного возраста разделяли на небольшие фрагменты (3-5 мм в диаметре) и выкладывали на фильтровальную бумагу в чашки Петри. На каждый фрагмент наносили по 5-10 мкл приготовленной суспензии ночной культуры агробактерии. После того, как избыток суспензии впитывался фильтровальной бумагой, кусочки каллуса переносили в чашки Петри со средой для индукции каллуса (MS1:MS+0,2 мг/л 2,4-Д+0,2 мг/л кинетина). Ко-культивирование проводили в течение 3 суток в темноте при температуре 22°С.
После ко-культивирования экспланты переносили на среду для индукции канамицинустойчивого каллуса (MS2: MS1+100 мг/л канамицина +500 мг/л цефотаксима). Культивирование проводили при температуре 22 С, освещенности 5 тыс. люкс и световом периоде 16/8 с пассированием на свежую среду аналогичного состава каждые 3-4 недели до начала эмбриогенеза. Хорошо сформировавшиеся эмбриоиды с развивающейся первой листовой пластинкой переносили на бумажные мостики в пробирки с жидкой питательной средой (MS3:MS+100 мг/л канамицина +500 мг/л цефотаксима) для развития растений-регенерантов. Растения с хорошо развитой корневой системой и розеткой листьев пересаживали в закрытый контейнер со стерильным грунтом (смесь мелкой фракции керамзита и вермикулита) и выращивали 3-4 недели, постепенно приоткрывая крышку для адаптации растений к атмосферной влажности. Хорошо адаптированные растения переносили в теплицу и помещали в ванны с керамзитом и автоматической подачей питательного раствора (стандартный раствор Кноппа) при освещенности 20 тыс. люкс и световом периоде 18/6 часов.
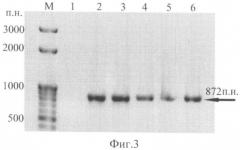
Были получены 70 первичных трансформантов, устойчивых к канамицину (100 мг/л). Трансгенная природа исходных растений была подтверждена методом полимеразной цепной реакции, показавшей наличие в растительном геноме полноразмерной встройки химерного гена (фиг.3).
На фиг.3 представлены результаты ПЦР с геномными ДНК 4-х отобранных трансформантов на наличие последовательности химерного гена (электрофореграмма, 1,5% агарозный гель), где: 1 - ДНК нетрансгенного растения; 2 - положительный контроль (pBi121-ESAT6-CFP10-gIFN); 3-6 - ДНК отобранных трансформантов поколения Т0; М - маркер длин фрагментов ДНК (в пн). Наличие амплифицированных фрагментов ДНК, размер которых совпадает с ПНР-фрагментом плазмидной ДНК, содержащей химерный ген, подтверждает присутствие в растительном геноме встройки целевого химерного гена.
Таким образом, приведенные данные свидетельствуют о том, что сконструированная плазмида pBi121-ESAT6-CFP10-gIFN обеспечивает перенос нуклеотидной последовательности химерного гена cfp10-esat6-gIFN в геномную ДНК растений.
Рекомбинантная плазмида pBi121-ESAT6-CFP10-gIFN, кодирующая белки ESAT6 и CFP10 Mycobacterium tuberculosis и γ-интерферон человека в трансгенных растениях, имеющая размер 15796 п.н. и содержащая следующие конструктивные элементы:фрагмент ДНК векторной плазмиды рВi121 размером 14726 п.н.;XbaI - BamHI фрагмент, кодирующий химерный ген, состоящий из двух генов esat6 и cfp10 M. tuberculosis и γ-IFN человека;5'UTR область из генома вируса гравировки табака;двойной 35S CaMV промотор из генома вируса мозаики цветной капусты;3'UTR область из генома вируса мозаики цветной капусты.