Способ ингибирования возбудителя хламидийной инфекции с использованием генов антимикробных пептидов паука lachesana tarabaevi
Иллюстрации
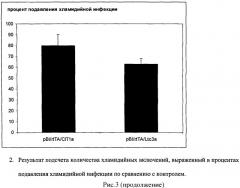
Показать всеИзобретение раскрывает создание рекомбинантных плазмидных векторов pBI/rtTA/CIT1a и pBI/rtTA/Ltc3a, в состав которых входит минимальный промотор цитомегаловируса человека, последовательности ДНК, кодирующие антимикробные пептиды CIT1a и Ltc3a из среднеазиатского паука Lachesana tarabaevi, последовательность ДНК, кодирующая трансактиваторный белок для эффективной экспрессии генов пептидов. Для ингибирования Chlamydia trachomatis проводят липофекцию клеток НЕК293 полученными векторами, инкубируют в присутствии доксициклина для индукции экспрессии генов, кодирующих антимикробные пептиды, затем клетки заражают хламидиями. После инкубирования клетки окрашивают и подсчитывают включения хламидий с помощью моноклональных антител к поверхностным антигенам хламидий, конъюгированных с флуоресцеином. Уровень ингибирования определяют по уменьшению количества хламидийных включений в трансформированных клетках по сравнению с контролем - количеством хламидийных включений в нетрансформированных клетках. Способ обеспечивает уровень ингибирования хламидийной инфекции 70-80%. 4 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии и молекулярной биологии, может быть использовано в фармацевтической промышленности и касается способов терапии внутриклеточных инфекций (хламидиозов).
Уровень техники
На протяжении последних лет во всем мире отмечается значительный рост устойчивости возбудителей инфекционных заболеваний к антибиотикам. Возникновение антимикробной резистентности является естественным биологическим ответом на использование антибиотиков, которые создают селективное давление, способствующее отбору, выживанию и размножению резистентных штаммов микроорганизмов [1].
В связи с этим ставится вопрос о создании альтернативных терапевтических средств, резистентность к которым будет развиваться ограниченно или полностью отсутствовать. Такими средствами могут явиться антимикробные пептиды (АМП) - уникальная и чрезвычайно разнообразная группа соединений, являющаяся важным компонентом врожденного иммунитета всех высших организмов. Несомненными преимуществами АМП перед другими антибиотиками являются более широкий спектр и быстрота антибактериального действия, трудность в селекции устойчивых мутантов in vitro, возможность синтеза аналогов природных пептидов с измененными свойствами [2]. Однако применение искусственно синтезированных АМП (с помощью пептидного синтеза) ограничено в силу высокой стоимости их получения.
До настоящего времени для подавления хламидийной инфекции при помощи АМП использовались дорогостоящие искусственно синтезированные химическим путем пептиды, которыми обрабатывали инфекционные формы хламидий - элементарные тельца [3, 4].
В разработке Bals R. et al. [5] (ближайший аналог) был предложен способ доставки гена, кодирующего АМП LL-37 из семейства кателицидинов в эпителиальные клетки дыхательных путей при муковисцидозе для наработки АМП непосредственно в очаге поражения с целью подавления инфекций Pseudomonas aeruginosa и Staphylococcus aureus. В качестве векторной системы использовался аденовирус человека. При введении этого вектора уровень содержания LL-37 возрастал в несколько раз, что вело к значительному ингибированию роста указанных патогенов. Возможность использования таких векторов для борьбы с другими инфекциями не исследовалась.
Задачей настоящего изобретения является создание прототипов генноинженерных препаратов для эффективного подавления хламидийной инфекции на основе рекомбинантных плазмидных векторов, содержащих гены АМП.
Поставленная задача решается путем конструирования рекомбинантных плазмидных векторов, содержащих последовательности генов АМП паука Lachesana tarabaevi, способных инактивировать Chlamydia trachomatis.
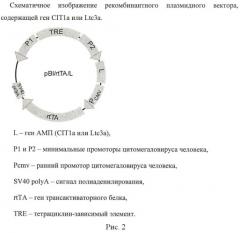
В данном изобретении мы используем гены АМП CIT1a и Ltc3a из яда среднеазиатского паука L. tarabaevi [6-8]. Отличительной особенностью этих пептидов является высокая антимикробная активность. Аминокислотные последовательности пептидов и нуклеотидные последовательности их генов приведены на рисунке 1.
Нуклеотидные последовательности, соответствующие генам АМП, синтезируют на автоматическом синтезаторе нуклеиновых кислот ASM-700 (Биоссет, Россия) и клонируют в плазмидный вектор pBI-EGFP (Clontech, США) с предварительно делегированным геном EGFP по сайту рестрикции PvuII. В этот плазмидный вектор по сайту рестрикции BglII также клонируют нуклеотидную последовательность гена трансактиваторного белка rtTA, представляющего собой составной полипептид из тетрациклинового белка-репрессора (TetR - последовательность из оперона тетрациклиновой устойчивости транспозона Tn10 Escherichia coli) и активаторного домена (AD - последовательность из белка VP16 вируса простого герпеса) [9]. Рекомбинантные плазмидные векторы имеют название pBI/rtTA/CIT1a (содержит ген CIT1a) и pBI/rtTA/Ltc3a (содержит ген Ltc3a) (рисунок 2). Экспрессия генов АМП начинается только в присутствии индуктора - доксициклина, что позволяет осуществлять регулирование уровня экспрессии генов АМП с помощью различных доз индуктора. Это является немаловажным в случае, если продукты экспрессии генов будут проявлять нежелательный побочный эффект.
Раскрытие изобретения
Поскольку показано, что гены АМП кателицидинов могут быть использованы в составе вирусных векторов для подавления стафилококковых и псевдомонадных инфекций, мы разработали рекомбинантные плазмидные векторы (прототипы генно-инженерных лекарственных средств), содержащие гены АМП паука L. tarabaevi для подавления инфекций, вызываемых внутриклеточной бактерией - хламидией. Для успешной борьбы с указанным возбудителем инфекции разработан протокол для проверки подавления хламидийной инфекции в культуре клеток, включающий:
1. трансфекцию культуры клеток HEK293 (АТСС CRL-1573) рекомбинантным плазмидным вектором pBI/rtTA/CIT1a или pBI/rtTA/Ltc3a с использованием липофектамина 2000 (Invitrogen, США);
2. заражение клеток хламидией С.trachomatis UW-57/Cx (АТСС VR-878) через 24 ч;
3. индукция экспрессии генов АМП с помощью доксициклина (Sigma, США).
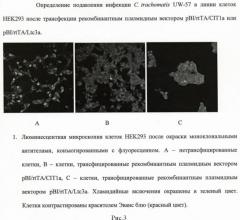
4. окрашивание хламидийных включений с использованием моноклональных антител, конъюгированных с флуоресцеином (Orion Diagnostica, Финляндия) спустя 24 ч;
5. подсчет хламидийных включений в сравнении с контролем (нетрансфицированные клетки) с помощью люминесцентной микроскопии.
Пример реализации изобретения
Ингибирование инфекции С.trachomatis UW-57 в линии клеток HEK293 после трансфекции рекомбинантным плазмидным вектором pBI/rtTA/CIT1a или pBI/rtTA/Ltc3a.
1. Клетки линии НЕК293 выращивают в среде MEM (Invitrogen, США), содержащей 10% эмбриональной бычьей сыворотки (ЭБС), 2 мг/мл глюкозы в планшете на покровных стеклах. Инокулят (10-15 включений в поле зрения при увеличении ×900) вносят в линию клеток HEK293 через 24 ч после трансфекции рекомбинантными плазмидными векторами pBI/rtTA/CIT1a или pBI/rtTA/Ltc3a и центрифугируют при 3000 g 1 ч при комнатной температуре с последующей заменой ростовой среды.
2. Трансфекцию проводят с использованием липофектамина 2000. В одной пробирке к 1 мкг рекомбинантного плазмидного вектора добавляют 15 мкл среды MEM без ЭБС. В другой пробирке к 15 мкл среды MEM без ЭБС добавляют 5 мкл липофектамина. Перемешивают осторожным пипетированием, после чего содержимое пробирок объединяют и инкубируют при комнатной температуре 15 мин. Далее полученную смесь ДНК/липофектамин добавляют к клеткам на 5 ч.
3. Заражение хламидиями проводят, как описано в п.1, с последующим добавлением доксициклина в дозе 20 нг/мл. Контрольные клетки трансфицируют в тех же условиях, но не вызывают индукцию экспрессии генов АМП доксициклином.
4. Через 24 ч клетки промывают фосфатно-солевым буфером (ФСБ; 1,7 мМ KH2PO4, 5,2 мМ Na2HPO4, 150 мМ NaCl, pH 7,4) и фиксируют метанолом. Добавляют антитела и инкубируют 30 мин при комнатной температуре.
5. Далее препарат промывают ФСБ и проводят подсчет количества включений (не менее 50 полей зрения) с использованием микроскопа Eclipse E800 (Nikon, Япония) при увеличении ×400. Результаты приведены на рисунке 3.
Литература
1. Fischbach M.A., Walsh C.T. // Science. 2009. V.325. P.1089-1093.
2. Finlay B.B., Hancock R.E.W. //Nat. Rev. Microbiol. 2004. V.2. P.497-504.
3. Yasin В., Pang M., Wagar E.A. // J. Pept. Res. 2004. V.64. P.65-71.
4. Chong-Cerrillo С., Selsted M.E., Peterson E.M., de la Maza L.M. // J. Pept. Res. 2003. V.61. P.237-242.
5. Bals R., Weiner D.J., Meegalla R.L., Wilson J.M. // J. Clin. Invest. 1999. V.103. P.1113-1117.
6. Kozlov S.A., Vassilevski A.A., Feofanov A.V., Surovoy A.Y., Karpunin D.V., Grishin E.V. // J. Biol. Chem. 2006. V.281. P.20983-209892.
7. Vassilevski A.A., Kozlov S.A., Samsonova O.V., Egorova N.S., Karpunin D.V., Pluzhnikov K.A., Feofanov A.V., Grishin E.V. // Biochem. J. 2008. V.411 P.687-696.
8. RU 2302466, 2005.
9. Gossen M., Bujard H. // Proc. Natl. Acad. Sci. 1992. V.89. P.5547-5551.
Способ ингибирования возбудителя хламидийной инфекции с использованием генов, кодирующих антимикробные пептиды (АМП), отличающийся тем, что культуру клеток трансфецируют рекомбинантным плазмидным вектором pBI/rtTA/CIT1a, содержащим ген CIT1a, или pBI/rtTA/Ltc3a, содержащим ген Ltc3a, кодирующим соответствующие пептиды из яда паука Lachesana tarabaevi, с использованием липофектамина, клетки инкубируют, добавляют доксициклин для индукции экспрессии генов АМП, заражают хламидиями, повторно инкубируют, затем окрашивают и подсчитывают хламидийные включения с помощью моноклональных антител к поверхностным антигенам хламидий, конъюгированных с флуоресцеином, и определяют ингибирование хламидий по уменьшению количества хламидийных включений в трансфецированных клетках по сравнению с контролем - нетрансфецированными клетками.