Биополимерное волокно, состав формовочного раствора для его получения, способ приготовления формовочного раствора, полотно биомедицинского назначения, способ его модификации, биологическая повязка и способ лечения ран
Иллюстрации
Показать всеИзобретение относится к получению биополимерных волокон из хитозана методом электроформования и нетканого волокнисто-пористого материала на их основе для получения полотна биомедицинского назначения в качестве биологической повязки для лечения ран. Состав формовочного раствора для формования биополимерных волокон включает полиэтиленоксид, хитозан, органическую кислоту и воду. Или состав формовочного раствора для формования биополимерных волокон включает хитозан, воду и компонент, выбранный из полиэтиленоксида, поливинилового спирта или поливинилпирролидона. При этом используют хитозан с молекулярной массой 30-40 кДа и полиэтиленоксид с молекулярной массой 2000-8000 кДа. Состав дополнительно содержит диацетат целлюлозы и биологически активные вещества. Способ приготовления формовочного раствора включает смешивание компонентов в порошкообразном состоянии и растворение их с перемешиванием до гомогенного состояния. Полотно биомедицинского назначения, сформированное из биополимерных волокон на основе хитозана, для получения из него повязки для лечения ран, подвергают набуханию в физиологическом растворе или дистиллированной воде. Дополнительно полотно биомедицинского назначения подвергают термообработке, после чего полотно помещают в дистиллированную воду или физиологический раствор для набухания. Или полотно дополнительно обрабатывают щелочным реагентом, с последующим промыванием дистиллированной водой, после чего помещают в дистиллированную воду для набухания. Для лечения ран полотно биомедицинского назначения в качестве биологической повязки накладывают на рану. Изобретение позволяет получить биополимерное волокно с использованием оптимальных составов прядильной композиции на основе хитозана и нетоксичного полимера для устойчивого электроформования бездефектных волокон. Способы модификации полотна биомедицинского назначения для получения повязки в виде раневого покрытия являются экологически чистыми и экономичными. 12 н. и 9 з.п. ф-лы, 2 табл., 73 пр., 5 ил.
Реферат
Группа изобретений относится к химической и биохимической технологии, в частности к способам получения растворов для формования биополимерных волокон из хитозана, к получению биополимерных волокон и нетканых волокнисто-пористых материалов из хитозана методом электроформования, а также к медицине, конкретно к новым биологическим повязкам на основе хитозана, предназначенным для лечения ран различной этиологии (ожогов II-IIIАБ степени, донорских участков, длительно незаживающих ран, трофических язв, пролежней и других дефектов кожного покрова), позволяющим ускорить процесс заживления, создать оптимальную среду для регенерации, защитить рану от возникновения инфекционного процесса и травматизации, предотвратить образование грубых рубцов. Группа изобретений может быть использована в химической, биохимической и косметической промышленности, биологии, медицине, фармакологии, а также в научно-исследовательской практике в этих областях.
Аминополисахарид животного происхождения хитозан, получаемый из хитина панцирей членистоногих, характеризуется рядом ценных свойств: не токсичен, в процессе получения полностью утрачивает антигенность, обладает высокой сорбционной способностью, совместим с большинством лекарственных средств, проявляет антибактериальное и противогрибковое действие, биосовместим с тканями человека, влияет на процессы регенерации поврежденных кожных покровов, биодеградируем естественным метаболическим путем и др. Важной особенностью хитозана является сохранение, а в ряде случаев улучшение этих полезных качеств у формованных изделий на его основе.
Хитозан широко используется в биотехнологии, фармакологии и является основным компонентом многих новых лекарственных, косметических и др. препаратов. Биосовместимость с живыми тканями, близость по функциональным качествам к компонентам дермы in vivo, биоинертность, биоразлагаемость, биоцидные и другие свойства хитозана определяют перспективность разработки на его основе новых материалов медико-биологического назначения.
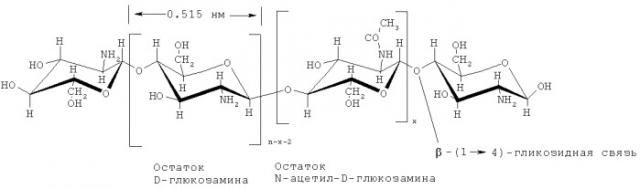
Макромолекула хитозана имеет гетероцепное строение и построена из звеньев остатков D-глюкозамина (в основном) и N-ацетил-D-глюкозамина, связанных β-1,4-гликозидными связями. В настоящее время термином хитозан принято называть сополимер со степенью деацетилирования (количество звеньев D-глюкозамина) выше ~75 мольн.% [Хитин и хитозан: Получение, свойства и применение / Под ред. К.Г.Скрябина, Г.А.Вихоревой, В.П.Варламова. М.: Наука. 2002. 368 с.]. Структурная формула макромолекулы хитозана приведена ниже, индекс n-x соответствует степени деацетилирования хитозана.
Замечено, что практически все функциональные свойства хитозана зависят от его молекулярных параметров, в частности молекулярной массы и степени деацетилирования (СД) [Holme H.K., Hagen A., Dornish М. // Chitosan Per os: from Dietary Supplement to Drug Carrier. Grottammare: Atec. 2001. P.153-163; Куликов С.Н., Чирков С.Н., Ильина А.В. и др. // Прикладная биохимия и микробиология. 2006. Т. 42. №2. С.224-228; Шиповская А.Б., Фомина В.И., Казмичева О.Ф. и др. // Высокомолек. соед. 2007. Т.49Б. №12. С.2195-2199]. Например, высокомолекулярный хитозан со средневязкостной молекулярной массой не растворим в воде и растворим в водных растворах органических и одноосновных неорганических кислот. Образцы низкомолекулярного хитозана с и СД≥70 мольн.% хорошо растворяются в воде. С увеличением СД до 85 мольн.% усиливается антибактериальное действие полимера [Герасименко Д.В., Авдиенко И.Д., Банникова Г.Е. и др. // Прикладная биохимия и микробиология. 2004. Т.40. №3. С.301-306; Герасименко Д.В., Авдиенко И.Д., Банникова Г.Е. и др. // Современные перспективы в исследовании хитина и хитозана: Матер, седьмой Международ. конф. М.: Изд-во ВНИРО. 2003. С.233-238], повышается селективность полимерного материала [Агеев Е.П., Вихорева Г.А., Матушкина Н.Н. и др. // Высокомолек. соед. 2000. Т.42А. №2. С.333-339] и др. В медицине, фармакологии, косметологии целесообразнее использовать образцы хитозана в широком диапазоне молекулярных масс и со степенью ацетилирования СД≥80 мольн.%.
В настоящее время одним из перспективных направлений переработки хитозана в материалы биомедицинского назначения является получение на его основе волокон с диаметром от нано- (нм) до микрометров (мкм), а также нетканых волокнисто-пористых материалов с наноразмерными порами.
На сегодняшний день единственным высокопроизводительным и апробированным в промышленности методом получения полимерных нановолокон и волокон субмикронного диаметра является электродинамический метод (электроформование). В основе метода лежит процесс образования тонких полимерных струй под действием электрического поля высокой напряженности с последующим высыханием струи и оседанием в виде однородного по длине волокна. Использование нановолокон для создания нетканых материалов биомедицинского назначения обусловлено рядом присущих волокнам наноскопического и субмикронного диаметра уникальных свойств, в числе которых большая удельная площадь поверхности и сверхмалый размер пор. Известно, что малый размер пор способствует фильтрации наноразмерных частиц уже на поверхности материала, а также препятствует диффузии находящейся в порах материала жидкости, эффективно удерживая ее внутри. С другой стороны, при использовании нетканого материала с наноразмерными порами и включением лекарственных веществ, могут быть осуществлены точное дозирование и адресная доставка препарата к поврежденным тканям. Эти свойства необходимы в клинической практике применения нетканого волокнисто-пористого материала для улучшенной абсорбции раневого отделяемого, надежной биологической защиты раневой поверхности на этапе восстановления эпителия, создания эффекта управляемого влияния на процессы регенерации и т.п.
Известен состав раствора для формования волокон из хитозана электродинамическим способом, включающий хитозан в концентрации С=6-8 мас.% и трифторуксусную кислоту или хитозан С=8 мас.% и смесь трифторуксусной кислоты с дихлорметаном в соотношении компонентов 90:10-70:30 [Ohkawa К., Cha D., Kim H. et al. // Macromolec. Rapid Communic. 2004. V.25. P.1600-1605. DOI: 10.1002/marc.200400253]. Электропряденое волокно, полученное из растворов хитозана в трифторуксусной кислоте, характеризуется диаметром d=330-610 нм, из растворов хитозана в смеси трифторуксусной кислоты с дихлорметаном - d=200-660 нм.
Недостатком является использование агрессивных растворителей - трифторуксусной кислоты и дихлорметана, небольшое количество которых неизбежно остается в готовом волокне. Трифторуксусная кислота обладает сильной кислотностью и быстро проникает в ткани, вызывая тяжелые ожоги кожи, глаз, слизистых оболочек и др. Вдыхание паров трифторуксусной кислоты вызывает отек легких. Дихлорметан очень летуч, в организме метаболизируется до монооксида углерода, что может вызвать острое отравление. Длительный покровный контакт с дихлорметаном может вызвать накопление его в жировых тканях и привести к ожогу. При длительной работе с дихлорметаном возможно поражение печени и нейропатия. ПДК дихлорметана в рабочей зоне 50 мг/м3, в воде водоемов не более 7.5 мг/л. Существенным недостатком является также нестабильность процесса электроформования.
Известны составы формовочных растворов для электроформования волокон из хитозана, включающие хитозан со СД=56-65 мольн.% в концентрации С=7 мас.% и уксусную кислоту концентрации CK=90% [Geng X., Kwon Oh-H., Jang J. // Biomaterials. 2005. V.26. P.5427-5432. DOI: 10.1016/j.biomaterials.2005.01.06] или хитозан со СД-75-85 мольн.% в концентрации С=3-5 мас.% и уксусную кислоту CK=80-90% [Vrieze De S., Westbroek P., Camp T.V., Langenhove Van L. // J.Mater. Sci. 2007. V.42. P.8029-8034. DOI: 10.1007/s10853-006-1485-6]. Средний диаметр получаемого электропряденого волокна составляет ~130 нм и 50-100 нм, соответственно.
Недостатком является использование хитозана с низкой степенью деацетилирования, что ограничивает применение волокна в медицинской практике. Кроме того, используется концентрация уксусной кислоты, близкая к ледяной уксусной кислоте, что экологически и экономически не целесообразно. Существенным недостатком является также нестабильность процесса электроформования волокна: незначительное увеличение концентрации хитозана в растворе (например, с 7 мас.% до 8 мас.%) или средневязкостной молекулярной массы хитозана (например, с до 398 кДа), а также снижение концентрации уксусной кислоты (например, с CK=90% до 80%) приводит к получению волокон с большим количеством дефектов.
Описан способ получения хитозановых волокон линейной плотности 0.52-1.0 Текс из раствора полимера С=3-4 мас.% в 2%-ной уксусной кислоте способом мокрого формования в осадительную ванну, содержащую 2% NaOH и 10% Na2SO4, с последующей фильерной вытяжкой от -45 до +90% и пластификационным вытягиванием от 20 до 110% [Илларионова Е.Л., Калинина Т.Н., Чуфаровская Т.И., Хохлова В.А. // Хим. волокна. 1995. №6. С.18-22]. При этом используют хитозан с и СД=75-99.5 мольн.%. Полученные волокна перерабатывают в иглопробивной нетканый материал и изготовляют салфетки или тампоны.
Недостатки: способ мокрого формования в осадительную ванну и, соответственно, низкая производительность процесса, необходимость фильерной и платификационной вытяжки. Цель - получение волокна из хитозана электростатическим методом - в способе не ставилась.
Расширению областей и эффективности применения хитозансодержащих материалов медико-биологического назначения способствует возможность их модификации, в том числе путем смешения хитозана с другими полимерами. Наиболее перспективными представляются смеси хитозана с биологически инертными искусственными полимерами многоцелевого назначения (применяемых в медицине, фармакологии, косметологии и т.п.): полиэтиленоксидом [Алексеев В.Л., Кельберг Е.А., Бронников С. В., Евмененко Г.А. // Высокомолек. соед. 2001. Т.43А. №10. С.1856-1860], поливиниловым спиртом [Мухина В.Р., Пастухова Н.В., Семчиков Ю.Д. и др. // Высокомолек. соед. 2001. Т.43А. №10. С.1797-1804; Внучкин А.А. // Автореф. канд. химич. наук. СПб. 2009], поливинилпирролидоном [Патент РФ №2247555, МПК A61K 7/48, A61K 31/14, A61K 31/722, А61Р31/04; Патент РФ №2379025, МПК A61K 9/06, A61K 31/79, A61K 31/722], диацетатом целлюлозы [Du J., Hsieh Y.-L. // Cellulose. 2009. V.16. P.247-260. DOI: 10.1007/s10570-008-9266-9] и др.
Смесевые хитозансодержащие материалы можно получить в виде электропряденых волокон и нетканых волокнисто-пористых полотен из общего формовочного раствора, получаемого посредством смешения водно-кислотного раствора хитозана и водного раствора вспомогательного полимера. Добавка второго полимерного компонента в формовочный раствор хитозана приводит к устойчивому и воспроизводимому электроформованию и получению волокна практически без наличия дефектов.
Известен состав формовочного раствора для получения хитозансодержащего волокна способом электродинамического формования, включающий хитозан с и 1300 кДа, степенью деацетилирования СД=77-78 мольн.% и поливиниловый спирт в соотношении компонентов 70:30-30:70 с общей концентрацией полимера в растворе СП=1-4.5 мас.%, муравьиную кислоту или 0.2 М уксусную кислоту [Ohkawa К., Cha D., Kim H. et al. // Macromolec. Rapid Communic. 2004. V.25. P.1600-1605. DOI: 10.1002/marc.200400253]. Хитозан растворяют в растворе кислоты, поливиниловый спирт - в воде, затем осуществляют смешение растворов в заданном соотношении компонентов. Волокна, полученные из раствора смеси хитозан: поливиниловый спирт = 70:30, характеризуются большим количеством дефектов в виде утолщений и капель. Волокна, полученные из раствора смеси хитозан: поливиниловый спирт = 50:50 с использованием хитозана с в муравьиной кислоте имеют диаметр d=80-170 нм, из раствора смеси хитозан:поливиниловый спирт = 30:70-d=110-220 нм. Волокна, полученные из раствора смеси хитозан: поливиниловый спирт = 50:50 с использованием хитозана с в муравьиной или 0.2 М уксусной кислоте характеризуются d=120-270 нм.
Недостатком является низкая степень деацетилирования хитозана, использование муравьиной кислоты (что недопустимо при получении биомедицинских материалов). Кроме того, устойчивое формование бездефектного волокна наблюдается только из растворов смесей хитозан:поливиниловый спирт при большом содержании второго полимерного компонента (>50%). В связи с чем основное содержание волокна составляет поливиниловый спирт, который, в отличие от хитозана, не является биологически активным полимером и не проявляет антибактериальные, репаративные и др. свойства.
Значительная часть литературных и патентных источников касается процесса электроформования, свойств и морфологии бикомпонентных нановолокон из смесей хитозана с полиэтиленоксидом в разном соотношении компонентов.
Известны составы для электроформования хитозансодержащего волокна из растворов смесей хитозана с полиэтиленоксидом в относительно разбавленной уксусной кислоте. Например, из растворов смесей хитозан: полиэтиленоксид = 50:50 или 67:33 с общей концентрацией полимера СП=4-6 мас.% в 2%-ной уксусной кислоте получают волокна с диаметром 80-180 нм [Duan В., Dong С., Yuan X., Yao K. // J. Biomater. Sci. Polymer Edn. 2004. V.15. №6. P.797-811], из растворов смесей хитозан:полиэтиленоксид = 25:75 с общей концентрацией полимера СП=5 мас.% в 3%-ной уксусной кислоте формуют при температуре 70°С волокна с core-shell структурой и d=340-495 нм [Zhang J.-F., Yang D.-Z., Xu F. et al. // Macromolec. 2009. V.42. №14. P.5278-5284. DOI: 10.1021/ma900657y]. Нановолокна из растворов смесей хитозан: полиэтиленоксид с общей концентрацией полимера СП=2.2-3 мас.% в 0.5 М уксусной кислоте получают только при соотношении полимерных компонентов в смеси 60:40 [Bhattarai N., Edmondson D., Veiseh O. et al. // Biomaterials. 2005. V.26. P.6176-6184. DOI: 10.1016/j.biomaterials.2005.03.027]. Для получения нановолокна из растворов смесей хитозан:полиэтиленоксид = 90:10 в 0.5М уксусной кислоте в систему добавляют сурфактант (Triton Х-100™ в количестве 0.3%) и сорастворитель (диметилсульфоксид в количестве 10%).
Недостатком всех составов, за исключением состава хитозан:полиэтиленоксид = 90:10, является малое содержание хитозана в формовочном растворе. Получение нановолокна из раствора смеси хитозан:полиэтиленоксид в соотношении компонентов 90:10 требует дополнительного введения неионогенного поверхносто-активного вещества и диметилсульфоксида. Все это существенно снижает биосовместимость, биодеградируемость и другие полезные свойства электропряденого волокна.
Известны также составы для электроформования хитозансодержащего нановолокна из растворов смесей хитозана с полиэтиленоксидом в концентрированной уксусной или муравьиной кислоте.
Известен состав прядильного раствора для формования нановолокон с d=60-145 нм, включающий хитозан и полиэтиленоксид или N-карбоксиэтилхитозан и полиэтиленоксид в соотношении компонентов 50:50 с общей концентрацией полимера в растворе СП=1.7-2 мас.%, уксусную кислоту концентрации СК=85% или муравьиную кислоту СК=85% [Penchev H., Paneva D., Manolova N., Rashkov I. // Macromolec. Biosci. 2009. №9. P.884-894. DOI: 10.1002/mabi.200900003].
Недостатками является небольшое содержание хитозана и низкая общая концентрация полимеров в формовочном растворе, что экономически не целесообразно. Содержание биополимера хитозана в готовом волокне также невелико.
Известен состав формовочного раствора, включающий хитозан и полиэтиленоксид в соотношении компонентов 62.5:37.5-30:70 с общей концентрацией полимера СП=2.5-4 мас.%, уксусную кислоту СК=32-45%, из которого формуют волокно с d=100-180 нм [Klossner R.R., Queen H.A., Coughlin A.J., Krause W.E. // Biomacromolec. 2008. V.9. №10. P.2947-2953]. При этом используется хитозан со СД=75-85 мольн.%. Хитозан растворяют в уксусной кислоте СК=80-90%, полиэтиленоксид - в воде (время приготовления гомогенных растворов индивидуальных полимеров 24-72 ч), затем осуществляют смешение полученных растворов в заданном соотношении компонентов. Отмечено также влияние содержания хитозана в формовочном растворе на диаметр электропряденого композитного волокна. Так, более тонкие волокна получаются при электроформовании из растворов смесей хитозан:полиэтиленоксид с большим содержанием хитозана.
Недостатком является то, что раствор и электропряденое волокно содержат сравнительно малое количество биосовместимого полимера, сравнительно низкая степень деацетилирования используемого хитозана, а также длительность и многостадийность процесса получения формовочного раствора. Задача получения волокна из водных растворов водорастворимого хитозана в способе не ставилась.
Имеется ряд патентов, описывающих способ получения волокон из хитинхитозана и многокомпонентных композитных волокон из смеси хитозана с другими природными и синтетическими полимерами, а также нетканого волокнисто-пористого материала на их основе.
Известен способ электроформования нановолокон из растворов хитинхитозана в N-метилморфолиноксиде, гексафлуоро-2-пропаноле, гидратированном гексафлюороацетоне и муравьиной кислоте [Патент KR 2005/10-0032656 А].
Недостатком является использование агрессивных и технологически не приемлемых растворителей.
Известен способ электроформования биокомпозитных нановолокон из смеси хитозана или олигохитозана с альгиновой кислотой в соотношении компонентов хитозан (олигохитозан):альгиновая кислота в готовом волокне 20:80-1:99 с использованием в качестве растворителя полимеров и олигомера водных растворов уксусной (СК=1%), соляной (СК=1-5%) и т.п. кислот [Патент WO 2007/093805 А1, МПК A61L 15/28; C08J 5/18; D01F 8/18].
Недостатки: максимальное содержание аминополисахарида хитозана в сухом волокне не превышает 80%, невозможность получения биокомпозитного волокна из водных растворов полимеров.
Известны способы получения электростатическим методом композитных нановолокон и нетканого материала на их основе из смесей хитозана с синтетическими полимерами: полиамидами [Патент KR 2007/10-0749966 В1; Патент CN 2009/10-1502759 А], полиэфирами (например, полиэтилентерефталатом) [Патент KR 2006/10-0652496 В1].
Главный недостаток - использование агрессивных растворителей (гексафлуороизопропанола, муравьиной кислоты и др.) для растворения синтетического полимера.
Известен способ получения нетканого волокнистого функционального материала, содержащего синтетический полимер полилактид, биополимеры хитозан, пептид, зеин, желатину, коллаген [Патент JP 2008/38271 А]. Описан способ получения биодеградируемого композитного нетканого материала из нановолокон, содержащих, мас.%: хитозан 0-50, полилактид и полигликолид 49.9-99.9, противовоспалительные и антибактериальные лекарства 0.1-25 [Патент CN 2009/10-1491689 А]. Известен способ получения волокнистого скаффолда биомедицинского назначения, включающий макромолекулы синтетических полимеров - полилактида, полигиколида, сополимеров полилактида и полигиколида, полигидроксибутирата, полигидроксивалериата, биополимеров - хитозана, хитина, альгиновой кислоты, коллагена, желатины и гиалуроновой кислоты [Патент KR 10-2007-0024092, МПК A61L 27/14, A61L 27/20, A61L 27/40]. Описан способ получения электростатическим методом нетканого материала, содержащего хитозан, биодеградирующий природный полимер (коллаген, желатину, полиглутаминовую кислоту, шелк, целлюлозу, альгиновую кислоту, гиалуроновую кислоту), биодеградирующий синтетический полимер (полиэтиленоксид, поливиниловый спирт, полигидроксибутират, полигидроксибутиратгидроксивалериат, полилактид, полигликолид, сополимеры полилактида с полигликолидом, поликапролактон, полиэфир, полиангидрид) и фактор роста клеток [Патент KR 2008/10-0104932 В1]. Описаны электропряденые аморфные фармацевтические композиции, предназначенные для изготовления стабильных твердых дисперсий аморфной формы лекарственного средства в полимерных нановолокнах, состоящие из водо- или неводорастворимого волокнообразующего полимера, или их комбинаций и частиц лекарственного вещества, в частности, из хитозана и его производных, полиэтиленоксида, поливинилацетата, поливинилпирролидона, поливинилового спирта, гиалуроновой кислоты, альгината, каррагинана, производных целлюлозы (Na-карбоксиметилцеллюлозы, метилцеллюлозы, этилцеллюлозы, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, фталат гидроксипропилметилцеллюлозы, ацетофталат целлюлозы), некристаллической целлюлозы, крахмала и его производных (гидроксиэтилкрахмала, гликолят натрий-крахмала), альбумина, желатины, коллагена, полиакрилатов и их производных (таких как члены семейства полимеров Eudragit от компании Rohm Pharma), полиальфагидроксикислоты, полиальфааминокислоты и их сополимеры, сложные полиортоэфиры, полифосфазины или полифосфоэфиры [Патент РФ №2331411, МПК A61K 9/48, A61K 9/20, A61K 9/52, A61K 9/22].
Главными недостатками указанных композиций являются их многокомпонентность, большое количество вспомогательного(ных) полимера(ов), сложная структурная организация и высокая себестоимость.
Имеются также патенты, описывающие составы формовочных растворов для формования двух- и трехкомпонентных композитных хитозансодержащих волокон со сравнительно высоким содержанием хитозана, способы получения и составы этих волокон и нетканого волокнисто-пористого материала на их основе, включающие хитозан и дополнительно полиэтиленоксид и/или другие инертные синтетические и природные полимеры.
Известны способы получения трехкомпонентных композитных волокон с d=50-500 нм и составы прядильных растворов для их формования. Например, предложен способ получения композитного нановолокна, содержащего хитозан:серин:полиэтиленоксид в соотношении компонентов 66:17:17 [Патент JP 2008/163520 А]. Описан способ получения нетканого волокнистого материала из нановолокон, содержащих, мас.%: хитозан 10-90 и смесь полиэтиленоксида с поливиниловым спиртом, остальное [Патент CN 2004/1569254 А]. Соотношение полиэтиленоксид: поливиниловый спирт варьируют от 90:10 до 10:90. Формование проводят из растворов с общей концентрацией полимера СП=4-8 мас.% в уксусной кислоте при напряжении электрического поля 5-30 кВ, объемном расходе 0.1-0.5 мл/ч, межэлектродном расстоянии 5-25 см.
Главный недостаток данных способов и составов - максимальное содержание хитозана в электропряденом волокне не превышает 90%.
Известен способ получения двухкомпонентного хитозансодержащего волокна с d=60-120 нм и содержанием хитозана до 96.3% электроформованием растворов смеси хитозана с полиэтиленоксидом или поливиниловым спиртом в трифторуксусной кислоте или других тригалогенкарбоновых кислотах [Патент WO 2009/011944 А2, МПК D01F 6/02, D01D 5/00, C12N 0/00]. При этом используется хитозан со СД=72-83 мольн.%. Получаемый материал дополнительно обрабатывают сшивающим агентом - глутаровым альдегидом.
Недостатками способа являются использование агрессивных канцерогенных растворителей, что исключает применение получаемого материала в медицине, фармакологии и т.п.; дополнительная обработка с применением токсичного глутарового альдегида, что приводит к образованию сшивок между глутаровым альдегидом, хитозаном и полиэтиленоксидом или поливиниловым спиртом, сопровождающемуся утратой водорастворимости, биодеградируемости и эластичности волокна и материала в целом. Цель - получение нановолокна из водных растворов смесей хитозана с полиэтиленоксидом или поливиниловым спиртом - в способе не ставилась.
Известны также способы получения хитозансодержащих искусственных волокон, обладающих антибактериальной активностью к Staphylococcus aureus. Streptococcus salivarius, Pseudomonas aeruginosa, биосовместимостью и биодеградируемостью, из хитина путем измельчения хитина, деацетилирования до хитозана с СД=91 мольн.% и более, ксантогенирования и мокрого формования [Патент РФ №2258102, МПК D01F 4/00, С08В 9/00], а также из хитозана путем измельчения хитозана, добавления раствора NaOH, проведения мерсеризации хитозана с последующим ксантогенированием, мокрого формования из полученной вискозы хитозана, отделки и сушки [Патент РФ №2278188, МПК D01F 4/00, С08В 9/00]. Полученное волокно содержит 10-100 мас.% хитозана, имеет толщину 16.6-17.2 текс, прочность 105-125 мН/текс, удлинение при разрыве 11-13%.
Недостатком является длительность и трудоемкость способа; микронный диаметр, высокая прочность и низкие эластичные свойства волокна. Задача получения хитозансодержащего нановолокна с антибактериальной активностью методом электростатического формования для получения лечебного покрытия для ран в способе не ставилась.
Между тем, использование электропряденых нетканых волокнисто-пористых материалов из волокон хитозана с нано- и субмикронным диаметром в качестве раневых покрытий или других биологических повязок чрезвычайно перспективно. Это обусловлено как ценными лечебными функциями аминополисахарида хитозана, так и уникальными особыми свойствами электропряденых волокон и материалов на их основе, определяемыми малым размером (диаметром) нановолокна, отсутствием протяженных дефектов, высокой удельной поверхностью материала и др. Однако до настоящего времени о применении нетканого полотна из нановолокон хитозана в клинической медицинской практике не известно.
Актуальность разработки и совершенствования раневых покрытий диктуется задачами современной хирургии и низкой эффективностью традиционных перевязочных средств. В медицине давно стоит проблема получения искусственных материалов, обладающих физико-химическими и биологическими свойствами, близкими к свойствам кожи, которые можно использовать в качестве раневых покрытий.
Условиями, обеспечивающими оптимальное заживление раны, являются: влажность раневой поверхности, достаточное напряжение кислорода в тканях раны, отсутствие избыточного количества раневого экссудата, предотвращение вторичного инфицирования, защита от внешних травмирующих воздействий и тепловых потерь.
Исходя из этого сформулированы требования к современным повязкам. Роль повязки сводится не только к защите раны от внешней среды и механической травматизации, ее назначение - активное воздействие на раневой процесс за счет создания наилучших условий для заживления и необходимой дозировки лекарственных средств, а также благоприятного микроклимата, достигаемого оптимальной паро- и газопроницаемостью и своевременным дренажом экссудата. Кроме того, повязка должна хорошо моделироваться на ране, плотно прилегать к раневой поверхности, иметь достаточную эластичность и механическую прочность, быть атравматичной, не оказывать токсического и местнораздражающего действия, не иметь антигенных и пирогенных свойств, быть устойчивой к стерилизации, комфортной в ношении, удобной в наложении и удалении, длительно эксплуатироваться на ране, иметь большой срок хранения. Используемые для этой цели раневые покрытия должны отвечать следующим требованиям: изолировать рану от попадания инфекции, защищать ее от высыхания, эффективно удалять избыток раневого экссудата и его токсических компонентов, обеспечивать влажную среду, газообмен, постоянную температуру вокруг раны, уменьшать теплоотдачу, обладать определенными антибактериальными свойствами, создавать оптимальную среду для регенерации и эпителизации, предотвращать травматизацию раны, потери тепла, белка и тканевой жидкости, защищать рану от загрязнения макрочастицами, обеспечивать возможность быть носителями для лекарственных препаратов. Биоматериалы, применяемые для создания раневых покрытий, должны быть достаточно прочными и эластичными, устойчивыми к стерилизации, удобными в применении для больного и медперсонала, биосовместимыми с дермальными тканями, а так же биодеградирующими [Шаповалов С.Г. // ФАР Миндекс-Практик. 2008. №8. С.38-46].
Однако ни одно из имеющихся к настоящему времени биопокрытий не удовлетворяет хирургов в полной степени. Все это ставит задачу разработки нового поколения материалов для решения проблем хирургии, способных не только выполнять защитные функции (закрытие раны от внешнего инфицирования, антибактериальное воздействие, дозированное сорбирование раневого экссудата и др.), но и способствовать развитию репарационных процессов вплоть до полной эпителизации поврежденной поверхности. Кроме того, одним из свойств новых биопокрытий должно явиться их эффективное воздействие на рану, что позволит уменьшить число болезненных перевязок и значительно увеличить интервал между ними.
В настоящее время наиболее удачно решают эту проблему покрытия, выполненные в виде листов или пленок из смеси синтетических полимеров и полимеров биологического происхождения, поскольку покрытия, выполненные только из синтетических полимеров, например монокомпонентные полиуретановые [Патент США №2871218, МПК C08G 18/66; C08G 18/76; C08G 18/00] или многокомпонентные из смеси полиуретана и полиаллилового эфира [Патент ФРГ №34098558], обладают хорошими физико-механическими свойствами, достаточно прочные, водо- и паропроницаемые, но выполняют только защитную функцию и не обладают способностью стимулировать регенерационные процессы. С другой стороны, покрытия, выполненные только из биополимеров, например монокомпонентные из коллагена [Патент США №4578067, A61L 15/32; A61L 15/16; A61F 13/16; A61L 15/00] или многокомпонентные из смеси желатина и хитозана [Патент США №4572906, A61L 26/00; C08L 5/08; C08L 89/06; A61F 13/00; A61K 31/70; A61K 37/00; C09D 3/04], смеси коллагена, хитозана и гликозоаминогликанов [Патент WO 88/10123, МПК A61L 27/00; A61L 27/26; A61L 27/34; C08L 89/06; C12N 5/00; A61L 27/00; C08L 89/00; C12N 5/00; A61L 15/04], хорошо стимулируют регенерационные процессы, но обладают низкими физико-механическими свойствами: хрупкие в сухом и непрочные во влажном состоянии, быстро разрушаются под действием ферментов, находящихся в биологических жидкостях раны, что приводит к потере защитных функций.
Известно достаточно много образцов раневых покрытий, отличающихся по химическому составу. Из существующего в настоящее время широкого ассортимента полимерных раневых покрытий в наибольшей степени отвечают всем медико-биологическим требованиям биодеградируемые покрытия из полисахаридов, которые могут быть полезны как на ранних стадиях лечения ран, так и на более поздних. Общими свойствами биосовместимых материалов из полисахаридов (в том числе хитозана) является их гидрофильность, обусловливающая высокую адсорбирующую способность (до 5000%), хорошая адгезия к ране, отсутствие токсичности и раздражающего действия, а также гемостатические свойства. Отмечено их стимулирующее действие на процессы заживления ран и ожогов, что способствует более быстрому развитию грануляционной ткани, ускорению эпителизации. Присутствие на ране полисахаридных материалов благоприятно сказывается на репарационных процессах на всех стадиях лечения раны. Основной проблемой получения покрытий из природных полисахаридов является достижение хорошей механической прочности покрытия и устойчивости на ране. Разработка биодеградируемых полимерных покрытий с высокой сорбирующей способностью и различными сроками рассасывания является в настоящее время наиболее актуальным направлением в области создания эффективных биологических повязок для лечения ран.
В настоящее время широко исследуются для решения указанной выше задачи биологические материалы на основе аминополисахарида хитина и его деацетилированного производного хитозана.
В последние годы препараты на основе хитозана и его композиций с другими природными, искусственными или синтетическими полимерами находят применение в регенеративной медицине в качестве порошкообразных [Патент РФ №2086247, МПК A61K 35/70; Алексеев А.А., Феофилова Е.П., Терешина В.М. и др.// Комбустиология. 2002. №4. http://burn.ru/all/number/show/?id=3493] или гелеобразных дерматопротекторных средств [Патент РФ №2258515, МПК A61K 31/722, A61K 31/355, A61K 9/08, А61Р 17/02], перфорированных пленочных покрытий для лечения ран [Патент РФ №2219954, МПК A61L 15/28], гидроколлоидных аппликационных покрытий [Патент РФ №2219955, МПК A61L 15/32, A61L 15/22, А61Р 17/02], покрытий губчатого типа [Патент РФ №2240830, МПК A61L 15/44], биологических композиций [Патент РФ №2108114, МПК A61L 15/28], гидрогелевых перевязочных средств [Патент РФ №2270646, МПК A61F 13/02, A61L 15/22, A61L 15/44, A61L 15/60] и др. При этом у материалов с волокнистой структурой отмечены более высокие кинетические характеристики, а также улучшенные биологические свойства.
Покрытия из хитозана воздухо- и паропроницаемы, препятствуют инвазии извне микроорганизмов, создают оптимальный микроклимат в ране, способствуют клеточному росту и пролиферации в ране. Хитозан, помимо стимулирования пролиферации на первых стадиях раневого процесса, очень полезен на завершающей фазе заживления - перестройке рубца. Его присутствие в ране помогает избежать образования грубых рубцов.
Известна повязка, один из вариантов которой содержит хитозан и выполнен в форме эластичной перфорированной пленки [Заявка РФ №99100105/14, МПК A61L 15/26, A61L 15/28, A61L 15/64].
Недостатками являются: многослойность и, как следствие, невозможность полной конгруэнтности с раневой поверхностью, удаление раневого отделяемого путем впитывания сорбирующим слоем повязки, что приводит к неизбежности частой смены повязок.
Известна также биологически активная полимерная сорбирующая пленка, созданная на основе хитозана [Кильдеева Н.Р., Вихорева Т.А., Ларионова А.С, Гальбрайх Л.С. // Современные подходы к разработке эффективных шовных материалов и полимерных имплантатов: Матер. III международ. Конф. М. 1998. 130-131 с.], содержащая ферментативный препарат трипсин и модифицированная сшивающим реагентом - додецилсульфатом натрия, проявляющим, кроме того, антимикробные свойства.
Недостатками являются: плохая моделируемость на ране, низкая прочность повязки во влажном состоянии, что создает вероятность выброса раневого отделяемого из повязки в раневую зону, а присутствие токсичного для организма человека реагента - додецилсульфата натрия.
Известна полимерная пленка на рану на основе хитозана, имеющая толщину 5-50 мкм, модифицированная сшивающим агентом - эпихлоргидрином, которая также может содержать 0-20% поливинилового спирта или полиэтиленгликоля и антибактериальные или антисептические вещества [Патент WO 2001/0141820 А1, МПК A61L 15/28; A61L 15/16].
Недостатки: относительно невысокая адсорбирующая способность пленки, быстрая биодеградация пленки в раневой среде, что затрудняет очищение раны, т.к. адсорбируемое пленкой раневое отделяемое и продукты биодеградации остаются в ране, полное удаление пленки возможно лишь при использовании на относительно сухих ранах.
Известна повязка, представляющая собой перфорированную пленку и содержащая хитозан в виде соли органической кислоты (уксусной, янтарной или гликолевой), глутаровый альдегид, поливиниловый спирт и биологически активную добавку в виде CO2-экстрактов лекарственных растений [Патент РФ 2219954, МПК A61L 15/28].
Недостатки повязки: недостаточная конгруэнтность с раневой поверхностью, невысокая адсорбирующая способность, ограниченная паропроницаемость, невозможность своевременного удаления избыточного раневого отделяемого из-за выполнения перфорации в виде отверстий или насечек. В случае использования в качестве биологически активной добавки CO2-экстрактов лекарственных растений (например, тысячелистника, облепихи, подорожника, эвкалипта, полыни горькой, зверобоя, кориандра) повышается вероятность развития аллергических реакций. Недостатками являются также сложный состав повязки, включение в нее токсичного глутарового альдегида, низкие эластичные свойства из-за увеличения сшивок между глутаровым альдегидом, хитозаном и поливиниловым спиртом.
Известна биологическая композиция для лечения ран «Коллахит», содержащая хитозан, глутаровый альдегид и антисептические препараты - синтетические или растительного происхождения, являющаяся биодеградируемым средством [Патент РФ №2108114, МПК A61L 15/28]. Композиция «Коллахит» может быть выполнена в форме пленки или губки.
Недостатками являются: высокая адгезия к раневой поверхности, невозможность использования на всех стадиях раневого процесса, необходимость частых перевязок, фрагментируемость повязки в результате ее лизиса при увеличении срока экспозиции повязки на ране, трудности при проведении перевязок, связанные с прилипанием повязок к ране. При наличии в ране даже умеренного количества раневого отделяемого отмечается лизис покрытия в течение первых суток его применения и образование на поверхности р