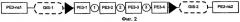Способы и композиции для лечения заболевания
Иллюстрации
Показать всеГруппа изобретений относится к медицине, конкретно к онкологии, и касается способов лечения или индивидуализации лечения рака у субъекта путем специфичного удаления злокачественных клеток из популяции клеток периферической крови, а также как такового способа специфичного удаления злокачественных клеток из популяции клеток периферической крови, предназначенной для аутотрансплантации. Получают популяцию клеток периферической крови, содержащую злокачественные и незлокачественные клетки, у субъекта, затем определяют активность по меньшей мере одного маркерного гена рака в указанной популяции клеток. Далее вводят в клетки полинуклеотид, кодирующий селектируемый маркер и полипептид, который является летальным для указанных злокачественных клеток, где экспрессия летального полипептида находится под прямым или опосредованным контролем промотора маркерного гена рака. После этого клетки подвергают воздействию в условиях селекции с получением клеток, содержащих указанный полинуклеотид. Далее обрабатывают полученные клетки в условиях индукции экспрессии летального полипептида, который убивает клетки, экспрессирующие маркерный ген рака. Затем убитые клетки отделяются от живых клеток, которые возвращают в организм субъекта. Предложенный новый способ специфичного удаления злокачественных клеток позволяет не только избежать реинфузии раковых клеток в организм пациента при аутотрансплантации, но и дает возможность индивидуализировать лечение злокачественного заболевания у субъекта путем конструирования индивидуального терапевтического полинуклеотида в зависимости от генотипа субъекта. 4 н. и 41 з.п. ф-лы, 8 ил., 5 пр.
Реферат
Предшествующий уровень техники
Область изобретения
Настоящее изобретение относится к способам и композициям для лечения субъекта, предназначенным для разрушения пораженных клеток у этого субъекта посредством селективной экспрессии летального полипептида в клетках, экспрессирующих по меньшей мере один маркерный ген заболевания.
Предшествующий уровень техники
Рак представляет собой набор заболеваний, являющихся результатом неконтролируемого клеточного роста, который вызывает хроническую боль и является причиной смерти более чем 300000 людей за один год только в Соединенных Штатах Америки. Онкогены представляют собой гены, которые по существу стимулируют рост раковых клеток. Полагают, что развитие рака зависит от активации онкогенов и сопутствующей инактивации генов-супрессоров роста (Park, M., "Oncogenes" в The Genetic Basis of Human Cancer (B.Vogelstein et al., eds.) pp.205-228 (1998)). Онкогены представляют собой мутированные, доминантные формы клеточных протоонкогенов, стимулирующие клеточную пролиферацию, в то время как гены-супрессоры опухолей являются рецессивными и в норме ингибируют клеточную пролиферацию.
Лечение раковых пациентов химиотерапевтическими агентами остается важнейшим способом лечения системного заболевания, и имеется прямая связь между интенсивностью химиотерапевтической дозы и показателем клинического ответа. Однако возрастающие дозы химиотерапии оказывают значительные побочные эффекты, включая повсеместную деструкцию гемопоэтических клеток-предшественников костного мозга с сопровождающей ее деструкцией клеточной насыщенности периферических миелоидных и лимфоидных тканей. Для облегчения восстановления гемопоэтической системы после химиотерапии часто в сочетании с высокой дозой химиотерапии используют трансплантацию стволовых клеток.
Часто используют трансплантацию аллогенных стволовых клеток, что представляет собой трансплантацию стволовых клеток донора, отличного от пациента. Однако выполнение протокола аллогенной трансплантации приводит к высокому коэффициенту смертности главным образом из-за реакции "трансплантат против хозяина" (GVD), когда трансплантированные клетки атакуют собственные ткани пациента.
Протокол трансплантации аутологических стволовых клеток представляет собой протокол, где стволовые клетки пациента выделяют до применения высокодозовой химиотерапии и впоследствии вводят путем реинфузии. Аутотрансплантация позволяет избежать осложнений, связанных с GVD, но может приводить к реинфузии опухолевых клеток из содержащего стволовые клетки продукта. Важность реинфузии опухолевых клеток заключается в том, что поступающие путем реинфузии опухолевые клетки могут вносить непосредственный вклад в развитие рецидива заболевания и приводить к плохому клиническому исходу, что было продемонстрировано в исследованиях с маркировкой генов. Например, в случаях лимфомы, лейкоза, рака молочной железы и нейробластомы, по меньшей мере некоторые из примесных опухолевых клеток при выполнении протокола трансплантации стволовых клеток периферической крови обладают способностью к клоногенному росту in vitro (Ross, et al., Blood 82: 2605-2610 (1993)), а также и в организме пациента.
Чтобы избежать реинфузии раковых клеток в организм пациента, подвергаемого трансплантации аутологических стволовых клеток, практикующие врачи предпринимают попытки "очистить" клетки костного мозга от загрязняющих их опухолевых клеток. Разработаны различные подходы для очистки ex vivo популяции стволовых клеток от примесных опухолевых клеток. Например, использование моноклональных антител против мембранных антигенов с цитотоксическими лекарственными средствами, токсинами, фототерапией и биологически активными модификаторами или цитотоксических лекарственных средств может снизить загрязнение опухолевыми клетками на 1-3 порядка по величине (Seiden, et al., J. Infusional Chemotherapy 6:17-22 (1996); включено посредством ссылки). В соответствии с другим протоколом, в попытке очистить опухолевые клетки использовали направленные на опухолевые клетки антитела, конъюгированные с радиоактивными изотопами. Использование цитотоксических лекарственных средств и/или радиоактивных изотопов может не обладать специфичностью, поскольку опухолевые клетки и клетки-предшественники зачастую проявляют схожий фенотип в отношении белков клеточной поверхности, и применение таких методик может препятствовать приживлению трансплантата. Для уменьшения реинфузии опухолевых клеток также применяли селекцию CD34+ гемопоэтических клеток-предшественников, хотя и с гораздо меньшей эффективностью очистки. И вновь, эти способы селекции, основанные на CD34, могут не обладать достаточной специфичностью, поскольку опухолевые клетки часто могут проявлять СD34-антиген.
Таким образом, в данной области существует потребность в разработке новых способов специфичного удаления пораженных клеток из клеточной популяции, предназначенной для аутотрансплантации.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способам и композициям для лечения субъекта, предназначенным для разрушения пораженных клеток у этого субъекта. В одном воплощении способы включают получение популяции клеток от субъекта и определение активности по меньшей мере одного маркерного гена заболевания в популяции полученных клеток. Затем молекулу полинуклеотида, кодирующую селектируемый маркер и летальный полипептид, вводят в клетки, где экспрессия летального полипептида находится под контролем промотора по меньшей мере одного из идентифицированных ранее маркерных генов заболевания. Летальный пептид определяют как полипептид, сам по себе являющийся летальным для данных клеток или который дает продукт, летальный для данных клеток. После введения полинуклеотида клетки подвергают воздействию в условиях селекции с целью получения клеток, содержащих полинуклеотид, и затем клетки обрабатывают в условиях индукции экспрессии летального полипептида с целью разрушения клеток, экспрессирующих маркерный ген(ы) заболевания. После разрушения пораженных клеток оставшиеся живые клетки, которые не экспрессировали летальный полипептид в той степени, которая необходима для того, чтобы убить эти клетки, отделяют от мертвых клеток, и эти живые клетки возвращают в организм субъекта.
В одном воплощении изобретения полинуклеотид, введенный в клетки, удаляют перед возвращением клеток в организм субъекта, в другом воплощении полинуклеотид не удаляют из клеток перед возвращением клеток в организм субъекта. Это позволяет осуществлять деструкцию возвращенных клеток in vivo при появлении рецидива заболевания.
Другое воплощение изобретения относится к способам индивидуализации лечения субъекта, нуждающегося в лечении аномального состояния, включающим получение популяции клеток от субъекта, определение активности по меньшей мере одного маркерного гена заболевания в популяции клеток, выделение по меньшей мере одного промотора маркерного гена заболевания и создание терапевтического полинуклеотида путем прямого или опосредованного связывания промотора с полинуклеотидом, кодирующим полипептид, являющийся летальным для указанных клеток, и размещения его в вектор, дополнительно включающий селектируемый маркер. Терапевтический полинуклеотид вводят в клетки, и клетки подвергают воздействию в условиях селекции с целью получения клеток, содержащих полинуклеотид, и затем обрабатывают в условиях индукции экспрессии летального полипептида, тем самым разрушая клетки, экспрессирующие маркерный ген заболевания. Оставшиеся живые непораженные клетки затем возвращают обратно субъекту.
Краткое описание графических материалов
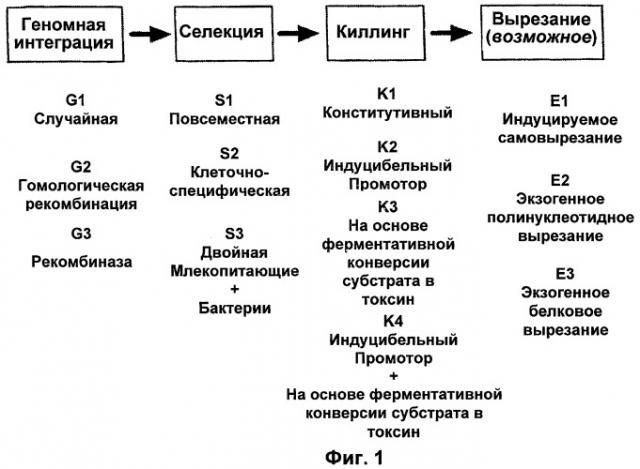
На Фиг.1 изображена рабочая схема последовательности операций типичного процесса обработки с использованием способов по настоящему изобретению. Способы, изображенные на Фиг.1, включают геномную интеграцию, селекцию и киллинг. Возможно, что конструкции могут быть вырезаны из генома. На рисунке также приведены неограничивающие вариации способов, которые находятся в пределах объема настоящего изобретения. Любой способ геномной интеграции (G1, G2 или G3) может быть комбинирован с любым способом селекции (S1, S2 или S3) и клеточного киллинга (K1, K2, K3 или K4). В свою очередь, также может быть выбран любой способ вырезания из генома (Е1, Е2 или Е3), если в данном геноме присутствуют компоненты, которые будут допускать вырезание.
На Фиг.2 изображено одно из воплощений терапевтических полинуклеотидов по настоящему изобретению. На Фиг.2 генная программа (gene program) PE3-1 представляет собой селекторный/репортерный ген геномной интеграции. Генная программа РЕ3-2 представляет собой промотор маркерного гена заболевания, управляющий экспрессией летального полипептида, например DTA (дифтерийный токсин). Генная программа РЕ3-3 представляет собой индуцибельный промотор, например TetO (тетрациклиновый оператор), управляющий экспрессией рекомбиназы, например Cre. Генная программа РЕ3-4 представляет собой конститутивный промотор, управляющий экспрессией индукторной кДНК, например rТТА (обратный тетрациклин-контролируемый трансактиватор). Генные программы РЕ3-ns представляют собой негативные селекторные/репортерные гены, которые могут быть использованы для улучшения целевой эффективности. Символ в виде стрелки означает цис-регуляторные последовательности, например IoxP, которые распознаются ферментом рекомбиназой, например Cre. Круги означают области в полинуклеотидной последовательности, которые могут содержать домен модификации хроматина (CMD). GIS-1 и GIS-2 представляют собой сайты геномной интеграции.
На Фиг.3 изображено другое воплощение терапевтических полинуклеотидов по настоящему изобретению. На фиг.3 генная программа PE3-1 представляет собой селекторный/репортерный ген геномной интеграции. Генные программы РЕ3-2 и РЕ3-3 каждая представляет собой промотор маркерного гена заболевания, управляющий экспрессией одной из двух половинок транскрипционного фактора Rheo. Генная программа РЕ3-4 представляет собой промотор Rheo, управляющий экспрессией летального полипептида, например DTA. Промотор Rheo требует присутствия транскрипционного фактора Rheo, который состоит из двух субъединиц, связанных вместе в присутствии лиганда. Каждая из субъединиц транскрипционного фактора Rheo экспрессируется под действием генных программ РЕ3-2 и РЕ3-3, соответственно. Генная программа РЕ3-5 представляет собой конститутивный промотор, управляющий экспрессией индукторной кДНК, например rТТА. Генная программа РЕ3-6 представляет собой индуцибельный промотор, например TetO, управляющий экспрессией рекомбиназы, например Cre. Генные программы РЕ3-ns представляют собой негативные селекторные/репортерные гены, которые могут быть использованы для улучшения целевой эффективности. Символ в виде стрелки означает цис-регуляторные последовательности, например IохР, которые распознаются ферментом рекомбиназой, например Cre. Круги означают области в полинуклеотидной последовательности, которые могут содержать домен модификации хроматина (CMD). GIS-1 и GIS-2 представляют собой сайты геномной интеграции.
На Фиг.4 изображено другое воплощение терапевтических полинуклеотидов по настоящему изобретению. На Фиг.4 генная программа РЕ3-1 представляет собой селекторный/репортерный ген геномной интеграции. Генная программа РЕ3-2 представляет собой промотор маркерного гена заболевания, управляющий экспрессией летального полипептида, например DTA. Генная программа РЕ3-3 представляет собой промотор маркерного гена заболевания, управляющий экспрессией летального полипептида. Промотор и летальный полипептид могут быть идентичными промотору и летальному полипептиду в генной программе РЕ3-2 или отличаться от них. Генная программа РЕ3-4 представляет собой конститутивный промотор, управляющий экспрессией индукторной кДНК, например rТТА. Генная программа РЕ3-5 представляет собой индуцибельный промотор, например TetO, управляющий экспрессией рекомбиназы, например Cre. Генные программы РЕ3-ns представляют собой негативные селекторные/репортерные гены, которые могут быть использованы для улучшения целевой эффективности. Символ в виде стрелки означает цис-регуляторные последовательности, например IохР, которые распознаются ферментом рекомбиназой, например Cre. Круги означают области в полинукпеотидной последовательности, которые могут содержать домен модификации хроматина (CMD). GIS-1 и GIS-2 представляют собой сайты геномной интеграции.
На Фиг.5 изображено одно из воплощений терапевтических полинуклеотидов по настоящему изобретению. На Фиг.5 генная программа РЕ3-1 представляет собой селекторный/репортерный ген геномной интеграции. Генная программа РЕ3-2 представляет собой промотор маркерного гена заболевания, управляющий экспрессией летального полипептида, например DTA. Генная программа РЕ3-3 представляет собой конститутивный промотор, управляющий экспрессией индукторной кДНК, например rТТА. Генная программа РЕ3-4 представляет собой индуцибельный промотор, например TetO, управляющий экспрессией рекомбиназы, например Cre. Генная программа РЕ3-5 представляет собой конститутивный промотор, управляющий экспрессией факторов, которые стимулируют дедифференцировку клеток-предшественников. Генные программы РЕ3-ns представляют собой негативные селекторные/репортерные гены, которые могут быть использованы для улучшения целевой эффективности. Символ в виде стрелки обозначает цис-регуляторные последовательности, например IохР, которые распознаются ферментом рекомбиназой, например Cre. Круги означают области в полинуклеотидной последовательности, которые могут содержать домен модификации хроматина (CMD). GIS-1 и GIS-2 представляют собой сайты геномной интеграции.
На Фиг.6 изображено одно из воплощений терапевтических полинуклеотидов по настоящему изобретению. На Фиг.6 генная программа РЕ3-1 представляет собой селекторный ген neo под контролем конститутивного промотора. Генная программа РЕ3-2 представляет собой промотор маркерного гена заболевания, управляющий экспрессией индукторной кДНК, например rТТА. Генная программа РЕ3-3 представляет собой индуцибельный промотор, например TetO, управляющий экспрессией летального полипептида, например DTA. Круги означают области в полинуклеотидной последовательности, которые могут содержать домен модификации хроматина (CMD).
На Фиг.7 изображено одно из воплощений терапевтических полинуклеотидов по настоящему изобретению. На Фиг.7 генная программа РЕ3-1 представляет собой селекторный ген геномной интеграции, например neo, управляемый промотором, специфическим для клеток-предшественников. Генная программа РЕ3-2 представляет собой промотор маркерного гена заболевания, управляющий экспрессией индукторной кДНК, например rТТА. Генная программа РЕ3-3 представляет собой индуцибельный промотор, например TetO, управляющий экспрессией гена-киллера, например DTA. Генная программа РЕ3-4 представляет собой конститутивный промотор, управляющий экспрессией второй индукторной кДНК, например RheoCept®. Генная программа РЕ3-5 представляет собой индуцибельный промотор, например RheoSwitch®, управляющий экспрессией рекомбиназы, например Cre, с целью делетирования конструкции. Символы в виде стрелок обозначают цис-регуляторную последовательность, распознаваемую ферментом рекомбиназой, например сайт IохР. Круги означают область в полинуклеотидной последовательности, которая может содержать домен модификации хроматина (CMD).
На Фиг. 8 изображено одно из воплощений терапевтических полинуклеотидов по настоящему изобретению. На Фиг.8 генная программа РЕ3-1 представляет собой селекторный ген геномной интеграции, управляемый промотором стволовых клеток. Генная программа РЕ3-2 представляет собой промотор маркерного гена заболевания, управляющий экспрессией индукторной кДНК, например rТТА. Генная программа РЕ3-3 представляет собой индуцибельный промотор, например TetO, управляющий субстратом на основе фермента для летальной конверсии гена-киллера, например тимидинкиназы. Генные программы РЕ3-ns представляют собой негативные селекторные гены, например конститутивный промотор, управляющий экспрессией цитозиндеаминазы (CDA) или дифтерийного (DTA) токсина, для улучшения целевой эффективности. Круги означают область в полинуклеотидной последовательности, которая может содержать домен модификации хроматина (CMD). GIS-1 и GIS-2 представляют собой сайты геномной интеграции.
Подробное описание изобретения
Настоящее изобретение относится к способам и композициям для лечения субъекта, направленным на разрушение пораженных клеток у этого субъекта. Способы включают получение популяции клеток от субъекта и определение активности по меньшей мере одного маркерного гена заболевания в популяции полученных клеток. Затем молекулу полинуклеотида, которая кодирует полипептид, летальный в отношении данных клеток, вводят в клетки, где экспрессия летального полипептида находится под контролем промотора по меньшей мере одного из идентифицированных ранее маркерных генов заболевания. После введения полинуклеотида клетки обрабатывают в условиях индукции экспрессии летального полипептида с целью разрушения клеток, экспрессирующих маркерный ген(ы) заболевания. После разрушения пораженных клеток оставшиеся живые клетки, которые не экспрессировали летальный полипептид в той степени, которая необходима для того, чтобы убить эти клетки, отделяют от мертвых клеток, и живые клетки возвращают обратно в организм субъекта.
В одном воплощении изобретения полинуклеотид, введенный в клетки, удаляют перед возвращением клеток в организм субъекта. В другом воплощении полинуклеотид не удаляют из клеток перед возвращением клеток в организм субъекта. Это позволяет осуществлять деструкцию введенных обратно клеток in vivo при появлении рецидива заболевания.
Как использовано в данном описании, термин "пораженная клетка" применяется для обозначения клетки или клеток с отклонениями от нормы либо в метаболизме, гистологии, скорости роста, скорости митоза, либо в фенотипе. Использованный в данном описании в отношении клеток термин "фенотип" применяется для обозначения совокупности белков, которые в норме клетка экспрессирует из конкретных ткани или органа. Например, фенотипы индивидуальных выделенных клеток могут быть оценены или классифицированы на основании наличия или отсутствия маркеров клеточной поверхности, таких как кластеры дифференцировки (CD факторы), которые представляют собой антигены клеточной поверхности. Несмотря на то, что обычно считается, что фенотипом клеток является совокупность белков, которые клетка экспрессирует или содержит, для адекватной классификации клетки в заданной популяции или субпопуляции либо для оценки ее фенотипа может быть необходимо только определить наличие или отсутствие единственного белка. Таким образом, используемый в данном описании термин "фенотип" применяется для соотнесения с конкретной популяцией или субпопуляцией, к которой принадлежит клетка, на основании наличия или отсутствия по меньшей мере одного белка или его части. Например, конкретные воплощения настоящего изобретения включают выделение CD34+-клеток, которые в норме обнаруживаются в периферической крови и костном мозге. Продолжая пример, фенотип заданной популяции или субпопуляции выделенных клеток просто может быть установлен как позитивный по CD34 (CD34+) или негативный по CD34 (CD34-). Несомненно, с целью классификации клетки в заданной популяции или субпопуляции клеток способы по настоящему изобретению также включают определение наличия или отсутствия более чем одного белка. Примеры CD-белков, которые могут быть использованы для классификации клеточных фенотипов, включают, но этим не ограничиваются, CD3, CD38, CD59, CD49, CD54, CD61 (витронектиновый рецептор), CD71, CD73 (SH3), CD90 (Thy-1), CD105 (SH2), CD117, CD133, CD144 и CD166. Для определения фенотипа заданной клетки или популяции клеток также можно использовать и другие белки. Примеры других белков, которые можно использовать для классификации клеточного фенотипа, включают, но этим не ограничиваются, транскрипционные факторы, такие как ОСТ4, cdx2 и Sox2, белки-транспортеры, такие как плацентарный АВС(АТФ-связывающий кассетный)-транспортер (АВС-р), и другие антигены клеточной поверхности, такие как кератинсульфат-ассоциированные антигены, TRA-1-60, TRA-1-81, Thy-1 и стадиеспецифичные эмбриональные антигены (SSEA), например SSEA-1, SSEA-2, SSEA-3 и SSEA-4. Следующие примеры белков, которые могут быть использованы для классификации клеточного фенотипа, включают рецепторы ростовых факторов, такие как рецепторы к фактору роста фибробластов (FGF), трансформирующему ростовому фактору-альфа (TGFα), трансформирующему ростовому фактору-бета (TGFβ), активину IIа и белку, участвующему в остеогенезе (BMP), а также белки главного комплекса гистосовместимости (МНС), т.е. белки МНС класса I и класса II. Следующие примеры маркеров, которые могут быть использованы для идентификации клеточных фенотипов, представляют собой СК (цитокератин) 9, СК19, pdx-1, нестин, Рах-6, Nk×2.2, нейрофиламент, Таи, нейрон-специфическую енолазу (NSE), нейрофиламентозный белок (NF), ассоциированный с микротрубочками белок 2 (МАР2), МАР2-киназу, фибриллярный кислый белок глии (GFAP) и циклонуклеотид-фосфодиэстеразу. К тому же, для оценки или классификации клеточного фенотипа также может оказаться возможным детектировать наличие или отсутствие частей или доменов белков, а не целого белка. Например, некоторые белки могут содержать src-гомологичный домен (SH), такой как SH1, SH2, SH3, SH4 и т.д., наличия или отсутствия которого может быть достаточно для адекватной оценки или классификации клеточного фенотипа, например SH2+ или SH2-. Как описано выше, фенотип клеток также может быть оценен или классифицирован по отсутствию конкретных белков.
Способы идентификации клеточных фенотипов включают, но этим не ограничиваются, стандартные иммуногистохимические методики с использованием антиген-специфических антител, таких как, например анти-CD34 антитела. Другие способы оценки или классификации клеточного фенотипа включают, но этим не ограничиваются, стандартные методики блоттинга, такие как вестерн-блоттинг и нозерн-блоттинг, и методики полимеразной цепной реакции (ПЦР), такие как ПЦР с использованием обратной транскриптазы (ОТ-ПЦР). В самом деле, должно быть очевидно, что непрямые способы, такие как анализы с измерением или детекцией мРНК, например ОТ-ПЦР, можно использовать для оценки или классификации клеточного фенотипа. Другие способы оценки или классификации фенотипов клеток включают методики с применение микромассивов и методики проточной цитометрии. Примеры методик проточной цитометрии, полезных для сортинга клеток, основанных на их фенотипе, описаны в книге Practical Flow Cytometry, 3-е издание, Wiley-Liss, Inc. (1995), которая тем самым включена посредством ссылки.
Пораженная клетка может иметь, например, аномальный фенотип по сравнению с другими клетками, взятыми из того же источника или ткани. Например, гемопоэтические стволовые клетки в норме экспрессируют CD34 и CD59, но не экспрессируют CD4, который в норме экспрессируется тимоцитами, Т-хелперными клетками, макрофагами, клетками Лангерганса, дендритными клетками или гранулоцитами. Поэтому любая гемопоэтическая стволовая клетка, которая экспрессирует CD34, CD59 и CD4, для задач настоящего изобретения может считаться имеющей аномальный фенотип, т.е. являться пораженной клеткой. В одном воплощении клетки включают гемопоэтические стволовые клетки, среди которых по меньшей мере часть гемопоэтических стволовых клеток представляют собой пораженные клетки.
Другие примеры стволовых клеток включают, но этим не ограничиваются, стволовые клетки печени, стволовые клетки молочной железы, панкреатические стволовые клетки, нейронные стволовые клетки, мезенхимные стволовые клетки и эмбриональные стволовые клетки. Стволовые клетки могут быть или могут не быть плюрипотентными. "Плюрипотентные клетки" включают клетки и их потомство, которые могут быть способны к дифференцировке в, или способны давать плюрипотентные, мультипотентные, олигопотентные и унипотентные клетки. "Мультипотентные клетки" включают клетки и их потомство, которые могут быть способны к дифференцировке в, или способны давать мультипотентные, олигопотентные и унипотентные клетки-предшественники и/или один или более чем один тип зрелых или частично зрелых клеток, за исключением того, что типы зрелых или частично зрелых клеток, происходящих из мультипотентных клеток, ограничены клетками конкретной ткани, органа или системы органов. Как использовано в данном описании, "частично зрелыми клетками" являются клетки, которые демонстрируют по меньшей мере одну характерную черту фенотипа, такую как морфология или экспрессия белков, зрелой клетки из того же органа или ткани. Например, мультипотентная гемопоэтическая клетка-предшественник и/или ее потомство обладают способностью к дифференцировке в, или способны давать один или более типов олигопотентных клеток, таких как миелоидные клетки-предшественники и лимфоидные клетки-предшественники, и кроме того способны давать другие зрелые клеточные компоненты, в норме обнаруживаемые в крови. "Олигопотентные клетки" включают клетки и их потомство, чья способность к дифференцировке в зрелые или частично зрелые клетки более ограничена по сравнению с мультипотентными клетками. Однако олигопотентные клетки все еще могут обладать способностью к дифференцировке в олигопотентные и унипотентные клетки и/или один или более чем один тип зрелых или частично зрелых клеток заданной ткани, органа или системы органов. Одним из примеров олигопотентной клетки является миелоидная клетка-предшественник, которая в конечном счете способна давать зрелые или частично зрелые эритроциты, тромбоциты, базофилы, эозинофилы, нейтрофилы и моноциты. "Унипотентные клетки" включают клетки и их потомство, которые обладают способностью к дифференцировке в, или способны давать другие унипотентные клетки и/или один тип зрелых или частично зрелых клеток. Используемый в данном описании термин "клетка-предшественник" применяется для обозначения клеток и их потомства, которые могут дифференцироваться по меньшей мере в частично зрелые клетки, но не обладают способностью к неограниченному самовосстановлению в культуре. Клетки-предшественники, как они использованы в данном описании, могут быть плюрипотентными, мультипотентными, олигопотентными или даже унипотентными.
Способы по настоящему изобретению включают получение популяции клеток от субъекта, нуждающегося в лечении. Используемый в данном описании термин "субъект" применяется взаимозаменяемо с термином "пациент" и используется для обозначения животного, в частности млекопитающего, и еще более конкретно примата, не являющегося или являющегося человеком.
Используемый в данном описании термин "получение", когда он применен в отношении клеток, предназначен для обозначения любого способа изъятия клеток у субъекта. Нет необходимости в выделении или очистке клеток, если они получены от субъекта. Клетки могут быть получены из любой жидкости организма субъекта (например крови, сыворотки, мочи, слюны, цереброспинальной жидкости) или из образцов ткани субъекта (например биоптатов, пунктатов костного мозга). После того как получены, желаемые клетки далее могут быть выделены.
Используемый в данном описании термин "выделенный" или "выделение" либо его варианты, когда он применен в отношении клетки или популяции клеток, означает, что клетка или популяция клеток отделены от большей части присутствующих окружающих молекул и/или веществ, которые окружают клетку или клетки, когда клетка или клетки находились в ассоциации с биологической системой (например, в костном мозге). Концентрацию таких веществ, как вода, соли и буфер, не учитывают, когда определяют, является ли клетка "выделенной". Таким образом, термин "выделенный" не предназначен для обозначения очищенной популяции клеток конкретного фенотипа или указания на нее, также не предназначен для обозначения популяции клеток, полностью свободных от остатков клеток, нежизнеспособных клеток или клеток другого фенотипа. Методы выделения клеток не должны ограничивать объем изобретения, изложенный в данном описании. Например, клетки могут быть выделены с использованием хорошо известных методов, таких как проточная цитометрия или другие методы, использующие клеточный фенотип. Дополнительные методы выделения клеток включают использование позитивных или негативных "селекторов", которые могут содержаться в терапевтических конструкциях, так что клетки могут быть выделены до или после введения терапевтического полинуклеотида в эти клетки. Таким образом, в одном воплощении конструкция может содержать позитивный "селектор", который может быть использован для "выделения" желаемых клеток из других клеток, полученных изначально. Используемый в данном описании термин "очищенный", когда он применен в отношении клетки или популяции клеток, означает, что клетка или клетки отделены по существу от всех веществ, которые в норме окружают клетку или клетки, когда данная клетка или клетки были связаны с биологической системой. Таким образом, термин "очищенный" является относительным и основывается на изменении в состояниях в терминах клеток и/или веществ, очень близких к выделенным клеткам, являющихся очищенными. Таким образом, выделенные гемопоэтические клетки считаются очищенными, даже если после выделения удаляется путем промывания или последующей обработки по меньшей мере некоторое количество клеточных остатков, нежизнеспособных клеток, клеток другого фенотипа или клеток либо таких молекул, как белки и/или углеводы. Термин "очищенный" не используется для обозначения того, что все вещество, предназначенное для удаления, удалено из клеток, являющихся очищенными. Поэтому некоторое количество примесей может присутствовать вместе с очищенными клетками.
В одном воплощении активность по меньшей мере одного маркерного гена заболевания определяют после того, как получены клетки, в другом воплощении активность по меньшей мере одного маркерного гена заболевания определяют до того, как клетки получены. Таким образом, можно допустить или предположить наличие активности одного или более маркерных генов заболевания, если заболевание или аномальное состояние у этого субъекта демонстрирует типичные симптомы или маркеры заболеваний или аномальных состояний, для которых установлена активность набора маркерных генов заболевания. Используемый в данном описании термин "маркерный ген заболевания" предназначен для обозначения гена, уровни экспрессии которого могут быть использованы для оценки, диагностики или помощи в постановке диагноза заболевания или аномального состояния. Маркерные гены заболевания включают гены, которые экспрессируются только в пораженных клетках, и гены, которые экспрессируются в обычных клетках, а в пораженных клетках экспрессируются с повышенными уровнями. Наиболее хорошо известными примерами маркерных генов заболевания являются онкогены, но способы по настоящему изобретению, однако, не ограничены онкогенами. Примеры классов онкогенов включают, но этим не ограничиваются, ростовые факторы, рецепторы ростовых факторов, протеинкиназы, регуляторы программированной клеточной смерти и транскрипционные факторы. Конкретные примеры онкогенов включают, но этим не ограничиваются, sis, erb В, erb B-2, ras, abl, myc и bcl-2 и TERT (теломеразная обратная транскриптаза). Примеры других маркерных генов заболевания включают гены опухолеассоциированных антигенов и другие гены, которые сверхэкспрессируются в пораженных клетках (например MAGE-1 (меланома-ассоциированный антиген 1), карциноэмбриональный антиген, тирозиназа, антиген предстательной железы, поверхностный антиген предстательной железы, р53, MUC-1 (муцин-1), MUC-2, MUC-4, HER-2/neu (рецептор 2 эпидермального фактора роста у людей/грызунов), Т/Th, MART-1 (меланомный антиген, распознаваемый Т-клетками), gp100, GM2 (ганглиозный антиген 2), Tn, sTn и антиген Томсена-Фриденрайха (TF)).
После того как маркерные гены заболевания определены, промоторы этих маркерных генов заболевания помещают в терапевтический полинуклеотид. Используемый в данном описании термин "терапевтический полинуклеотид" применяется для обозначения полинуклеотида, который вводят в популяцию клеток с целью разрушения пораженных клеток. В одном воплощении промотор вставлен в полинуклеотид таким образом, что он функционально связан с частью полинуклеотида, который кодирует полипептид, являющийся летальным в отношении клеток. Поэтому в способах используется аномальная активность пораженной клетки, так что пораженная клетка в конечном счете будет разрушать саму себя. Используемый в данном описании термин "функционально связанный" означает функциональную связь между последовательностью, контролирующей экспрессию нуклеиновой кислоты, (такой как промотор, или совокупность сайтов связывания транскрипционных факторов) и второй нуклеиновокислотной последовательностью, при этом контролирующая экспрессию последовательность управляет транскрипцией нуклеиновой кислоты, соответствующей второй последовательности. В другом воплощении промотор связан с экспрессией летального полипептида опосредованно. Например, промотор маркера заболевания может быть функционально связан с транскрипционным фактором, который активирует второй промотор, функцинально связанный с полинуклеотидом, кодирующим летальный полипептид.
Термин "промотор" применяется в данном описании аналогично его использованию в данной области техники. А именно, термин промотор относится к области ДНК, которая позволяет осуществлять связывание РНК-полимеразы с целью инициации транскрипции генетической последовательности. Последовательность многих маркерных генов заболевания, включая промоторную область, известна в данной области техники, и к ней есть доступ в опубликованных базах данных, например GenBank. Таким образом, после того, как в полученных или выделенных клетках идентифицирован маркерный ген заболевания, последовательность промотора можно легко идентифицировать и получить. Другой аспект настоящего изобретения относится к идентификации маркерного гена заболевания, промотор которого может быть выделен и помещен в терапевтический полинуклеотид. Поэтому идентификация маркерного гена заболевания может быть не критична для конкретных воплощений настоящего изобретения, если только промотор может быть выделен и использован в последующих условиях или окружениях. Следовательно, настоящее изобретение включает применение промоторов маркерных генов заболевания, которые еще будут идентифицированы. После того как новые маркерные гены заболевания идентифицированы, предметом обычной практики или экспериментирования может быть определение генетических последовательностей, необходимых для функционирования промотора. Действительно, существует несколько промышленных протоколов, оказывающих помощь в определении промоторной области генов, представляющих интерес. В качестве примера, Ding и др. недавно раскрыли последовательность промотора нового гена Sprouty4 (Am. J.Physiol. Lung Cell. Mol. Physiol., 287: L52-L59 (2004), что включено посредством ссылки) путем постепенного удаления 5'-фланкирующей последовательности гена Sprouty4 человека. Кратко, после того, как был определен сайт инициации транскрипции, были созданы ПЦР-фрагменты с использованием общих ПЦР-праймеров для клонирования сегментов 5'-фланкирующего сегмента в одном направлении. Образованные сегменты клонировали в люциферазный репортерный вектор и измеряли люциферазную активность с целью определения области промотора гена Sprouty4 человека.
Другой пример протокола получения и подтверждения достоверности промоторов маркерного гена заболевания включает следующие стадии: (1) получения образцов злокачественных и незлокачественных клеток/тканей подобного/того же самого тканевого типа; (2) выделения общей РНК или мРНК из данных образцов; (3) проведения дифференциального анализа с использованием микромассива злокачественных и незлокачественных РНК; (4) идентификации рак-специфических транскриптов-кандидатов; (5)