Контрастные агенты
Иллюстрации
Показать всеНастоящее изобретение относится к новым соединениям, содержащим две связанные йодированные фенильные группы, имеющим общую формулу (I), где R, R3 и Х имеют значения, приведенные в формуле изобретения, а также к применению в качестве контрастных агентов в диагностической рентгеновской визуализации и к рентгеновским диагностическим композициям, содержащим такие соединения. 6 н. и 9 з.п. ф-лы, 22 пр.
Реферат
Техническая область изобретения
Настоящее изобретение относится к классу соединений, которые являются йодсодержащими соединениями, и к диагностическим композициям, содержащим такие соединения. Более конкретно, эти йодсодержащие соединения представляют собой химические соединения, содержащие две связанные йодированные фенильные группы, имеющие общую формулу R-N(CHO)-X-N(R3)-R, где Х означает возможно замещенную алкиленовую группу, R3 означает атом водорода или ацильную функциональную группировку и каждый R означает трийодированный фенильный остаток, дополнительно замещенный гидрофильными группировками. Изобретение также относится к применению таких диагностических композиций в качестве контрастных агентов в диагностической визуализации, в частности в рентгеновской визуализации, и к контрастным средам, содержащим такие соединения.
Описание предшествующего уровня техники
Любая диагностическая визуализация основана на достижении разных уровней сигналов от разных структур в организме. Так, например, при рентгеновской визуализации на изображении данной визуализируемой структуры организма ослабление рентгеновского излучения этой структурой должно отличаться от ослабления рентгеновского излучения окружающими тканями. Разница в сигнале между структурой организма и ее окружением часто называется контрастом, и много усилий было направлено на создание средств усиления контраста при диагностической визуализации, поскольку чем больше контраст между структурой организма и ее окружением, тем выше качество изображений и больше их ценность для врача, ставящего диагноз. Более того, чем больше контраст, тем меньшего размера структуры организма могут быть визуализированы, то есть увеличение контраста может приводить к увеличению пространственного разрешения.
Диагностическое качество изображений сильно зависит от внутреннего уровня шума при визуализации, поэтому можно считать, что отношение уровня контраста к уровню шума является эффективным показателем диагностического качества диагностических изображений.
Достижение улучшения такого показателя диагностического качества давно и до сих пор остается важной целью. В таких методах, как рентгеновская визуализация, магнитно-резонансная визуализация (МРВ) и ультразвуковая визуализация, одним из подходов к улучшению показателя диагностического качества было введение усиливающих контраст веществ, приготовленных в виде контрастных сред, в визуализируемую область организма.
Так, для рентгена ранними примерами контрастных агентов были нерастворимые неорганические соли бария, которые усиливали ослабление рентгеновского излучения в зонах организма, в которых они были распределены. В течение последних 50 лет в области рентгеноконтрастных агентов преобладали растворимые йодсодержащие соединения. Коммерчески доступные контрастные среды, содержащие йодированные контрастные агенты, обычно классифицируются как ионные мономеры, такие как диатризоат (продается, например, под товарным знаком Gastrografen™), ионные димеры, такие как иоксаглат (продается, например, под товарным знаком Hexabrix™), неионные мономеры, такие как иогексол (продается, например, под товарным знаком Omnipaque™), иопамидол (продается, например, под товарным знаком Isovue™), иомепрол (продается, например, под товарным знаком Iomeron™) и неионный димер иоксанол (продается под товарным знаком Visipaque™).
Наиболее широко используемые коммерческие неионные рентгеноконтрастные агенты, например, упомянутые выше, считаются безопасными. В США контрастные среды, содержащие йодированные контрастные агенты, используют более чем в 20 миллионах рентгеновских обследований ежегодно, и число нежелательных реакций считается приемлемым. Однако, поскольку для рентгеновского обследования с усиленным контрастом требуется вводить вплоть до примерно 200 мл контрастной среды в суммарной дозе, существует постоянный стимул к созданию улучшенных контрастных сред.
Пригодность контрастной среды определяется, главным образом, ее токсичностью, ее диагностической эффективностью, нежелательными эффектами, которые она может вызывать у субъекта, которому вводят контрастную среду, и простотой производства, хранения и введения. Поскольку такие среды традиционно используют в диагностических целях, а не для достижения прямого терапевтического эффекта, обычно желательно иметь среды, которые оказывают как можно меньшее возможное воздействие на различные биологические механизмы клеток или организма и, соответственно, обеспечивают снижение токсичности и снижение нежелательного клинического эффекта. Токсичность и нежелательные биологические эффекты контрастной среды оказывают компоненты среды препарата, например растворитель или носитель, а также сам контрастный агент и его компоненты, такие как ионы для ионных контрастных агентов, и также их метаболиты.
Главные факторы токсичности контрастной среды идентифицированы как хемотоксичность контрастного агента, осмоляльность контрастной среды и ионный состав контрастной среды или отсутствие такового.
Желательными характеристиками йодированного контрастного агента являются низкая токсичность (хемотоксичность) самого соединения, низкая вязкость контрастной среды, в которой растворено соединение, низкая осмоляльность контрастной среды и высокое содержание йода (часто измеряемое в мг йода на мл контрастной среды для введения). Йодированный контрастный агент также должен быть полностью растворимым в среде препарата, обычно водной среде, и оставаться растворенным при хранении.
Осмоляльность коммерческих продуктов и, в частности, неионных соединений приемлема для большинства сред, содержащих димеры и неионные мономеры, хотя все еще существуют возможности для улучшения. Например, в коронарной ангиографии инъекция болюсной дозы контрастной среды в систему кровообращения вызывает тяжелые побочные эффекты. В этой процедуре контрастная среда, а не ток крови через систему в течение короткого периода времени, и различия в химической и физико-химической природе контрастной среды и крови, которую она вытесняет, могут вызывать нежелательные вредные эффекты, такие как аритмии, пролонгирование QT и снижение силы сердечных сокращений. Такие эффекты наблюдаются, в частности, при использовании ионных контрастных агентов, если осмотоксические эффекты ассоциированы с гипертоничностью инъецируемой контрастной среды. Контрастные среды, которые являются изотоническими или слабо гипотоническими по отношению к жидкостям организма, особенно желательны. Контрастные среды с низкой осмоляльностью имеют низкую почечную токсичность, что является особенно желательным. Осмоляльность является функцией количества частиц на единицу объема приготовленной контрастной среды.
У пациентов с острой почечной недостаточностью нефропатия, индуцированная контрастной средой, остается одним из наиболее клинически важных осложнений использования йодированной контрастной среды. Aspelin, Р. et al. (New England Journal of Medicine 348:491-499 (2003)) пришли к выводу, что нефропатия, индуцированная контрастной средой, может развиваться с меньшей вероятностью у пациентов группы высокого риска при использовании иодиксанола, а не неионной контрастной среды с низкой осмоляльностью.
Часть популяции пациентов, считающаяся пациентами высокого риска, увеличивается. Чтобы удовлетворить потребность постоянного улучшения in vivo рентгеновских диагностических агентов для всей популяции пациентов, существует постоянный стимул к поиску рентгеноконтрастных агентов, которые имеют улучшенные свойства, что также касается индуцируемой контрастным агентом нефротоксичности (CIN).
Чтобы удерживать инъецируемый объем контрастной среды на как можно более низком уровне, крайне желательно готовить контрастные среды с высокой концентрацией йода на мл и при этом поддерживать осмоляльность среды на низком уровне, предпочтительно ниже или близко к изотоничности. В результате разработки неионных мономерных контрастных агентов и, в частности, неионных бис(трийодфенил) димеров, таких как иодиксанол (патент ЕР 108638), созданы контрастные среды с пониженной осмотоксичностью, что дает возможность достигать эффективную с точки зрения контраста концентрацию йода с использованием гипотонического раствора и даже возможность корректировать ионный дисбаланс введением плазменных ионов с сохранением желаемой осмоляльности контрастной среды Visipaque™ (WO 90/01194 и WO 91/13636).
Рентгеновские контрастные среды при коммерческой высокой концентрации йода имеют высокую относительную вязкость в пределах от примерно 15 до примерно 60 мПа·с при температуре окружающей среды. Контрастные среды, где усиливающим контраст агентом является димер, обычно имеют более высокую вязкость, чем соответствующие контрастные среды, где агент, усиливающий контраст, представляет собой мономер, соответствующий этому димеру. Такая высокая вязкость может создавать проблемы тем, кто вводит контрастную среду, связанные с тем, что потребуются относительно более толстые иглы или потребуется прилагать сильное давление, и это особенно актуально в педиатрической радиографии и в радиографических методах, которые требуют быстрого введения болюсов, например для ангиографии.
Рентгеноконтрастные среды, содержащие в качестве активного(ых) фармацевтического(их) ингредиента(ов) химическое соединение, имеющее две трийодированные фенильные группы, связанные связывающей группой, обычно называются димерными контрастными агентами или димерами. За многие годы было предложено большое множество разных йодированных димеров. Релевантные патентные публикации включают ЕР 1186305, ЕР 686046, ЕР 108638, ЕР 0049745, ЕР 0023992, WO 2003080554, WO 2000026179, WO 1997000240, WO 9208691, US 3804892, US 4239747, US 3763226, US 3763227 и US 3678152. В настоящее время на рынке есть одна контрастная среда, имеющая йодированный неионный димер в качестве активного фармацевтического ингредиента, продукт Visipaque™, содержащий соединение иодиксанол. Также на рынке имеется продукт Hexabrix™, содержащий ионное димерное соединение йоксагловую кислоту.
Следовательно, все еще существует потребность в разработке контрастных агентов, которые решают одну или более проблем, которые обсуждались выше. Такие агенты в идеале должны обладать улучшенными свойствами по сравнению с растворимыми йодсодержащими соединениями, имеющимися на рынке, в одном или более следующих отношениях: почечная токсичность, осмоляльность, вязкость, растворимость, инъецируемый объем/концентрация йода и ослабление/доза радиации и любой дополнительный нежелательный эффект, известный или обнаруженный для таких йодированных соединений. Агенты должны быть стабильными при хранении в сухой форме и/или в растворе, и дополнительным желательным свойством является простота и экономичность их изготовления.
Краткое описание сущности изобретения
Согласно настоящему изобретению предложены соединения, полезные в качестве контрастных сред, имеющих улучшенные свойства по сравнению с известными средами по меньшей мере по одному из критериев, упомянутых выше, и, в частности, почечной токсичности, осмоляльности, вязкости и растворимости. Контрастные среды содержат усиливающие контраст йодсодержащие соединения, причем эти йодсодержащие соединения представляют собой химические соединения, содержащие две связанные йодированные фенильные группы. Усиливающие контраст йодсодержащие соединения могут быть синтезированы из коммерчески доступных и относительно недорогих исходных веществ.
Подробное описание изобретения
Новые соединения по изобретению, их применение в качестве рентгеноконтрастных агентов, их состав и получение точно определены в прилагаемой формуле изобретения и в описании изобретения ниже.
Усиливающие контраст соединения представляют собой синтетические химические соединения формулы (I)
и их соли или оптически активные изомеры,
где
Х означает С3-8 алкиленовую группировку с прямой или разветвленной цепью, в которой возможно одна или две группировки CH2 заменены атомами кислорода, атомами серы или группами NR1 и которая возможно замещена группами -OR1 в количестве до шести включительно;
R1 означает водород или С1-4 алкильную группу с прямой или разветвленной цепью;
R3 означает атом водорода или ацильную функциональную группу; и
R одинаковые или разные и каждый независимо представляет собой трийодированную фенильную группу, дополнительно замещенную двумя группами R2, причем группы R2 одинаковые или разные и каждая представляет собой атом водорода или неионную гидрофильную группировку, при условии, что по меньшей мере одна группа R2 в соединении формулы (I) представляет собой гидрофильную группировку.
В вышеуказанной формуле (I) Х означает С3-8алкилен с прямой цепью, возможно замещенный одной-шестью группами -OR1. Более предпочтительно, Х означает С3-5алкилен с прямой цепью, имеющий по меньшей мере одну группу -OR1, предпочтительно по меньшей мере одну гидроксильную группу в положении, которое не является соседним с мостиковым атомом азота. Более предпочтительно, алкиленовая цепь замещена одной-тремя гидроксильными группами, и еще более предпочтительно алкиленовая цепь представляет собой пропилен, бутилен или пентилен с прямой цепью, замещенный одной, двумя или тремя гидроксильными группами. Конкретные предпочтительные группы Х содержат 2-гидрокси-пропиленовую, 2,3-дигидрокси-бутиленовую, 2,4-дигидрокси-пентиленовую и 2,3,4-тригидрокси-пентиленовую группировку, в частности 2-гидрокси-пропиленовую группировку.
Предпочтительно, R1 означает атом водорода или метильную группу, наиболее предпочтительно атом водорода.
Заместитель R3 предпочтительно представляет собой атом водорода или остаток алифатической органической кислоты, в частности C1-5 органической кислоты, например формильную, ацетильную, пропионильную, бутирильную, изобутирильную и валериильную группировки. Также возможны гидроксилированные и метоксилированные ацильные группировки. В особенно предпочтительном воплощении R3 в соединении формулы (I) означает атом водорода, формильную группировку или ацетильную группировку, наиболее предпочтительно формильную группировку.
Йодированные группы R могут быть одинаковыми или разными, и каждая предпочтительно представляет собой 2,4,6-трийодированную фенильную группу, дополнительно замещенную двумя группами R2 в оставшихся положениях 3 и 5 фенильной группировки.
Неионные гидрофильные группировки могут представлять собой любые неионизирующие группы, традиционно используемые для повышения растворимости в воде. Следовательно, заместители R2 могут быть одинаковыми или разными и предпочтительно все будут представлять собой неионную гидрофильную группировку, содержащую сложноэфирные, амидные и аминные группировки, возможно дополнительно замещенную C1-10 алкильными группами с прямой цепью или разветвленной цепью, предпочтительно С1-5 алкильными группами, причем в этих алкильных группах одна или более группировок CH2 или СН могут быть заменены атомами кислорода или азота. Заместители R2 могут также дополнительно содержать одну или более групп, выбранных из оксо, гидроксила, амино или карбоксильного производного, и замещенные группой оксо атомы серы или фосфора. Каждая алкильная группа с прямой или разветвленной цепью содержит предпочтительно от 1 до 6 гидроксильных групп и более предпочтительно от 1 до 3 гидроксильных групп. Поэтому в еще одном предпочтительном аспекте заместители R2 одинаковые или разные и каждый представляет собой полигидрокси-С1-5алкил, гидроксиалкоксиалкил с 1-5 атомами углерода и гидроксиполиалкоксиалкил с 1-5 атомами углерода, и присоединены к йодированной фенильной группе через амидную или карбамоильную связь, предпочтительно амидную связь.
Особенно предпочтительными являются группы R2 формул, указанных ниже:
- CONH2
- СОNНСН3
- CONH-CH2-CH2-OH
- СОNН-СН2-СН2-ОСН3
- CONH-CH2-CHOH-CH2-OH
- СОNН-СН2-СНОСН3-СН2-ОН
- СОNН-СН2-СНОН-СН2-ОСН3
- СОN(СН3)СН2-СНОН-СН2OН
- СОNН-СН-(СН2-ОН)2
- CON-(CH2-CH2-OH)2
- СОN-(СН2-СНОН-СН2-ОН)2
- CONH-ОСН3
- CON(CH2-CHOH-CH2-OH)(CH2-CH2-OH)
- СОNН-С(СН2-ОН)2СН3,
- СОNН-С(СН2-ОН)3 и
- CONH-CH(CH2-OH)(CHOH-CH2-OH)
- NН(СОСН3)
- N(СОСН3)С1-3алкил
- N(СОСН3)-моно-, бис- или трис-гидрокси-С1-4алкил
- N(СОСН2OН)-водород, моно-, бис- или трис-гидрокси-С1-4алкил
- N(СО-СНОН-СН2OН)-водород, моно-, бис- или тригидроксилированный С1-4алкил
- N(СО-СНОН-СНОН-СН2OН)-водород, моно-, бис- или тригидроксилированный С1-4алкил
- N(СО-СН-(СН2OН)2)-водород, моно-, бис- или тригидроксилированный С1-4алкил) и
- N(СОСН2OН)2.
Еще более предпочтительно, группы R2 одинаковые или разные и представляют собой одну или более группировок формул -CONH-CH2-CH2-OH, -CONH-CH2-CHOH-CH2-OH, -СОN(СН3)СН2-СНОН-СН2OН, -CONH-CH-(CH2-OH)2 и -СОN-(СН2-СН2-ОН)2. Еще более предпочтительно, обе группы R одинаковые, и группы R2 в каждом R одинаковые или разные и представляют собой -CONH-CH2-CH2-OH, -CONH-CH2-CHOH-CH2-OH, СОN(СН3)СН2-СНОН-СН2OН, -СОN-(СН2-СН2-ОН)2 и -CONH-CH-(CH2-OH)2. В особенно предпочтительном воплощении обе группы R одинаковые, и все группы R2 представляют собой группировку формулы -CONH-CH2-CHOH-CH2-OH.
Таким образом, предпочтительные структуры по изобретению включают соединения формулы (II):
В формуле (II) каждая группа R имеет вышеуказанное значение, более предпочтительно обе йодфенильные группы R одинаковые, и группы R2 все представляют собой неионные гидрофильные группировки, и предпочтительно группы R2 связаны с йодированной фенильной группировкой амидными связями. Х предпочтительно означает алкиленовые группы с прямой цепью с 3-5 атомами углерода, имеющие от одного до трех гидроксильных заместителей в положениях, которые не являются соседними с азотсодержащей функциональной группой.
Особенно предпочтительными являются соединения формулы (IIа), в частности соединения, имеющие моногидроксилированный алкиленовый мостик X, в частности пропиленовый мостик.
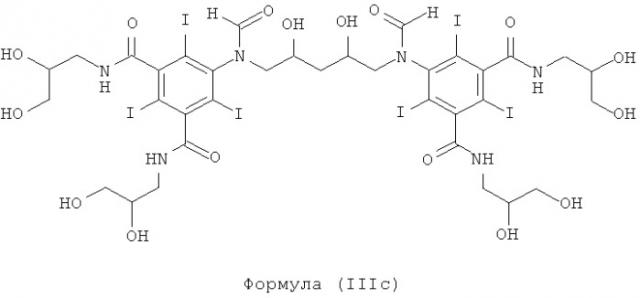
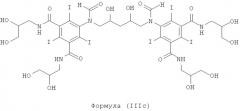
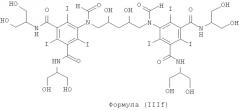
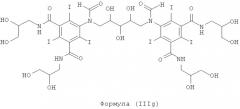
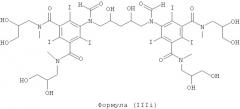
Некоторые предпочтительные примеры структур по изобретению включают указанные ниже соединения формул (IIIa)-(IIIu).
При концентрации йода 320 мг/мл, которая представляет собой обычную концентрацию для коммерчески доступных йодированных контрастных сред, концентрация соединения формулы (I) будет составлять примерно 0,42 М (молярная). Контрастная среда при этой концентрации йода будет гипоосмолярной, и это является преимущественным свойством с точки зрения нефротоксичности контрастной среды. В контрастную среду могут быть добавлены электролиты для снижения сердечно-сосудистых эффектов, как раскрыто в WO 90/01194 и WO 91/13636.
Соединения формулы (I) также включают оптически активные изомеры и существуют в нескольких изомерных формах, поскольку имеют хиральные атомы углерода. Кроме того, соединения проявляют экзо/эндо-изомерию, обусловленную ограниченным вращением связи N-CO в формильной функциональной группе из-за близости объемного атома йода. Охвачены оба энантиомерно чистых продукта, а также смеси оптических изомеров.
Соединения по изобретению могут быть использованы в качестве контрастных агентов и могут быть приготовлены с традиционными носителями и эксципиентами для получения диагностических контрастных сред.
Таким образом, в еще одном аспекте изобретения предложена диагностическая композиция, содержащая соединение формулы (I), как оно определено выше, вместе с по меньшей мере одним физиологически переносимым носителем или эксципиентом, например в водном растворе для инъекций, возможно вместе с добавленными плазменными ионами или растворенным кислородом.
Композиция контрастного агента по изобретению может быть в форме, готовой для применения, или может быть в форме концентрата для разведения перед введением. Обычно композиции в форме, готовой для применения, будут иметь концентрацию йода по меньшей мере 100 мг I/мл, предпочтительно по меньшей мере 150 мг I/мл, причем концентрация по меньшей мере 300 мг I/мл, например 320 мг I/мл, является предпочтительной. Чем выше концентрация йода, тем выше диагностическая ценность в виде ослабления рентгеновского излучения контрастной средой. Однако чем выше концентрация йода, тем выше вязкость и осмоляльность композиции. В норме максимальная концентрация йода для данной контрастной среды будет определяться растворимостью усиливающего контраст агента, например йодированного соединения, и переносимыми пределами вязкости и осмоляльности.
Для контрастных сред, вводимых инъекцией или инфузией, желательный верхний предел вязкости раствора при температуре окружающей среды (20°С) составляет примерно 30 мПа·с, однако переносимой может быть вязкость до 50-60 мПа·с и даже более 60 мПа·с. Для контрастных сред, вводимых болюсной инъекцией, например при ангиографических процедурах, следует учитывать осмотоксические эффекты, и осмоляльность предпочтительно должна быть ниже 1 осмоль/кг Н2О, предпочтительно ниже 850 мосмоль/кг H2O и более предпочтительно примерно 300 мосмоль/кг Н2О.
Достижение таких целевых вязкости, осмоляльности и концентраций йода возможно с соединениями по этому изобретению. Разумеется, эффективные концентрации йода могут быть достигнуты с использованием гипотонических растворов. Поэтому может быть желательным компенсировать недостаточность тоничности растворов добавлением плазменных катионов, чтобы снизить содействие токсичности вследствие эффектов дисбаланса после болюсной инъекции. Такие катионы желательно вводить в диапазонах, предложенных в WO 90/01194 и WO 91/13636.
В частности, желательным и достижимым является добавление ионов натрия и ионов кальция, чтобы сделать контрастную среду изотоничной с кровью при всех концентрациях йода. Плазменные катионы могут быть предоставлены в форме солей с физиологически переносимыми противоионами, например хлоридом, сульфатом, фосфатом, бикарбонатом и т.д., причем предпочтительным является использование плазменных анионов.
В еще одном воплощении изобретения предложены диагностические агенты, содержащие соединение формулы (I), и диагностические композиции, содержащие соединение формулы (I), вместе с фармацевтически приемлемыми носителями или эксципиентами. Диагностические агенты и композиции предпочтительно предназначены для применения в рентгеновской диагностике.
Контрастные среды, содержащие соединения формулы (I), можно вводить инъекцией или инфузией, например внутрисосудистым введением. Альтернативно, контрастные среды, содержащие соединения формулы (I), можно также вводить перорально. Контрастная среда для перорального введения может быть в форме капсулы, таблетки или в виде жидкого раствора.
Следовательно, изобретение также охватывает применение диагностического агента и диагностической композиции, содержащей соединение формулы (I), в рентгеноконтрастных обследованиях и применение соединения формулы (I) для изготовления диагностической композиции для применения в качестве рентгеноконтрастного агента.
Предложен также способ диагностики, включающий введение соединения формулы (I) в организм человека или животного, обследование организма с использованием диагностического устройства и компилирование данных обследования. В этом способе диагностики соединения формулы (I) можно также вводить в организм предварительно.
Предложен также способ визуализации, в частности рентгеновской визуализации, включающий введение соединения формулы (I) в организм человека или животного, обследование организма с использованием диагностического устройства и компилирование данных обследования и возможно анализ данных. В этом способе визуализации соединения формулы (I) также можно вводить в организм предварительно.
Соединения общей формулы (I) могут быть синтезированы многостадийными способами из исходных веществ, которые либо известны из уровня техники, либо коммерчески доступны, либо без труда могут быть получены из коммерчески доступных веществ. Для получения соединений формулы (I) обычно может быть адаптирован известный синтез иодиксанола.
Получение
Общая методика получения соединений формулы (I)
Соединения формулы (IVa) и, если необходимо, формулы (IVb)
подвергают взаимодействию с реакционноспособной линкерной группой формулы (V)
где Y и Y' представляют собой легко удаляемые атомы или группы, а Х имеет вышеуказанное значение, или ее гидроксил-защищенным производным, или соответствующим эпоксидом, в котором один из заместителей Y и Y' или оба заменены -O-, и, если требуется, затем удаляют защитные группы. Группы Y и Y' могут быть выбраны из атомов галогенов, например хлора, брома или йода, или сульфатных гидрокарбилсульфонилоксигрупп, например алкил- или арил-сульфонилоксигрупп, таких как тозилокси или мезилокси.
Примерами подходящих соединений формулы (V) являются соединения формул (Va), (Vb), (Yc) и (Vd).
где Y представляет собой легкоудаляемый(ую) атом или группу.
Дополнительно, соединения формулы (V), обеспечивающие присутствие мостика с 3 атомами углерода, раскрыты в Bjørsvik, H-R., and Priebe, H. Acta Chem. Scand. 49 (1995) 446-456, "Multivariate data analysis of molecular descriptors estimated by using при semi-empirical quantum chemistry methods. Principal properties for synthetic screening of 2-chloromethyl-oxirane and analogous bis-alkylating C3 moieties".
Таким образом, подходящими соединениями формулы (V) могут быть эпихлоргидрин, диэпоксид бутадиена, диэпоксид 1,4-пентадиена, ди(оксиран-2-ил)метанол или любой предшественник, который может образовать эпоксид или диэпоксид в основных условиях, такой как 1,4-дихлор-бутан-2,3-диол или 1,5-дихлорпентан-2,4-диол.
Гидроксильные группы, присутствующие в группах R и в группе X, могут, если желательно, быть защищенными. Подходящие защитные группы включают ацильные группы, такие как ацетил, или, если имеются соседние гидроксильные группы, такие как циклические кетальные или ацетальные группы.
Взаимодействие между соединениями формул (IVa) и (V) и возможно формул (IVa), (IVb) и (V) предпочтительно осуществляют в присутствии агента, связывающегося с кислотой, например органического или неорганического основания, предпочтительно в водной или спиртовой среде или в таких смесях, как вода и/или алканол или гликоль. В качестве основания может быть использован алкоксид щелочного металла, такой как метоксид натрия, или гидроксид щелочного металла, такой как гидроксид натрия и калия.
Любая защитная группа может быть удалена стандартными способами, например гидролизом. Соединения формул (IVa) и (IVb) могут быть получены формилированием соответствующих соединений, имеющих свободные аминогруппы. В этой реакции гидроксильные группы в заместителях R также могут быть защищены ацилированием.
Соединения формулы (I) могут быть очищены любым удобным способом, например препаративной хроматографией или перекристаллизацией.
Получение промежуточных соединений (если они коммерчески недоступны)
Предшественники соединений формул (IVa) и (IVb), трийодированные фенильные группы, имеющие свободную аминогруппу, коммерчески доступны, или они могут быть получены по методикам, описанным или указанным в, например, WO 95/35122 и WO 98/52911. Например, 5-амино-2,4,6-трийод-изофталевая кислота доступна от Aldrich, а 5-амино-2,4,6-трийод-N,N'-бис(2,3-дигидроксипропил)-изофталамид коммерчески доступен от, например, Fuji Chemical Industries, Ltd.
Примеры коммерчески доступных предшественников соединений формул (IVa) и (IVb), либо коммерчески доступных, либо ранее описанных в литературе, включают:
5-Амино-N,N'-бис-(2,3-дигидрокси-пропил)-2,4,6-трийод-изофталамид
5-Амино-N-(2,3-дигидрокси-пропил)-N'-(2-гидрокси-1-гидроксиметил-этил)-2,4,6-трийод-изофталамид (WO 2002044125)
5-Амино-N,N'-бис-(2,3-дигидрокси-пропил)-2,4,6-трийод-N,N'-диметил-изофталамид
5-Амино-N-(2,3-дигидрокси-пропил)-N'-(2-гидрокси-этил)-2,4,6-трийодизофталамид (WO 8700757)
Соединения формул (IVa) и (IVb) могут быть получены ацилированием соответствующих соединений, имеющих свободные аминогруппы. В этой реакции гидроксильные группы в заместителе R также могут быть защищены ацилированием.
Ацилирование может быть осуществлено любым удобным способом, например использованием активированной муравьиной кислоты, такой как смешанные ангидриды, которые могут быть получены различными способами, описанными в литературе.
Удобным способом получения смешанных ангидридов является добавление ангидрида карбоновой кислоты к избытку муравьиной кислоты при контролируемой температуре. Смешанные ангидриды также могут быть получены добавлением хлорангидрида карбоновой кислоты к раствору соли муравьиной кислоты. Формил-смешанные ангидриды могут включать ацетил, изобутирил, пивалоил, бензоил и т.д.
В настоящем воплощении используют смешанный уксусный-муравьиный ангидрид. К избытку охлажденного предварительно полученного смешанного уксусного-муравьиного ангидрида добавляют 5-амино-мономер и эту смесь перемешивают в течение ночи. Смесь концентрируют в вакууме и непосредственно используют на стадии алкилирования, как описано в Экспериментальном разделе (способ Б), или, альтернативно, перед алкилированием O-ацилированные группы могут быть подвергнуты гидролизу, как описано в Экспериментальном разделе (способ А). Гидролиз удобно проводить в водной основной среде, как в примерах, приведенных в Экспериментальном разделе, или, альтернативно, его можно осуществлять алкоголизом, например как описано в WO 1997000240.
Можно также растворить 5-аминомономер в муравьиной кислоте и затем добавить ангидрид карбоновой кислоты, но для снижения нежелательного ацилирования лучше получить смешанный ангидрид отдельно и затем смешать его с 5-аминомономером, как описано выше.
Экспериментальный раздел
Пример 1
5,5'-(2-гидpoкcипpoпaн-1,3-диил)биc(фopмилaзaндиил)биc(N1,N3-биc(2,3-дигидроксипропил)-2,4,6-трийодизофталамид)
Способ А:
1а) N,N'-Бис-(2,3-дигидроксипропил)-5-формиламино-2,4,6-трийодизофталамид Муравьиную кислоту (300 мл) загружали в сухую колбу на 1000 мл, оснащенную капельной воронкой, мешалкой, термометром и газовпускным патрубком. Кислоту охлаждали на ледяной бане под азотом и уксусный ангидрид (144,8 г, 1,418 моль) по каплям добавляли с такой скоростью, чтобы температура не превышала 2,5°С. После окончания добавления ледяную баню убирали и температуре давали возможность подняться до 10°С. Смесь снова охлаждали на льду, добавляли в нее 5-амино-N,N'-бис(2,3-дигидроксипропил)-2,4,6-трийодизофталамид (100 г, 141,8 ммоль) в течение 5 минут и смесь оставляли перемешиваться в течение ночи, при этом ее температура достигала температуры окружающей среды. Смесь упаривали досуха и добавляли метанол (300 мл) и воду (300 мл). Добавляли 2 М гидроксид калия до тех пор, пока все вещество не переходило в раствор и пока не устанавливалось стабильное значение рН 12,5. Метанол удаляли в вакууме. Смесь нейтрализовали добавлением 4 М HCl, при этом начиналось медленное осаждение. Добавляли 300 мл воды, и за ночь продукт выпадал в осадок. Осадок собирали, промывали небольшим количеством воды и сушили на фильтре до образования влажного осадка на фильтре и дополнительно сушили в вакууме с получением 84,8 г (81,5%) N,N'-бис-(2,3-дигидроксипропил)-5-формиламино-2,4,6-трийодизофталамида.
1H-ЯМР 500 МГц (растворитель: D2O, эталон N2O=4,8 м.д. (миллионные доли), 25°С): 8.35 и 8.05 м.д. (2s, 1 Н), 3.94 м.д. (m, 2H), 3.67 м.д. (m, 2H), 3.55 м.д. (m, 2H), 3.45 м.д. (m, 2H), 3.34 м.д. (m, 2H).
ЖХ-МС (жидкостная хроматография/масс-спектрометрия) (колонка Agilent Zorbax SB-Aq 3,5 мкм 3,0×100 мм, растворители: А = вода/0,1% муравьиной кислоты и В = ацетонитрил/0,1% муравьиной кислоты; градиент 0-30% В за 20 мин; скорость потока 0,3 мл/мин, УФ-детектирование при 214 и 254 нм, ЭРИ-МС (масс-спектрометрия с электрораспылительной ионизацией)) дала два пика при 5,5 мин с m/z (М+ Н+) 733,828, m/z (M+ NH4+) 750,855, m/z (M+ Na+) 755,817, соответствующие данной структуре.
1б) 5,5'-(2-гидpoкcипpoпaн-1,3-диил)биc(фopмилaзaндиил)биc(N1,N3-бис(2,3-дигидроксипропил)-2,4,6-трийодизофталамид)
Гидроксид калия (1,07 г) растворяли в воде (6,9 мл) и метаноле (3,4 мл) в круглодонной колбе на 50 мл, оснащенной магнитной мешалкой. К перемешиваемому раствору добавляли борную кислоту (0,41 г, 6,6 ммоль) и N,N'-бис-(2,3-дигидроксипропил)-5-формиламино-2,4,6-трийодизофталамид (7,0 г, 9,56 ммоль). К этому раствору добавляли эпихлоргидрин (260 мкл, 3,32 ммоль) и в колбу устанавливали электрод рН-метра и поддерживали значение рН 12,7 добавлением 4 М раствора гидроксида калия по каплям в течение 4 ч. После этого смесь оставляли перемешиваться в течение ночи. рН доводили до значения рН 4 добавлением 4 М раствора соляной кислоты и метанол удаляли в вакууме. Оставшийся водный раствор разбавляли водой (75 мл) и обрабатывали ионообменниками (АМВ200С и IRA67) до нулевой проводимости. Ионообменники удаляли фильтрованием и промывали водой и объединенные водные фильтраты подвергали сублимационной сушке. Неочищенный продукт очищали препаративной ВЭЖХ (колонка Phenomenex Luna C18 10 мкм; растворители: А = вода и В = ацетонитрил; градиент 05-20% В за 60 мин). После сублимационной сушки получили 5,5'-(2-гидроксипропан-1,3-диил)биc(фopмилaзaндиил)-биc(N1,N3-биc(2,3-дигидpoкcипpoпил)-2,4,6-трийодизофталамид) (3,80 г, выход 74,8%).
1H-ЯМР 500 МГц (растворитель: D2O, эталон H2O=4,8 м.д., 25°С): 8.34 и 8.08 м.д. (т, 2 Н), 2.80-4.80 м.д. (т 26 Н). ЖХ-МС времяпролетная (ВП): 1522.68 m/z (М+H+), 1544.66 m/z (М+Na+).
Пример 2
5,5'-(2-гидpoкcипpoпaн-1,3-диил)биc(фopмилaзaндиил)биc(N1,N3-биc(2,3-дигидроксипропил)-2,4,6-трийодизофталамид)
Способ В:
2а) 1-формиламино-3,5-бис(2,3-бис(формилокси)пропан-1-илкарбамоил)-2,4,6-трийод-бензол
Муравьиную кислоту (4 л) загружали в су