Новые соединения для лечения заболеваний, связанных с амилоидом или амилоидподобными белками
Иллюстрации
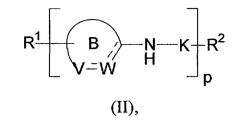
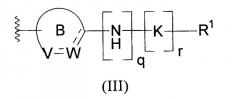
Показать всеИзобретение относится к новым соединениям формулы II, которые имеют значения радикалов и символов, определенные в формуле изобретения. Данные соединения могут быть использованы при лечении группы расстройств и аномалий, связанных с амилоидным белком, таких как болезнь Альцгеймера, и заболеваний или состояний, связанных с амилоид-подобными белками. Соединения настоящего изобретения могут также быть использованы для лечения глазных заболеваний, связанных с патологическими отклонениями и изменениями в тканях зрительной системы. Настоящее изобретение также относится к фармацевтической композиции, включающей данные соединения, а также применению данных соединений для получения лекарственных препаратов для лечения и профилактики заболеваний или состояний, связанных с амилоидом и/или амилоид-подобными белками. 10 н. и 9 з.п. ф-лы, 5 табл., 27 пр. получения, 5 пр. биол. исслед.
Реферат
Изобретение относится к новым соединениям, которые могут быть использованы при лечении группы расстройств и отклонений, связанных с амилоидным белком, таких как болезнь Альцгеймера, и заболеваний или состояний, связанных с амилоид-подобными белками. Настоящее изобретение относится также к фармацевтическим композициям, включающим эти соединения, а также к применению этих соединений для получения медицинских препаратов для лечения заболеваний или состояний, связанных с амилоидом или амилоид-подобными белками, к способу лечения заболеваний или состояний, связанных с амилоидом или амилоид-подобными белками.
Соединения настоящего изобретения могут также быть использованы для лечения глазных заболеваний, связанных с патологическими отклонениями и изменениями в тканях зрительной системы, особенно связанных с патологическими отклонениями и изменениями в тканях зрительной системы, связанными с амилоидом-бета, такими как деградация нейронов. Указанные патологические отклонения могут произойти, например, в различных тканях глаза, как, например, в зрительной коре, что ведет к корковым зрительным нарушениям; в передней камере и зрительном нерве, что ведет к глаукоме; в хрусталике, что ведет к катаракте в результате отложения бета-амилоида; в стекловидном теле, что ведет к зрительному амилоидозу; в сетчатке, что ведет к первичной дегенерации сетчатки и дегенерации желтого пятна, например, связанной со старческой дегенерацией желтого пятна; в зрительном нерве, что ведет к друзам в зрительном нерве, оптической невропатии и невриту зрительного нерва, и в роговице, что ведет к решетчатой дистрофии роговицы.
Многие болезни старения вызваны или связаны с амилоидом или амилоид-подобными белками и характеризуются, в частности, образованием внеклеточных скоплений амилоида или амилоид-подобного материала, которые вносят вклад в патогенез, а также прогрессирование болезни. Эти заболевания включают, но не ограничиваются, неврологическими расстройствами, такими как болезнь Альцгеймера (AD), заболеваниями или состояниями, характеризующимися потерей памяти, когнитивных способностей, такие как, например, синдром мягкого когнитивного снижения (MCI), деменция с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (голландский тип); гуамский комплекс паркинсонизм-деменция. Другие заболевания, вызванные либо связанные с амилоид-подобными белками, представляют собой прогрессивный супрануклеарный паралич, рассеянный склероз; болезнь Крейтцфельда-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотропный латеральный склероз), миозит с тельцами включения (IBM), сахарный диабет взрослых; старческий амилоидоз сердца; эндокринные опухоли и другие заболевания, в том числе связанные с амилоидом глазные заболевания, которые затрагивают различные ткани глаза, как, например, в зрительной коре, что ведет к корковым зрительным нарушениям; в передней камере и зрительном нерве, что ведет к глаукоме; в хрусталике, что ведет к катаракте в результате отложения бета-амилоида; в стекловидном теле, что ведет к зрительному амилоидозу; в сетчатке, что ведет к первичной дегенерации сетчатки и дегенерации желтого пятна, например, связанной со старческой дегенерацией желтого пятна; в зрительном нерве, что ведет к друзам в зрительном нерве, оптической невропатии и невриту зрительного нерва, и в роговице, что ведет к решетчатой дистрофии роговицы.
Хотя патогенез этих заболеваний может быть различным, характеристические отложения при этих заболеваниях зачастую содержат много общих молекулярных составляющих. В значительной степени, это может быть связано с активизацией локальных про-воспалительных путей, ведущих к одновременному отложению активированных компонентов комплемента, реактантов острой фазы, иммуномодуляторов и других воспалительных медиаторов.
Болезнь Альцгеймера (AD) представляет собой неврологическое расстройство, в первую очередь вызванное амилоидными бляшками, накоплением избыточных белков в мозге. Наиболее частым видом амилоидных скоплений в мозге пострадавшего индивидуума являются, главным образом, скопления из Аβ фибрилл. Научные данные свидетельствуют о том, что увеличение продукции и накопления белка бета-амилоида в бляшках приводит к смерти нервных клеток, что вносит свой вклад в развитие и прогрессирование AD. Потеря нервных клеток головного мозга в стратегических областях, в свою очередь, вызывает уменьшение количества нейротрансмиттеров и ухудшение памяти. Белки, в основном, ответственные за создание бляшек, представляют собой прекурсоры амилоидных белков (АРР) и два презенилина (презенилин I и презенилин II). Отщепление последовательности от прекурсоров амилоидных белков (АРР), которые постоянно экспрессируются и катаболизируются в большинстве клеток, с помощью ферментов секретаз β и γ приводит к освобождению Аβ пептида, содержащего от 39 до 43 аминокислотных остатков. Деградация АРР обычно увеличивает их склонность к агрегации в бляшки. Аβ(1-42) фрагмент имеет особенно высокую склонность к образованию агрегатов из-за двух очень гидрофобных аминокислотных остатков на С-конце. Поэтому считается, что Аβ(1-42) фрагмент ответственен и вовлечен в инициирование формирования нейротических бляшек при AD, и имеет, следовательно, высокий патологический потенциал. Следовательно, существует потребность в специфических молекулах, которые могут связываться и разрушать амилоидные бляшки.
Симптомы AD проявляются постепенно, и первым симптомом может быть легкая забывчивость. На этой стадии, люди могут забывать недавние события, мероприятия, имена известных людей или названия вещей и не могут решить простые математические задачи. Поскольку болезнь прогрессирует, симптомы становится легче заметить, и они становятся достаточно серьезными, чтобы заставить людей с AD или членов их семей обратиться за медицинской помощью. Симптомы средней стадии AD включают проблемы с общением, пониманием, чтением или письмом, потерю способности ухаживать за собой. Поздняя стадия характеризуется тем, что AD больные могут стать агрессивными или беспокойными, могут уходить из дома, и, в конечном счете, им становится необходима полная забота.
В настоящее время единственный точный способ диагностирования AD. заключается в выявлении бляшек и связок в тканях головного мозга при вскрытии после смерти человека. Таким образом, пока человек еще жив, врач может сделать лишь диагноз "возможно" или "вероятно" AD. При использовании современных методов врач может правильно диагностировать AD в до 90 процентов случаев, используя несколько инструментов для диагностики "вероятной" AD. Врачи задают вопросы по поводу общего состояния здоровья человека, медицинских проблем в прошлом, и любых трудностях, которые человек испытывает в повседневной деятельности. Поведенческие тесты на память, решение задач, внимание, счет и речь предоставляют информацию о когнитивной дегенерации, а медицинские анализы, такие как анализы крови, мочи и спинномозговой жидкости, а также сканирование мозга, могут предоставить некоторую дополнительную информацию.
Терапия AD состоит из медикаментозного и немедикаментозного лечения. Процедуры, направленные на изменение текущего хода болезни (отсрочка или обращение прогрессирования), до сих пор были в основном неудачными. Было показано, что лекарственные средства, которые восстанавливают дефицит (недостаток), или неправильную работу химических медиаторов нервных клеток (нейротрансмиттеров), в частности, ингибиторы холинэстеразы (ChEI), такие как такрин и ривастигмин, улучшают проявления симптомов. ChEI препятствуют ферментативной деградации нейротрансмиттеров, тем самым, увеличивая количество химических посредников для передачи нервных сигналов в мозге.
Для некоторых людей на ранних и средних стадиях болезни, лекарственные препараты такрин (Cognex®, Morris Plains, NJ), донепезил (Aricept®, Токио, Япония), ривастигмин (Exelon®, East Hanover, NJ), или галантамин (Reminyl®, New Brunswick, NJ) могут помочь предотвратить ухудшения некоторых симптомов в течение ограниченного времени. Другой лекарственный препарат, мемантин (Namenda®, New York, NY), был одобрен для лечения форм AD от умеренной до тяжелой. Лекарственные средства также влияют на психиатрические проявления AD. Кроме того, некоторые лекарственные препараты могут помочь контролировать поведенческие симптомы AD, такие как бессонница, возбуждение, беспокойство, тревога и депрессия. Лечение этих симптомов часто делает пациентов более спокойными и делает уход за ними легче. К сожалению, несмотря на значительные успехи в лечении, свидетельствующие о том, что этот класс препаратов является, несомненно, лучшим, чем плацебо, заболевание продолжает прогрессировать, и общее воздействие на психическое функционирование является скромными. Многие лекарственные препараты, применяемые в специальных курсах лечения AD, такие как, например, ChEI, обладают также побочными эффектами, включающими дисфункции желудочно-кишечного тракта, печени, токсичность и потерю веса.
Другие заболевания, которые обусловлены или связаны с накоплением и отложением амилоид-подобных белков, представляют собой синдром мягкого когнитивного снижения, деменция с тельцами Леви (LBD), амиотропный латеральный склероз (ALS), миозит с тельцами включения (IBM) и дегенерацию желтого пятна, в частности, связанную с возрастом дегенерацию желтого пятна (AMD).
Синдром мягкого когнитивного снижения (MCI) является общим термином, обычно определяемым как едва различимое, но установимое расстройство памяти. Человек с MCI испытывает б'ольшие проблемы с памятью, чем обычно ожидается со старением, но не проявляет другие симптомы слабоумия, как, например, нарушения в принятии решений или аргументации.
Деменция с тельцами Леви (LBD) представляет себе нейродегенеративное расстройство, которое может возникнуть у людей старше 65 лет, которое, как правило, вызывает симптомы когнитивного (мыслительного) нарушения и аномальные поведенческие изменения. Симптомы могут включать когнитивные нарушения, неврологические нарушения, расстройство сна, вегетативные нарушения. Когнитивные нарушения в большинстве случаев являются характеристической особенностью LBD. У пациентов наблюдаются периодические эпизоды замешательства, которые прогрессивно ухудшаются. Флуктуации когнитивных способностей часто связаны с изменением степени внимания и умственной деятельности. Когнитивные нарушения и флуктуации мыслительной деятельности могут изменяться в течение минут, часов или дней.
Латеральный амиотрофический склероз (ALS) характеризуется дегенерацией верхних и нижних моторных нейронов. У некоторых ALS больных может присутствовать слабоумие или афазия (ALS-D). Деменция чаще всего является фронтотемпоральной (FTD), и во многих из этих случаев наблюдаются убиквитин-положительные, тау-негативные включения в нейронах зубчатой фасции и поверхностных слоях фронтальной и височной долей.
Миозит с тельцами включения (IBM) является серьезным заболеванием, как правило, наблюдаемым у людей в возрасте старше 50 лет, при котором у них наблюдается развитие воспаления в мышечных волокнах, и волокна начинают атрофироваться, но при этом не затрагивается мозг, и пациенты в полной мере сохраняют свой интеллект. Было выяснено, что количество двух ферментов, участвующих в продукции амилоидного белка-β, увеличено внутри мышечных клеток у пациентов с наиболее распространенным, прогрессирующим мышечным заболеванием пожилых людей, при котором количество амилоида-β также увеличено.
Дегенерация желтого пятна является широко распространенным заболеванием глаз, которая вызывает ухудшение состояния желтого пятна, которое является центральной областью сетчатки (тонкая ткань в задней части глаза, где светочувствительные клетки посылают визуальные сигналы в мозг). Резкие, четкие, изображения, изображения расположенных прямо перед наблюдателем предметов обрабатываются желтым пятном. Повреждения желтого пятна проявляются в развитии слепых пятен и размытом или искаженном изображении. Связанная с возрастом дегенерация желтого пятна (AMD) является одной из основных причин нарушения зрения в Соединенных Штатах Америки, и для людей старше 65 лет она является ведущей причиной слепоты среди кавказцев. Около 1,8 миллиона американцев в возрасте 40 лет и старше имеют тяжелую AMD, и еще 7,3 миллиона человек со средней AMD подвергаются существенному риску потери зрения. По оценкам правительства, к 2020 году число людей с продвинутой стадией AMD будет составлять 2,9 миллиона. Жертвы AMD часто удивлены и разочарованы, когда узнают, как мало известно о причинах и лечении этого ведущего к слепоте состояния.
Существуют две формы дегенерации желтого пятна: сухая дегенерация желтого пятна и влажная дегенерация желтого пятна. Сухая форма, при которой клетки из желтого пятна медленно начинают разрушаться, диагностируется в 85 процентов случаев дегенерации желтого пятна. Обычно, сухой формой AMD поражены оба глаза, хотя один глаз может потерять зрение, а другой глаз остаться неизменным. Друзы, которые представляют собой желтые отложения под сетчаткой, являются частыми первыми признаками сухой AMD. Риск развития тяжелой сухой или влажной AMD возрастает с увеличением количества или размера друз. Сухая форма AMD может принять более тяжелую форму и вызвать потерю зрения без перехода в мокрую форму этого заболевания, однако ранняя стадия сухой AMD также может внезапно перейти во влажную форму.
Хотя влажная форма составляет лишь 15 процентов случаев, она приводит к 90 процентов случаев слепоты и считается тяжелой AMD (нет ранней или средней стадий влажного AMD). Влажной AMD всегда предшествует сухая форма заболевания. Если при сухой форме начинается ухудшение, у некоторых больных начинается аномальный рост кровеносных сосудов за желтым пятном. Эти сосуды очень хрупки, что приводит к утечке жидкости и крови (отсюда 'влажная' дегенерация желтого пятна), что вызывает быстрое причинение повреждений желтому пятну.
Сухая форма AMD часто первоначально приводит к слегка размытому изображению. Центр изображения, в частности, может стать размытым, и эта зона растет по мере прогрессирования заболевания. Если затронут только один глаз, симптомы могут не быть замечены. При влажном AMD, прямые линии могут восприниматься как волнистые, и может быстро произойти потеря центрального зрения.
Диагностирование дегенерации желтого пятна, как правило, включает расширенное обследование глаза, тест на остроту зрения, а также обследования глазного дна с использованием процедуры, называемой фундоскопия, и - если подозревают влажный AMD - также может быть выполнена флуоресцеиновая ангиография. Если сухая AMD достигнет тяжелой стадии, в настоящее время не известно способа лечения для предотвращения потери зрения. Однако применение высоких доз антиоксидантов конкретной формулы и цинка может задержать или предотвратить прогрессирование AMD от средней до тяжелой стадии. С помощью Macugen® (пегаптаниб-натрий, раствор для инъекций), лазерной фотокоагуляции и фотодинамической терапии можно контролировать аномальный рост кровеносных сосудов и кровотечения в желтом пятне, что является полезным для больных, страдающих влажной AMD; однако, потерянное зрение не может быть восстановлено с использованием этой техники. Если зрение уже потеряно, то помочь улучшить качество жизни могут вспомогательные средства для слабовидящих.
Один из самых ранних признаков, связанных с возрастной дегенерацией желтого пятна (AMD), представляет собой образование внеклеточных скоплений, известных как друзы, между базальной ламиной пигментного эпителия сетчатки (RPE) и мембраной Бруха (ВМ). Недавние исследования, проведенные Anderson и др., подтвердили, что друзы содержат бета-амилоид (Experimental Eye Reserch 78 (2004) 243-256).
Прионы являются причиной нейродегенеративных заболеваний, таких, как губчатый энцефалит овец, губчатые энцефалопатии крупного рогатого скота и болезнь Крейтцфельда-Якоба у людей. Единственный известный компонент этих частиц представляет собой характерную для губчатого энцефалита изоформу белка PrPSc. Хотя прионы множатся, нет никаких доказательств того, что они содержат нуклеиновые кислоты. PrPSc происходит из неинфекционного, клеточного белка PrPC посредством посттрансляционного процесса, в ходе которого PrPC претерпевает глубокие конформационные изменения.
Белок губчатого энцефалита PrPSc играет критически важную роль в нейрональной дегенерации и в ходе развития болезни проходит три этапа: PrPC (обычная клеточная изоформа белка) - PrPSc: инфекционная форма (изоформа белка, характерная для губчатого энцефалита) - белок PrP27-30.
Такой каскад событий происходит в ходе развития болезни Крейтцфельда-Якоба (CJD), Куру, синдрома Герстмана-Штраусслера-Шейнкера (GSS), смертельной семейной бессонницы у человека, губчатого энцефалита овец и коз, энцефалопатии у норки и губчатой энцефалопатии крупного рогатого скота.
Клеточный нетоксичный белок (PrPC) представляет собой сиалогликопротеин молекулярной массой от 33000 до 35000, который экспрессируется преимущественно в нейронах. При упомянутых выше заболеваниях, PrPC преобразуется в измененную форму (PrPSc), которая отличается от своих обычных гомологов его относительной устойчивостью к пищеварительным протеазам. PrPSc накапливается в центральной нервной системе больных животных и людей, и ядро его внеклеточных агрегатов обладает устойчивостью к протеазам.
Амилоидоз представляет собой не одно заболевание, а группу различных прогрессирующих процессов, характеризующихся внеклеточным отложением в тканях воскообразного, крахмалообразного белка, называемого амилоидом, который накапливается в одном или нескольких органах или системах организма. Образовавшиеся отложения амилоида начинают мешать нормальному функционированию органов или систем организма. Существует по меньшей мере 15 различных типов амилоидоза. Основными формами являются первичный амилоидоз без известных предшественников, вторичный амилоидоз и следующие за ним некоторые другие состояния, и наследственный амилоидоз.
Вторичный амилоидоз возникает у людей, имеющих хронические инфекции и воспалительные заболевания, такие, как туберкулез, бактериальная инфекция, называемая семейной средиземноморской лихорадкой, инфекции костей (остеомиелит), ревматоидный артрит, воспаление тонкой кишки (грануломатозный илеит), болезнь Ходжкина и проказа.
Глаукома представляет собой группу заболеваний зрительного нерва, связанных с потерей ганглиозных клеток сетчатки (RGC) в характерной области оптической невропатии. Глаукома часто, но не всегда, сопровождается повышенным глазным давлением, которое может быть результатом блокирования циркуляции жидкости или дренажной системы глаза.
Хотя повышенное внутриглазное давление является существенным фактором риска для развития глаукомы, не может быть определен порог внутриглазного давления, который определенно приведет к возникновению глаукомы.
Ущерб может быть также вызван плохим кровоснабжением жизненно важных волокон зрительного нерва, слабостью структуры нерва и/или проблемами в состоянии самих нервных волокон.
Не подвергающаяся лечению глаукома приводит к постоянному повреждению зрительного нерва и, как результат, сокращению поля зрения, которое может прогрессировать до слепоты.
RGC представляют собой нервные клетки, передающие визуальные сигналы от глаза к мозгу. Каспазы-3 и каспазы-8 представляют собой два основных фермента в процессе апоптоза, которые включены в процесс, ведущий к апоптозу RGC. Каспазы-3 расщепляют белки-прекурсоры амилоида (АРР), образуя нейротоксические фрагменты, в том числе амилоид β. Без защитного влияния АРР, накопление амилоида β в слое ганглиозных клеток сетчатки приводит к смерти RGC и необратимой потере зрения.
Различные типы глауком классифицируются на открытоугольные глаукомы, если состояние хроническое, и закрытоугольные глаукомы, в случае острой глаукомы, которая возникает неожиданно. Глаукома обычно затрагивает оба глаза, но болезнь может прогрессировать более быстрыми темпами в одном глазу, чем в другом.
Хроническая открытоугольная глаукома (COAG), также известная как первичная открытоугльная глаукома (POAG), является наиболее распространенным видом глаукомы. COAG вызывается микроскопической блокадой в трабекулярной сети, которая уменьшает водный отток в шлеммовом канале и повышает внутриглазное давление (IOP). POAG обычно затрагивает оба глаза и тесно связана с возрастом и позитивным семейным анамнезом. Частота заболеваемости возрастает у пожилых людей, так как дренажная система глаза может постепенно забиваться со старением. Увеличение внутриглазного давления у лиц, страдающих хронической открытоугольной глаукомой, не сопровождается никакими симптомами до тех пор, пока потери зрения не ощущается в центральной визуальной области.
Острая закрытоугольная глаукома (AACG) или закрытоугольная глаукома является довольно редким видом глаукомы, для которого характерно внезапное повышение внутриглазного давления с 35 до 80 мм ртутного столба, что приводит к сильной боли и необратимой потере зрения. Резкое повышение давления обусловлено закрытием фильтрационного угла и блокадой дренажных каналов. Индивидуумы с узким углом имеют повышенный риск внезапного закрытия угла. AACG обычно происходит с одним глазом, но риск существует для обоих глаз. Возраст, катаракта и псевдоэкфолиация также представляют собой факторы риска, поскольку они связаны с расширением хрусталика и уплотнением или сужением угла. Внезапный приступ глаукомы может сопровождаться серьезной глазной и головной болью, воспалением глаз, тошнотой, рвотой и размытым зрением.
Смешанная глаукома или глаукома с комбинированным механизмом представляет собой сочетание или комбинацию открытоугольной и закрытоугольной глаукомы. Эта форма возникает у пациентов с острой ACG, у которых угол открыт после лазерной иридотомии, но которым по-прежнему требуются лекарства для IOP контроля, а также пациенты с POAG или псевдоэксфолиативной глаукомой, у которых угол постепенно сужается.
Глаукома с нормальным внутриглазным давлением (NTG), также известная как глаукома с низким внутриглазным давлением (LTG), характеризуется прогрессирующим повреждением зрительного нерва и потерей периферического зрения, аналогичной той, которая наблюдается при других видах глаукомы, однако, внутриглазное давление является нормальным или даже ниже нормы.
Врожденная (детская) глаукома является относительно редким, наследственным типом открытоугольной глаукомы. Недостаточное развитие дренажной области приводит к увеличению давления в глазу, что может привести к потере зрения от повреждения зрительного нерва и расширению глаз. Ранняя диагностика и лечение имеют решающее значение для сохранения зрения у младенцев и детей, страдающих этим заболеванием.
Вторичная глаукома может возникнуть в результате травмы глаза, воспаления радужки глаза (воспаление радужной оболочки глаза), сахарного диабета, катаракты или использования стероидов стероид-восприимчивыми лицами. Вторичная глаукома может также быть связана с отслоением сетчатки или окклюзией или блокированием вен сетчатки.
Пигментная глаукома характеризуется отслоением гранул пигмента в радужке. Гранулы вызывают блокирование дренажной системы глаза, что приводит к повышению внутриглазного давления и повреждению зрительного нерва.
Эксфолиативная глаукома (псевдоэксфолиативная) характеризуется отложением хлопьевидного материала в передней капсуле и в углу глаза. Накопление хлопьевидного материала блокирует дренажную систему и повышает глазное давление.
Диагностика глаукомы может быть осуществлена с использованием различных тестов. Тонометрия определяет глазное давление путем измерения тонуса или твердости глазной поверхности. В данном тесте используются несколько видов тонометров, но наиболее распространенным является аппланационный тонометр. Пахиметрия определяет толщину роговицы, которая, в свою очередь, является мерой внутриглазного давления. Гониоскопия позволяет изучить фильтрационный угол и дренажную область глаза. Гониоскопия может также определить блокирование аномальными кровеносными сосудами дренажа водянистой жидкости из глаза. Офтальмоскопия позволяет изучить зрительный нерв и может обнаружить повреждения слоя нервного волокна, изменения в зрительном диске или образование вдавлений (образование чашеобразных углублений) в этой структуре, которые могут быть вызваны увеличением внутриглазного давления или отмиранием аксонов. Гониоскопия также полезна при оценке ущерба, нанесенного нерву плохим кровоснабжением или повышением внутриглазного давления. Карты для тестирования поля зрения, субъективно, могут обнаружить признаки глаукоматозных повреждений зрительного нерва. Они определяются специфической моделью потери поля зрения. Оптическая когерентная томография, средство объективного измерения потери слоя нервных волокон, осуществляется путем изучения толщины слоя волокон зрительного нерва (измененной при глаукоме) с помощью различий в светопропускании через поврежденные ткани аксона.
Друзы в зрительном нерве представляют собой конкреции глобулярных белков и солей кальция, которые, как считается, являются выделениями через врожденно измененные сосудистые структуры, влияющие на слой аксонов нервных волокон. Эти накопления происходят в перипапиллярном слое нервных волокон и либо непосредственно повреждают слой нервных волокон путем сжатия, либо косвенным путем, нарушая сосудистое снабжение слоя нервных волокон. Как правило, они становятся видимыми после первых десяти лет жизни больных. Они встречаются чаще всего в обоих глазах, но могут также затрагивать один глаз, и могут на протяжении многих лет вызывать легкую потерю периферического зрения.
Оптическая невропатия представляет собой заболевание, характеризующееся повреждением зрительного нерва, вызванным демиелинизацией, блокированием доступа крови, недостаточным питанием или токсинами. В основе демиелинизирующих зрительных невропатий (оптический неврит, см. ниже), как правило, лежит процесс демиелинизации, такой как рассеянный склероз. Блокирование доступа крови, известное как ишемическая оптическая невропатия, может привести к смерти или дисфункции клеток зрительного нерва. Неартериальная ишемическая оптическая невропатия, как правило, имеет место у людей среднего возраста. К факторам риска относятся высокое кровяное давление, диабет и атеросклероз. Артрическая ишемическая оптическая невропатия обычно возникает у пожилых людей после воспаления артерий (артериита), особенно височной артерии (височный артериит). Потеря зрения может быть быстрой или развиваться постепенно от 2 до 7 дней, и затронуты могут быть один или оба глаза. У людей с оптической невропатией, вызванной воздействием токсина или недостаточностью питания, как правило, затрагиваются оба глаза.
Около 40% людей с неартериальной ишемической оптической невропатией испытывают спонтанное улучшение с течением времени. Неартериальная ишемическая оптическая невропатия подвергается лечению с помощью контроля артериального давления, лечения диабета и контроля уровня холестерина. Артериальная ишемическая оптическая невропатия подвергается лечению высокими дозами кортикостероидов для предотвращения потери зрения вторым глазом.
Неврит зрительного нерва приводит к легкой или тяжелой потере зрения одним или двумя глазами и может быть вызван системным демиелинизирующим процессом (см. выше), вирусной инфекцией, вакцинацией, менингитом, сифилисом, рассеянным склерозом и внутриглазным воспалением (увеитом). Движения глаз могут быть болезненными, и зрение может ухудшиться при повторных приступах. Диагностирование предполагает изучение реакции зрачка и определение, является ли оптический диск распухшим. Магнитно-резонансная томография (MRI) может показать рассеянный склероз, или, в редких случаях, опухоль, давящую на зрительный нерв, и в этом случае зрение улучшается после того, как давящую опухоль удаляют. В большинстве случаев при неврите зрительного нерва в течение нескольких месяцев наступает улучшение без какого-либо лечения. В некоторых случаях может быть необходимо лечение внутривенным введением кортикостероидов.
Катаракта представляет собой непрозрачность, которая развивается в хрусталике глаза или в его оболочке. Катаракта, как правило, вызывает прогрессивную потерю зрения и может привести к слепоте при оставлении без лечения. При Морганиевой катаракте, корковые слои катаракты постепенно разжижаются, образуя молочно-белую жидкость, и могут вызвать серьезные воспаления при разрыве капсулы зрачка и утечке. При отсутствии лечения, катаракта также может вызывать факоморфическую глаукому. Катаракты могут быть врожденными или вызванными генетическими факторами, преклонным возрастом, продолжительным ультрафиолетовым облучением, радиационным облучением, сахарным диабетом, ранением глаза или физической травмой.
Экстракапсулярная (ЕССЕ) хирургия является наиболее эффективным способом лечения катаракты. При операции удаляется хрусталик, но большая часть хрусталиковой сумки остается неизменной. Факоэмульсификация, небольшой надрез на роговице, обычно используется для удаления хрусталика до экстракции.
Зрительный амилоидоз представляет собой наследственное расстройство, связанное с семейной амилоидной полинейропатией I типа (FAP), и характеризуется аномалиями конъюнктивальных сосудов, сухостью конъюнктивы и роговицы, зрачковыми аномалиями, а в некоторых случаях, непрозрачностью стекловидного тела и вторичной глаукомой. Тип I FAP связан с мутациями транстиретина (TTR), терамерного плазменного белка (преальбумина), который синтезируется в печени, пигментном эпителии сетчатки и хороидном сплетении мозга. Различные мутации вызывают полимеризацию транстиретина в складчатые структуры амилоидных фибрилл, ведущие к наследственному амилоидозу. Наиболее частой мутацией является TTR-met303, при которой метионин заменяет валин в 30 позиции последовательности транстиретина.
Тип IV FAP связан с решетчатой дистрофией роговицы (LCD). Решетчатая дистрофия роговицы представляет собой наследственный, первичный, как правило, билатеральный амилоидоз роговицы, характеризующийся наличием преломляющих решетчатых линий с двойным контуром в строме роговицы. LCD I типа (Бибера-Гааба-Диммера) представляет собой аутосомно-доминантное, симметричное билатеральное поражение роговицы, характеризующееся наличием многочисленных полупрозрачных решетчатых тонких линий с белыми точками и слабым затуманиванием в поверхностных и средних слоях центральной стромы. Симптомы начинают проявляться в течение первого или второго десятилетия жизни, что приводит к прогрессирующей утрате зрения. Большинство пациентов к 40 годам нуждаются в пересадке роговицы. LCD II типа ассоциируется с системным амилоидозом (синдромом Meretoja (в русской литературе не переводится) и характеризуется наличием решетки из толстых линий в лимбе роговицы, центральной части и строме роговицы. Это долгое время не влияет на зрение. LCD III типа встречается у людей среднего возраста и характеризуется наличием решетки из толстых линий, которые тянутся от лимба до лимба. LCD III А типа характеризуется накоплением амилоидных отложений в строме и наличием амилоидных лент между стромой и Боуменовым слоем, LCD типа III А отличается от LCD типа III наличием эрозии роговицы, встречаемостью среди белого населения и аутосомно-доминантным типом наследования.
Синдром Дауна (DS) или трисомия по 21 паре является самым распространенным генетическим расстройством со встречаемостью примерно 1:700 у новорожденных и зачастую связан с различными врожденными аномалиями. Нарушения, которые вызваны присутствием дополнительной 21 хромосомы, связаны с преждевременным отложением бляшек, образованных бета-амилоидом, и развитием болезни Альцгеймера в среднем возрасте. Кроме того, многие люди, страдающие DS, подвержены катаракте, начиная с детства, и многие страдают от врожденной глаукомы. Поскольку ген прекурсоров амилоидного белка, который расщепляется с образованием амилоида бета, находится на длинном плече 21 хромосомы человека, гиперэкспрессия этого гена может привести к повышению уровня прекурсоров амилоида и отложению амилоида при синдроме Дауна.
Способа лечения глаукомы не существует. Лекарственные препараты для лечения глаукомы включают агенты, уменьшающие продукцию внутриглазной жидкости, такие как бета-блокаторы (Тимоптик, Бетоптик), ингибиторы карбоангидразы (Азопт, Трусопт) и альфа-агонисты (Альфаган, Иопидин), а также вещества, которые перенаправляют дренаж внутриглазной жидкости через различные пути в светочувствительном слое глаза, например, простагландины (Ксалатан). Лазерные операции включают трабекулопластику, процедуру, которая помогает внутриглазной жидкости более эффективно покидать глаз. По данным Glaucoma Foundation, почти 80% пациентов реагировали на процедуру достаточно хорошо, так что необходимость в дальнейшем хирургическом вмешательстве отпала или отсрочилась. Тем не менее, согласно данным National Eye Institute, у половины всех больных внутриглазное давление снова возрастает в течение двух лет после лазерной операции. Инцизионные операции производятся, если лекарства и первоначальное лазерное лечение не привели к снижению давления внутри глаза. При одном из видов операций, трабекулотомии, создается отверстие в стенке глаза так, что внутриглазная жидкость может оттекать. Однако, по данным Glaucoma Foundation, примерно у одной трети подвергнутых трабекулотомии пациентов катаракта развивается в течение пяти лет после операции. Если трабекулотомия не приводит к желаемому результату, дополнительные инцизионные процедуры включают введение дренажной трубки в глаз между роговицей и радужной оболочки глаза и использование лазерного лечения или замораживания для уничтожения ткани глаза, продуцирующей внутриглазную жидкость. Хирургия может спасти оставшееся у пациента зрение, но не может его улучшить. Зрение после операции может ухудшиться.
Связанная с возрастом дегенерация желтого пятна (AMD) является основной причиной слепоты среди кавказцев старше 65 лет. Несмотря на значительный прогресс, достигнутый в последнее время в научных исследованиях дегенерации желтого пятна, не известно способа лечения, спасающего гибнущие во время болезни нейрональные клетки. Не существует также надежных способов лечения других глазных заболеваний, связанных с деградацией нейронов, вызванной бета-амилоидом, таких как корковый визуальный дефицит, друзы зрительного нерва, оптическая невропатия, неврит зрительного нерва, зрительные амилоидозы и решетчатая дистрофия.
Амилоидные отложения обычно содержат три компонента. Фибриллы амилоидного белка, на долю которых приходится около 90% амилоидного материала, составляют один из нескольких типов белков. Эти белки способны складываться в так называемые фибриллы из "бета-складчатых" листов, уникальная конфигурация которых создает сайты связывания для Конго красного, что приводит к уникальному окрашиванию этого амилоидного белка. Кроме того, амилоидные скопления тесно связаны с амилоидным Р (пятиугольным) компонентом (АР), гликопротеином, родственным нормальному сывороточному амилоиду Р (SAP), а также с сульфатированными гликозаминогликанами (GAG), сложными углеводами соединительной ткани.
Одним из направлений в развитии лечения болезни Альцгеймера и прионных заболеваний была разработка молекул, связывающихся с аномальными β-листовыми конформациями Аβ и PrP, соответственно, тем самым препятствующим агрегации этих молекул. β-Листовая конформация пептидов характеризуется образованием регулярного мотива водородных связей между соседними аминокислотными цепями. Этот механизм приводит к стабильной трехмерной структуре. Н-связывающие акцепторы (С=O группы) и Н-связанные доноры (NH группы) чередуются в естественных пептидах со связываемыми атомами примерно на одной линии. Внутри каждой цепи аминокислот, расстояния межд