Люминесцирующие комплексные соединения рзэ с пиразолсодержащими 1,3-дикетонами и способ их получения
Иллюстрации
Показать всеИзобретение относится к комплексному соединению редкоземельных элементов общей формулы , где Ln - ион трехвалентного редкоземельного элемента, например Nd, Рr, Sm, Eu, Tb, Dy, Но, Tm, Er, Yb; L1 - дикетонатный лиганд, являющийся производным 1,3-дипиразолилпропандиона-1,3 общей формулы
.
где R1, R3 - алкильный, фторалкильный, арильный, циклоалкильный или гетероциклический заместитель, R2, R4 - атом водорода, алкильный, фторалкильный, арильный, циклоалкильный или гетероциклический заместитель, атом галогена, СF3 или NO2 - группа, причем сопряжение дикетонного фрагмента может осуществляться симметрично или несимметрично по положениям 3, 4 или 5 каждого пиразольного цикла, М+ - одновалентный катион щелочного металла, например Li, К, Na, Rb, Cs, ион NH4 +, остаток четвертичного аммониевого основания, например +N(Me)4, +N(Еt)4, +N(Bu)4, катион пиридиния или катион вторичного амина, например пиперидиния или пирролидиния, или третичного амина, например, триэтиламмония или триметиламмония. Также предложен способ получения комплексного соединения. Комплексные соединения обладают высокой интенсивностью люминесценции и могут применяться в оптико-электронных устройствах. 2 н.п. ф-лы, 3 ил., 9 пр.
Реферат
Изобретение относится к новому классу 1,3-дикетонатных производных редкоземельных элементов, которые могут быть использованы в качестве активных слоев органических светоизлучающих диодов (OLED), оптико-электронных устройств, а также флуоресцентных меток и маркеров.
Ближайшими аналогами предложенных соединений РЗЭ можно считать известные комплексные соединения, включающие в качестве дикетонатного лиганда 4-ацилпиразолоны [1-2].
Получают данные известные соединения путем взаимодействия исходного 4-ацилпиразолона с солью редкоземельного элемента и гидроксидом щелочного металла (или органическим основанием) в среде водного спирта с последующей кристаллизацией малорастворимого продукта. Например, для получения известного [3] комплексного соединения тербия с 1-фенил-3-метил-4-адамантилкарбонилпиразононом растворяют 0.5 ммоль пиразолона и 0.5 ммоль КОН в этаноле, после чего добавляют раствор 0.167 ммоль Tb(NO3)3)*6H2O в 50% водном этаноле, выдерживают 2 часа при комнатной температуре и отделяют малорастворимый продукт путем фильтрования.
В данных известных соединениях дикетонный фрагмент является частью сопряженной системы пиразолона, что ограничивает возможность варьирования структуры с целью получения оптимальных люминесцентных (квантовый выход, интенсивность люминесценции) и технологически важных (термическая стабильность, пленкообразующая способность, растворимость и летучесть в вакууме) свойств.
Задачей, решаемой изобретением, является создание новых комплексных соединений РЗЭ, обладающих высокой интенсивностью люминесценции и заданными технологическими параметрами, такими, как термическая стабильность, пленкообразующая способность, растворимость и летучесть в вакууме, что в свою очередь, обеспечивает возможность их применения в оптико-электронных устройствах.
Для достижения поставленной задачи в качестве люминесцирующих комплексных соединений РЗЭ в настоящей заявке предложены комплексные соединения следующего строения:
где Ln - ион трехвалентного редкоземельного элемента, например Nd, Pr, Sm, Eu, Tb, Dy, Но, Tm, Er, Yb; L1 - дикетонатный лиганд, являющийся производным 1,3-дипиразолилпропандиона-1,3 общей формулы
где R1, R3 - алкильный, фторалкильный, арильный, циклоалкильный или гетероциклический заместитель, R2, R4 - атом водорода, алкильный, фторалкильный, арильный, циклоалкильный или гетероциклический заместитель, атом галогена, CF3 или NO2 - группа, причем сопряжение дикетонного фрагмента может осуществляться симметрично или несимметрично по положениям 3, 4 или 5 каждого пиразольного цикла. M+ - одновалентный катион щелочного металла, например Li, К, Na, Rb, Cs, ион NH4 +, остаток четвертичного аммониевого основания, например +N(Me)4, +N(Et)4, +N(Bu)4, катион пиридиния или катион вторичного амина, например пиперидиния или пирролидиния, или третичного амина, например, триэтиламмония или триметиламмония.
В отличие от известных соединений РЗЭ, в соединениях общей формулы 1, дикетонный фрагмент не является частью сопряженной системы пиразола и может быть введен в любое возможное положение (а не только в С4) пиразольного цикла, что позволяет в широких пределах варьировать электронные и стерические свойства данного лиганда.
Авторам неизвестны примеры синтеза комплексных соединений редкоземельных элементов с 1-3-дикетонами ряда пиразола. Методом рентгеноструктурного анализа показана идентичность структуры свободного лиганда со структурой лиганда в составе комплексного соединения.
Введение в качестве дикетонной компоненты производных пиразола формулы 2 позволяет повысить интенсивность люминесценции комплексных соединений по сравнению с известными, а также варьировать в широких пределах такие практически значимые характеристики комплексов, как растворимость, пленкообразующая способность, термическая стабильность и летучесть в вакууме.
Синтез комплексных соединений общей формулы 1 осуществляют следующим образом: к раствору дикетона в этиловом спирте при повышенной температуре (предпочтительно 30-35°С) добавляют последовательно 1-3 М водный раствор гидроксида щелочного металла, или гидроксида четвертичного аммониевого основания, или 1-10 М раствор вторичного или третичного амина, взятый в эквивалентном (по молям) количестве по отношению к дикетону, и водный раствор соли редкоземельного элемента, взятой в соотношении 1 моль РЗЭ на 4 моля дикетона, причем взаимодействие компонентов осуществляют в течение 12-24 часов при температуре 35-45°С в герметично закрытых контейнерах.
Использование герметически закрытого контейнера является существенным, так как в этом случае не требуется восполнять потерю на испарение растворителя и летучих компонентов, таких, как амины. Кроме того, при использовании в качестве основания аминов, использование закрытого контейнера позволяет существенно уменьшить побочные процессы, происходящие из-за окисления реагентов кислородом воздуха.
Для выделения конечных продуктов реакционную массу упаривают досуха, остаток экстрагируют полярным органическим растворителем, например, этанолом, метанолом, пропанолом-2 или тетрагидрофураном или смесью этих растворителей с хлороформом или дихлорметаном, полученный раствор фильтруют и концентрируют. Комплексное соединение выделяют путем осаждения из полученного раствора посредством медленного добавления подходящего растворителя, например, пентана, гексана, гептана, бензола или диэтилового эфира, в результате чего комплексное соединение осаждается в твердом виде.
Альтернативный путь выделения может заключаться в упаривании досуха сконцентрированного раствора комплексного соединения в полярном органическом растворителе и перекристаллизации остатка из подходящего растворителя (этанола, метанола, ацетонитрила, хлороформа, дихлорметана или их смесей).
Указанный температурный режим является оптимальным для проведения данного синтеза и позволяет добиться полной конверсии исходных материалов в конечные продукты за указанный промежуток времени. При более высоких температурах или продолжительном (более 24 часов) времени взаимодействия реагентов происходит образование побочных продуктов. При низких температурах (менее 30°С) время реакции значительно удлиняется по сравнению с указанным и снижается полнота образования конечных продуктов.
Спектральные данные, иллюстрирующие люминесцентные характеристики синтезированных соединений при фотовозбуждении, представлены на фиг.1-3.
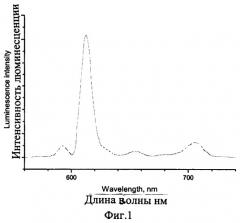
На фиг.1 изображен спектр люминесценции твердого образца цезия (тетракис-(1,3-бис(1,3-диметил-1H-пиразол-4-ил)-1,3-пропандионо)европиата (λвозб.=320 нм).
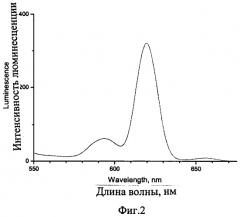
На фиг.2 приведен спектр люминесценции твердого образца натрия (тетракис-(1,3-бис(1,3-диметил-1H-пиразол-4-ил)-1,3-пропандионо)европиата (λвозб.=320 нм)
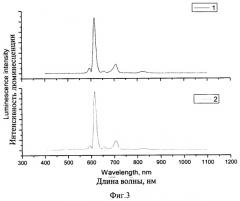
Фиг.3 иллюстрирует идентичность спектров люминесценции пленки из метилметакрилата (кривая 1), содержащей цезия (тетракис-(1,3-бис(1,3-диметил-1H-пиразол-4-ил)-1,3-пропандионо)европиат и твердого образца (кривая 2) этого комплекса (λвозб.=320 нм).
Пример 1.
Цезия (тетракис-(1,3-бис(1,3-диметил-1H-пиразол-4-ил)-1,3-пропандионо)европиат (III))
В 15 мл этанола при нагревании растворяют 1.041 г (4 ммоль) 1,3-бис(1,3-диметил-1H-пиразол-4-ил)-1,3-пропандиона (Art-Chem GmbH, Германия) и добавляют 4 мл (4 ммоль) 1М водного раствора CsOH. Центрифугируют 5 минут при 5000 об/мин, раствор переносят в стеклянный контейнер и добавляют по каплям раствор 0.445 г (1 ммоль) Еu(NО3)3*6Н2O (99,9% Aldrich, США) в 5 мл воды при интенсивном перемешивании. Устанавливают рН=7 путем добавления нескольких капель уксусной кислоты, закрывают контейнер и выдерживают в термостате при +40°С 24 часа, после чего охлаждают до комнатной температуры. Растворитель отгоняют, сухой остаток экстрагируют 30 мл абсолютного этанола, фильтруют, упаривают до начала кристаллизации. Осадок отделяют и сушат в вакууме. Белый микрокристаллический порошок. Выход 0.81 г (61%).
Найдено (%): С, 47.41; Н, 4.79; N, 16.61; Eu, 11.55. Вычислено для C52H60CsEuN16O8 (%): С, 47.24; Н, 4.57; N, 16.95; Eu, 11.49.
Пленку на стеклянную подложку наносили методом центрифугирования (spin-coating), используя в качестве связующего 2% раствор метилметакрилата в ТГФ, содержащий 0.1% комплекса. Люминесценция в растворе, пленке и твердом виде характеризуется следующими значениями: λmах возб.=320 нм, длина волны в максимуме спектра люминесценции - 615 нм.
Пример 2.
Тетраметиламмония (тетракис-(1,3-бис(1,3-диметил-1H-пиразол-4-ил)-1,3-пропандионо) тербиат (III))
Получают аналогично Примеру 1 из 0.453 г (1 ммоль) Тb(NО3)3*6Н2O и 3М водного раствора гидроксида тетраметиламмония. Белый микрокристаллический порошок. Выход - 1.05 г (83%). Найдено (%): С, 52.81; Н, 5.77; N, 18.88; Tb, 12.51. Вычислено для C56H72N17O8Tb (%): С, 52.95; Н, 5.71; N, 18.75; Tb, 12.60.
Люминесценция в растворе, пленке и твердом виде характеризуется следующими значениями: λмах возб.=370 нм, длина волны в максимуме спектра люминесценции - 550 нм.
Пример 3.
Натрия (тетракис-(1,3-бис(1,3-диметил-1H-пиразол-4-ил)-1,3-пропандионо)европиат (III))
Получают аналогично Примеру 1 из 0.445 г (1 ммоль) Еu(NО3)3*6Н2O и 1М раствора NaOH. Белый микрокристаллический порошок. Выход 0.70 г (58%). Найдено (%): С, 51.61; Н, 5.12; N, 18.73; Eu, 12.50. Вычислено для C52H60NaEuN16O8 (%): С, 51.53; Н, 4.99; N, 18.49; Eu, 12.54.
Пример 4.
Аммония (тетракис-(1-(3,5-диметил-1-фенил-1Н-пиразол-4-ил)-3-[1-метил-4-нитро-3-(трифторметил)-1Н-пиразо-5-ил]пропан-13-дионо)европиат (III).
Получают аналогично Примеру 1 из 0.445 г (1 ммоль) Еu(NО3)3*6Н2O и 6М водного раствора аммиака. Белый порошок. Выход 1.20 г (63%). Найдено (%): С, 48.99; Н, 3.21; N, 15.57; Eu, 8.03. Вычислено для C76H64EuF12N21O16 (%): С, 47.86; Н, 3.38; N, 15.42; Eu, 7.97. Максимум эмиссии - 620 нм (λвозб.=390 нм).
Пример 5.
Пиперидиния (тетракис-(1-[4-хлор-5-фенил-1-(2,2,2-трифторэтил)-1Н-пиразол-3-ил-3-(1-циклопентил-1Н-пиразол-4-ил)пропан-1,3-дионо)европиат (III).
Получают аналогично Примеру 1 из 0.445 г (1 ммоль) Еu(NО3)3*6Н2O и 5М водного раствора пиперидина. Светло-желтый порошок. Выход 0.59 г (28%). Найдено (%): С, 53.51; Н, 4.31 N, 11.49; Eu, 7.30. Вычислено для C93H87Cl4EuF12N17O8 (%): С, 53.38; Н, 4.19; N, 11.38; Eu, 7.26. Максимум эмиссии - 618 нм (λвозб.=390 нм).
Пример 6.
Пиридиния (тетракис-(1-(3-циклопропил-1-метил-1H-пиразол-4-ил)-3-[1-метил-3,5-бис-(2,2,2трифторэтил)-1H-пиразол-4-ил]пропан-1,3-дионо)тербиат (III).
Получают аналогично Примеру 1 из 0.453 г (1 ммоль) Тb(NО3)3*6Н2O и 10М водного раствора пиридина. Желтый порошок. Выход 0.97 г (49%). Найдено (%): С, 46.91; Н, 3.85 N, 11.91; Tb, 7.98. Вычислено для C77H73F24N17O8Tb (%): С, 46.72; Н, 3.72; N, 12.03; Tb, 8.03. Максимум эмиссии - 546 нм (λвозб.=405 нм).
Пример 7.
Триэтиламмония(тетракис-(1-[4-хлор-5-фенил-1-(2,2,2-трифторэтил)-1Н-пиразол-3-ил-3-(1-циклопентил-1Н-пиразол-4-ил)пропан-1,3-дионо)европиат (III).
Получают аналогично Примеру 1 из 0.445 г (1 ммоль) Еu(NО3)3*6Н2O и 10М водного раствора триэтиламина. Светло-желтый порошок. Выход 1.15 г (55%). Найдено (%): С, 53.47; Н, 4.39 N, 11.33; Eu, 7.28. Вычислено для C94H91Cl4EuF12N17O8 (%): С, 53.34; Н, 4.35; N, 11.29; Eu, 7.21. Максимум эмиссии - 621 нм (λвозб.=390 нм).
Пример 8.
Калия (тетракис-(1-(1-метил-1H-пиразол-5-ил)-3-[1-метил-3-(2-тиенил)-1H-пиразол-4-ил]пропан-1,3-дионо)иттербиат (III).
Получают аналогично Примеру 1 из 0.467 г (1 ммоль) Yb(NO3)3*6Н2O и 1М водного раствора КОН. Белый порошок. Выход 0.63 г (44%). Найдено (%): С, 49.21; Н, 3.61 ;N, 15.33; Yb, 11.71. Вычислено для C60H52KN16O8S4Yb (%): С, 49.17; Н, 3.58; N, 15.29; Yb, 11.81. Максимум эмиссии - 1552 им (λвозб.=370 нм).
Пример 9.
Цезия (тетракис-(1-(1-метил-1H-пиразол-5-ил)-3-[1-(5-нитро-2-тиенил)-1H-пиразол-5-ил]пропан-1,3-дионо)иттербиат (III).
Получают аналогично Примеру 1 из 0.467 г (1 ммоль) Yb(NО3)3*6Н2O и 1 М водного раствора CsOH. Оранжево-красный порошок. Выход 0.57 г (35%). Найдено (%): С, 40.09; Н, 2.53; N, 16.81; Yb, 10.32. Вычислено для C56H40CsN20O16S4Yb (%): С, 39.96; Н, 2.40; N, 16.69; Yb, 10.28. Максимум эмиссии - 1550 нм (λвозб.=410 нм).
Нами впервые установлено, что синтезированные комплексы РЗЭ с пиразолсодержащими 1,3-дикетонами имеют выраженные интенсивные полосы люминесценции в видимой или ближней инфракрасной области спектра, причем вид спектров практически не отличается для соединения в твердой фазе, растворах и для пленки на стекле или другом прозрачном материале, полученные методом центрифугирования или погружения.
Эти результаты свидетельствуют о том, что при выполнении технологических операций, таких, как растворение, осаждение, испарение растворителя, не происходит разложения комплексов или изменения их спектральных свойств, что открывает возможность использования этих комплексов в технологических процессах изготовления электролюминесцентных приборов на их основе.
Источники информации:
1. Комплексное соединение редкоземельных элементов общей формулы [Ln(L1)4]-M+, где Ln - ион трехвалентного редкоземельного элемента, например Nd, Pr, Sm, Eu, Tb, Dy, Но, Tm, Er, Yb; L1 - дикетонатный лиганд, являющийся производным 1,3-дипиразолилпропандиона-1,3 общей формулы где R1, R3 - алкильный, фторалкильный, арильный, циклоалкильный или гетероциклический заместитель, R2, R4 - атом водорода, алкильный, фторалкильный, арильный, циклоалкильный или гетероциклический заместитель, атом галогена, СF3 или NO2-группа, причем сопряжение дикетонного фрагмента может осуществляться симметрично или несимметрично по положениям 3, 4 или 5 каждого пиразольного цикла, M+ - одновалентный катион щелочного металла, например Li, K, Na, Rb, Cs, ион NH4 +, остаток четвертичного аммониевого основания, например +N(Me)4, +N(Еt)4, +N(Bu)4, катион пиридиния или катион вторичного амина, например пиперидиния или пирролидиния, или третичного амина, например триэтиламмония или триметиламмония.
2. Способ получения комплексного соединения редкоземельных элементов по п.1, включающий растворение дикетона в этиловом спирте при повышенной температуре (предпочтительно 30-35°С), добавление в полученный раствор 1-3 М водного раствора гидроксида щелочного металла или четвертичного аммониевого основания или 1-10 М раствора третичного или вторичного амина, взятого в эквивалентном (по молям) количестве по отношению к дикетону, последующее добавление в реакционную массу водного раствора соли редкоземельного элемента, взятой в соотношении 1 моль РЗЭ на 4 моль дикетона, причем взаимодействие компонентов осуществляют в водно-спиртовой среде в течении 12-24 ч при температуре 35-45°С в герметично закрытых контейнерах, выделение комплексного соединения редкоземельных элементов осуществляют упариванием досуха реакционной массы и последующей экстракцией остатка полярным органическим растворителем, например этанолом, метанолом, пропанолом-2 или тетрагидрофураном или смесью этих растворителей, с хлороформом или дихлорметаном, полученный раствор фильтруют, упаривают и выделяют комплексное соединение редкоземельных элементов путем медленного добавления подходящего растворителя, например пентана, гексана, гептана, бензола или диэтилового эфира, в результате чего комплексное соединение осаждается в твердом виде.