Пептидные вакцины против рака с экспрессией полипептидов mphosph1 или depdc1
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к выделенному декапептиду или нонапептиду, способному индуцировать цитотоксические Т-клетки, а также к данным пептидам, в которых 1 аминокислота заменена, к полинуклеотиду, который кодирует данные пептиды, к фармацевтической композиции и вакцине, которые включают данные пептиды, способу индукции антиген-презентирующих клеток, способу индукции цитотоксических Т-клеток, выделенной цитотоксической CD8+Т-клетке, дендритной клетке, индуцирующей CTL и способу лечения заболевания, связанного с повышенной экспрессией генов SEQ ID NO: 1, 3 и/или 5. Выделенный декапептид или нонапептид, способный индуцировать цитотоксические Т-клетки, содержит аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 7, 8, 12, 9, 10, 11, 192, 195, 197, 209, 225, 226, 228, 230, 240, 241, 243, 244, 253, 254 и 255. Фармацевтическая композиция для лечения заболевания, связанного с повышенной экспрессией генов SEQ ID NO: 1, 3 и/или 5 содержит один или несколько вышеуказанных пептидов и фармацевтически приемлемый носитель. Способ лечения заболевания, связанного с повышенной экспрессией генов SEQ ID NO: 1, 3 и/или 5, у индивида, включает введение указанному индивиду вакцины, содержащей один или несколько вышеуказанных пептидов. Предложенное изобретение позволяет получать пептиды, которые используются при лечении заболевания, связанного с повышенной экспрессией генов SEQ ID NO: 1, 3 и/или 5, например рака. 11 н. и 11 з.п. ф-лы, 26 ил., 7 табл., 2 пр.
Реферат
Область техники, к которой относится изобретение
По настоящей заявке испрашивается приоритет предварительной заявки США No. 60/852575, поданной 17 октября 2006, полное содержание которой приведено в настоящем описании в качестве ссылки.
Настоящее изобретение относится к области биологии, более конкретно, к области терапии рака. В частности, настоящее изобретение относится к новым пептидам, которые являются чрезвычайно эффективными вакцинами против рака, и к лекарственным средствам для лечения и профилактики опухолей, содержащих такие пептиды.
Уровень техники
Показано, что CD8+ цитотоксические T-лимфоциты (CTL) распознают пептиды-эпитопы, происходящие из ассоциированных с опухолью антигенов (TAA), представленных на молекулах MHC класса I, и лизируют опухолевые клетки. С момента обнаружения семейства MAGE в качестве первого примера TAA с использованием иммунологических способов было обнаружено много других TAA (Boon T. (1993) Int J Cancer 54: 177-80.; Boon T. et al., (1996) J Exp Med 183: 725-9.; van der Bruggen P et al., (1991) Science 254: 1643-7.; Brichard V et al., (1993) J Exp Med 178: 489-95.; Kawakami Y et al., (1994) J Exp Med 180: 347-52.). Некоторые из них в настоящее время проходят разработку в клинике в качестве мишеней для иммунотерапии. Обнаруженные к настоящему времени TAA включают в себя MAGE (van der Bruggen P et al., (1991) Science 254: 1643-7.), gp100 (Kawakami Y et al., (1994) J Exp Med 180: 347-52.), SART (Shichijo S et al., (1998) J Exp Med 187:277-88.) и NY-ESO-1 (Chen Y.T. et al., (1997) Proc. Natl. Acd. Sci. USA, 94: 1914-8.). С другой стороны, было показано, что продукты определенных генов с повышенной до некоторой степени специфической экспрессией в опухолевых клетках, распознаются в качестве мишени для индукции клеточных иммунных ответов. Продукты таких генов включают в себя p53 (Umano Y et al., (2001) Br J Cancer, 84:1052-7.), HER2/neu (Tanaka H et al., (2001) Br J Cancer, 84: 94-9.), CEA (Nukaya I et al., (1999) Int. J. Cancer 80, 92-7.) и т.п.
Несмотря на значительный прогресс в фундаментальных и клинических исследованиях в отношении TAA (Rosenberg SA et al., (1998) Nature Med, 4: 321-7.; Mukherji B. et al., (1995) Proc Natl Acad Sci USA, 92: 8078-82.: Hu X et al., (1996) Cancer Res, 56: 2479-83.), в настоящее время доступно только очень ограниченное число TAA-кандидатов, подходящих для лечения рака. TAA с избыточной экспрессией в раковых клетках, и экспрессия которых ограничена раковыми клетками, были бы многообещающими кандидатами в качестве мишеней для иммунотерапии.
Как HLA-A24, так и HLA-A0201 представляют собой общераспространенные аллели HLA в японской популяции и в популяциях европеоидов (Date Y et al., (1996) Tissue Antigens 47: 93-101.; Kondo A et al., (1995) J Immunol 155: 4307-12.; Kubo RT et al., (1994) J Immunol 152: 3913-24.; Imanishi et al., Proceeding of the eleventh International Histocompatibility Workshop and Conference Oxford University Press, Oxford, 1065 (1992); Williams F et al., (1997) Tissue Antigen 49: 129-33.). Таким образом, антигенные пептиды рака, представляемые этими аллелями HLA, могут обладать определенной эффективностью для лечения рака у японских и европеоидных пациентов. Кроме того, известно, что индукция низкоаффинных CTL in vitro обычно происходит в результате воздействия высоких концентраций пептида, образующих высокий уровень комплексов специфический пептид/MHC на антиген-презентирующих клетках (APC), которые могут эффективно активировать эти CTL (Alexander-Miller et al., (1996) Proc Natl Acad Sci USA 93: 4102-7).
Недавние разработки в способах микрочипов кДНК позволили сконструировать подробные характеристики экспрессии генов в злокачественных клетках по сравнению с нормальными клетками (Okabe, H. et al., (2001) Cancer Res., 61, 2129-37.; Lin YM. et al., (2002) Oncogene, 21;4120-8.; Hasegawa S. et al., (2002) Cancer Res 62:7012-7.). Этот способ позволяет лучше понять сложную природу раковых клеток и механизмы канцерогенеза, и облегчает идентификацию генов, регуляция экспрессии которых прекращена в опухолях (Bienz M. et al., (2000) Cell 103, 311-20.). Среди транскриптов, идентифицированных как обладающие повышенной регуляцией при раке, недавно был обнаружен MPHOSPH1 (фосфoбелок 1 M-фазы; инвентарный No. в GenBank NM_016195; SEQ ID NО:1, 2), и DEPDC1 (содержащий домен DEP 1; инвентарный No. в GenBank BM683578). См. WO 2004/031413, WO 2006/085684 и WO 2007/013,665, полное содержание которых приведено в настоящем описании в качестве ссылки. DEPDC1 описан в контексте двух различных транскрипционных вариантов - DEPDC1 V1 (SEQ ID NО: 3, 4) и DEPDC1 V2 (SEQ ID NО:5, 6). Показано, что эти гены обладают специфической повышенной регуляцией в опухолевых клетках различных раковых тканей в анализированных случаях (см. ниже); однако, анализы Нозерн-блоттингом показали, что продукты этих генов не обнаружены в нормальных жизненно важных органах (см. PCT/JP2006/302684). Поскольку иммуногенные пептиды, полученные из MPHOSPH1 и DEPDC1, могут находить применение для уничтожения опухолевых клеток, экспрессирующих эти антигены, эти гены представляют особенный интерес для авторов настоящего изобретения.
Поскольку цитотоксические лекарственные средства, такие как M-VAC, часто вызывают тяжелые побочные реакции, понятно, что тщательный отбор новых молекул-мишеней на основании хорошо охарактеризованных механизмов действия является важным для создания эффективных противораковых лекарственных средств с минимальным риском нежелательных побочных эффектов. Для этой цели авторы изобретения предварительно провели анализ профиля экспрессии различных видов рака и нормальной ткани человека, и обнаружили множество генов с повышенной экспрессией при раке (Lin YM, et al., Oncogene. 2002 Jun 13;21:4120-8.; Kitahara O, et al., Cancer Res. 2001 May 1;61:3544-9.; Suzuki C, et al., Cancer Res. 2003 Nov 1;63:7038-41.; Ashida S, Cancer Res. 2004 Sep 1;64:5963-72.; Ochi K, et al., Int J Oncol. 2004 Mar;24(3):647-55.; Kaneta Y, et al., Int J Oncol. 2003 Sep;23:681-91.; Obama K, Hepatology. 2005 Jun;41:1339-48.; Kato T, et al., Cancer Res. 2005 Jul 1;65:5638-46.; Kitahara O, et al., Neoplasia. 2002 Jul-Aug;4:295-303.; Saito-Hisaminato A et al., DNA Res 2002, 9: 35-45.). Из них, MPHOSPH1 (No. для внутреннего пользования C2093) и DEPDC1 (No. для внутреннего пользования B5860N) представляли собой идентифицированные гены с повышенной экспрессией при различных видах рака. В частности, MPHOSPH1 идентифицировали как ген, обладающий повышенной экспрессией при раке мочевого пузыря, раке молочной железы, раке шейки матки, холангиоцеллюлярной карциноме, CML, раке ободочной и прямой кишки, раке желудка, NSCLC, лимфоме, остеосаркоме, раке предстательной железы, карциноме почки, опухоли мягких тканей. Аналогично, DEPDC1 идентифицировали как ген, обладающий повышенной экспрессией при раке мочевого пузыря, раке молочной железы, раке шейки матки, холангиоцеллюлярной карциноме, CML, NSCLC, лимфоме, остеосаркоме, раке предстательной железы, SCLC, опухоли мягких тканей.
MPHOSPH1 ранее был идентифицирован как один из белков, специфически фосфорилированных при переходе G2/M, и охарактеризован как белок, родственный направленному к плюс-концу кинезину (Abaza A et al., J Biol Chem 2003, 278: 27844-52.). Более конкретно, ранее сообщалось, что MPHOSPH1 представляет собой направленный к плюс-концу молекулярный мотор, который играет критическую роль в цитокинезе и накапливается в средней зоне веретена во время анафазы - телофазы в клетках HeLa (Abaza A et al., J Biol Chem 2003, 278: 27844-52; Kamimoto T et al., J Biol Chem 2001, 276: 37520-8). кДНК MPHOSPH1 кодирует белок из 1780 аминокислот, который состоит из трех доменов: NH2-моторный домен кинезина, центральный домен спираль-стебель, и глобулярный хвостовой C-домен. Вместе эти данные позволяют сделать предположение о том, что MPHOSPH1 представляет собой белок, сходный с кинезином NH2-типа.
Что касается DEPDC1, то его функция остается неясной. Домен DEP, содержащийся в этом белке, обнаружен также в Dishevelleed, Egl-10, и плекстрине. Домен DEP в disheveled Drosophila играет определяющую роль в устранении дефектов планарной полярности и индуцирует передачу сигналов JNK; тем не менее, его функция у человека до конца не выяснена. Однако, как описано в PCT/JP2006/302684, миРНК для DEPDC1 могут супрессировать рост раковых клеток. Эти результаты показывают, что DEPDC1 играет важную роль в росте большинства раковых клеток.
Краткое изложение сущности изобретения
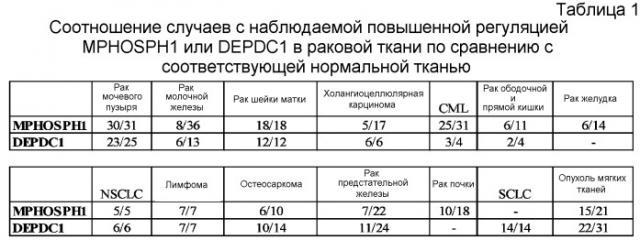
Как указано выше, MPHOSPH1 (фосфобелок 1 M-фазы), и DEPDC1 (содержащий домен DEP 1) идентифицировали как гены, обладающие повышенной регуляцией при различных видах рака. Более конкретно, гены идентифицировали путем определения профиля экспрессии генов с помощью микрочипа кДНК для всего генома. Как указано выше, было показано, что экспрессия MPHOSPH1 и DEPDC1 обладает специфической повышенной регуляцией в различных опухолевых клетках, включая рак легкого и рак мочевого пузыря. Как описано в таблице 1, показано, что экспрессия MPHOSPH1 воспроизводимо повышена в 30 из 31 случая рака мочевого пузыря, 8 из 36 случаев рака молочной железы, 18 из 18 случаев рака шейки матки, 5 из 17 холангиоцеллюлярных карцином, 25 из 31 случая CML, 6 из 11 случаев рака ободочной и прямой кишки, 6 из 14 случаев рака желудка, 5 из 5 случаев NSCLC, 7 из 7 лимфом, 6 из 10 остеосарком, 7 из 22 случаев рака предстательной железы, 10 из 18 карцином почки и 15 из 21 опухоли мягких тканей. В то же самое время, показано, что экспрессия DEPDC1 воспроизводимо увеличена в 23 из 25 случаев рака мочевого пузыря, 6 из 13 случаев рака молочной железы, 12 из 12 случаев рака шейки матки, 6 из 6 холангиоцеллюлярных карцином, 3 из 4 CML, 2 из 4 случаев рака ободочной и прямой кишки, 6 из 6 случаев NSCLC, 7 из 7 лимфом, 10 из 14 остеосарком, 11 из 24 рака предстательной железы, 14 из 14 случаев SCLC и 22 из 31 опухоли мягких тканей, как описано в таблице 1.
Настоящее изобретение основано, по крайней мере отчасти, на идентификации специфических эпитопов пептидов, продуктов указанных генов (MPHOSPH1 и DEPDC1), которые способны индуцировать цитотоксические T-лимфоциты (CTL), специфические в отношении соответствующих молекул. Как подробно описано ниже, мононуклеарные клетки периферической крови (PBMC) здорового донора стимулировали с помощью пептидов-кандидатов, связывающих HLA-A*2402 и HLA-A*0201, полученных из MPHOSPH1 или DEPDC1. Затем получали клоны и/или линии CTL со специфической цитотоксичностью против положительных по HLA-A24 или HLA-A2 клеток-мишеней, обработанных каждым из пептидов-кандидатов. Эти результаты показывают, что пептиды являются пептидами, ограниченными HLA-A24 или HLA-A2 эпитопами, которые могут индуцировать сильные и специфические иммунные ответы против клеток, экспрессирующих MPHOSPH1 или DEPDC1.
Соответственно, настоящее изобретение относится к способам лечения или профилактики заболевания, связанного с повышенной экспрессией MPHOSPH1 и/или DEPDC1, например рака. Такие способы включают в себя стадию введения индивиду полипептида MPHOSPH1 и/или DEPDC1 по изобретению. Введение такого пептида(пептидов) приводит к возникновению иммунитета против опухолей. Таким образом, настоящее изобретение относится к способам, вызывающим иммунитет против опухолей у индивида, где такие способы включают в себя стадию введения индивиду полипептида MPHOSPH1 и/или DEPDC1, а также к фармацевтическим композициям для лечения или профилактики заболевания, связанного с повышенной экспрессией MPHOSPH1 и/или DEPDC1, например рака, которые содержат полипептиды MPHOSPH1 и/или DEPDC1. Раком в качестве неограничивающих примеров может быть рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярная карцинома, CML, рак ободочной и прямой кишки, рак желудка, NSCLC, лимфома, остеосаркома, рак предстательной железы, карцинома почек, SCLC и опухоль мягких тканей.
Таким обазом, настоящая заявка включает в себя следующие варианты осуществления и любые их сочетания.
[1] Выделенный пептид, способный индуцировать цитотоксические T-клетки, где указанный пептид получен из аминокислотной последовательности SEQ ID NO:2, 4 или 6.
[2] Выделенный пептид, состоящий по меньшей мере приблизительно из 15 аминокислот, выбранный из группы, состоящей из пептидов, содержащих аминокислотные последовательности SEQ ID NO:7, 8 и 12, или пептид, способный индуцировать цитотоксические T-клетки, где указанный пептид содержит аминокислотную последовательность, выбранную из группы, состоящей SEQ ID NO:7, 8 и 12, где 1, 2 или несколько аминокислот заменены, делетированы или добавлены.
[3] Пептид, способный индуцировать цитотоксические T-клетки, как указано в п.[2], где вторая аминокислота от N-конца представляет собой фенилаланин, тирозин, метионин или триптофан.
[4] Пептид, способный индуцировать цитотоксические T-клетки, как указано в п.[2], где C-концевая аминокислота представляет собой фенилаланин, лейцин, изолейцин, триптофан, или метионин.
[5] Выделенный пептид, состоящий по меньшей мере приблизительно из 15 аминокислот, выбранный из группы, состоящей из пептидов, содержащих аминокислотные последовательности SEQ ID NO: 9, 10, 11, 192, 195, 197, 209, 225, 226, 228, 230, 240, 241, 243, 244, 253, 254 и 255, или пептид, способный индуцировать цитотоксические T-клетки, где указанный пептид содержит аминокислотную последовательность, выбранную из группы, состоящей SEQ ID NO: 9, 10, 11, 192, 195, 197, 209, 225, 226, 228, 230, 240, 241, 243, 244, 253, 254 и 255, где 1, 2 или несколько аминокислот заменены, делетированы или добавлены.
[6] Пептид, способный индуцировать цитотоксические T-клетки, как указано в п.[5], где вторая аминокислота от N-конца представляет собой лейцин или метионин.
[7] Пептид, способный индуцировать цитотоксические T-клетки, как указано в п.[5], где C-концевая аминокислота представляет собой валин или лейцин.
[8] Вектор, в котором ДНК кодирует пептиды по любому из п.п.[1]-[7].
[9] Фармацевтическая композиция для лечения или профилактики заболевания, связанного с повышенной экспрессией генов SEQ ID NO: 1, 3 и/или 5, где указанная композиция содержит один или несколько пептидов по любому из п.п.[1]-[7].
[10] Фармацевтическая композиция как указано в п.[9], где заболеванием является рак.
[11] Фармацевтическая композиция как указано в п.[10], где рак выбран из группы, состоящей из рака мочевого пузыря, рака молочной железы, рака шейки матки, холангиоцеллюлярной карциномы, CML, рака ободочной и прямой кишки, рака желудка, NSCLC, лимфомы, остеосаркомы, рака предстательной железы, карциномы почек, SCLC и опухоли мягких тканей.
[12] Экзосома, презентирующая на своей поверхности комплекс, содержащий пептид по любому из п.п.[1]-[7] и антиген HLA.
[13] Экзосома как указано в п.[12], где антиген HLA представляет собой HLA-A24.
[14] Экзосома как указано в п.[13], где антиген HLA представляет собой HLA-A2402.
[15] Экзосома как указано в п.[12], где антиген HLA представляет собой HLA-A2.
[16] Экзосома как указано в п.[13], где антиген HLA представляет собой HLA-A0201.
[17] Способ индукции антиген-презентирующих клеток, способный к высокоэффективной индукции цитотоксических T-клеток, включающий стадию приведения в контакт антиген-презентирующих клеток с пептидом по любому из п.п.[1]-[7].
[18] Способ индукции цитотоксических T-клеток путем приведения в контакт T-клетки с пептидом по любому из п.п.[1]-[7].
[19] Способ индукции антиген-презентирующих клеток, способный к высокоэффективной индукции цитотоксических T-клеток, где указанный способ включает в себя стадию переноса гена, содержащего полинуклеотид, кодирующий пептид по любому из п.п.[1]-[7], в антиген-презентирующую клетку.
[20] Выделенная цитотоксическая T-клетка, которую индуцируют путем приведения в контакт T-клетки с пептидом по любому из п.п.[1]-[7], или которую трансдуцируют нуклеиновыми кислотами, кодирующими полипептиды субъединиц TCR, связывающие пептид по любому из п.п.[1]-[7] в контексте HLA-A24 или HLA-A2.
[21] Антиген-презентирующая клетка, содержащая комплекс, сформированный между антигеном HLA и пептидом по любому из [1] - [7].
[22] Антиген-презентирующая клетка как указано в п.[21], индуцированная способом как указано в п.[17].
[23] Вакцина, ингибирующая пролиферацию клеток, экспрессирующих гены из SEQ ID NO: 1, 3 и/или 5, где вакцина в качестве активного ингредиента содержит пептид по любому из п.п.[1]-[7].
[24] Вакцина как указано в п.[23], где клетка представляет собой раковую клетку.
[25] Вакцина как указано в п.[24], где рак выбран из группы, состоящей из рака мочевого пузыря, рака молочной железы, рака шейки матки, холангиоцеллюлярной карциномы, CML, рака ободочной и прямой кишки, рака желудка, NSCLC, лимфомы, остеосаркомы, рака предстательной железы, карциномы почек, SCLC и опухоли мягких тканей.
[26] Вакцина как указано в п.[23], предназначенная для введения индивиду, антиген HLA которого представляет собой HLA-A24 или HLA-A2.
[27] Способ лечения или профилактики заболевания, связанного с повышенной экспрессией генов SEQ ID NO: 1, 3 и/или 5, у индивида, включающий введение указанному индивиду вакцины, содержащей один или несколько пептидов по любому из п.п.[1]-[7], его иммунологически активный фрагмент или полинуклеотид, кодирующий указанный пептид или иммунологически активный фрагмент.
[28] Способ как указано в п.[27], где заболеванием является рак.
[29] Способ как указано в п.[28], где рак выбран из группы, состоящей из рака мочевого пузыря, рака молочной железы, рака шейки матки, холангиоцеллюлярной карциномы, CML, рака ободочной и прямой кишки, рака желудка, NSCLC, лимфомы, остеосаркомы, рака предстательной железы, карциномы почек, SCLC и опухоли мягких тканей.
Альтернативно, настоящее изобретение также относится к способу индукции цитотоксических T-клеток, включающему стадию приведения в контакт T-клетки с антиген-презентирующей клеткой, полученной способом как указано в п.[19].
Эти и другие объекты и признаки изобретения будут более очевиды при ознакомлении с нижеприведенным подробным описанием, а также сопутствующими фигурами и примерами. Однако, следует учесть, что как предшествующее краткое описание сущности изобретения, так и последующее подробное описание, представляют собой предпочтительные варианты осуществления, и не являются ограничивающими изобретение или другие альтернативные варианты осуществления изобретения.
Краткое описание рисунков
[Фиг.1] На фиг.1A показаны результаты анализа ELISPOT IFN-гамма для скрининга пептидов-эпитопов, которые, в свою очередь, показывают, что MPHOSPH1-A24-9-278 (SEQ ID NO:7) вызывает сильную продукцию IFN-гамма. CTL для этих пептидов, полученных из MPHOSHP1, получены согласно способам, описанным в разделе «Материалы и методы» из примеров ниже. Показаны полученные CTL, обладающие поддающейся детекции специфической активностью CTL. В частности, для клеток в лунке номер #4, стимулированных MPHOSPH1-A24-9-278, показали сильную продукцию IFN-гамма для узнавания обученных пептидом клеток-мишеней по сравнению с контролем. На фиг.1B показаны результаты анализа ELISPOT IFN-гамма для скрининга клонов CTL после лимитирующего разведения (клон CTL MPHOSPH1-A24-9-278). Клетки в положительной лунке размножали и проводили лимитирующее разведение. Как показывают описанные результаты, получены клоны CTL, обладающие специфическими активностями CTL против обученной пептидом мишени по сравнению с активностями против мишени без обучения пептидом.
[Фиг.2] На фиг.2A показаны результаты анализа ELISPOT IFN-гамма для скрининга цитотоксичности пептидов-эпитопов, которые, в свою очередь, показывают, что MPHOSPH1-A24-10-278 (SEQ ID NO:8) вызывает сильную продукцию IFN-гамма. CTL для этих пептидов, полученных из MPHOSHP1, получены согласно способам, описанным в разделе «Материалы и методы» из примеров ниже. Показаны полученные CTL, обладающие поддающейся детекции специфической активностью CTL. В частности, для клеток в лунке номер #8, стимулированных MPHOSPH1-A24-10-278, показали сильную продукцию IFN-гамма по сравнению с контролем. На фиг.2B показаны результаты анализа ELISPOT IFN-гамма для скрининга клонов CTL после лимитирующего разведения (клон CTL MPHOSPH1-A24-10-278). Клетки в положительной лунке размножали и проводили лимитирующее разведение. Как показывают описанные результаты, получены клоны CTL, обладающие специфическими активностями CTL против обученной MPHOSPH1-A24-10-278 мишени по сравнению с активностями против мишени без обучения пептидом.
[Фиг.3] На фиг.3A показано получение клонов CTL, стимулированных MPHOSPH1-A24-9-278. (SEQ ID NO:7). Для этого клона CTL показали высокую специфическую активность CTL против клеток-мишеней (A24LCL), обученных MPHOSPH1-A24-9-278, но не показали значительной активности CTL против таких же клеток-мишеней (A24LCL) без обучения пептидами. На фиг.3B показано получение клонов CTL, стимулированных MPHOSPH1-A24-10-278 (SEQ ID NO:8). Для этого клона CTL показали высокую специфическую активность CTL против клеток-мишеней (A24LCL), обученных MPHOSPH1-A24-10-278, в то время как не показали значительной активности CTL против таких же клеток-мишеней (A24LCL) без обучения пептидами. R обозначает Отвечающий: клон CTL. S обозначает Стимулятор: обученные пептидом A24-LCL (1×104/лунку).
[Фиг.4] На фиг.4 показана экспрессия MPHOSPH1-A24-9-278 (SEQ ID NO:7) на поверхности клетки-мишени с HLA-A24. Специфическую активность CTL против COS7, трансфицированных геном и полноразмерного MPHOSPH1, и молекулы HLA-A*2402, анализировали с использованием в качестве эффекторных клеток клона CTL, стимулированного посредством MPHOSPH1-A24-9-278. COS7, трансфицированные полноразмерным MPHOSPH1, но не HLA-A*2402, и COS7, трансфицированные HLA-A*2402, но не полноразмерным MPHOSPH1, получали в качестве контролей. Для клона CTL показали высокую специфическую активность CTL против COS7, трансфицированных и MPHOSPH1, и HLA-A24. Однако, не показали значительной специфической активности CTL против COS7, не трансфицированных ни MPHOSPH1, ни HLA-A24. R обозначает Отвечающий: клон CTL. S обозначает Стимулятор: трансфектант COS7 (1×104/ лунку).
[Фиг.5] На фиг.5 показана активность CTL против линий клеток рака мочевого пузыря с эндогенной экспрессией MPHOSPH1. Полученный клон CTL, индуцированный пептидом MPHOSPH1-A24-9-278, узнает опухолевые клетки с эндогенной экспрессией MPHOSPH1. Клетки HT1376, RT-4 и J82 экспрессируют эндогенный MPHOSPH1, соответственно. Для клона CTL показали продукцию IFN-гамма против HT1376, обладающих генотипом HLA-A*2402, но не показали ответа против RT-4 и J82, не обладающих генотипом HLA-A*2402.
[Фиг.6] На фиг.6 показан анализ иммуногенности in vivo с использованием пептида MPHOSPH1-A24-9-278. IFA-конъюгированный пептид инъецировали подкожно мышам BALB/c на сутки 0 и 7. На сутки 14 спленоциты вакцинированных мышей собирали и использовали в качестве отвечающих клеток, и 1×104 клеток RLmale1, обученных пептидом MPHOSPH1-A24-9-278, использовали в качестве стимулирующих клеток для анализа ELISPOT IFN-гамма. Счет образующихся пятен (SFC) указан в случае каждой мыши; пять мышей (Ani1~Ani5) вакцинировали пептидом-эпитопом и трех мышей (nega1~nega3) инъецировали эмульсией Mock IFA в качестве отрицательного контроля.
[Фиг.7] На фиг.7 показаны результаты анализа ELISPOT IFN-гамма для скрининга пептидов-эпитопов, которые, в свою очередь, показывают, что MPHOSPH1-A2-9-282 (SEQ ID NO:9), MPHOSPH1-A2-9-638 (SEQ ID NO:10) и MPHOSPH1-A2-10-1714 (SEQ ID NO:11) обладают сильной активностью для продукции IFN-гамма. CTL для этих пептидов, полученных из MPHOSHP1, получены согласно способам, описанным в разделе «Материалы и методы» из примеров, описанных ниже. Показаны полученные CTL, обладающие поддающейся детекции специфической активностью CTL. В частности, на Фиг.7A показано, что для клеток в лунках #1 и #5, стимулированных MPHOSPH1-A2-9-282, показали сильную продукцию IFN-гамма, достаточную для узнавания обученных пептидами клеток-мишеней, по сравнению с контролем. На фиг.7B показано, что для клеток в лунке номер #8, стимулированных MPHOSPH1-A2-9-638, показали сильную продукцию IFN-гамма, достаточную для узнавания обученных пептидом клеток-мишеней, по сравнению с контролем. На фиг.7C показано, что для клеток в лунке номер #4, стимулированных MPHOSPH1-A2-10-1714, показали сильную продукцию IFN-гамма для узнавания обученных пептидом клеток-мишеней, по сравнению с контролем.
[Фиг.8] На фиг.8 показано получение линий CTL, стимулированных MPHOSPH1-A02-9-282, (SEQ ID NO:9) MPHOSPH1-A02-9-638 (SEQ ID NO:10) и MPHOSPH1-A02-10-1714 (SEQ ID NO:11). Клетки в положительных лунках размножали и, как показывают описанные результаты, получили линии CTL, обладающие более высокими специфическими активностями CTL против обученной MPHOSPH1-A02-9-282 мишени (A), обученной MPHOSPH1-A02-9-638 мишени (B) или обученной MPHOSPH1-A02-10-1714 мишени (C) по сравнению с активностями против мишени без обучения пептидом. R обозначает Отвечающий: линии CTL. S обозначает Стимулятор: обученные пептидом T2 (1×104/лунку).
[Фиг.9] На фиг.9A показаны результаты анализа ELISPOT IFN-гамма для скрининга клонов CTL после лимитирующего разведения (клон MPHOSPH1-A2-9-282 CTL). Клетки в положительной лунке размножали и проводили лимитирующее разведение. Как показывают описанные результаты, получены клоны CTL, обладающие более высокими специфическими активностями CTL против обученной MPHOSPH1-A2-9-282 (SEQ ID NO:9) мишени по сравнению с активностями против мишени без обучения пептидом. На фиг.9B показано получение клонов CTL, стимулированных MPHOSPH1-A02-9-282. Клон CTL обладает высокой специфической активностью CTL против клеток-мишеней (T2), обученных MPHOSPH1-A2-9-282, но не обладает значительной активностью CTL против таких же клеток-мишеней (T2) без обучение пептидами. R обозначает Отвечающий: клон CTL. S обозначает Стимулятор: обученные пептидом T2 (1×104/лунку).
[Фиг.10] На фиг.10A показаны результаты анализа ELISPOT IFN-гамма для скрининга пептидов-эпитопов, которые, в свою очередь, показывают, что DEPDC1-A24-9-294 (SEQ ID NO:12) вызывает сильную продукцию IFN-гамма. CTL для этих пептидов, полученных из DEPDC1, получены согласно способам, описанным в разделе «Материалы и методы» из примеров ниже. Показаны полученные CTL, обладающие поддающейся детекции специфической активностью CTL. Для клеток в лунке номер #10, стимулированных DEPDC1-A24-9-294, показали сильную продукцию IFN-гамма для узнавания обученных пептидом клеток-мишеней по сравнению с контролем. На фиг.10B показаны результаты анализа ELISPOT IFN-гамма для скрининга клонов CTL после лимитирующего разведения (клон DEPDC1-A24-9-294 CTL). Клетки в положительной лунке размножали и проводили лимитирующее разведение. Как показывают описанные результаты, получены клоны CTL, обладающие более высокими специфическими активностями CTL против обученной DEPDC1-A24-9-294 мишени по сравнению с активностями против мишени без обучения пептидом.
[Фиг.11] На фиг.11 показано получение клонов CTL, стимулированных DEPDC1-A24-9-294 (SEQ ID NO:12). Для клона CTL показали высокую специфическую активность CTL против клеток-мишеней (A24LCL), обученных DEPDC1-A24-9-294, в то время как не показали значительной активности CTL против таких же клеток-мишеней (A24LCL) без обучения пептидами. R обозначает Отвечающий: клон CTL DEPDC-A24-9-294. S обозначает Стимулятор: обученные пептидом A24-LCL (1×104/лунку).
[Фиг.12] На фиг.12 показана экспрессия DEPDC1-A24-9-294 (SEQ ID NO:12) на поверхности клетки-мишени с HLA-A24. Специфическую активность CTL против COS7, трансфицированных геном и полноразмерного DEPDC1, и молекулы HLA-A*2402, анализировали с использованием в качестве эффекторных клеток клона CTL, стимулированного DEPDC1-A24-9-294. COS7, трансфицированные полноразмерным DEPDC1, но не HLA-A*2402, и COS7, трансфицированные HLA-A*2402, но не полноразмерным DEPDC1, получали в качестве контролей. Для полученного клона CTL показали высокую специфическую активность CTL против COS7, трансфицированных и DEPDC1, и HLA-A24. Однако не показали значительной специфической активности CTL против COS7, не трансфицированных ни DEPDC1, ни HLA-A24. R обозначает Отвечающий: клон CTL DEP-A24-9-294. S обозначает Стимулятор: трансфектант COS7 (1×104/лунку).
[Фиг.13] На фиг.13 показана активность CTL против линий клеток рака мочевого пузыря с эндогенной экспрессией DEPDC1. Полученный клон CTL, индуцированный пептидом DEPDC1-A24-9-294, узнает опухолевые клетки с эндогенной экспрессией DEPDC1. Клетки HT1376, RT-4 и J82 экспрессируют эндогенный DEPDC1, соответственно. Для клона CTL показали продукцию IFN-гамма против HT1376, обладающих генотипом HLA-A*2402, но не показали ответа против RT-4 и J82, не обладающих генотипом HLA-A*2402.
[Фиг.14] На фиг.14 показан анализ иммуногенности in vivo с использованием пептида DEPDC1-A24-9-294. IFA-конъюгированный пептид инъецировали подкожно мышам BALB/c на сутки 0 и 7. На сутки 14 спленоциты вакцинированных мышей собирали и использовали в качестве отвечающих клеток, и 1×104 клеток RLmale1, обученных пептидом DEPDC1-A24-9-294, использовали в качестве стимулирующих клеток для анализа ELISPOT IFN-гамма. Счет образующихся пятен (SFC) указан в случае каждой мыши; пять мышей (Ani1~Ani5) вакцинировали пептидом-эпитопом, и двух мышей (nega1 и nega2) инъецировали эмульсией Mock IFA в качестве отрицательного контроля.
[Фиг.15] На фиг.15 показана сильная продукция IFN-гамма DEPDC1-A02-10-644, -10-575, -10-506, -10-765, -10-395, -10-224, -9-297, -10-296 и -10-302 по анализу ELISPOT IFN-гамма для скрининга пептидов-эпитопов. CTL для этих пептидов, полученных из DEPDC1, получены способом, описанным в «Материалах и методах». Для клеток в лунках номер #4 и #7, стимулированных с помощью DEPDC1-A02-10-644, #2 - с помощью DEPDC1-A02-10-575, #7 - с помощью DEPDC1-A02-10-506, #1 - с помощью DEPDC1-A02-10-765 и #1 - с помощью DEPDC1-A02-10-395, #1 и #2 с помощью DEPDC1-A02-10-224, #4 - с помощью DEPDC1-A02-9-297, #3 и #4 - с помощью DEPDC1-A02-10-296 и #2, #3, #5 и #7 - с помощью DEPDC1-A02-10-302, показали сильную продукцию IFN-гамма по сравнению с контролем.
[Фиг.16] На фиг.16 показана продукция IFN-гамма линией CTL, полученной с помощью пептида DEPDC1-A02-10-296. Полученные линии CTL, стимулированные пептидом DEPDC1-A02-10-296, обладают сильной активностью продукции IFN-гамма. Показана продукция IFN-гамма против обученных пептидом клеток-мишеней, но не показана продукция против клеток-мишеней без обучения пептидом. Используемые клетки-мишени представляли собой клетки T2, экспрессирующие молекулу HLA-A2 на поверхности клеток.
[Фиг.17] На фиг.17 показана активность CTL против мишеней с эндогенной экспрессией молекул DEPDC1 и HLA-A2. На верхней панели показано, что полученная линия CTL, полученная с помощью пептида DEPDC1-A02-10-296, обладает активностью продукции IFN-гамма против клеток-мишеней с эндогенной экспрессией DEPDC1V2 и HLA-A2. Случай с использованием пептида DEPDC1-A02-10-296 показан на нижней панели. Клетки-мишени, экспрессирующие только DEPDC1V2, и экспрессирующие только HLA-A2, с обработкой обучением пептидом DEPDC1V1-9-674 или DEP-9-462, получали в качестве отрицательного контроля. Клетки-мишени получали из трансфектанта HEK293, со стабильной экспрессией HLA-A2 или пустого.
[Фиг.18] На фиг.18 показана экспрессия антигена в случае 2. В случае 2 и MPHOSPH1, и DEPDC1, экспрессировались сильно. Таким образом, проводили вакцинацию двумя видами пептидов-эпитопов, полученных из MPHOSPH1 и DEPDC1.
[Фиг.19] На фиг.19 показана клиническая оценка местного рецидива рака мочевого пузыря в случае 2. Случай 2 оценивали как SD согласно критериям RECIST.
[Фиг.20] На фиг.20 показана экспрессия антигена в случае 3. В случае 3 DEPDC1 экспрессировался сильно. Таким образом, авторы настоящего изобретения проводили вакцинацию только пептидом-эпитопом, полученным из DEPDC1.
[Фиг.21] На фиг.21 показана клиническая оценка правой доли легкого с метастазированием в случае 3. Скорость прогрессирования снижалась после вакцинации. В частности, размер опухоли уменьшался после 3-го курса.
[Фиг.22] На фиг.22 показана клиническая оценка левой доли легкого с метастазированием в случае 3. Скорость прогрессирования снижалась после вакцинации. В частности, размер опухоли уменьшался после 3-го курса.
[Фиг.23] На фиг.23 показан противоопухолевый эффект в случае 3. Скорость прогрессирования метастазирующей опухоли снижалась после вакцинации.
[Фиг.24] На фиг.24 показан специфический ответ CTL в случае 3. Показан сильный специфический ответ CTL после вакцинации.
[Фиг.25] На фиг.25 показана экспрессия антигена в случае 4. В случае 4 экспрессировались MPHOSPH1 и DEPDC1. Таким образом, проводили вакцинацию двумя видами пептидов-эпитопов, полученных из MPHOSPH1 и DEPDC1.
[Фиг.26] На фиг.26 показана клиническая оценка местного рецидива рака мочевого пузыря в случае 4. Размер опухоли уменьшился на 20% согласно критериям RECIST после 1-го курса вакцинации.
Подробное описание изобретения
Форму единственного числа используют в данном случае для обозначения «по меньшей мере один», если конкретно не указано иного.
Если не определено иначе, все технические и научные термины, используемые в описании, имеют то же значение, что и общепринятое и понятное специалисту в данной области, к которой относится настоящее изобретение.
Идентификация новых TAA, в частности, TAA, которые индуцируют сильные и специфические противоопухолевые иммунные ответы, гарантирует дальнейшую разработку клинического применения способа вакцинации пептидами при различных видах рака (Boon T et al., (1996) J Exp Med 183: 725-9.; van der Bruggen P et al., (1991) Science 254: 1643-7.; Brichard V et al., (1993) J Exp Med 178: 489-95.; Kawakami Y et al., (1994) J Exp Med 180: 347-52.; Shichijo S et al., (1998) J Exp Med 187:277-88.; Chen YT et al., (1997) Proc.Natl.Acd. Sci.USA, 94: 1914-8.; Harris CC, (1996) J Natl Cancer Inst 88:1442-55.; Butterfield LH et al., (1999) Cancer Res 59:3134-42.; Vissers JL et al., (1999) Cancer Res 59: 5554-9.; van der Burg SH et al., (1996) J. Immunol 156:3308-14.; Tanaka F et al., (1997) Cancer Res 57:4465-8.; Fujie T et al., (1999) Int J Cancer 80:169-72.; Kikuchi M et al., (1999) Int J Cancer 81: 459-66.; Oiso M et al., (1999) Int J Cancer 81:387-94.). Как указано выше, MPHOSPH1 (фосфобелок 1 M-фазы; инвентарный No. в GenBank NM_016195; SEQ ID NО:1, 2) и DEPDC1 (содержащий домен DEP 1; инвентарный No. в GenBank BM683578), более конкретно, его два варианта, DEPDC1V1 (SEQ ID NО:3, 4) и DEPDC1V2 (SEQ ID NО:5, 6), ранее были идентифицированы с использованием способов биочипов кДНК как обладающие повышенной экспрессией при различных видах рака. MPHOSPH1 был ранее идентифицирован как один из белков, специфически фосфорилированных при переходе G2/M, и охарактеризован как белок, сходный с направленным к плюс-концу кинезином (Abaza A et al., J Biol Chem 2003, 278: 27844-52.). Более конкретно, ранее было описано, что MPHOSPH1 представляет собой направленный к плюс-концу молекулярный мотор, который играет критическую роль в цитокинезе, и накапливается в средней зоне веретена во время анафазы - телофазы в клетках HeLa (Abaza A et al., J Biol Chem 2003, 278: 27844-52; Kamimoto T et al., J Biol Chem 2001, 276: 37520-8.). кДНК MPHOSPH1 кодирует белок из 1780 аминокислот, который состоит из трех доменов: NH2-моторный домен кинезина, центральный домен спираль-стебель, и глобулярный хвостовой C-домен. Эти данные позволяют сделать предположение, что MPHOSPH1 представляет собой белок, сходный с кинезином NH2-типа.
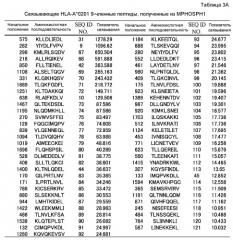
Функция белка DEPDC1 остается неизвестной. Домен DEP, содержащийся в этом белке, обнаружен также в Dishevelled, Egl-10 и плекстрине. В частности, домен DEP в dishevelled Drosophila необходим для устранения дефектов планарной полярности и индуцирует передачу сигналов JNK; тем не менее, его функция у человека до конца не ясна. Однако, как описано в PCT/JP2006/302684, DEPDC1 (No. для внутреннего пользования B5860N), обладает двумя различными транскрипционными вариантами, состоящими из 12 и 11 экзонов, соответствующими DEPDC1 V1 и V2, соответственно. Отмечены альтернативные варианты в экзоне 8 V1, и обнаружено, что остальные экзоны являются одинаковыми у обоих вариантов. Вариант V2 не имеет экзона 8 из V1, но образует такой же стоп-кодон внутри последнего экзона. Варианты последовательности полноразмерной кДНК B5860NV1 и B5860NV2 состоят из 5318 и 4466 нуклеотидов, соответственно. ORF этих вариантов начинается внутри каждого экзона 1. В конечном счете, транскрипты V1 и V2 кодируют 811 и 527 аминокислот, соответственно. миРНК супрессировали рост раковых клеток. Эти результаты показывают, что DEPDC1 играет важную роль в росте большинства раковых клеток.
Как описано в PCT/JP2006/302684, MPHOSPH1 и DEPDC1 обладают повышенной экспрессией при раке мочевого пузыря, но минимально экспрессируются в нормальных тканях. Кроме того, было обнаружено, что эти гены выполняют важную функцию, связанную с пролиферацией клеток.
В настоящем изобретении показано, что пептиды, полученные из MPHOSPH1 или DEPDC1, являются эпитопами TAA, рестриктированными по HLA-A24 и HLA-A2, аллелям HLA, общераспространенным в японской популяции и в популяциях европеоидов. В частности, с использованием их аффинности связывания с HLA-A24 и HLA-A2, были идентифицированы пептиды-кандидаты, связывающие HLA-A24 и HLA-A2, полученные из MPHOSPH1 или DEPDC1. После стимуляции T-клеток in vitro посредством дендритных клеток (DC), нагруженных этими пептидами, были успешно получены CTL с использованием MPHOSPH1-A24-9-278 (IYNEYIYDL (SEQ ID NO:7)), MPHOSPH1-A24-10-278 (IYNEyIYDLF (SEQ ID NO:8)), MPHOSPH1-A2-9-282 (YIYDLFVPV (SEQ ID NO:9)), MPHOSPH1-A2-9-638 (RLAIFKDLV (SEQ ID NO:10)), MPHOSPH1-A2-10-1714 (TMSSsKLSNV (SEQ ID NO:11)), DEPDC1-A24-9-294 (EYYELFVNI (SEQ ID NO:12)), DEPDC1-A02-10-644 (SLMIhTFSRC (SEQ ID NO:240)), DEPDC1-A02-10-575 (SLLPaSSMLT (SEQ ID NO:241)), DEPDC1-A02-10-506 (QLCRsQSLLL (SEQ ID NO:243)), DEPDC1-A02-10-765 (KQFQkEYPLI (SEQ ID NO:244)), DEPDC1-A02-10-395 (IMGGSCHNLI (SEQ ID NO:249), DEPDC1-A02-10-224 (NMANtSKRGV (SEQ ID NO:253)), DEPDC1- A02-9-297 (ELFVNILGL (SEQ ID NO:226)), DEPDC1-A02-10-296 (YELFvNILGL (SEQ ID NO:254)), DEPDC1-A02-10-301 (NILGlLQPHL (SEQ ID NO:255)), DEPDC1-A2-9-589 (LLQPHLERV (SEQ ID NO:192)), DEPDC1-A2-9-619 (LLMRMISRM (SEQ ID NO:195)), DEPDC1-A2-9-290 (LLTFEYYEL (SEQ ID NO:197)), DEPDC1-A2-9-563 (RLCKSTIEL (SEQ ID NO:209)), DEPDC1-A2-9-653 (CVLCCAEEV (SEQ ID NO:225)), DEPDC1-A2-10-674 (FLMDhHQEIL (SEQ ID NO:228)) и DEPDC1-A2-10-302 (ILVVcGYITV (SEQ ID NO:230)). Для этих CTL была показана сильная цитотоксическая активность против обученных пептидом клеток A24LCL и T2. Более того, для клонов CTL, полученных из этих клеток, также показали специфическую цитотоксичность против положительных по HLA-A24 или HLA-A2 клеток, экспрессирующих MPHOSPH1 или DEPDC1, соответственно. Однако эти клоны CTL не обладали цитотоксической активностью против клеток с экспрессией только одного из пептидов, включая HLA-A24, HLA-A2, MPHOSPH1 и DEPDC1. Вместе эти результаты позволяют предполагать эффективность MPHOSPH1 и DEPDC1 в качестве TAA для раковых клеток и то, что MPHOSPH1-A24-9-278 (IYNEYIYDL (SEQ ID NO:7)), MPHOSPH1-A24-10-278 (IYNEyIYDLF (SEQ ID NO:8)), MPHOSPH1-A2-9-282 (YIYDLFVPV (SEQ ID NO:9)), MPHOSPH1-A2-9-638 (RLAIFKDLV (SEQ ID NO:10)), MPHOSPH1-A2-10-1714 (TMSSsKLSNV (SEQ ID NO:11)), DEPDC1-A24-9-294 (EYYELFVNI (SEQ ID NO:12)), DEPDC1-A02-10-644 (SLMIhTFSRC (SEQ ID NO:240)), DEPDC1-A02-10-575 (SLLPaSSMLT (SEQ ID NO:241)), DEPDC1-A02-10-506 (QLCRsQSLLL (SEQ ID NO:243)), DEPDC1-A02-10-765 (KQFQkEYPLI (SEQ ID NO:244)), DEPDC1-A02-10-395 (IMGGSCHNLI (SEQ ID NO:249), DEPDC1-A02-10-224 (NMANtSKRGV (SEQ ID NO:253)), DEPDC1-A02-9-297 (ELFVNILGL (SEQ ID NO:226)), DEPDC1-A02-10-296 (YELFvNILGL (SEQ ID NO:254)), DEPDC1-A02-10-301 (NILGlLQPHL (SEQ ID NO:255)), DEPDC1-A2-9-589 (LLQPHLERV (SEQ ID NO:192)), DEPDC1-A2-9-619 (LLMRMISRM (SEQ ID NO:195)), DEPDC1-A2-9-290 (LLTFEYYEL (SEQ ID NO:197)), DEPDC1-A2-9-563 (RLCKSTIEL (SEQ ID NO:209)), DEPDC1-A2-9-653 (CVLCCAEEV (SEQ ID NO:225)), DEPDC1-A2-10-674 (FLMDhHQEIL (SEQ ID NO:228)) и DEPDC1-A2-10-302 (ILVVcGYITV (SEQ ID NO:230)) представляют собой пептиды-эпитопы каждого TAA, рестрик