Iphk-опосредованное ингибирование связанных с фактором некроза опухоли альфа состояний
Иллюстрации
Показать всеИзобретение относится к биохимии и представляет собой способ ослабления экспрессии мРНК TNFR1 у субъекта. Способ осуществляется путем введения композиции, содержащей эффективное количество интерферирующей РНК длиной 19-27 нуклеотидов, и фармацевтически приемлемый носитель, где интерферирующая РНК содержит смысловую нуклеотидную цепь, антисмысловую нуклеотидную цепь, в которой участок комплементарности составляет, по меньшей мере, 19 непрерывных нуклеотидов. Также предложены способы лечения связанного с TNF-α состояния у нуждающегося в этом субъекта и композиция для лечения связанного с TNF-α глазного состояния. Изобретение может эффективно применяться при лечении пациентов, имеющих связанное с TNF-α состояние или имеющих риск развития подобного состояния. 4 н. и 19 з.п. ф-лы, 1 ил., 2 табл., 1 пр.
Реферат
Родственные заявки
Представленная заявка претендует на приоритет по совместно поданной предварительной патентной заявке США, серийный номер 60/801788, поданной 19 мая 2006 г., озаглавленной «iРНК-опосредованное ингибирование связанных с фактором некроза опухоли α состояний», текст которой включен в настоящее описание в виде ссылки.
Область изобретения
Представленное изобретение относится к области композиций интерферирующей РНК для подавления фактора некроза опухоли α (TNF-α) путем подавления мРНК рецептора TNF-α на поверхности клеток (Рецептора-1 TNF, или TNFR1), или мРНК TNF-α-превращающего фермента (NFCT/ADAM17). Подавление таких мишеней TNF-α полезно при лечении пациентов, имеющих связанное с TNF-α состояние или имеющих риск развития подобного состояния.
Область техники
Лечение воспалений обычно проводят с использованием стандартных противовоспалительных режимов, включая лечение стероидами и/или нестероидными противовоспалительными препаратами (NSAIDS). Аллергические конъюктивиты, воспаление глаза, дерматиты, риниты и астма исторически подвергались лечению с использованием режимов орального, интраназального или наружного применения антигистаминов в дополнение к оральному или интраназальному применению стероидов. Системное лечение обычно требует введения более высоких концентраций лекарственного соединения для того, чтобы эффективная концентрация достигла необходимого участка лечения. Известно, что антигистаминные препараты воздействуют на центральную нервную систему; сонливость и сухость слизистых оболочек являются обычным побочным эффектом применения антигистаминов. Стероиды и NSAIDS имеют потенциальные побочные эффекты, включая увеличение внутриглазного давления, катаракту, глаукому или расплавление роговицы.
Сухость глаз, также известная как сухой кератоконъюктивит, является распространенным офтальмологическим расстройством, вовлекающим распад слезной пленки на глазу, приводящий к дегидратации обнаженной внешней поверхности глаза. На сегодняшний день лечение сухости глаз проводится путем наружного применения синтетических растворов слез. Некоторые из этих растворов содержат слизеподобные вещества для временной замены или восполнения муцинового слоя у пациентов с дефицитом муцина. Для кратковременного «импульсного» лечения обострений сухости глаз было предложено применение метилпреднизолона. Предложенная «импульсная» терапия требуется для того, чтобы избегнуть осложнений, связанных с традиционной терапией воспалительных состояний стероидами, таких как увеличенное внутриглазное давление и образование катаракты.
Цитокин TNF-α является мишенью противовоспалительной терапии сухости глаз и увеитов. В модели сухости глаз, вызванной воспалением слезной железы на кролике, ингибирование окрашивания роговицы и восстановление времени разрушения слезы достигалось путем специфической модуляции уровней TNF-α на поверхности глаза. Терапия сухости глаз производилась путем ингибирования синтеза TNF-α (RDP58) или путем специфической нейтрализации TNF-α с применением моноклональных антител (REMICADE®) или растворимого рецептора (ENBREL®). Каждый из этих направленных на TNF-α видов лечения приводил к изменению эффективности на несколько порядков при местном применении глазных противовоспалительных стероидов.
Патентная заявка США 2005/0227935, опубликованная 13 октября 2005 г., McSwiggen et al., относится к РНК-опосредованному ингибированию экспрессии генов TNF и рецептора TNF. Однако в упомянутой публикации не приводятся конкретные последовательности-мишени для РНК-интерференции, предложенные здесь.
Варианты осуществления представленного здесь изобретения связаны с удовлетворением потребностей в данной области в лекарственных средствах и методах лечения сухости глаз и воспалений, и предложен альтернативный вариант их лечения.
Сущность изобретения
В вариантах осуществления представленного изобретения предложен мощный и эффективный способ лечения, предотвращения или вмешательства в связанные с TNF-α состояния при отсутствии побочных эффектов, связанных со стероидами или NSAIDS. В одном аспекте способы согласно изобретению включают лечение субъекта, имеющего связанные с TNF-α состояния или риск возникновения связанного с TNF-α состояния путем назначения ему интерферирующей РНК, которая подавляет экспрессию мРНК TACE или мРНК TNFR1, таким образом препятствуя связыванию TNF-α с его рецептором на поверхности клеток, соответственно, таким образом, ослабляя действие TNF-α и предотвращая каскад событий, связанных с апоптозом и воспалением.
Состояния, связанные с TNF-α, включают такие состояния как сухость глаз и связанные с TNF-α воспалительные состояния. Связанные с TNF-α воспалительные состояния включают такие состояния как, например, глазные воспаления, аллергические конъюктивиты, дерматиты, риниты и астму, а также клеточные изменения, вызванные активностью TNF-α, которая прямо или косвенно приводит к связанным с TNF-α воспалительным состояниям. Связанные с TNF-α состояния, в частности, включают связанные с TNF-α глазные состояния, такие как сухость глаз, аллергический конъюктивит и глазные воспаления. Предложенная здесь интерферирующая РНК осуществляет подавление мРНК-мишени TNF-α TACE или мРНК TNFR1, не вызывая при этом нежелательных побочных эффектов, связанных с неспецифическими препаратами.
Вариантом осуществления изобретения является способ ослабления экспрессии мРНК TACE у субъекта. Способ включает в себя введение субъекту композиции, содержащей эффективное количество интерферирующей РНК, имеющей длину от 19 до 49 нуклеотидов, и фармацевтически приемлемый носитель, при этом интерферирующая РНК содержит участок не менее чем из 13 расположенных рядом нуклеотидов, имеющих по меньшей мере 90% комплементарность последовательности или по меньшей мере 90% идентичность последовательности предпоследним 13 нуклеотидам с 3'-конца мРНК, соответствующей любой из SEQ ID NO:3, SEQ ID NO:14 - SEQ ID NO:58, и SEQ ID NO:155 - SEQ ID NO:201. Таким образом ослабляют экспрессию мРНК TACE.
Другим вариантом осуществления изобретения является способ лечения связанных с TNF-α состояний у субъектов, нуждающихся в этом. Способ включает в себя назначение субъекту композиции, содержащей эффективное количество интерферирующей РНК, имеющей длину от 19 до 49 нуклеотидов, и фармацевтически приемлемый носитель, причем интерферирующая РНК содержит участок не менее чем из 13 расположенных рядом нуклеотидов, имеющих по меньшей мере 90% комплементарность последовательности или по меньшей мере 90% идентичность последовательности предпоследним 13 нуклеотидам с 3'-конца мРНК, соответствующей любой из SEQ ID NO:3, SEQ ID NO:14 - SEQ ID NO:58 и SEQ ID NO:155 - SEQ ID NO:201. Таким образом проводится лечение связанного с TNF-α состояния.
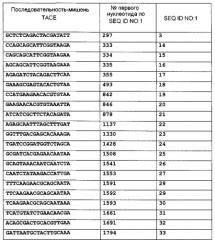
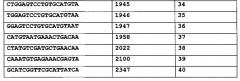
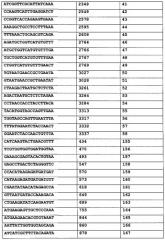
В еще одном варианте осуществления изобретения способ ослабления действия TNF-α у субъекта путем подавления у субъекта экспрессии мРНК TACE или мРНК TNFR1 включает в себя назначение субъекту композиции, содержащей эффективное количество интерферирующей РНК, имеющей длину от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, интерферирующая РНК содержит смысловую нуклеотидную цепь, антисмысловую нуклеотидную цепь, и участок по меньшей мере почти идеальной непрерывной комплементарности не менее чем из 19 нуклеотидов, где антисмысловая цепь гибридизуется в физиологических условиях с частью мРНК, соответствующей SEQ ID NO:1 и включающей в себя нуклеотиды 297, 333, 334, 335, 434, 470, 493, 547, 570, 573, 618, 649, 689, 755, 842, 844, 846, 860, 878, 894, 900, 909, 910, 913, 942, 970, 984, 1002, 1010, 1053, 1064, 1137, 1162, 1215, 1330, 1334, 1340, 1386, 1393, 1428, 1505, 1508, 1541, 1553, 1557, 1591, 1592, 1593, 1597, 1604, 1605, 1626, 1632, 1658, 1661, 1691, 1794, 1856, 1945, 1946, 1947, 1958, 2022, 2094, 2100, 2121, 2263, 2277, 2347, 2349, 2549, 2578, 2595, 2606, 2608, 2629, 2639, 2764, 2766, 2767, 2769, 3027, 3028, 3261, 3264, 3284, 3313, 3317, 3332 или 3337, или где антисмысловая цепь гибридизуется в физиологических условиях с частью мРНК, соответствующей SEQ ID NO:2, начиная с нуклеотида 124, 328, 387, 391, 393, 395, 406, 421, 423, 444, 447, 455, 459, 460, 467, 469, 470, 471, 475, 479, 513, 517, 531, 543, 556, 576, 587, 588, 589, 595, 601, 602, 611, 612, 651, 664, 667, 668, 669, 677, 678, 785, 786, 788, 791, 792, 804, 813, 824, 838, 843, 877, 884, 929, 959, 960, 961, 963, 964, 965, 970, 973, 974, 1000, 1002, 1013, 1026, 1053, 1056, 1057, 1058, 1161, 1315, 1318, 1324, 1357, 1360, 1383, 1393, 1420, 1471, 1573, 1671, 2044, 2045, 2046, 2047, 2048, 2089, 2090, 2091, 2092 или 2098. Экспрессия мРНК TACE уменьшена в тех вариантах осуществления, где антисмысловая цепь гибридизуется с частью мРНК, соответствующей SEQ ID NO:1, как приведено выше. Экспрессия мРНК TNFR1 уменьшена в тех вариантах осуществления, где антисмысловая цепь гибридизуется с частью мРНК, соответствующей SEQ ID NO:2, как приведено выше.
Также вариантом осуществления изобретения является способ лечения связанного с TNF-α состояния у субъекта, нуждающегося в этом, способ включает в себя назначение субъекту композиции, содержащей эффективное количество интерферирующей РНК, имеющей длину от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, интерферирующая РНК содержит смысловую нуклеотидную цепь, антисмысловую нуклеотидную цепь, и участок по меньшей мере почти идеальной непрерывной комплементарности не менее чем из 19 нуклеотидов; где антисмысловая цепь гибридизуется в физиологических условиях с частью мРНК, соответствующей SEQ ID NO:1 и включающей в себя нуклеотиды 297, 333, 334, 335, 434, 470, 493, 547, 570, 573, 618, 649, 689, 755, 842, 844, 846, 860, 878, 894, 900, 909, 910, 913, 942, 970, 984, 1002, 1010, 1053, 1064, 1137, 1162, 1215, 1330, 1334, 1340, 1386, 1393, 1428, 1505, 1508, 1541, 1553, 1557, 1591, 1592, 1593, 1597, 1604, 1605, 1626, 1632, 1658, 1661, 1691, 1794, 1856, 1945, 1946, 1947, 1958, 2022, 2094, 2100, 2121, 2263, 2277, 2347, 2349, 2549, 2578, 2595, 2606, 2608, 2629, 2639, 2764, 2766, 2767, 2769, 3027, 3028, 3261, 3264, 3284, 3313, 3317, 3332 или 3337. Таким образом проводится лечение связанного с TNF-α состояния.
Дальнейшим вариантом осуществления изобретения является способ лечения связанного с TNF-α состояния у субъекта, нуждающегося в этом, способ включает в себя назначение субъекту композиции, содержащей эффективное количество интерферирующей РНК, имеющей длину от 19 до 49 нуклеотидов, и фармацевтически приемлемый носитель, интерферирующая РНК содержит смысловую нуклеотидную цепь, антисмысловую нуклеотидную цепь, и участок по меньшей мере почти идеальной непрерывной комплементарности не менее чем из 19 нуклеотидов; где антисмысловая цепь гибридизуется в физиологических условиях с частью мРНК, соответствующей SEQ ID NO:2, включающей в себя нуклеотид 124, 328, 387, 391, 393, 395, 406, 421, 423, 444, 447, 455, 459, 460, 467, 469, 470, 471, 475, 479, 513, 517, 531, 543, 556, 576, 587, 588, 589, 595, 601, 602, 611, 612, 651, 664, 667, 668, 669, 677, 678, 785, 786, 788, 791, 792, 804, 813, 824, 838, 843, 877, 884, 929, 959, 960, 961, 963, 964, 965, 970, 973, 974, 1000, 1002, 1013, 1026, 1053, 1056, 1057, 1058, 1161, 1315, 1318, 1324, 1357, 1360, 1383, 1393, 1420, 1471, 1573, 1671, 2044, 2045, 2046, 2047, 2048, 2089, 2090, 2091, 2092 или 2098. Таким образом проводится лечение связанного с TNF-α состояния.
В следующем варианте осуществления субъекту может также быть введена вторая интерферирующая РНК, имеющая длину от 19 до 49 нуклеотидов; вторая интерферирующая РНК содержит смысловую нуклеотидную цепь, антисмысловую нуклеотидную цепь и участок по меньшей мере почти идеальной комплементарности по меньшей мере из 19 нуклеотидов, где антисмысловая цепь второй интерферирующей РНК гибридизуется в физиологических условиях с частью мРНК, соответствующей SEQ ID NO:2, начиная с нуклеотида 124, 328, 387, 391, 393, 395, 406, 421, 423, 444, 447, 455, 459, 460, 467, 469, 470, 471, 475, 479, 513, 517, 531, 543, 556, 576, 587, 588, 589, 595, 601, 602, 611, 612, 651, 664, 667, 668, 669, 677, 678, 785, 786, 788, 791, 792, 804, 813, 824, 838, 843, 877, 884, 929, 959, 960, 961, 963, 964, 965, 970, 973, 974, 1000, 1002, 1013, 1026, 1053, 1056, 1057, 1058, 1161, 1315, 1318, 1324, 1357, 1360, 1383, 1393, 1420, 1471, 1573, 1671, 2044, 2045, 2046, 2047, 2048, 2089, 2090, 2091, 2092 или 2098.
Когда мишенью первой интерферирующей РНК является SEQ ID NO:1, мишенью второй интерферирующей РНК может являться или SEQ ID NO:1, или SEQ ID NO:2, и наоборот, когда мишенью первой интерферирующей РНК является SEQ ID NO:2, мишенью второй интерферирующей РНК может являться или SEQ ID NO:1, или SEQ ID NO:2. В дальнейших вариантах осуществления могут быть введены третья, четвертая или более интерферирующих РНК.
Дальнейший вариант осуществления изобретения представляет собой способ лечения связанного с TNF-α состояния у субъекта, нуждающегося в этом, способ включает в себя введение субъекту композиции, содержащей двухцепочечную молекулу siРНК, которая отрицательно регулирует экспрессию гена TACE посредством интерференции РНК, где каждая цепь молекулы siРНК независимо имеет длину от 19 до 27 нуклеотидов; и одна цепь молекулы siРНК содержит нуклеотидную последовательность, имеющую значительную комплементарность с мРНК, соответствующей гену TACE, так что молекула siРНК направляет расщепление мРНК путем РНК-интерференции.
Следующий вариант осуществления изобретения представляет собой способ лечения связанного с TNF-α глазного состояния у субъекта, нуждающегося в этом, метод включает в себя введение субъекту композиции, содержащей двухцепочечную молекулу siРНК, которая способствует отрицательной регуляции экспрессии гена TNFR1 посредством интерференции РНК, где каждая цепь молекулы siРНК независимо имеет длину от 19 до 27 нуклеотидов; и одна цепь молекулы siРНК содержит нуклеотидную последовательность, имеющую значительную степень комплементарности мРНК, соответствующей гену TACE, так что молекула siРНК направляет расщепление мРНК путем РНК-интерференции.
Способ уменьшения экспрессии мРНК TACE у субъекта, включающий в себя введение субъекту композиции, содержащей эффективное количество одноцепочечной интерферирующей РНК, и фармацевтически приемлемый носитель является еще одним вариантом осуществления. Одноцепочечная интерферирующая РНК имеет длину от 19 до 49 нуклеотидов и гибридизуется в физиологических условиях с частью мРНК, соответствующей SEQ ID NO:1 и включающей нуклеотиды 297, 333, 334, 335, 434, 470, 493, 547, 570, 573, 618, 649, 689, 755, 842, 844, 846, 860, 878, 894, 900, 909, 910, 913, 942, 970, 984, 1002, 1010, 1053, 1064, 1137, 1162, 1215, 1330, 1334, 1340, 1386, 1393, 1428, 1505, 1508, 1541, 1553, 1557, 1591, 1592, 1593, 1597, 1604, 1605, 1626, 1632, 1658, 1661, 1691, 1794, 1856, 1945, 1946, 1947, 1958, 2022, 2094, 2100, 2121, 2263, 2277, 2347, 2349, 2549, 2578, 2595, 2606, 2608, 2629, 2639, 2764, 2766, 2767, 2769, 3027, 3028, 3261, 3264, 3284, 3313, 3317, 3332 или 3337, интерферирующая РНК имеет участок почти совершенной непрерывной комплементарности с гибридизуемым участком мРНК, соответствующим SEQ ID NO:1. Таким образом уменьшается экспрессия мРНК TACE.
В качестве еще одного варианта осуществления изобретение включает в себя композицию, содержащую интерферирующую РНК, имеющую длину от 19 до 49 нуклеотидов, и содержащую нуклеотидную последовательность, соответствующую любой из последовательностей SEQ ID NO:3, SEQ ID NO:14 - SEQ ID NO:58 и SEQ ID NO:155 - SEQ ID NO:201, или комплементарную им последовательность, и фармацевтически приемлемый носитель.
В качестве еще одного из вариантов осуществления изобретение включает в себя композицию, содержащую интерферирующую РНК, в основном состоящую из любой из последовательностей SEQ ID NO:59 - SEQ ID NO:69, SEQ ID NO:71 - SEQ ID NO:92 и SEQ ID NO:94 - SEQ ID NO:154, или комплементарных им последовательностей; и фармацевтически приемлемый носитель.
Использование любого из вариантов осуществления, описанных здесь при приготовлении лекарственного средства для уменьшения экспрессии мРНК TACE или мРНК TNFR1 в качестве способа уменьшения активности TNF-α и лечения таким образом связанных с TNF-α состояний, как это изложено здесь, также является вариантом осуществления представленного изобретения.
Краткое описание чертежей
Для того чтобы показать способы, с применением которых были получены приведенные выше и иные преимущества и объекты изобретения, будет приведено более детальное описание кратко описанного выше изобретения путем ссылки на конкретные варианты его осуществления, которые проиллюстрированы в прилагаемых изображениях.
Понимая, что эти изображения демонстрируют только типичные варианты осуществления изобретения и таким образом не должны считаться ограничивающими область действия изобретения, изобретение будет описано с дополнительной точностью и деталями путем использования сопутствующих изображений, на которых:
На Фиг. 1 представлена картина вестерн-блоттинга клеток GTM-3, трансфицированных siРНК TNFR1 №1, №2, №3 и №4, и контрольной siРНК без RISC, каждая в концентрации 10 нМ, 1 нМ, и 0,1 нМ; ненацеленная контрольная siРНК (NTC2) в концентрации 10 нМ; и контроль буфера (без siРНК). Стрелки указывают положение полос 55 кДа TNFR1 и 42 кДа актина.
Подробное описание изобретения
Цитируемые здесь ссылки, в той степени, в которой они представляют иллюстративные процедурные или иные детали, дополняющие изложенные здесь, введены сюда особо в виде ссылки.
Специалистам в данной области, в свете представленного раскрытия, должно быть понятно, что в объеме, охватываемом настоящим изобретением, возможны модификации. Все варианты осуществления, раскрытые здесь, могут быть созданы и исполнены без проведения излишних экспериментов в свете представленного раскрытия. Полный объем, охватываемый изобретением, определяется его раскрытием и его эквивалентными вариантами осуществления. Описание не должно толковаться как сужение объема защиты, на который претендует представленное изобретение.
Показанные здесь детали приведены в качестве примера и только для иллюстрации предпочтительных вариантов осуществления изобретения и представлены здесь для наибольшей эффективности и легкости восприятия принципов и концептуальных аспектов различных вариантов осуществления изобретения. В этом отношении структурные подробности изобретения приведены в том объеме, который необходим для фундаментального понимания изобретения, описание, взятое вместе с иллюстрациями и/или примерами, дано для уяснения специалистами в данной области того, каким образом некоторые варианты изобретения могут быть воплощены на практике.
Последующие определения и объяснения должны считаться определяющими в любых дальнейших конструкциях, за исключением случаев, когда они четко и однозначно изменены в последующих примерах или когда применение этих значений делает какие-либо конструкции бессмысленными или в основном бессмысленными. В случаях, когда включающие термины конструкции сделают их бессмысленными или практически бессмысленными, определение должно быть взято из словаря Webster's 3-го издания.
Если не указано иное, все использованные здесь проценты являются весовыми процентами.
Если не указано иначе, существительные в единственном числе могут также относиться и к множественному числу.
Термин «сухость глаз», также известный как сухой конъюктивит или сухой кератоконъюктивит, является часто встречающимся офтальмологическим расстройством, вовлекающим распад слезной пленки на глазу, приводящий к дегидратации оголенной внешней поверхности глаза.
Используемый здесь термин «глазное воспаление» включает, например, ирит, увеит, эписклерит, склерит, кератит, эндофтальмит, блефарит, и ятрогенные воспалительные состояния.
Здесь термин «аллергические конъюктивиты» относится к воспалению конъюнктивы, которая представляет собой тонкую мембрану, которая находится под веками и покрывает наружную поверхность склеры. Термин «аллергический конъюктивит» включает, например, атопический кератоконъюктивит, конъюктивит гигантоклеточный папиллярный, связанный с сенной лихорадкой конъюктивит, хронический аллергический конъюктивит, и весенний кератоконъюктивит.
Здесь термин «дерматит» относится к воспалению кожи и включает, например, аллергический контактный дерматит, крапивницу, астеатозный дерматит (сухость кожи в нижней части ног), атопический дерматит, контактный дерматит, включая контактный дерматит вследствие действия раздражающих веществ и урушиол-индуцированный контактный дерматит, отит наружного уха, периоральный дерматит и себорейный дерматит.
Здесь термин «ринит» относится к воспалению слизистых мембран носа и включает, например, аллергический ринит, атопический ринит, эозинофильный неаллергический ринит, медикаментозный ринит и нейтрофильный риносинусит.
Термин «астма» относится к воспалению дыхательных путей, приводящему к сужению дыхательных путей, которые проводят воздух из носа и рта в легкие, и включает, например, аллергическую астму, атопическую астму, атопическую бронхиальную IgE-опосредованную астму, бронхиальную астму, бронхиолит, эмфизематозную астму, первичную астму, астму напряжения, экзогенную астму, вызванную факторами внешней среды, раннюю астму, эндогенную астму, вызванную патофизиологическими расстройствами, неаллергическую астму, не-атопическую астму и синдром бронхита новорожденных.
Фраза «непрерывный участок не менее чем из 13 нуклеотидов, имеющий по меньшей мере 90% комплементарность последовательности или по меньшей мере 90% идентичность последовательности с предпоследними 13 нуклеотидами 3'-конца мРНК, соответствующей любой из (идентификатор последовательности)» допускает одну нуклеотидную замену. Две нуклеотидные замены (например, 11/13=85% идентичности/комплементарности) не включены в подобную фразу.
Термин «процент идентичности» описывает процент непрерывных нуклеотидов в первой молекуле нуклеиновой кислоты, являющихся такими же, что и в наборе непрерывных нуклеотидов той же длины во второй молекуле нуклеиновой кислоты. Термин «процент комплементарности» описывает процент непрерывных нуклеотидов в первой молекуле нуклеиновой кислоты, которые способны образовывать пары оснований в Уотсон-Криковском смысле с набором непрерывных нуклеотидов во второй молекуле нуклеиновой кислоты.
Использованный здесь, термин «гибридизация» обозначает и относится к процессу, в котором одноцепочечные нуклеиновые кислоты с комплементарными или почти комплементарными последовательностями оснований взаимодействуют, образуя связанные водородными связями комплексы, называемые гибридами. Реакции гибридизации являются чувствительными и избирательными. Специфичность гибридизации (т.е. ее жесткость) in vitro управляется, например, концентрациями соли или формамида в растворах для прегибридизации и гибридизации, и температурой гибридизации; подобные процедуры хорошо известны в данной области. В частности, жесткость увеличивается при уменьшении концентрации соли, увеличении концентрации формамида, или при повышении температуры гибридизации.
Например, условия высокой жесткости могут иметь место при приблизительно 50% формамида при температуре от 37°С до 42°С. Условия пониженной жесткости могут иметь место при приблизительно от 35% до 25% формамида при температуре от 30°С до 35°С. Примеры жестких условий для гибридизации приведены в Sambrook, J., 1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. Дальнейшие примеры жестких условий гибридизации включают 400 мM NaCl, 40 мM PIPES pH 6,4, 1 мM EDTA, 50°C или 70°C в течение 12-16 часов с последующей промывкой, или гибридизацию при 70°C в IXSSC или при 50°C в IXSSC с 50% формамида с последующей промывкой при 70°C в 0,3XSSC, или гибридизацию при 70°C в 4XSSC или при 50°C в 4XSSC с 50% с последующей промывкой при 67°C в IXSSC. Температура гибридизации приблизительно на 5-10°С меньше, чем температура плавления (Tm) гибрида, где Tm определяется для гибридов длиной между 19 и 49 парами оснований с использованием следующих вычислений: Tm,°C=81,5+16,6(log10[Na+])+0,41(%G+C)-(600/N), где N представляет собой число оснований в гибриде и [Na+] является концентрацией ионов натрия в буфере для гибридизации.
Приведенные здесь последовательности нуклеиновых кислот записаны в направлении от 5' к 3', если не указано иное. Термин «нуклеиновая кислота» относится или к ДНК, или к РНК, или к их модифицированной форме, содержащей пуриновые или пиримидиновые основания, присутствующие в ДНК (аденин «A», цитозин «С», гуанин «G», тимин «T») или в РНК (аденин «A», цитозин «C», гуанин «G», урацил «U»). Предложенные здесь интерферирующие РНК могут содержать основания «Т», особенно на 3'-конце, несмотря на то, что «Т» обычно не встречается в РНК. Термин «нуклеиновая кислота» включает термины «олигонуклеотид» и «полинуклеотид», и может относиться к одноцепочечным молекулам и к двухцепочечным молекулам. Двухцепочечная молекула образована путем Уотсон-Криковского спаривания оснований между основаниями А и Т, основаниями С и G и между основаниями А и U. Цепи двухцепочечной молекулы могут иметь частичную, значительную или полную комплементарность друг другу и будут формировать гибридный дуплекс, сила связывания в котором зависит от природы и степени комплементарности последовательности оснований.
Последовательность мРНК может быть легко выведена логически на основании последовательности соответствующей ДНК. Например, SEQ ID NO:1 представляет собой последовательность смысловой цепи, соответствующей мРНК TACE. Последовательность мРНК идентична последовательности ДНК смысловой цепи, где основания «Т» заменены основаниями «U». Таким образом последовательность мРНК TACE известна из SEQ ID NO:1, и последовательность мРНК TNFR1 известна из SEQ ID NO:2.
Интерференция РНК (iРНК) представляет собой процесс, при котором двухцепочечная РНК (dsРНК) используется для подавления экспрессии гена. Если не отдавать предпочтение конкретной теории, РНК-ингибирование начинается с расщепления более длинных двухцепочечных dsРНК на маленькие интерферирующие РНК (siРНК) подобным РНКазеIII ферментом, дайсером. siРНК представляют собой dsРНК, которые обычно имеют длину от 19 до 28 нуклеотидов, или от 20 до 25 нуклеотидов, или от 21 до 22 нуклеотидов и часто содержат 2-нуклеотидные 3'-нависающие концы и 5'-фосфатные и 3'-гидроксильные концевые группы. Одна из цепей siРНК включается в рибонуклеопротеиновый комплекс, известный как РНК-индуцируемый подавляющий комплекс (RISC). RISC использует цепь siРНК для идентификации молекул мРНК, которые по меньшей мере частично комплементарны встроенной цепи siРНК, после чего расщепляет эти мРНК-мишени или подавляет их трансляцию. Таким образом, цепь siРНК, которая встраивается в RISC известна как направляющая цепь или антисмысловая цепь. Другая цепь siРНК, известная как цепь-пассажир или смысловая цепь, удаляется из siРНК и является по меньшей мере частично гомологичной мРНК-мишени. Специалисты в данной области техники поймут, что, в принципе, любая цепь siРНК может быть встроена в RISC и функционировать в качестве направляющей цепи. Однако конструкция siРНК (например, пониженная стабильность РНК-дуплекса на 5'-конце желаемой направляющей цепи) может создавать преимущества встраиванию в RISC желаемой цепи.
RISC-опосредованное расщепление мРНК, имеющей последовательность, по меньшей мере частично комплементарную направляющей цепи приводит к уменьшению уровня этой мРНК и соответствующего белка, кодируемого этой мРНК, в состоянии покоя. Альтернативно, RISC может также понижать экспрессию соответствующего белка путем репрессирования трансляции без расщепления РНК-мишени. Другие молекулы РНК и РНК-подобные молекулы могут взаимодействовать с RISC и подавлять экспрессию генов. Примеры других молекул РНК, которые способны взаимодействовать с RISC, включают РНК с короткой шпилькой (shРНК), одноцепочечные siРНК, микроРНК (miРНК) и 27-членные дуплексные субстраты дайсера. Использованный здесь термин «siРНК» относится к двухцепочечной интерферирующей РНК, если не указано иное. Примеры РНК-подобных молекул, которые могут взаимодействовать с RISC включают молекулы РНК, содержащие один или более химически модифицированных нуклеотидов, один или более дезоксирибонуклеотидов, и/или одну или более не-фосфодиэфирных связей. Для целей представленного обсуждения все РНК и РНК-подобные молекулы, которые способны взаимодействовать с RISC и участвовать в RISC-опосредованных изменениях экспрессии генов будут упоминаться как «интерферирующие РНК». Таким образом, siРНК, shРНК, miРНК, и 27-членные дуплексные субстраты дайсера являются подтипами «интерферирующих РНК».
Интерферирующие РНК в соответствии с вариантами осуществления изобретения, по всей видимости, действуют как катализаторы расщепления РНК-мишени, то есть интерферирующая РНК способна воздействовать на ингибирование мРНК-мишени в субстехиометрических количествах. При таких условиях расщепления для достижения терапевтического эффекта требуется значительно меньше интерферирующей РНК по сравнению с терапией антисмысловыми цепями.
Представленное изобретение относится к применению интерферирующей РНК для ингибирования экспрессии рецептора TNF-1 (TNFR1), рецептора TNF-α на поверхности клеток или TNF-α-превращающего фермента (TACE/ADAM17, обозначенного здесь «TACE»), ингибирование которых уменьшает активность фактора некроза опухоли α (TNF-α). Связывание TNF-α с его рецептором на поверхности клеток, рецептором TNF-1(TNFR1), активирует сигнальный каскад, который воздействует на различные ответы клетки, включая апоптоз и воспаление. Сам TNF-α экспрессируется сначала в виде неактивного связанного с мембраной предшественника. Высвобождение активной формы TNF-α с поверхности клетки требует протеолитического процессинга предшественника TNF-α с участием TNF-α-превращающего фермента (TACE/ADAM17), члена семейства 1А дизинтегринов и металлопротеаз (ADAM).
В соответствии с представленным изобретением, ингибирование экспрессии мРНК TNFR1, мРНК TACE или обеих МРНК TNFR1 и TACE эффективно уменьшает действие TNF-α. Далее, интерферирующие РНК, как изложено здесь, введенные экзогенно или экспрессированные эндогенно, весьма эффективны для подавления мРНК TNFR1 или мРНК TACE.
мРНК фактор некроза опухоли α-превращающего фермента (TACE/ADAM17): база данных GenBank предоставляет последовательность ДНК для TACE под номером доступа NM_003183, приведенную в «списке последовательностей» как SEQ ID NO:1. SEQ ID NO:1 представляет собой последовательность смысловой цепи ДНК, которая соответствует мРНК, кодирующей TACE (с заменой оснований «Т» на основания «U»). Кодирующая последовательность TACE состоит из нуклеотидов 184-2658.
Эквивалентами приведенной выше последовательности мРНК TACE являются альтернативные формы сплайсинга, аллельные формы, изозимы или родственные им формы. Родственной является мРНК фактор некроза опухоли α-превращающего фермента из другого вида млекопитающих, которая гомологична SEQ ID NO:1 (т.е. является ортологом).
мРНК рецептора фактора некроза опухоли 1 (TNFR1): база данных GenBank предоставляет последовательность ДНК для TACE под номером доступа NM_001065, приведенную в «списке последовательностей» как SEQ ID NO:2. SEQ ID NO:2 представляет собой последовательность смысловой цепи ДНК, которая соответствует мРНК, кодирующей TNFR1 (с заменой оснований «Т» на основания «U»). Кодирующая последовательность TACE состоит из нуклеотидов 282-1649.
Эквивалентами приведенной выше последовательности мРНК TACE являются альтернативные формы сплайсинга, аллельные формы, изозимы или их родственники. Родственной является мРНК рецептора фактора некроза опухоли 1 из другого вида млекопитающих, которая гомологична SEQ ID NO:2 (т.е. является ортологом).
Ослабление экспрессии мРНК: здесь фраза «ослабление экспрессии мРНК» означает введение или экспрессирование количества интерферирующей РНК (например, siРНК) для уменьшения трансляции мРНК-мишени в белок либо путем расщепления РНК, либо путем прямого ингибирования трансляции. Уменьшение экспрессии мРНК или соответствующего протеина обычно упоминается как «нокдаун» и показывается относительно уровней, присутствующих после введения или экспрессии ненацеленной контрольной РНК (например, ненацеленной контрольной siРНК). Вариантами осуществления здесь рассматривается нокдаун экспрессии на величину от 50% до 100%, включая и сами эти значения. Однако для целей представленного изобретения не является необходимым достижение таких уровней нокдауна. В одном варианте осуществления пациенту назначается единственная интерферирующая РНК, нацеленная на мРНК TACE или на мРНК TNFR1. В других вариантах осуществления назначаются две или более интерферирующих РНК, нацеленных на мРНК TACE или на мРНК TNFR1. В дальнейших вариантах осуществления интерферирующие РНК, каждая из которых нацелена на мРНК TACE или на мРНК TNFR1, назначаются в сочетании или с таким интервалом, чтобы их действия перекрывались.
Нокдаун часто оценивается путем измерения уровней мРНК с использованием амплификации в количественной полимеразной цепной реакции (qПЦР) или путем измерения уровней протеина методом вестерн-блот или иммуноферментного анализа (ИФА). Анализ уровня протеина позволяет оценить и расщепление РНК, и ингибирование трансляции. Другие способы измерения нокдауна включают гибридизацию РНК в растворе, защиту от нуклеаз, нозерн-гибридизацию, мониторинг экспрессии генов при помощи микроанализа, связывание антител, радиоиммунный анализ и анализ с применением анализа активированных флуоресцентных клеток.
Ингибирование TACE или TNFR1 может также быть определено in vitro путем оценки уровней мРНК-мишени или белка-мишени например, в клетках эпителия роговицы человека после трансфекции РНК, интерферирующей с TACE или TNFR1, как описано ниже.
Также можно сделать вывод об ингибировании активности TNF-α вследствие ингибирования экспрессии мРНК TACE или мРНК TNFR1 у человека или млекопитающего на основании наблюдения улучшений симптомов связанного с TNF-α состояния, такого как улучшение симптомов, относящихся к сухости глаз, аллергическим конъюктивитам, воспалению глаза, дерматиту, ринитам или астме. Улучшения в любых симптомах, например, сухости глаз, отеков, чесотки, воспаления, или переносимости к неблагоприятным условиям среды, являются показательными в отношении ингибирования активности TNF-α.
Интерферирующие РНК: в одном варианте осуществления изобретения интерферирующие РНК (например, siРНК) имеют смысловую цепь и антисмысловую цепь, включающую участок почти идеальной непрерывной комплементарности не менее чем из 19 нуклеотидов.
В дальнейших вариантах осуществления изобретения интерферирующие РНК (например, siРНК) имели смысловую цепь и антисмысловую цепь, соответственно, антисмысловая цепь содержала участок по меньшей мере почти идеальной непрерывной комплементарности по отношению к последовательности-мишени мРНК TACE или мРНК TNFR1, состоящий не менее чем из 19 нуклеотидов, и смысловая цепь содержала участок по меньшей мере почти идеальной непрерывной идентичности по отношению к последовательности-мишени мРНК или мРНК TNFR1, состоящий не менее чем из 19 нуклеотидов.
В дальнейших вариантах осуществления изобретения интерферирующая РНК содержит непрерывный участок не менее чем из 13, 14, 15, 16, 17 или 18 нуклеотидов, имеющих процент комплементарности последовательности или процент идентичности последовательности с предпоследними 13, 14, 15, 16, 17 или 18 нуклеотидами 3'-конца соответствующей последовательности-мишени мРНК.
Длина каждой цепи интерферирующей РНК составляет от 19 до 49 нуклеотидов, что включает длину в 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49 нуклеотидов.
Антисмысловая цепь siРНК является активным направляющим фактором siРНК, антисмысловая цепь встраивается в RISC, позволяя таким образом RISC идентифицировать мРНК-мишени, которые по меньшей мере частично комплементарны антисмысловой цепи siРНК для их расщепления или подавления их трансляции.
В вариантах осуществления представленного изобретения последовательности-мишени интерферирующей РНК (например, последовательности-мишени siРНК) внутри последовательности мРНК-мишени отбираются с использованием доступных инструментов конструирования. Интерферирующие РНК, соответствующие последовательностям-мишеням TACE или TNFR1, затем проверяются путем трансфекции клеток, экспрессирующих РНК-мишень с последующей оценкой нокдауна, описанной выше.
Техника отбора последовательностей-мишеней для siРНК предложена Tuschl, T. et al, "The siRNA User Guide," переработано 6 мая 2004 г., доступно на интернет-сайте Университета Рокфеллера; в Technical Bulletin #506, "siRNA Design Guidelines," Ambion Inc. На интернет-сайте Ambion; или с использованием любых других сетевых инструментов дизайна, например, доступные на интернет-сайтах Invitrogen, Dharmacon, Integrated DNA Technologies, Genscript, или Proligo. Начальные параметры поиска могут включать содержание G/C между 35% и 55% и длину siРНК между 19 и 27 нуклеотидами. Последовательность-мишень может быть расположена в кодирующем участке или на 5'- или 3'-нетранслируемых участках мРНК.
Вариант 19-членной нуклеотидной ДНК-последовательности-мишени для мРНК TACE соответствует нуклеотидам 297-315 последовательности SEQ ID NO:1:
5'-GCTCTCAGACTACGATATT-3' SEQ ID NO:3.
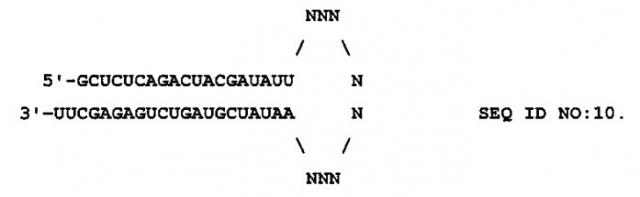
siРНК согласно изобретению, нацеленная на соответствующую последовательность мРНК SEQ ID NO:3 и имеющая 21-членные нуклеотидные цепи и 2-членный нуклеотидный 3'-нависающий конец:
5'-GCUCUCAGACUACGAUAUUNN-3 SEQ ID NO:4
3'-NNCGAGAGUCUGAUGCUAUAA-5' SEQ ID NO:5
Каждый остаток «N» может быть любым нуклеотидом (A, C, G, U T) или модифицированным нуклеотидом. На 3'-конце может находиться число остатков «N» от 1 до 6, включая 1, 2, 3, 4,