Способ количественного определения рутина методом тонкослойной хроматографии
Иллюстрации
Показать всеИзобретение относится к области фармацевтической, пищевой и химической отраслей промышленности и может быть использовано для контроля качества пищевых продуктов, косметических средств и биологически активных добавок к пище по содержанию рутина (витамина Р). Способ количественного определения рутина включает растворение анализируемого образца препарата при нагревании в этаноле с последующим хроматографированием с использованием силикагелевых пластинок марки «Sorbfil», элюент - этилацетат-ледяная уксусная кислота-вода (7,5:1,5:1,5); проявитель - 5% спиртовый раствор NaOH, после проявления хроматографических зон пластины сканируют с помощью планшетного сканера EPSON PERFECTION 2480 PHOTO и полученные изображения обрабатывают компьютерной программой «Sorbfil Videodensitometer», а содержание рутина в анализируемом образце (с, %) рассчитывают по формулам
, где S - значение площади хроматографической зоны на хроматограмме, вычисленное с помощью компьютерной программы «Sorbfil Videodensitometer». Техническим результатом изобретения является экспрессность, доступность, достаточная чувствительность, селективность. 4 ил.
Реферат
Изобретение относится к способам стандартизации лекарственных препаратов, лекарственного растительного сырья, изделий пищевой, химической и косметологической отраслей промышленности по содержанию рутина - основного биологически активного вещества группы флавоноидов.
Способ позволяет проводить определение подлинности, степени чистоты и количественного содержания субстанции рутина и стандартизировать лекарственные препараты, лекарственное растительное сырье, изделия пищевой, химической и косметологической отраслей промышленности по содержанию рутина и отличается достаточной чувствительностью (5·10-7 г), экономичностью, доступностью и экспрессностью.
Известны способы идентификации рутина в субстанции, одно- и многокомпонентных лекарственных формах, лекарственном растительном сырье, премиксах, биологически активных добавках, культурах микроорганизмов с помощью цветных реакций (Биологически активные вещества лекарственных растений / Георгиевский В.П., Комисаренко Н.Ф., Дмитрук С.Е. - Новосиб.: Наука, 1990. - 333 с.; ВФС 42-2577-95. Таблетки «Аскорутин»; Государственная фармакопея СССР. - М.: Медицина. - 10-е изд., 1968. - сс.599-600).
Нашли широкое применение также спектральные методы анализа, такие как фотоэлектроколориметрия, прямая и дифференциальная спектрофотометрия, основанные на измерении оптической плотности исследуемых растворов после добавления каких-либо цветореагентов, образующие с рутином окрашенные комплексы (цитратно-боратный реактив, хлориды алюминия и железа (III), реактив Циннода, диазореактив, растворы аммиака и др.) (Андреева В.Ю., Калинкина Г.И. Разработка методики количественного определения флавоноидов в манжетке обыкновенной. Химия растит. сырья. - 2000. - №1. - сс.85-88; Бекетов Е.В., Абрамов А.А., Нестерова О.В., Кондрашев С. В. Идентификация и количественная оценка флавоноидов в плодах черемухи обыкновенной. Вести. Моск. Ун-та. Сер.2. Химия. - 2005. - Т. 46. - №4. - сс.259-262; Блинова М.П., Теслов Л.С. Разработка метода количественной оценки содержания флавоноидов в траве бубенчика широколистного. Сборник научных трудов «Фармация из века в век». Часть III. Анализ и стандартизация лекарственных средств. - СПб: Изд-во СПХФА, 2008. - сс.6-8).
Недостатками указанных способов являются: громоздкость и длительность определений, нестабильность окрашенных продуктов цветных реакций, недостаточная чувствительность и селективность, невозможность определения рутина в присутствии других представителей группы флавоноидов.
Для идентификации и количественного определения флавоноидов, в том числе рутина, также широко применяется метод ВЭЖХ (Высочина Г.И., Шалдаева Т.М., Коцупий О.В., Храмова Е.П. Флавоноиды Мари белой (Chenopodium album L.), произрастающей в сибири. - Химия растительного сырья, 2009. - №4. - сс.107-112; Кошечкина А.С. Разработка методов анализа флавонов как индикаторных компонентов лекарственного растительного сырья, Автореферат диссертации на соискание ученой степени кандидата фармацевтических наук Москва - 2007. - 25 с.; Птицын А.В. Технология выделения флавоноидов винограда Vitis vinifera сорта «Изабелла» для косметики и изучение их свойств, Автореф. на соиск. уч. ст. канд. хим. н. Москва 2007. - 26 с.). Недостатком которого является нехватка квалифицированных кадров, дорогостоящего оборудования и стандартных образцов.
Известно использование тонкослойной хроматографии (ТСХ) для изучения флавоноидного состава ромашки аптечной (Кочергина Н.В. Изучение флавоноидного состава аллопатических и гомеопатических препаратов ромашки аптечной методом тонкослойной хроматографии // VIII конгресс молодых ученых и специалистов «Науки о человеке». - Томск, 2007. - сс.228-229), бадана толстолистного (Федосеева Л.М., Тимохин Е.В. Изучение флавоноидов красных листьев бадана толстолистного, произрастающего на Алтае, Химия растит. сырья. - 1999. - №4. - сс.81-84), календулы лекарственной (Шарова О.В., Куркин В.А. Флавоноиды цветков календулы лекарственной, Химия растит, сырья. - 2007. - №1. - сс.65-68).
ТСХ, обладая всеми преимуществами хроматографических методов - экспрессностью, доступностью, достаточной чувствительносттю, селективностью и простоте выполнения анализа, находит широкое применение.
В научной фармацевтической и медицинской литературе способов, позволяющих идентифицировать и количественно определять рутин методом ТСХ, авторами не выявлено.
Задача изобретения - разработка способа определения подлинности, степени чистоты и количественного содержания субстанции рутина, разделения сложных смесей рутина с другими биологически активными веществами и стандартизации лекарственных препаратов, лекарственного растительного сырья, изделий пищевой, химической и косметологической отраслей промышленностей по содержанию рутина методом ТСХ.
Технический результат заключается в возможности количественного определения содержания субстанции рутина в лекарственных препаратах, лекарственном растительном сырье с достаточной чувствительностью.
Технический результат достигается тем, что способ количественного определения рутина включает растворение анализируемого образца препарата при нагревании в этаноле с последующим хроматографированием с использованием силикагелевых пластинок марки «Sorbfil» 5×10 см с полимерной подложкой ПТСХ-П-А-УФ, элюент - этилацетат-ледяная уксусная кислота-вода (7,5:1,5:1,5), время насыщения камеры парами элюента 20 мин; время элюирования 35 мин; проявитель - 5% спиртовый раствор NaOH, время выдерживания пластинки в термостате при tº≥80ºС 3-5 мин, сразу же после проявления хроматографических зон пластины сканируют с помощью планшетного сканера EPSON PERFECTION 2480 PHOTO и полученные изображения обрабатывают компьютерной программой «Sorbfil Videodensitometer», а содержание рутина в анализируемом образце (с, %) рассчитывают по формулам
где S - значение площади хроматографической зоны на хроматограмме, вычисленное с помощью компьютерной программы «Sorbfil Videodensitometer».
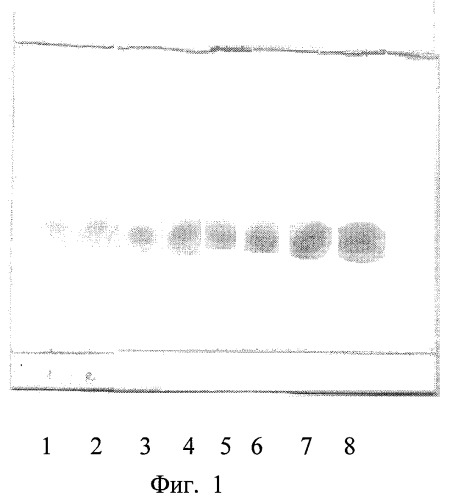
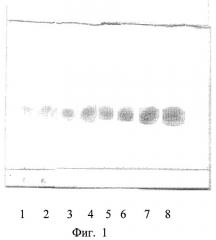
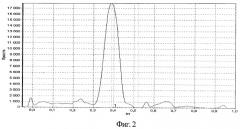
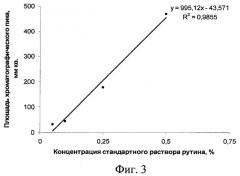
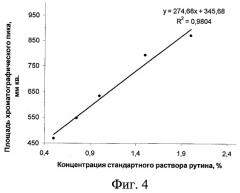
На фиг.1 изображена калибровочная хроматограмма с серией стандартных растворов рутина (с=0,05-2%):1 0,05%; 2 0,1%; 3 0,25%; 4 0,5%; 5 0,75%; 6 1%; 7 1,5%; 8 2%; фиг.2 - аналоговая кривая раствора рутина; фиг.3 - градуировочный график для определения содержания рутина в области концентраций 0,05-0,5%; фиг.4 - градуировочный график для определения содержания рутина в области концентраций 0,5-2,0%.
Навеску исследуемого препарата растворяют при нагревании в этаноле с последующим хроматографированием с использованием силикагелевых пластинок марки «Sorbfil» 5х10 см с полимерной подложкой ПТСХ-П-А-УФ; элюент - этилацетат-ледяная уксусная кислота-вода (7,5:1,5:1,5); проявитель - 5% спиртовый раствор NaOH; оптимальный объем пробы - 3 мкл спиртового раствора с содержанием рутина 2 мг/мл; время насыщения камеры парами элюента 20 мин; время элюирования 35 мин; время выдерживания пластинки в термостате при tº≥80ºС 3-5 минут. Сразу же после проявления хроматографических зон пластины сканируют с помощью планшетного сканера EPSON PERFECTION 2480 PHOTO, а полученные изображения (фиг.1) обрабатывают компьютерной программой «Sorbfil Videodensitometer». В результате получают треки в координатах Rf - интенсивность (фиг.2).
Данная методика позволяет не только получать на хроматограммах четкие зоны рутина округлой формы с оптимальным значением величины Rf, но и проводить разделение сложных смесей рутина с другими биологически активными веществами.
Установлена линейная зависимость между содержанием рутина и интенсивностью окраски хроматографической зоны в диапазоне концентраций рутина 0,05-0,5% и 0,5-2,0%. По полученным результатам были построены градуировочные графики, иллюстрирующие эту зависимость (фиг.3 и 4).
Наличие точки перегиба объясняется снижением коэффициента инструментальной чувствительности определения («а» в уравнении у=ax+b) с увеличением концентрации. Поэтому ошибка в определении концентрации рутина будет уменьшаться с увеличением «а», следовательно, применение градуировочного графика для определения содержания рутина в области низких концентраций, где а=995,12 (фиг.3), приводит к более точным результатам по сравнению с результатами, полученными по графику, представленному на фиг.4, где а=274,68. Наличие в регрессионном уравнении коэффициентов b, отличных от нуля и равных 43,571 и 345,68, говорит о постоянной систематической ошибке, обусловленной влиянием яркости фона пластины на оценку яркости окрашенной хроматографической зоны при обработке хроматограммы компьютерной программой «Sorbfil Videodensitometer».
Таким образом, содержание рутина в анализируемом образце (с, %) можно рассчитать по формулам 1 и 2:
где S - значение площади хроматографической зоны на хроматограмме, вычисленное с помощью компьютерной программы «Sorbfil Videodensitometer».
Пример 1. Навеску измельченных плодов шиповника рода Rosa массой 5 г помещали в мерную колбу на 100 мл и растворяли при нагревании в этаноле. Смесь отфильтровывали, 3 мкл полученного спиртового извлечения наносили на хроматографическую пластину марки «Sorbfil» 5×10 см с полимерной подложкой ПТСХ-П-А-УФ. Пластину помещали в хроматографическую камеру, заполненную элюентом: этилацетат - ледяная уксусная кислота - вода (7,5:1,5:1,5). Через 35 мин пластину вынимали, высушивали и обрабатывали 5% спиртовым раствором NaOH. Визуализированные хроматографические зоны сканировали с помощью планшетного сканера EPSON PERFECTION 2480 PHOTO, а полученные изображения обрабатывали компьютерной программой «Sorbfil Videodensitometer». По формуле (2) рассчитывали содержание рутина в образце. Содержание рутина в плодах шиповника составило 1,7%.
Пример 2. Навеску измельченных листьев березы массой 1 г помещали в мерную колбу на 100 мл и доводили до метки дистиллированной водой и отфильтровывали. 10 мл полученного водного извлечения переносили в мерную колбу на 100 мл и доводили до метки этанолом. 3 мкл спиртового раствора наносили на хроматографическую пластину марки «Sorbfil» 5×10 см с полимерной подложкой ПТСХ-П-А-УФ. Пластину помещали в хроматографическую камеру, заполненную элюентом: этилацетат - ледяная уксусная кислота - вода (7,5:1,5:1,5). Через 35 минут пластину вынимали, высушивали и обрабатывали 5% спиртовым раствором NaOH. Визуализированные хроматографические зоны сканировали с помощью планшетного сканера EPSON PERFECTION 2480 PHOTO, а полученные изображения обрабатывали компьютерной программой «Sorbfil Videodensitometer». По формуле (2) рассчитывали содержание рутина в образце. Содержание рутина в листьях березы составило 1,2%.
Способ количественного определения рутина включает растворение анализируемого образца препарата при нагревании в этаноле с последующим хроматографированием с использованием силикагелевых пластинок марки «Sorbfil» 5×10 см с полимерной подложкой ПТСХ-П-А-УФ, элюент - этилацетат-ледяная уксусная кислота-вода (7,5:1,5:1,5), время насыщения камеры парами элюента - 20 мин; время элюирования - 35 мин; проявитель - 5%-ный спиртовый раствор NaOH, время выдерживания пластинки в термостате при t≥80°С - 3-5 мин, сразу же после проявления хроматографических зон пластины сканируют с помощью планшетного сканера EPSON PERFECTION 2480 PHOTO и полученные изображения обрабатывают компьютерной программой «Sorbfil Videodensitometen», а содержание рутина в анализируемом образце (с, %) рассчитывают по формулам: ,где S - значение площади хроматографической зоны на хроматограмме, вычисленное с помощью компьютерной программы «Sorbfll Videodensitometer».