Фармакологическое средство, обладающее противотуберкулезной активностью
Иллюстрации
Показать всеИзобретение относится к области фармацевтики, в частности к средствам, обладающим противотуберкулезной активностью. Данное изобретение представляет собой полимерный комплекс хитозана с коллоидным золотом, содержит в своей структуре от 8 до 21% (мас.) золота с размером частиц около 1 нм, обладает противотуберкулезной активностью в отношении лекарственно устойчивых микобактерий туберкулеза. Комплекс обеспечивает повышение эффективности противотуберкулезного действия по отношению к штаммам с множественной лекарственной устойчивостью. 3 ил.
Реферат
Изобретение относится к области фармацевтики, в частности к средствам, обладающим противотуберкулезной активностью.
Известны лекарственные средства, применяющиеся в химиотерапии туберкулеза, способные к ингибированию роста микобактерий туберкулеза (МБТ), или бактерицидному действию: изониазид, рифампицин; стрептомицин и другие (Машковский, Лекарственные средства, 2008).
В числе существенных недостатков противотуберкулезных лекарственных средств находится явление лекарственной устойчивости значительного количества существующих штаммов микобактерий туберкулеза (МБТ), которые называют штаммы с множественной лекарственной устойчивостью (МЛУ), вредное побочное действие на организм, токсичность. В практике количество штаммов с МЛУ, резистентных к изониазиду и рифампицину (полирезистентных штаммов) 25%, количество штаммов, резистентных к изониазиду, рифампицину и стрептомицину - 20,1% (данные получены при обследовании первичных больных туберкулезом легких в Воронежском городском противотуберкулезном диспансере).
Известно, что хитозан обладает антибактериальной активностью в отношении микроорганизмов рода Mycobacterium, причем хитозан с низкой молекулярной массой обладает наибольшей антибактериальной активностью (Останина Е.С. Технология переработки восковой моли, изучение противотуберкулезных свойств хитозана и взаимодействия с липолитическими ферментами. Диссертация к.б.н., 2007, стр.3-4).
Лечение пациентов, у которых туберкулезный процесс вызван штаммами с МЛУ представляет большие трудности. Оно является длительным, дорогостоящим и требует использования препаратов резервного ряда или хирургического лечения.
Задача изобретения - улучшение качества жизни и удлинение ее продолжительности.
Технический результат заключается в повышение эффективности противотуберкулезного действия по отношению к штаммам с множественной лекарственной устойчивостью.
Технический результат достигается тем, что для лечения туберкулеза используется фармакологическое средство, представляющее собой полимерный комплекс хитозана с коллоидным золотом, содержащее в своей структуре от 8 до 21% (мас.) золота с размерами частиц около 1 нм.
Синтез предлагаемого фармакологического средства, золотосодержащего комплекса хитозана (АuХТЗ), проводился в условиях конверсии низкомолекулярных хитозанов и коллоидного золота.
Коллоидное золото используется в медицине как диагностическое лекарственное средство, например, разработаны способы лечения ревматоидного артрита с использованием дисперсий золота, применяются соответствующие схемы с содержанием изотопа золота 198 с периодом полураспада 1657 в химиотерапии онкологических заболеваний. Нерадиоактивное коллоидное золото успешно применяется для изучения транспорта веществ в клетку путем эндоцитоза для доставки генного материала в клеточное ядро, а также для адресной доставки лекарственных веществ (Дыкман Л.А., Богатырев В.А., Успехи химии 2007. - 2007. - Т.75, №2. - С.199-213).
Известен полимерный комплекс хитозана с коллоидным золотом в качестве мультифункционального наноносителя для клеточного нацеливания и доставки лекарственных препаратов (ACS JOURNAL OF SURFACES AND COLLOIDS, GUO R., QIAN H, LI R, JIANG X., LIU В., 26.08.2010).
Проведены исследования условий светоиндукционного формирования наноразмерных золотосодержащих частиц в полимерной матрице хитозана с различной молекулярной массой (Якимович Н.О., Соколова Н.В., УФ-индуцированное формирование и характеристики наноразмерных частиц золота в полимерной матрице хитозана // 11 международная конференция студентов и аспирантов «Синтез, исследование свойств, модификация и переработка высокомолекулярных соединений, Казань 24-25 мая 2005, С.237. РЖХО6. 22-19 ф.33). Известно, что частицы золота такого характера состоят из кристаллического золота (Au[м]), на поверхности которого сорбированы ионы Au→Cl4, устанавливающие отрицательный заряд частицы. Ионы Au→Cl4 определяют величину потенциала абсорбции. Для варианта формирования мицелл ионы Н+ находятся в интермицеллярном растворе (диффузионная и сорбционная область двойного электрического слоя).
Предлагаемое фармакологическое средство получают путем взаимодействия низкомолекулярных гомологов хитозана с ММ 2-8 кДа, синтезируемых известным методом управляемого селективного пероксидного гидролиза.
Гомологи хитозана с пониженной степенью полимеризации синтезировали на основе товарного аминогликана (Mcp≈400 кДа и СДА более 90%) с применением известного метода селективного пероксидного гидролиза. В зависимости от молекулярной массы применяющихся гомологов хитозана, условий образования металлокомплексов, хитозан использовался в основной форме (Mcp 2 кДа) или солевой форме (Mcp 8 кДа).
В металлокомплексообразовании использовались водные растворы, основания или соли хитозана с концентрацией 0,1-0,4%.
В качестве металлокомпонента применяли коллоидное золото в виде водного раствора с концентрацией 0,24 мг/мл, ориентировочный размер коллоидных частиц около 1 нм (препарат производства фирмы Голден-Макс). Процесс взаимодействия коллоидного золота с аминогликаном или его солью в водной среде завершался в течение 120-180 минут, при термостатировании 75-80°С. Образовавшиеся металлокомплексы выделяли путем вакуумирования соответствующих водных растворов в виде порошкообразных веществ.
Оценка структуры полученных соединений производилась после соответствующего их селективного экстрагирования. При исследовании применяли элементный анализ, а также метод спектроскопии и другие.
Пример 1
0,052 г хитозана (ММ 8-9 кДа, СДА 90%) растворили в 10 мл 2% водной уксусной кислоты. 30 мл коллоидного раствора золота (концентрация 0,24 мг/мл, размер частиц ~1 нм) - масса коллоидного (диспергированного) компонента 7,2 мг смешивали с раствором хитозана при 20-22°С в течение 60 минут и термостатировании при перемешивании и 65°С в течение 120 минут. Получен однородный практически бесцветный раствор.
Образовавшийся комплекс хитозана с коллоидным золотом выделяли из полученного раствора путем вакуумирования при 40-45°С (~0,9 атм) до образования гелеобразного остатка, который экстрагировали 80% водным этанолом при 10-15°С в целях удаления примесей низкомолекулярных соединений, продукт высушивали в вакууме (~0,95 атм, 50°С). Концентрацию металла в составе комплекса определяли известным методом «мокрого сжигания», включающего обработку точной навески вещества смесью концентрированной HClO4 и HNO3 (3:5) при 300°С, отмывку, сушку и определение массы остатка. Найдено содержание Au в составе комплекса - 10,35%. Расчетное массовое содержание диспергированной фазы хемосорбированной хитозаном - 12,10%.
Комплекс хитозана, полученный обработкой полимера коллоидным золотом, сформировали в виде пленки из водного раствора. Проведен спектральный анализ полученного материала в диапазоне 300-800 нм с шагом 5 нм. Отмечено наличие максимума со слабой интенсивностью в диапазоне 510-530 нм, отсутствующего в составе спектра хитозана, что подтверждает наличие координационной связи Au-ХТЗ.
[Ясная М.А. [и др.] 8-я международная конференция (Кисловодск-Ставрополь), Сев. Кав. ГТУ, 2008. - С.448].
Пример 2
0,042 г хитозана (MM 2-8 кДа, СДА 90,5%) растворили в 10 мл 2% водной уксусной кислоты. 24 мл коллоидного раствора золота (концентрация 0,24 мг/мл, размер частиц ~1 нм) - масса коллоидного (диспергированного) компонента 5,8 мг смешивали с раствором хитозана при 20-22°С в течение 60 минут и термостатировании при перемешивании и 65°С в течение 120 минут. Получен однородный практически бесцветный раствор.
Образовавшийся комплекс хитозана с коллоидным золотом выделяли из полученного раствора путем вакуумирования при 40-45°С (~0,9 атм) до образования гелеобразного остатка, который экстрагировали 80% водным этанолом при 10-15°С в целях удаления примесей низкомолекулярных соединений - продукт высушивали в вакууме (~0,95 атм, 50°С). Концентрацию металла в составе комплекса определяли известным методом «мокрого сжигания», включающего обработку точной навески вещества смесью концентрированной HClO4 и HNO3 (3:5) при 300°С, отмывку, сушку и определение массы остатка. Найдено содержание Au в составе комплекса - 8,05%. Расчетное массовое содержание диспергированной фазы хемосорбированной хитозаном - 9,60%.
Комплекс хитозана, полученный обработкой полимера коллоидным золотом, сформировали в виде пленки из водного раствора. Проведен спектральный анализ полученного материала в диапазоне 300-800 нм с шагом 5 нм. Отмечено наличие максимума со слабой интенсивностью в диапазоне 510-530 нм, отсутствующего в составе спектра хитозана, что подтверждает наличие координационной связи Au-ХТЗ.
Пример 3
0,100 г хитозана (ММ 2-8 кДа, СДА 90,5%) растворили в 20 мл 2% водной уксусной кислоты. 63 мл коллоидного раствора золота (концентрация 0,24 мг/мл, размер частиц ~ 1 нм) - масса коллоидного (диспергированного) компонента 14,5 мг смешивали с раствором хитозана при 20-22°С в течение 60 минут и термостатировании при перемешивании и 65°С в течение 120 минут. Получен однородный практически бесцветный раствор.
Образовавшийся комплекс хитозана с коллоидным золотом выделяли из полученного раствора путем вакуумирования при 40-45°С (~0,9 атм) до образования гелеобразного остатка, который экстрагировали 80% водным этанолом при 10-15°С в целях удаления примесей низкомолекулярных соединений - продукт высушивали в вакууме (~0,95 атм, 50°С). Концентрацию металла в составе комплекса определяли известным методом «мокрого сжигания», включающего обработку точной навески вещества смесью концентрированной HClO4 и HNO3 (3:5) при 300°С, отмывку, сушку и определение массы остатка. Найдено содержание Au в составе комплекса - 20,9%. Расчетное массовое содержание диспергированной фазы хемосорбированной хитозаном - 23,8%.
Комплекс хитозана, полученный обработкой полимера коллоидным золотом, сформировали в виде пленки из водного раствора. Проведен спектральный анализ полученного материала в диапазоне 300-800 нм с шагом 5 нм. Отмечено наличие максимума со слабой интенсивностью в диапазоне 510-530 нм, отсутствующего в составе спектра хитозана, что подтверждает наличие координационной связи Au-ХТЗ.
Пример 4
1. 0,04 г олигохитозана со степенью полимеризации 9-10, MM 1,5-1,6 кДа (СДА 94%) растворили в 5 мл дистиллированной воды при 20-25°С. 35 мл раствора коллоидного золота (концентрация 0,24 мг/мл; размер частиц ≈1 нм) с массой диспергированного компонента 8,4 мг смешивали с раствором олигохитозана при 20-22°С в течение 60 минут. Раствор термостатировали при перемешивании и 65-70°С в течение 120 минут. Фильтрат раствора - бесцветная, однородная жидкость - после термической стерилизации был использован для биологических испытаний.
2. 0,042 г олигохитозана со степенью полимеризации 9-10, MM 1,5-1,6 кДа (СДА 94%) растворили в 5 мл дистиллированной воды при 20-25°С. 24 мл коллоидного раствора золота (концентрация 0,24 мг/мл; размер частиц ≈1 нм) с массой диспергированного компонента 5,8 мг смешивали с раствором олигохитозана при 20-22°С в течение 60 минут. Раствор термостатировали при перемешивании и 65-70°С в течение 120 минут. Фильтрат раствора - бесцветная, однородная жидкость - после термической стерилизации был использован для биологических испытаний.
3. 0,100 г олигохитозана со степенью полимеризации 9-10, MM 1,5-1,6 кДа (СДА 94%) растворили в 10 мл дистиллированной воды при 20-25°С. 63 мл коллоидного раствора золота (концентрация 0,24 мг/мл; размер частиц ≈1 нм) с массой диспергированного компонента 14,5 мг смешивали с раствором олигохитозана при 20-22°С в течение 60 минут. Раствор термостатировали при перемешивании и 65-70°С в течение 120 минут. Фильтрат раствора - бесцветная, однородная жидкость - после термической стерилизации был использован для биологических испытаний.
Проведено определение концентрации металла в составе комплексов по методике Примера 1. Получены практически идентичные результаты. Исследование спектров комплекса олигохитозана, полученного путем взаимодействия с коллоидным золотом показывают наличие в диапазоне 300-800 нм наличие характеристического максимума - 510-530 нм (отмечено в Примере 1).
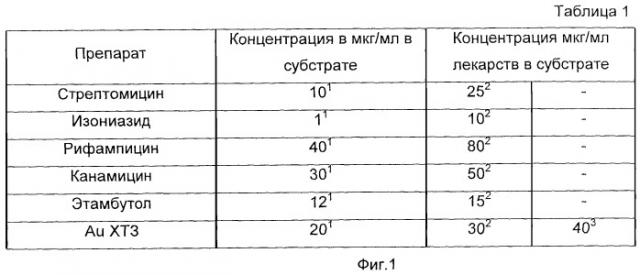
На фиг.1 представлена таблица 1, содержащая концентрации препаратов, используемые при определении лекарственной чувствительности микобактерий;
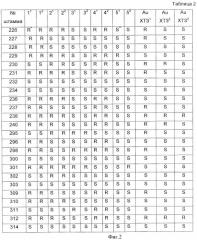
на фиг.2 - таблица 2, содержащая результаты исследования лекарственной чувствительности противотуберкулезных препаратов и Au ХТЗ к МБТ (R* - устойчивый, S** - чувствительный; 1 - стрептомицин, 2 - изониазид, 3 - канамицин, 4 - рифампицин, 5 - этамбутол);
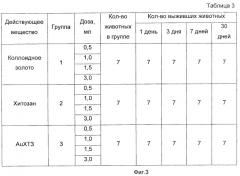
на фиг.3 - таблица 3, содержащая результаты изучения острой токсичности коллоидного золота, хитозана и АuХТЗ 9 (1 мл коллоидного золота содержит 2 мг Au; 1 мл раствора хитозана содержит 10 мг полимера; 1 мл раствора АuХТЗ содержит 12 мг комплекса).
Определение степени устойчивости МБТ, в том числе штаммов с МЛУ к действию противотуберкулезных лекарств и предлагаемого фармакологического средства.
Для биологических исследований предлагаемое фармакологическое средство представлялось в виде стерильных водных растворов.
Определение спектра и степени устойчивости микобактерий к противотуберкулезным препаратам имеет важное значение для тактики химиотерапии больных, контроля за эффективностью лечения, определения прогноза заболевания. Степень лекарственной устойчивости микобактерий определяется в соответствии с установленными критериями, которые зависят как от противотуберкулезной активности лекарственного препарата, так и его концентрации в очаге поражения, величины максимальной терапевтической дозы, фармакокинетики препарата и многих других факторов.
Для установления резистентности микобактерий к исследуемым препаратам выполняли определение лекарственной устойчивости методом абсолютных концентраций на плотной питательной среде Левинштейна-Йенсона.
Чувствительность микобактерий к препаратам определяли неспособностью штамма расти на среде, содержащей препарат, при стандартных условиях постановки опыта. Чувствительными к данному препарату считаются те штаммы, на которые этот препарат в критической концентрации оказывает бактерицидное или бактериостатическое действие в соответствии с принятым критерием устойчивости. Резистентность определяется как снижение чувствительности до такой степени, что данный штамм МБТ способен размножаться при воздействии на него препарата в критической или более высокой концентрации.
Для определения резистентности МБТ к препаратам, указанным в таблице 1, произвели постановку лекарственной чувствительности к двадцати четырем штаммам МБТ, полученным от больных с различными сроками лечения.
Показатели таблицы 2 позволяют сделать следующие выводы:
- штаммов МБТ, резистентных к АuХТЗ (16,7%), эффективность подавления роста микобактерий у АuХТЗ составляет 83,3%;
- штаммов с МЛУ, резистентных одновременно к стрептомицину, изониазиду и рифампицину - 5 (20,1%), из них чувствительных к АuХТЗ - 4 (80% от 5);
- штаммов с МЛУ, резистентных одновременно к изониазиду и рифампицину 6 (25%), из них чувствительных к АuХТЗ - 4 (66,6% от 6);
- штаммов, резистентных одновременно к стрептомицину и изониазиду 7 (28,2%), из них чувствительных к АuХТЗ - 6 (85,7%);
- штаммов, резистентных одновременно к стрептомицину и рифампицину 11 (45,8%), из них чувствительных к АuХТЗ - 8 (82,7% от 11);
- штаммов, резистентных к стрептомицину 15 (62,5%), из них чувствительных к АuХТЗ - 12 (80% от 15);
- штаммов, резистентных к изониазиду 10 (41,7%), из них чувствительных к АuХТЗ - 8 (80% от 10);
- штаммов, проявляющих резистентность к тем или иным противотуберкулезным препаратам 19 (79,2%), из них чувствительных к АuХТЗ - 15 (78,9% от 19);
- штаммов, чувствительных к тем или иным противотуберкулезным препаратам 14 (58,3%), штаммов, чувствительных к АuХТЗ - 20 (83,3%), эффективность подавления роста микобактерий у АuХТЗ выше на 20%.
Анализ полученных данных при исследовании лекарственной устойчивости штаммов МБТ позволяет сделать следующие выводы.
Предлагаемое новое фармакологическое средство обладает высокой туберкулостатической активностью в отношении моно- и полирезистентных штаммов МБТ, проявляющих устойчивость к известным противотуберкулезным лекарственным препаратам.
Исследование «острой токсичности» нового фармакологического средства.
Объектом исследования были 63 беспородные белые мыши (самцы) массой 18-25 г. Водные растворы исследуемых субстанций - коллоидного золота, хитозана и АuХТЗ - вводились перорально металлическим зондом, однократно, дважды и трижды через каждые 6 часов в течение 24 часов. Кормление животных прекращалось за 12 часов до эксперимента. Продолжительность наблюдения составляла 30 дней. Животные были разбиты на 3 группы.
В первой группе субстанция коллоидного золота вводилась однократно, дважды и трижды.
Во второй группе хитозан вводился в виде раствора однократно, дважды и трижды.
В третьей группе АuХТЗ вводился однократно, дважды и трижды.
При изучении острой токсичности за животными наблюдали в течение 2 часов непрерывно, а затем ежедневно. Обращали внимание на питьевой режим, на кормление и поведение животных. Результаты исследования представлены в таблице 3.
Наблюдения за поведением животных, питьевым режимом и кормлением показали, что поведение животных в группе хитозан + золото не отличается от групп, получавших коллоидное золото и хитозан.
В результате проведенных исследований установлено, что однократное и многократное введение раствора хитозана, коллоидного золота и раствора комплекса хитозана + золото в объеме от 0,5 мл до 3,0 мл не вызывает изменения поведения животных, ухудшения состояния и их гибели в течение 30 суток.
Пероральное введение исследуемых субстанций в объеме 0,5 мл и дробно в объеме 1,0, 1,5, 3,0 мл беспородным мышам в желудок не вызывает гибели животных в течение 30 суток и не влияет на питьевой режим, режим кормления и поведения животных.
Фармакологическое средство, обладающее противотуберкулезной активностью в отношении лекарственно устойчивых микобактерий туберкулеза, представляющее собой полимерный комплекс хитозана с коллоидным золотом, содержащий в своей структуре от 8 до 21 мас.% золота с размером частиц около 1 нм.