Двухслойная композиция для непрерывного высвобождения ацетаминофена и трамадола
Иллюстрации
Показать всеНастоящее изобретение связано с двухслойной композицией для доставки ацетаминофена и трамадола в течение по меньшей мере двенадцатичасового периода после первоначального введения. Первый слой определяет быстрое высвобождение части композиции и содержит ацетаминофен. Второй слой определяет непрерывное высвобождение части композиции и содержит ацетаминофен, трамадол и поперечно сшитый высокоамилозный крахмал. Одноразовое введение двухслойной композиции может обеспечить обезболивающий эффект в интервале, начиная приблизительно от получаса и примерно до одного часа после введения, с продолжительностью, составляющей по меньшей мере двенадцать часов после первоначального введения. Двухслойные композиции по изобретению могут быть использованы для обеспечения как быстроты, так и непрерывности обезболивающего действия нуждающемуся в этом пациенту. 5 н. и 19 з.п. ф-лы, 10 ил., 5 табл., 5 пр.
Реферат
Ссылка на родственные заявки
Настоящая заявка претендует на право на защиту и на приоритет по патентной заявке США с серийным № 60/980203, поданной 16 октября 2007 года, которая в полном объеме включена в настоящее описание в виде ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом связано с композициями, содержащими трамадол и ацетаминофен, а более конкретно с двухслойной композицией для контролируемого высвобождения трамадола и ацетаминофена.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ацетаминофен и трамадол являются широко используемыми аналгетиками, и обычно их на протяжении уже целого ряда лет используют либо отдельно, либо в сочетании друг с другом. Композиция в виде таблетки с немедленным высвобождением, содержащая трамадол и ацетаминофен, а также ее применение описаны, например, в патенте США № 5336691, который был переиздан как патент США № RE39221. Композиции с немедленным высвобождением являются коммерчески доступными под торговым названием Ultracet(R), и взрослым их обычно вводят в четыре-шесть часов раз. Ultracet(R) в течение многих лет успешно используется для контролирования острой боли.
Тем не менее, существует потребность в производстве композиций с непрерывным высвобождением, содержащих оба этих препарата, трамадол и ацетаминофен, для более эффективного облегчения боли, а также для большего удобства пациентов и для улучшения качества их жизни. Подразумевается, что непрерывное высвобождение веществ обеспечит комфорт пациенту, поскольку ему не придется помнить о том, что нужно принять лекарство, и затем принимать его в виде многократных доз в течение двенадцатичасового периода. Это даст еще и то дополнительное преимущество, что поможет избежать перерыва в обезболивании, который может наступить, если пропустить повторный прием композиции с немедленным высвобождением или если принять ее несвоевременно. Кроме того, считается, что препараты длительного высвобождения будут способствовать улучшению качества жизни в связи с тем, что в целом они уменьшают колебания концентрации высвобождаемых веществ в плазме, потенциально обеспечивая более состоятельное обезболивание.
Обычно, поскольку ацетаминофен является слабым лекарственным средством, требующим введения больших доз для эффективного и пролонгированного обезболивания, а также поскольку дистальные области желудочно-кишечного тракта, такие как толстый кишечник, имеют малую площадь поверхности всасывания по сравнению с проксимальным тонким кишечником, считается, что трудно введением ацетаминофена в однократной дозе добиться уровня концентраций в плазме, достаточно высоких для непрерывного более чем восьмичасового периода обезболивания. Целый ряд композиций с непрерывным высвобождением для доставки комбинации ацетаминофена и трамадола описан, например, в патенте США № 7374781 и патентной заявке США № US 2003/0092724 A1. Однако на сегодняшний день нет ни одной композиции с непрерывным высвобождением, содержащей и трамадол, и ацетаминофен, которая была бы одобрена в США или в Европе.
В результате по-прежнему существует потребность в композициях с непрерывным высвобождением, которые позволили бы в течение длительного промежутка времени, например по меньшей мере приблизительно в течение двенадцати часов, осуществлять доставку ацетаминофена и трамадола для обеспечения обезболивания в течение указанного периода.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение связано с двухслойной композицией для доставки трамадола и ацетаминофена по меньшей мере в течение двенадцати часов после его введения. Введение такой композиции обеспечивает быстрое начало обезболивания, например приблизительно от получаса приблизительно до одного часа после введения, и продолжительность обезболивания, составляющую по меньшей мере приблизительно двенадцати часов после введения. Считается, что такие композиции высвобождают ацетаминофен и трамадол таким образом, что оба этих активных ингредиента способны действовать in vivo синергически, обеспечивая более чем двенадцатичасовое обезболивание.
В одном из аспектов настоящее изобретение связано с двухслойной композицией для высвобождения ацетаминофена и трамадола. Двухслойная композиция содержит первый слой, обеспечивающий быстрое высвобождение части (порции), которая содержит ацетаминофен. Двухслойная композиция содержит также второй слой, прилегающий к первому слою, определяющий непрерывное высвобождение порции, которая содержит ацетаминофен и трамадол в качестве активных ингредиентов, а также поперечно сшитый высокоамилозный крахмал в качестве инертного наполнителя, способствующего контролируемому высвобождению. Указанные композиции имеют такую кинетику высвобождения in vitro, что при их тестировании в аппарате U.S.P. типа III в режиме 20 обмакиваний в минуту при 37°C в раствор 250 мл одноосновного фосфата калия, pH 6,8, в течение одного часа, а затем, после удаления раствора и замены его 250 мл свежего раствора одноосновного фосфата калия, pH 6,8, еще в течение одиннадцати часов, кинетика высвобождения ацетаминофена и трамадола будет такова, как приведено в Таблице 1.
| Таблица 1 | ||
| Время (часы) | Ацетаминофен, % высвобождения (по весу) | Трамадол, % высвобождения (по весу) |
| 1 | 30-60 | ≤35 |
| 4 | 60-90 | 45-65 |
| 8 | 80-90 | ≤90 |
| 12 | ≥90 | ≤90 |
В одном из воплощений первый слой содержит приблизительно от 70% приблизительно до 90% вес/вес ацетаминофена, тогда как второй слой содержит приблизительно от 40% приблизительно до 60% вес/вес ацетаминофена и приблизительно от 5% приблизительно до 15% вес/вес трамадола.
В другом аспекте изобретение связано с двухслойной композицией для доставки трамадола и ацетаминофена. Двухслойная композиция содержит первый слой, определяющий быстрое высвобождение порции композиции, которая содержит ацетаминофен. Двухслойная композиция содержит также второй слой, определяющий непрерывное высвобождение порции композиции, которая содержит ацетаминофен, трамадол и поперечно сшитый высокоамилозный крахмал. Из двухслойной композиции, при введении ее млекопитающему (например, человеку), высвобождается ацетаминофен и трамадол таким образом, что отношение по весу ацетаминофен:трамадол в плазме млекопитающего составляет по меньшей мере 6:1 по меньшей мере в течение 12 часов после первого введения млекопитающему.
Двухслойные композиции согласно изобретению, при их введении млекопитающему, например, человеку, в виде однократной болюсной дозы могут вызывать начало обезболивания приблизительно от получаса приблизительно до одного часа после их проглатывания, и такое обезболивание длится по меньшей мере в течение двенадцати часов после проглатывания. Соответственно, композиции согласно изобретению могут быть использованы для обеспечения как быстроты, так и непрерывности обезболивающего действия нуждающемуся в этом пациенту.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Настоящее изобретение проиллюстрировано прилагаемыми здесь фигурами, не предназначенными для его ограничения, при этом:
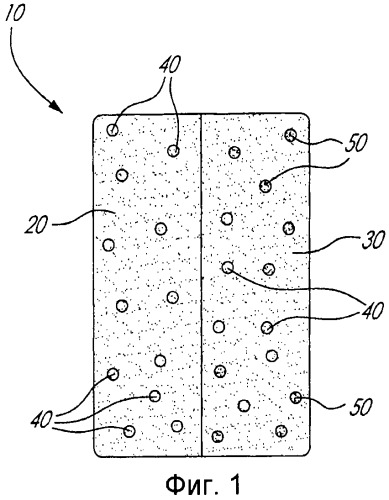
Фиг.1 является схематическим представлением типичной двухслойной композиции согласно изобретению;
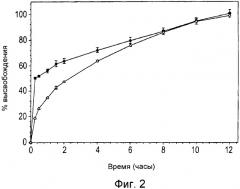
Фиг.2 является графиком, иллюстрирующим профиль деструктивного растворения in vitro типичной интактной двухслойной композиции (композиция 1 в примере 1), демонстрирующий выделение ацетаминофена (•) или трамадола (Δ) в течение 12-часового периода, полученный с помощью аппарата U.S.P. типа III;
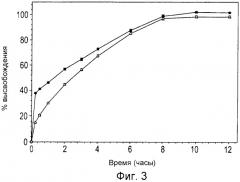
Фиг.3 является графиком, иллюстрирующим профиль деструктивного растворения in vitro типичной интактной двухслойной композиции (композиция 2 в примере 1), демонстрирующий выделение ацетаминофена (•) или трамадола (Δ) в течение 12-часового периода, полученный с помощью аппарата U.S.P. типа III;
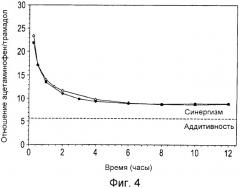
Фиг.4 является графиком, на котором показано отношение ацетаминофена к трамадолу, которые высвобождаются из композиции 1 примера 1 (-Δ-) или из композиции 2 примера 2 (-•-), как функция от времени, полученное с помощью аппарата U.S.P. типа III. Пунктирной линией показано отношение ацетаминофена к трамадолу (приблизительно 5,7:1 на основе предклинических исследований), выше которого, как полагают, эффекты активных ингредиентов должны быть синергическими, а ниже которого эффекты активных ингредиентов, как считается, должны быть аддитивными;
Фиг.5A-5C представляют собой графики, иллюстрирующие средние (±SD) концентрации в плазме трамадола in vivo (Фиг.5A), O-десметилтрамадола (М1) (Фиг.5B) и ацетаминофена (APAP) (Фиг.5C) после одноразовой двухтаблеточной дозы композиции 1 (каждая таблетка содержит 75 мг трамадола и 650 мг ацетаминофена) в условиях воздержания от приема пищи;
Фиг.6A-6C представляют собой графики, иллюстрирующие средние (±SD) концентрации в плазме трамадола in vivo (Фиг.6A), O-десметилтрамадола (М1) (Фиг.6B) и ацетаминофена (APAP) (Фиг.6C) после либо (i) одноразовой двухтаблеточной дозы композиции 1 (каждая таблетка содержит 75 мг трамадола и 650 мг ацетаминофена) в условиях воздержания от приема пищи (•), либо (ii) двухразовой двухтаблеточной дозы таблеток Ultracet(R) (каждая таблетка содержит 37,5 мг трамадола HCl и 325 мг ацетаминофена), где каждую последующую дозу вводят с интервалом в 6 часов (▲), в условиях воздержания от приема пищи;
Фиг.7A-7C представляют собой графики, иллюстрирующие средние (±SD) концентрации в плазме трамадола in vivo (Фиг.7A), O-десметилтрамадола (М1) (Фиг.7B) и ацетаминофена (APAP) (Фиг.7C) после одноразовой двухтаблеточной дозы композиции 2 (каждая таблетка содержит 75 мг трамадола и 650 мг ацетаминофена) в условиях воздержания от приема пищи;
Фиг.8A-8C представляют собой графики, иллюстрирующие средние (±SD) концентрации в плазме трамадола in vivo (Фиг.8A), O-десметилтрамадола (М1) (Фиг.8B) и ацетаминофена (APAP) (Фиг.8C) после либо (i) одноразовой двухтаблеточной дозы композиции 2 (каждая таблетка содержит 75 мг трамадола и 650 мг ацетаминофена) в условиях воздержания от приема пищи (•), либо (ii) двухразовой двухтаблеточной дозы таблеток Ultracet(R) (каждая таблетка содержит 37,5 мг трамадола HCl и 325 мг ацетаминофена), где каждую последующую дозу вводят с интервалом в 6 часов (▲), в условиях воздержания от приема пищи;
Фиг.9 является графиком, на котором показано весовое отношение ацетаминофен:трамадол в плазме после введения композиции 1 (-♦-) или композиции 2 (-■-) как функция от времени после введения; и
Фиг.10A-10B представляют собой графики, иллюстрирующие высвобождение ацетаминофена (Фиг.10A) или трамадола (Фиг.10B) из композиции 2 примера 1, полученное с помощью аппарата U.S.P. типа III, где кинетика высвобождения активного ингредиента из интактных таблеток обозначена как -*-, а кинетика высвобождения активного ингредиента из половины таблеток, полученной путем разламывания интактных таблеток пополам, обозначена как -▲-.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение отчасти основано на открытии того, что можно получить композицию, которая позволит осуществить независимое высвобождение трамадола и ацетаминофена из единой лекарственной формы в течение 12-часового периода, с тем, чтобы осуществлять обезболивание в течение полного указанного 12-часового периода. В частности, композиция создана с учетом того, чтобы обеспечить терапевтически эффективную концентрацию ацетаминофена в плазме в интервале, начиная приблизительно от получаса и приблизительно до одного часа после введения, после чего одновременное высвобождение трамадола и оставшегося количества ацетаминофена обеспечивает концентрации каждого из указанных активных средств в плазме, достаточные для достижения синергического обезболивающего эффекта, а следовательно, и продолжительного эффективного обезболивания в течение по меньшей мере двенадцати часов. Таким образом, после начального быстрого высвобождения ацетаминофена, приблизительно достаточного для инициации процесса обезболивания, из композиции высвобождаются трамадол и ацетаминофен вместе, но с разными скоростями, так, чтобы были достигнуты приемлемые для синергического эффекта in vivo скорости абсорбции в кишечнике и последующие уровни в плазме и, следовательно, чтобы был обеспечен эффект обезболивания на протяжении всего двенадцатичасового периода. Насколько известно авторам настоящего изобретения, никому до настоящего времени не удавалось создать композицию в виде однократной лекарственной формы, содержащей ацетаминофен и трамадол, в которой достигались бы подходящие для данного случая высвобождение и кинетика абсорбции, с тем, чтобы облегчить быстрое, но в то же время непрерывное обезболивание на протяжении двенадцати часов, в связи с тем, что такая лекарственная форма должна пройти через желудок пациента, через верхние отделы желудочно-кишечного тракта и нижние отделы желудочно-кишечного тракта.
На Фиг.1 схематически представлена типичная двухслойная композиция согласно изобретению. В частности, как показано на Фиг.1, двухслойная композиция 10 содержит быстро высвобождающийся слой 20 и слой замедленного высвобождения 30. Слой быстрого высвобождения 20 содержит ацетаминофен 40. Слой непрерывного высвобождения 30 содержит как ацетаминофен 40, так и трамадол 50 в наполнителе, осуществляющем контроль высвобождения, таком, например, как поперечно сшитый высокоамилозный крахмал. Следует, однако, иметь в виду, что для определенных композиций слой с быстрым высвобождением 20 также может включать в себя определенное количество трамадола 50.
В одном из аспектов двухслойная композиция содержит первый слой, определяющий быстрое высвобождение порции, которая содержит ацетаминофен. Двухслойная композиция содержит также второй слой, прилегающий к первому и определяющий непрерывное высвобождение порции, которая содержит ацетаминофен и трамадол в качестве активных ингредиентов и поперечно сшитый высокоамилозный крахмал в качестве наполнителя, осуществляющего контролируемое высвобождение. Указанные композиции имеют такую кинетику высвобождения in vitro, что при их тестировании в аппарате U.S.P. типа III в режиме 20 обмакиваний в минуту при 37°C в раствор 250 мл одноосновного фосфата калия, pH 6,8, в течение одного часа, а затем, после удаления раствора и замены его 250 мл свежего раствора одноосновного фосфата калия, pH 6,8, еще в течение одиннадцати часов, кинетика высвобождения ацетаминофена и трамадола будет такова, как показано в Таблице 1.
Двухслойные композиции согласно изобретению содержат первый слой, определяющий быстрое высвобождение порции (например, посредством матрицы немедленного высвобождения), в которой по меньшей мере 50% (необязательно по меньшей мере 60% или 70%) по весу ацетаминофена в порции быстрого высвобождения высвобождается в течение 30 минут согласно измерениям, производимым в аппарате U.S.P. типа III в указанных выше условиях. Кроме того, двухслойные композиции содержат второй слой, определяющий непрерывное высвобождение порции (например, посредством матрицы контролируемого высвобождения), в которой по меньшей мере 50% (необязательно по меньшей мере 40% или 30%) по весу ацетаминофена в порции контролируемого высвобождения высвобождается в течение 30 минут согласно измерениям, производимым в аппарате U.S.P. типа III в указанных выше условиях. Разумеется, кинетика высвобождения может быть измерена на интактной двухслойной таблетке, например, путем нахождения оригинала функции обсуждаемых профилей высвобождения, например в примере 1, или путем измерения высвобождения меченого (например, радиоактивно меченного или флуоресцентно меченного) ацетаминофена. Альтернативно, кинетика высвобождения каждого слоя может быть измерена отдельно. Например, кинетика высвобождения может быть измерена для композиции, которая содержит такую же самую композицию, что и порция быстрого высвобождения, а затем, в отдельном эксперименте, для композиции, которая содержит такую же самую композицию, что и порция замедленного высвобождения.
Кроме того, при введении млекопитающему, например человеку в виде однократного болюса двухслойная композиция может позволить достичь (i) терапевтически эффективной концентрации ацетаминофена в плазме в интервале, начиная приблизительно от получаса и приблизительно до одного часа после первоначального введения, и (ii) терапевтически эффективных комбинированных концентраций трамадола и ацетаминофена в плазме приблизительно в течение по меньшей мере двенадцати часов после введения.
Термин "терапевтический эффект" известен в данной области и относится к локальному или системному эффекту у животных, в частности млекопитающих, а еще более конкретно у человека, вызванному фармакологически активным веществом. Фраза "терапевтически эффективное количество" означает такое количество указанного вещества, которое вызывает некий требуемый локальный или системный эффект с приемлемым соотношением благотворность/риск, применимым при любом лечении. Терапевтически эффективное количество такого вещества варьирует, в зависимости от конкретного субъекта и болезненного состояния, подлежащего лечению, веса и возраста больного, степени тяжести болезненного состояния, способа введения и прочего, что с легкостью может быть определено рядовым специалистом в данной области. Например, определенные композиции согласно изобретению могут быть введены в количествах, достаточных для достижения удовлетворительных концентраций в плазме, которых достаточно для получения приемлемых соотношений благотворность/риск, применимых при любом лечении.
В другом аспекте настоящего изобретения предложена двухслойная композиция для доставки трамадола и ацетаминофена. Указанная двухслойная композиция содержит первый слой, определяющий быстрое высвобождение части композиции, которая содержит ацетаминофен. Данная двухслойная композиция содержит второй слой, определяющий непрерывное высвобождение части (порции) композиции, которая содержит ацетаминофен, трамадол и поперечно сшитый высокоамилозный крахмал. При введении указанной двухслойной композиции млекопитающему (например, человеку) ацетаминофен и трамадол высвобождаются таким образом, что весовое отношение ацетаминофен:трамадол в плазме млекопитающего составляет более чем 5,7:1, предпочтительно, по меньшей мере 6:1, по меньшей мере в течение 12 часов после первоначального введения млекопитающему.
Разумеется, аналгезирующие свойства ацетаминофена и трамадола могут быть аддитивными (например, когда весовое отношение ацетаминофена к трамадолу составляет менее чем 5,7:1), тогда как в определенных других условиях аналгезирующие свойства ацетаминофена и трамадола могут быть синергическими (например, на основе предклинических данных, когда весовое отношение ацетаминофена к трамадолу составляет более чем 5,7:1). Из композиций согласно изобретению, как описано в примере 2 и проиллюстрировано на Фиг.4, более чем в течение 12 часов высвобождаются ацетаминофен и трамадол, которые способны синергично взаимодействовать друг с другом, обеспечивая эффект обезболивания в течение более чем двенадцатичасового периода. Например, из композиций согласно изобретению высвобождаются ацетаминофен и трамадол таким образом, что отношение высвобождения этих компонентов составляет в интервале приблизительно от 25:1 примерно до 8:1. Кроме того, как обсуждается в примере 4 и как показано на Фиг.9, концентрации в плазме ацетаминофена и трамадола являются таковыми, что весовое отношение ацетаминофен:трамадол в плазме млекопитающего составляет более чем приблизительно 6:1 по меньшей мере в течение 12 часов.
Из двухслойных композиций согласно изобретению высвобождаются ацетаминофен и трамадол таким образом, что в течение двенадцатичасового периода весовое отношение высвобождающихся ацетаминофена к трамадолу составляет по меньшей мере 6:1, по меньшей мере 7:1, по меньшей мере 8:1, по меньшей мере 9:1 или по меньшей мере 10:1. Следует иметь в виду, что в определенных воплощениях изобретения весовое соотношение высвобождаемых ацетаминофена и трамадола изменяется приблизительно от 25:1, если его измерять приблизительно в интервале от 30 минут до 1 часа после введения, а в дальнейшем постепенно уменьшается приблизительно до соотношения 8:1, в течение 12 часов, согласно измерениям, производимым в аппарате U.S.P. типа III. Нужно учесть, что в определенных воплощениях весовое соотношение ацетаминофена и трамадола в плазме изменяется приблизительно от 200:1 примерно в интервале от 30 минут до 1 часа после введения, в дальнейшем, в течение 12-часового периода, постепенно уменьшаясь приблизительно до соотношений от 6:1 до 10:1. В результате полагают, что количество ацетаминофена, высвобождаемого из двухслойной композиции, является достаточным для того, чтобы осуществлялось синергическое действие ацетаминофена и трамадола друг с другом в течение продолжительного периода, так, чтобы двухслойная композиция могла обеспечить быстрое ослабление боли, которое длилось бы непрерывно в течение 12 часов.
Как показано в примере 5, двухслойные композиции согласно изобретению могут быть разломаны или иным способом разделены на субъединицы, при этом каждая субъединица имеет, по существу, такие же свойства, связанные с высвобождением, что и интактная или неразделенная твердая лекарственная форма, из которой она была получена. Лекарственные формы могут быть рассечены, например разделены на две по существу равноценные части, или же они могут быть разделены на иное количество частей, например на три или четыре части. Лекарственные формы могут быть разделены на неравные части, например одна треть/две трети.
Профили деструктивного растворения in vitro интактных и разделенных двухслойных композиций, как здесь описано, можно сравнивать друг с другом с помощью факторов соответствия или других приемов математического сравнения. Такие факторы соответствия известны специалистам в данной области и используются для предсказаний биоэквивалентности различных лекарственных форм. Фактор соответствия f1 представляет собой относительную ошибку между двумя кривыми или, иными словами, среднюю относительную разницу по всем измеренным точкам. Иногда фактор соответствия f1 называют фактором различия. Средняя относительная разница для каждого образца, соответствующего каждой точке, должна составлять приблизительно от 0 приблизительно до 15% для соблюдения биоэквивалентности. В некоторых воплощениях композиции и/или рецептуры могут иметь факторы различия между интактной лекарственной формой и субъединицами интактной лекарственной формы, составляющие приблизительно менее чем 15%, приблизительно менее чем 10% или приблизительно менее чем 7%. Фактор соответствия f2 представляет собой логарифмическое преобразование средней относительной ошибки различий площадей между двумя кривыми. Фактор соответствия f2 иногда называют фактором подобия. Для соблюдения биоэквивалентности между субъединичными и интактными лекарственными формами фактор подобия должен, например, составлять приблизительно от 50 и примерно до 100. В некоторых воплощениях композиции и/или рецептуры могут иметь факторы подобия между интактной лекарственной формой и субъединицами, полученными из интактной лекарственной формы, составляющие по меньшей мере 50, по меньшей мере 55, по меньшей мере 60, по меньшей мере 65, по меньшей мере 70, по меньшей мере 75, по меньшей мере 80 и по меньшей мере 85.
Специфические дозировки для форм с непрерывным высвобождением могут быть специально рассчитаны с помощью описанных здесь лекарственных форм путем их разрушения (разламывания) для более низких, по существу, подобных этим, доз, имеющих по существу подобные профили высвобождения. Например, более низкие дозы могут быть использованы пациентами с малым весом тела и/или в педиатрической практике. Альтернативно, может быть предусмотрена одна дозировка, но в меньшей форме, которая может быть более приемлема для пациента. Например, пациенту может быть удобно разделить дозировку на более легкие для проглатывания компоненты, которые, однако, будут сохранять профили высвобождения исходной лекарственной формы. Возможность менять дозировку от пациента к пациенту на основе одной лекарственной формы может также представлять удобство, например, для лечащего врача или фармацевта.
В некоторых воплощениях лекарственные формы, например таблетки, могут быть снабжены рисками. Предпочтительно, чтобы таблетки с рисками или таблетки без рисок разламывались с большой точностью, с тем чтобы была уверенность в том, что они будут иметь одинаковые или пропорциональные профили высвобождения из каждой из образовавшихся частей. Точность разделения может быть определена, например, путем оценки однородности по массе разделенных, например, надвое частей одной и той же таблетки. Указанная однородность таблетки по массе может быть определена в терминах относительного стандартного отклонения (RSD) от средней массы разделенных таблеток с помощью теста U.S.P. на предельные условия испытания на однородность (test limit of uniformity) (RSD менее 6%). Нанесение рисок может производиться с разной глубиной, например, приблизительно от 0% (например, отсутствие рисок) приблизительно до 50% толщины таблетки. Каждая таблетка может иметь одну, две или несколько рисок, и/или нанесение рисок может производиться с одной или с обеих сторон таблетки.
В определенных воплощениях ацетаминофен может быть распределен между первым и вторым слоями, как описано в Таблице 2.
| Таблица 2 | |
| Процент от общего содержания ацетаминофена в двухслойной композиции, локализованного в первом слое | Процент от общего содержания ацетаминофена в двухслойной композиции, локализованного во втором слое |
| 10% | 90% |
| 15% | 85% |
| 20% | 80% |
| 25% | 75% |
| 30% | 70% |
| 35% | 65% |
| 40% | 60% |
| 45% | 55% |
| 50% | 50% |
| 55% | 45% |
| 60% | 40% |
| 65% | 35% |
| 70% | 30% |
Сходным образом, в определенных воплощениях трамадол может быть распределен между первым и вторым слоями, как описано в Таблице 3.
| Таблица 3 | |
| Процент от общего содержания трамадола в двухслойной композиции, локализованного в первом слое | Процент от общего содержания трамадола в двухслойной композиции, локализованного во втором слое |
| 0% | 100% |
| 5% | 95% |
| 10% | 90% |
| 15% | 85% |
| 20% | 80% |
| 25% | 75% |
| 30% | 70% |
| 35% | 65% |
| 40% | 60% |
| 45% | 55% |
| 50% | 50% |
В одном из воплощений первый слой (порция быстрого высвобождения) содержит приблизительно 30-40% от общего содержания ацетаминофена двухслойной композиции, а второй слой (порция непрерывного высвобождения) содержит 60-70% от общего содержания ацетаминофена в двухслойной композиции и 100% трамадола двухслойной композиции. В другом воплощении первый слой содержит приблизительно 40% от общего содержания ацетаминофена в двухслойной композиции, а второй слой содержит 60% от общего содержания ацетаминофена в двухслойной композиции и 100% трамадола двухслойной композиции. В другом воплощении первый слой содержит приблизительно 30% от общего содержания ацетаминофена в двухслойной композиции, а второй слой содержит приблизительно 70% от общего содержания ацетаминофена в двухслойной композиции и 100% трамадола двухслойной композиции.
При определенных обстоятельствах первый слой содержит приблизительно от 70% примерно до 90% вес/вес ацетаминофена. Второй слой содержит приблизительно от 40% примерно до 60% вес/вес ацетаминофена и приблизительно от 5% примерно до 15% вес/вес трамадола.
Поперечно сшитый высокоамилозный крахмал действует в качестве наполнителя, способствующего контролируемому высвобождению. В определенных воплощениях второй слой содержит приблизительно от 5% вес/вес примерно до 30% вес/вес поперечно сшитого высокоамилозного крахмала и более предпочтительно приблизительно от 10% вес/вес примерно до 20% вес/вес поперечно сшитого высокоамилозного крахмала. В определенных воплощениях второй слой содержит приблизительно 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24% или 25% вес/вес поперечно сшитого высокоамилозного крахмала.
В одном из воплощений поперечно сшитый высокоамилозный крахмал является поперечно связанным посредством хлорангидрида фосфорной кислоты и/или содержит гидроксипропиловые боковые цепи. Подходящий наполнитель разработан и коммерчески доступен в компании Labopharm, Inc., Laval, Canada, под торговым названием CONTRAMID(R). Синтез наполнителя CONTRAMID(R) описан, например, в патенте США № 6607748, в полном объеме, включенном в настоящее описание в виде ссылки для любых целей. Предусмотренные здесь композиции могут включать в себя поперечно сшитый высокоамилозный крахмал вместе с одним или более дополнительными наполнителями, способствующими контролируемому высвобождению, например гидроксипропилметилцеллюлозой.
Поперечное связывание высокоамилозного крахмала является эффективным способом модификации крахмала. Обычно гранулы крахмала поперечно сшивают для повышения резистентности состава к нагреванию или сдвигу. Такие химически поперечно сшитые крахмалы обеспечивают гладкую текстуру и сохраняют стабильную вязкость в процессе проведения операций по переработке и обладают нормальной устойчивостью при хранении. В некоторых воплощениях поперечно сшитый высокоамилозный крахмал, предусмотренный в настоящем изобретении, после поперечного сшивания может быть желатинирован. В предпочтительном воплощении поперечно сшитый высокоамилозный крахмал может включать в себя дополнительную химическую модификацию (например, гидроксипропилирование) перед желатинированием.
Поперечное связывание высокоамилозного крахмала может быть выполнено в соответствии со способами, описанными в данной области. Например, поперечное связывание амилозы может быть выполнено способом, описанным Mateescu (BIOCHEMIE 60: 535-537 (1978)), путем включения амилозы в реакцию с эпихлоргидрином в щелочной среде. Точно так же крахмал может быть также поперечно сшит посредством реагента, выбранного из группы, состоящей из эпихлоргидрина, ангидрида адипиновой кислоты, триметафосфата натрия и хлорокиси фосфора или других перекрестносшивающих агентов, включая, но не ограничиваясь перечисленным, 2,3-дибромпропанол, неразветвленные смешанные ангидриды уксусной и двух- или трехосновных карбоновых кислот, винилсульфон, диэпоксиды, хлорангидрид циануровой кислоты, гексагидро-1,3,5-трис-акрилоил-s-триазин, гексаметилен-диизоцианат, толуол-2,4'-диизоцианат, N,N'-метилен-бис-акриламид, N,N'-бис(гидроксиметил) этиленмочевина, смешанных ангидридов углекислоты-карбоновой кислоты, имидазолидов угольной и полиосновных карбоновых кислот, имидазолидов солей полиосновных карбоновых кислот и гуанидиновых производных поликарбоновых кислот. Используемые условия реакции будут варьировать в зависимости от типа и количества используемого перекрестносшивающего агента, а также от исходной концентрации, количества и типа крахмала.
Считается, что крахмалы, содержащие приблизительно более чем 40% вес/вес амилозы, могут быть использованы для образования поперечно сшитого высокоамилозного крахмала, например крахмала гороха и мозгового гороха, крахмала бобовых, крахмала гибридных или генетически модифицированных тапиоки или картофеля или же крахмала из любого другого корнеплода, клубнеплода или злака. Предпочтительно, чтобы в качестве исходного материала был использован высокоамилозный крахмал, содержащий приблизительно 70% вес/вес амилозы. Например, может быть использован высокоамилозный крахмал Cerestar AmyloGel 03003 (Cerestar U.S.A. Inc.). В определенных воплощениях наполнитель содержит поперечно сшитый высокоамилозный крахмал, содержащий приблизительно от 65% и примерно до 75% вес/вес амилозы, поперечно сшитой оксихлоридом фосфора.
В других определенных воплощениях второй слой необязательно содержит гидроксипропилметилцеллюлозу для усиления свойств, связанных с замедленным высвобождением во втором слое. В определенных воплощениях второй слой содержит приблизительно от 5% вес/вес и примерно до 20% вес/вес гидроксипропилметилцеллюлозы. В определенных воплощениях второй слой содержит 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14% или 15% вес/вес гидроксипропилметилцеллюлозы.
В определенных воплощениях первый слой необязательно дополнительно содержит один или более гранулирующих агентов, наполнитель, разрыхлитель, смазывающее вещество и вещество, способствующее скольжению. Помимо этого в определенных воплощениях второй слой необязательно дополнительно содержит один или более гранулирующих агентов, наполнитель, связующее вещество, смазывающее вещество и вещество, способствующее скольжению.
Типичные для применения в первом слое и/или во втором слое гранулирующие агенты могут быть выбраны из группы, состоящей из коповидона и крахмала. Крахмал, однако, является предпочтительным. Типичные для применения в первом слое и/или во втором слое наполнители могут быть выбраны из группы, состоящей из лиофилизированной лактозы, прежелатинированного крахмала, декстрина, мальтозы и микрокристаллической целлюлозы. Однако предпочтительной является микрокристаллическая целлюлоза. Типичные для применения в первом слое и/или во втором слое смазывающие вещества могут быть выбраны из группы, состоящей из стеарилфумарата натрия, стеарата магния, стеарата кальция, стеариновой кислоты, гидрогенизированных овощных масел и пр. Однако предпочтительным является стеарилфумарат натрия. Типичные для применения в первом слое и/или во втором слое вещества, способствующие скольжению, могут быть выбраны из группы, состоящей из коллоидной двуокиси кремния, талька и пр. Однако предпочтительной является коллоидная двуокись кремния. Типичные для применения в первом слое разрыхлители могут быть выбраны из группы, состоящей из кросповидона, натрия гликолят крахмала, альгината натрия и кроскармелозы натрия. Однако предпочтительной является кроскармелоза натрия. Типичные для применения во втором слое связующие вещества могут быть выбраны из группы, состоящей из полиэтиленоксида, метилцеллюлозы, гидропропилцеллюлозы, гидроксиэтилцеллюлозы, поликарбофила и коповидона. Однако предпочтительным является коповидон. Само собой разумеется, что и другие добавки, хорошо известные специалистам в данной области, могут, конечно, быть включены в состав двухслойной композиции согласно изобретению в пределах заявленного здесь объема изобретения и в рамках концепции настоящего изобретения.
В одном из воплощений первый и второй слои имеют следующие составы. Первый слой (слой быстрого высвобождения) содержит приблизительно от 70% примерно до 90% вес/вес ацетаминофена, приблизительно от 5% примерно до 15% вес/вес крахмала, приблизительно от 1% примерно до 4% вес/вес микрокристаллической целлюлозы, приблизительно от 1% примерно до 3% вес/вес кроскармелозы натрия, приблизительно от 0,5% примерно до 2% вес/вес стеарилфумарата натрия и приблизительно от 0,1% примерно до 1% вес/вес коллоидной двуокиси кремния. Второй слой (слой с непрерывным высвобождением) содержит приблизительно от 40% примерно до 60% вес/вес ацетаминофена, приблизительно от 5% примерно до 15% вес/вес трамадола, приблизительно от 5% примерно до 10% вес/вес крахмала, приблизительно от 1% примерно до 6% вес/вес микрокристаллической целлюлозы, приблизительно от 5% примерно до 25% поперечно сшитого высокоамилозного крахмала, приблизительно от 5% примерно до 15% вес/вес гидропропилметилцеллюлозы, приблизительно от 0% примерно до 5% вес/вес коповидона, приблизительно от 0,5% примерно до 2% вес/вес стеарилфумарата натрия и приблизительно от 0,1% примерно до 1% вес/вес коллоидной двуокиси кремния.
Разумеется, двухслойная композиция согласно изобретению может иметь разную конфигурацию и быть представлена в виде различных лекарственных форм, например, в виде таблеток, капсул или овоида, а также может быть покрыта или не покрыта оболочкой. Предпочтительными, однако, являются таблетки.
Типичной методикой для получения композиции двухслойных таблеток согласно изобретению является следующая. Комп