N-оксидные и/или ди-n-оксидные производные стабилизаторов/модуляторов рецепторов дофамина, проявляющие улучшенные профили сердечно-сосудистых побочных эффектов
Иллюстрации
Показать всеИзобретение относится к N-оксидным и/или ди-N-оксидным производным стабилизаторов/модуляторов рецепторов дофамина, имеющим формулу (2) - (см. в описании), и к фармацевтическим препаратам, содержащим указанные соединения. Кроме того, изобретение относится к применению указанных соединений для лечения расстройства центральной нервной системы и, в частности, для лечения расстройств, опосредованных дофамином, таких как, например, двигательные расстройства, психозы, тревожные расстройства, нарушения развития нервов, расстройства сна и расстройства, связанные с веществами. 3 н. и 6 з.п. ф-лы, 2 ил.
Реферат
Предшествующий уровень техники
Область изобретения
Данное изобретение относится к N-оксидным и/или ди-N-оксидным производным "стабилизаторов/модуляторов рецептора дофамина" (примерами стабилизаторов являются OSU6162 и ACR16), обладающим улучшенным терапевтическим потенциалом, улучшенной пероральной биодоступностью, улучшенным профилем побочных эффектов, в частности, в отношении снижения риска провокации удлинения QT интервала и за счет этого также снижения риска возникновения двунаправленной желудочковой тахикардии, и более длительным действием, а также к фармацевтическим композициям, содержащим эти соединения и подходящие фармацевтические носители, к способам лечения неврологических и/или психиатрических заболеваний у млекопитающего с применением этих лекарственных средств и к способам изготовления лекарственных средств.
Предшествующий уровень техники, относящийся к N-оксидам/ди-N-оксидам
N-оксиды некоторых производных морфинана известны в предшествующем уровне техники, например в Tiffany, патент США №2813097, раскрыт 3-гидрокси-N-метилморфинан-N-оксид и его полезность в качестве анальгетика. В Tiffany, патент США №2813098, раскрыт 3-метокси-N-метилморфинана N-оксид и его полезность в качестве противокашлевого средства. Хотя установлено, что эти N-оксиды обладают более высоким терапевтическим индексом, чем соответствующие третичные амины, не предполагается, что N-оксид 3-гидрокси-N-метилморфинана может обладать улучшенной пероральной биодоступностью по сравнению с исходным соединением.
В Bartels-Keith, патент США №3299072, раскрыты производные тебаина. Эти соединения обладают анальгетической активностью и/или активностью наркотических антагонистов. В этом документе заявлены третичные амины, N-оксиды и различные соли установленной формулы без какого-либо дифференцирования N-оксидов. Отсутствует упоминание о пути введения.
Описаны N-оксидные производные других неморфинановых анальгетиков. W.Graf, патент Швеции №481124.
K.Orzechowska, Arch. Immunol. Ther. Exp.15(2), 290 (1967), и В. Bobranski and J.Pomorski, Arch. Immunol. Ther. Exp.14(1), 121 (1966) сообщают о получении N-оксидов некоторых 1-алкил-4-фенил-4-ацилоксипиперидиновых соединений. N-оксид 1-метил-4-фенил-4-пропионоксипиперидина HCl проявлял анальгетическую активность, равную активности долантина HCl, но с более продолжительным действием. Токсичность также была меньше.
Хорошо известны N-оксиды морфина и простых производных морфина, таких как кодеин, гидроморфон (дигидроморфинон) и гидрокодон (дигидрокодеинон), описанные среди прочего в: М.Polonovski et al. Bull. Acad. Med. 103, 174 (1930); N.H.Chang et al. J.Org. Chem. 15, 634 (1950); B.Kelentei et al. Arzneimittel-Forsch. 7, 594 (1957); K.Takagi et al. Yakugaku Zasshi 83, 381 (1963) (Chem. Abs. 59: 9224b); L. Lafon, патент США №3131185; M.R.Fennessy, Brit. J.Pharmacol. 34, 337 (1968); M.R.Fennessy, Eur. J. Pharmacol. 8, 261 (1969) и M.R.Fennessy, J.Pharm. Pharmacol. 21, 668 (1969). Различные авторы сообщают, что N-оксид морфина либо менее активен, либо неактивен в качестве анальгетика, но является эффективным противокашлевым средством, а также обладает несколько более низкой токсичностью, чем морфин. Однако нет ни указания, что эти N-оксиды когда-либо вводили перорально, ни какого-либо предположения, что они могут проявлять улучшенную пероральную биодоступность.
В Woods, патент Британии №1217296, раскрыто применение комбинации N-оксида морфина и амифеназола в качестве анальгетической композиции. Указано, что эта комбинация усиливает анальгетическую активность N-оксида морфина, при этом уменьшает побочные эффекты обоих соединений.
Окислительный метаболизм до N-оксида, который выводится, входит в множество метаболических путей, которые были идентифицированы у млекопитающих при введении различных третичных аминов. J.D.Phillipson et al. Eur. J. Drug Metab. Pharmacokinetics 3, 119 (1978), сообщают, что морфин и кодеин частично превращаются в соответствующие N-оксиды микросомальным препаратом из печени морской свинки, а также, что эти два лекарственных средства частично метаболизируются до N-оксидов при введении крысам. Т.Ishida et al. Drug Metab. Dispos. 7, 162 (1979) и Т.Ishida et al. J.Pharmacobio-Dyn. 5, 521 (1982), сообщают, что оксикодона N-оксид является одним из ряда идентифицируемых метаболитов, обнаруженных в моче кроликов, которым подкожно был введен оксикодон. Хотя другие метаболиты были обнаружены как в свободной, так и в конъюгированной формах, оксикодон-N-оксид был обнаружен только в свободной неконъюгированной форме. Считают, что анальгетическая активность оксикодона обусловлена неизмененным лекарственным средством, а не метаболитами. S.Y.Yen et al. J.Pharm. Sci. 68, 133 (1979), также сообщают о выделении N-оксида морфина из мочи морских свинок, которым был введен сульфат морфина.
Некоторые N-оксиды третичных аминов частично метаболизируются путем восстановления до третичного амина при введении испытуемым животным. R.L.H.Heimans et al. J.Pharm. Pharmacol. 23, 831 (1971) сообщают, что N-оксид морфина частично восстанавливается до морфина после введения крысам. Т.Chyczewski, Pol. J. Pharmacol. Pharm. 25, 373 (1973), сообщают, что N-оксид 1-метил-4-фенил-4-пиперидинола пропионата частично восстанавливается до третичного амина после введения кроликам, мышам и крысам. P.Jenner et al. Xenobiotica 3 (6), 341 (1973), сообщают, что никотин-1′-N-оксид частично восстанавливается до никотина у человека после перорального введения, но не после внутривенного введения. Пероральное введение никотин-1′-N-оксида по существу позволяет избежать явления пресистемного метаболизма, наблюдаемого при пероральном введении никотина. Считается, что восстановление до никотина, которое происходит в нижнем отделе желудочно-кишечного (ЖК) тракта, осуществляется ЖК флорой.
Хорошо установлено, что N-окисление алифатических(ой) третичных(ой) аминных(ой) групп(ы) в N-10 боковой цепи фенотиазиновых нейролептических агентов является основным путем метаболизма этих лекарственных средств у людей (Yeung, P.K. et al., J Pharm Sci, 1987. 76(10): p.803-8; Marder, S.R. et al., Psychopharmacol Bull, 1989. 25(3): p.479-82; Aravagiri, M. et al., Ther Drug Monit, 1990. 12(3): p.268-76; Marder, S.R. et al., Psychopharmacol Bull, 1990. 26(2): p.256-9; Marder, S.R. et al., Br J Psychiatry, 1991, 158: p.658-65; Hubbard, J.W. et al., Br J Psychiatry Suppl, 1993(22): p.19-24; Javorski, T.J. and M.S. Sardessai, Journal of Pharmaceutical Sciences, 1993. 82(3): p.330-333; Midha, K.K. et al., Ther Drug Monit, 1993. 15(3): p.179-89; Yeung, P.K. et al., Eur J Clin Pharmacol, 1993. 45(6): p.563-9; Aravagiri, M. et al., Ther Drug Monit, 1994. 16(1): p.21-9).
Высокие уровни в плазме N-оксидных метаболитов наблюдаются у людей для хлорпромазина, флуфеназина и трифторперазина. Однако действительный вклад этих метаболитов в клинический ответ исследован только в случае флуфеназина. N4-Оксид флуфеназина был более сильно связан с побочными эффектами, чем исходное лекарственное средство. N-Оксид хлорпромазина, напротив, позволял избежать антидофаминергических эффектов. Однако хлорпромазина N-оксид превращается в хлорпромазин у людей, и его метаболический профиль очень похож на профиль исходного лекарственного средства. Известно, что и N-оксид клозапина (Chang, W. et al., Prog Neuropsychopharmacol Biol Psychiatry, 1998. 22(5): p.723-739), и N-оксид оланзапина (патентная заявка США 6352984 В1) являются метаболитами клозапина и оланзапина соответственно. Также известно, что их соответствующие N-оксиды являются пролекарствами, образуя клозапин и оланзапин соответственно.
Пероральное введение многих лекарственных средств обычно вызывает существенно меньший ответ по сравнению с равной дозой, вводимой парентерально. Это снижение эффективности чаще всего является результатом интенсивного метаболизма лекарственного средства во время его прохождения через желудочно-кишечный тракт в общий кровоток. Например, слизистая оболочка кишечника и печень, через которые при пероральном введении проходит лекарственное средство, прежде чем оно поступает в системное кровообращение, обладают высокой ферментативной активностью и могут, следовательно, метаболизировать лекарственное средство за счет множества путей.
Когда перорально вводимое лекарственное средство быстро метаболизируется в неактивную или значительно менее активную форму желудочно-кишечной системой или печенью до поступления в общее кровообращение, его биодоступность низка. В некоторых случаях эту проблему можно преодолеть за счет введения лекарственного средства другим путем. Примеры таких альтернативных путей включают назальный (пропранолол), сублингвальный (нитроглицерин) и ингаляционный (кромолин натрий). Лекарственные средства, вводимые этими путями, избегают метаболизма в печени и кишечной стенке на своем пути в общее кровообращение.
В некоторых случаях пресистемный метаболизм некоторых перорально вводимых лекарственных средств можно преодолеть за счет получения производных функциональной группы в молекуле, которая чувствительна к желудочно-кишечному или печеночному метаболизму. Эта модификация защищает группу от метаболической атаки в процессе всасывания или пресистемного прохождения через печень. Однако маскирующая группа должна быть, в конечном счете, удалена, чтобы обеспечить проявление лекарственным средством его максимального эффекта, и поскольку маскирующая группа высвобождается в организме, она должна быть относительно нетоксичной. Это превращение может происходить в крови или в ткани. Эти типы защищенных лекарственных средств обычно называют пролекарствами.
Предшествующий уровень техники о дофаминергической регуляции/модулировании
Дофамин представляет собой нейротрансмиттер в головном мозге. С момента этого открытия, сделанного в 1950-е годы, функция дофамина в головном мозге интенсивно исследуется. К настоящему времени хорошо установлено, что дофамин играет существенную роль в некоторых аспектах функционирования головного мозга, включая двигательную, когнитивную, сенсорную, эмоциональную и автономную (например, регуляцию аппетита, температуры тела, сна) функции. Следовательно, модулирование дофаминергической функции может быть полезно в лечении широкого ряда расстройств, поражающих функции головного мозга. Действительно, как неврологические, так и психиатрические расстройства лечат лекарственными средствами, основанными на взаимодействиях с дофаминовыми системами и дофаминовыми рецепторами в головном мозге.
Лекарственные средства, которые воздействуют прямо или косвенно на центральные дофаминовые рецепторы, обычно применяют в лечении неврологических и психиатрических расстройств, например болезни Паркинсона и шизофрении. Доступные в настоящее время фармацевтические агенты имеют тяжелые побочные эффекты, такие как экстрапирамидальные побочные эффекты и поздняя дискинезия у дофаминергических антагонистов, применяемых в качестве нейролептических агентов, и дискинезии и психозы у дофаминергических агонистов, применяемых в качестве противопаркинсонических агентов. Терапевтические эффекты во многих отношениях неудовлетворительны. Для улучшения эффективности и снижения побочных эффектов дофаминергических фармацевтических агентов проводят поиск новых лигандов рецепторов дофамина с селективностью на специфических подтипах рецепторов дофамина или региональной селективностью. В данном контексте также разрабатывают частичные агонисты рецепторов дофамина, то есть лиганды рецепторов дофамина с некоторой, но неполной, собственной активностью на рецепторах дофамина для достижения оптимальной степени стимуляции на рецепторах дофамина, избегая избыточной блокады рецепторов дофамина или избыточной дофаминовой стимуляции.
Ранее описаны соединения, принадлежащие к классу замещенных 3-(фенил-N-алкил)пиперидинов, 4-(фенил-N-алкил)пиперазинов и замещенных 4-(фенил-N-алкил)пиперидинов (например, OSU6162 и ACR16). Среди этих соединений некоторые неактивны в ЦНС, некоторые проявляют серотонергические или смешанные серотонергические/дофаминергические фармакологические профили, в то время как некоторые являются полными или частичными антагонистами или агонистами рецепторов дофамина с высоким сродством к рецепторам дофамина.
Ряд производных 4-фенилпиперазина и 4-фенилпиперидина известен и описан, например, в Costall et al. European J.Pharm. 31, 94, (1975), и Mewshaw et al. Bioorg. Med. Chem. Lett., 8, 295, (1998). Описанные соединения представляют собой замещенные 4-фенилпиперазины, большинство из которых являются 2-, 3- или 4-ОН-фенилзамещенными и проявляют агонистические свойства к ауторецептору DA.
В Fuller R.W. et al., J.Pharmacol. Exp.Therapeut. 218, 636, (1981) раскрыты замещенные пиперазины (например, 1-(мета-трифторметилфенил)пиперазин), которые, по сообщениям, действуют как агонисты серотонина и ингибируют захват серотонина. В Fuller R.W. et al Res., Commun. Chem. Pathol. Pharmacol. 17, 551, (1977) раскрыты сравнительные эффекты 1-(пара-хлорфенол)пиперазина на концентрацию 3,4-дигидроксифенилуксусной кислоты, и в Res. Commun. Chem. Pathol. Pharmacol. 29, 201, (1980) раскрыты сравнительные эффекты на концентрацию 5-гидроксииндолуксусной кислоты в головном мозге крыс.
В Boissier J. et al., Chem Abstr. 61:10691c раскрыты двузамещенные пиперазины. Эти соединения являются, по сообщениям, адренолитическими, антигипертензивными потенциаторами барбитуратов и депрессантами центральной нервной системы. Кроме того, в Akasaka et al. (EP 0675118) раскрыты дифенилпроизводные пиперазинов, которые проявляют антагонизм к рецептору дофамина D2 и/или антагонизм к рецептору 5-НТ2.
Опубликованы сведения о ряде разных замещенных пиперазинов в качестве лигандов рецепторов 5-НТ1А, например, в Glennon R.A. et al. J. Med. Chem., 31, 1968, (1988) и van Steen B.J., J.Med. Chem., 36, 2751 (1993), Dukat M. - L., J.Med. Chem., 39, 4017, (1996). Glennon R.А. в международных патентных заявках WO 93/00313 и WO 91/09594 раскрыл различные амины, среди них замещенные пиперазины, в качестве лигандов сигма-рецепторов. В клинических исследованиях по изучению свойств лигандов сигма-рецепторов у пациентов с шизофренией не были получены данные, свидетельствующие о нейролептической активности или активности при каком-либо другом расстройстве ЦНС. Два из наиболее широко исследованных селективных антагонистов сигма-рецепторов, BW234U (римказол) и BMY14802, не имели успеха в клинических исследованиях у пациентов с шизофренией (Borison et al. 1991, Psychopharmacol Bull 27(2): 103-106; Gewirtz et al. 1994, Neuropsychopharmacology 10:37-40).
Недавняя патентная заявка, озаглавленная "Noncardiotoxic pharmaceutical compounds", Donald L. Barbeau (США) (№публикации/дата публикации: 20060035863/16 февраля 2006, №/дата подачи: 11199866/9 августа 2005, классификация США: 514/89; 546/21, международная классификация: А61К 31/675; C07F 9/59, временная заявка №60600699, поданная 11 августа 2004, временная заявка №60673545, поданная 21 апреля 2005), относится к новым некардиотоксичным соединениям и к фармацевтическим композициям, полезным в лечении ряда расстройств, включая лечение депрессии, аллергий, психозов, рака и желудочно-кишечных расстройств. В частности, в данном изобретении описаны фармацевтические композиции, которые уменьшают угрожающие жизни аритмии, такие как двунаправленная желудочковая тахикардия, на основании того, что избегают высоких уровней в плазме кардиотоксических гидроксилированных метаболитов за счет применения некардиотоксичного пролекарства, которое было разработано как некардиотоксичное само по себе. За счет преодоления пресистемного вторичного метаболизма эти гидроксилированные метаболиты будут образовываться в значительно меньшей концентрации, чем в случае введения самого действующего начала.
Даже несмотря на то, что N-оксиды упомянуты в патенте Barbeau (см. выше), настоящее изобретение направлено на N-оксиды определенного класса стабилизаторов рецепторов дофамина, относящихся к OSU6162 и ACR16. Неожиданно было обнаружено, что некоторые из заявленных соединений, кроме их способности стабилизировать рецепторы DA путем восстановительной биоактивации, также обладают собственным воздействием на рецептор DA. Также удивительно, было обнаружено, что эти пролекарства обладают фармакокинетическим профилем, который снижает риск серьезных сердечно-сосудистых побочных эффектов (например, QTc (корригированного интервала QT) и двунаправленной желудочковой тахикардии).
Краткое описание графических материалов
На Фиг.1 и 2 показана концентрация лекарственного средства и предшественника (выраженная в импульсах/с) во времени.
Описание изобретения
Настоящее изобретение относится к N-оксидным и/или ди-N-оксидным производным стабилизаторов/модуляторов рецепторов дофамина, имеющим общую формулу
где А выбран из группы, состоящей из
и
с образованием соединения общей формулы (1)
и соединения общей формулы (2)
соответственно, и к их фармацевтически приемлемым солям, где
R1 представляет собой радикал, выбранный из группы, состоящей из CF3, OSO2CF3, OSO2CH3, SOR4, SO2R4, COR4, CN, OR4, NO2, CONHR4, 3-тиофена, 2-тиофена, 3-фурана, 2-фурана, F, Cl, Br и I, где R4 является таким, как определено ниже;
R2 представляет собой радикал, выбранный из группы, состоящей из Н, F, Cl, Br, I, CN, CF3, СН3, ОСН3, ОН, NH2, SOmCF3, O(CH2)mCF3, SO2N(R4)2, CH=NOR4, COCOOR4, COCOON(R4)2, (С1-С8)алкила, (С3-С8)циклоалкила, CH2OR4, CH2(R4)2, NR4SO2CF3, NO2, на фениле в положениях 2, 4, 5 или 6, где х и R4 являются такими, как определено ниже;
R3 представляет собой радикал, выбранный из группы, состоящей из водорода, CF3, CH2CF3, (С1-С8)алкила, (С3-С8)циклоалкила, (С4-С9)циклоалкилметила, (С2-С8)алкенила, (С2-С8)алкинила, 3,3,3-трифторпропила, 4,4,4-трифторбутила, CH2SCH3, CH2CH2OCH3, CH2CH2CH2F, CH2CF3, фенилэтила, 2-тиофенетила и 3-тиофенетила;
R4 представляет собой радикал, выбранный из группы, состоящей из CF3, CH2CF3, (С1-С8)алкила, (С3-С8)циклоалкила, (С4-С9)циклоалкилметила, (С2-С8)алкенила, (С2-С8)алкинила, 3,3,3-трифторпропила, 4,4,4-трифторбутила, 2-тетрагидрофурана и 3-тетрагидрофурана;
X выбран из группы, состоящей из N и sp3-гибридизованного С;
Y выбран из группы, состоящей из О, и когда R3 представляет собой Н, ОН;
Z выбран из группы, состоящей из Н и ОН, когда X представляет собой sp3-гибридизованный С или Z представляет собой О или неподеленную электронную пару, когда X представляет собой N;
пунктирная линия представляет собой связь, когда X представляет собой sp2-гибридизованный С, или отсутствует, когда X представляет собой N;
m представляет собой целое число 1 или 2;
n представляет собой целое число 1-3;
при условии, что,
когда n в формуле 1 равно 2, R1 представляет собой SO2CH3, и R2 представляет собой Н, R3 не является н-пропилом.
Конкретные воплощения соединений по изобретению изложены в зависимых пунктах формулы изобретения 2-8.
В соответствии с другим аспектом настоящее изобретение относится к фармацевтическому препарату, содержащему в качестве активного ингредиента соединение по изобретению или его фармацевтически приемлемую соль, как изложено в п.9-18.
В соответствии с еще одним аспектом настоящее изобретение относится к применению соединения по изобретению или его фармацевтически приемлемой соли для изготовления фармацевтической композиции для лечения расстройства центральной нервной системы, как изложено в п.19-28.
В соответствии с еще одним аспектом настоящее изобретение относится к способу лечения расстройства центральной нервной системы пациента, при котором указанному пациенту вводят фармацевтически активное количество соединения по изобретению или его фармацевтически приемлемой соли, как изложено в п.29-39.
Соединения по данному изобретению обладают, прямо и/или косвенно, свойствами дофаминовой стабилизации/модулирования и полезны в лечении многих расстройств центральной нервной системы, включающих как психиатрические, так и неврологические симптомы. Заболевания, при которых могут быть полезны соединения со стабилизирующими/модулирующими эффектами на дофаминергические системы, представляют собой расстройства, связанные со старением, для предупреждения брадикинезии и депрессии и для улучшения умственных функций. Их также можно применять для облегчения симптомов расстройств настроения. Их можно применять при ожирениях в качестве анорексического агента и при других расстройствах питания. Их можно применять для улучшения когнитивных функций и связанных с ними эмоциональных расстройств при нейродегенеративных расстройствах, а также после повреждения головного мозга, индуцированного сосудистыми или травматическими инсультами. Также можно улучшить когнитивные и двигательные дисфункции, связанные с нарушениями развития, возникающие в младенчестве, детстве или в подростковом возрасте. Их можно применять для улучшения всех симптомов шизофрении и шизофрениформных расстройств, для улучшения текущих симптомов, а также для предупреждения возникновения новых психотических эпизодов. Можно также улучшить другие психотические расстройства, не характеризуемые как шизофрения, шизоаффективные симптомы, а также психотические симптомы, бредовые расстройства и галлюцинации, вызванные другими лекарственными средствами. Можно также улучшить расстройства разрушительного поведения, такие как синдром дефицита внимания и гиперактивности (СДВГ), кондуктивное расстройство и оппозиционно-вызывающее расстройство. Их также можно применять при тиковых расстройствах, таких как синдром Жиля де ла Туретта и другие тиковые расстройства. Также можно улучшить расстройства речи, такие как заикание. Их можно также применять для регуляции патологических расстройств приема пищи, кофе, чая, табака, алкоголя и вызывающего привыкание лекарственного средства, а также для улучшения психических расстройств, связанных с чрезмерным употреблением психоактивных веществ (включая алкоголь), включающих галлюцинации, симптомы отмены, бредовые расстройства, расстройства настроения, сексуальные и когнитивные нарушения.
Тревожные расстройства, обсессивно-компульсивное расстройство и другие расстройства контроля над побуждениями, посттравматический стрессовый синдром, личностные расстройства и конверсионную истерию также можно лечить соединениями по изобретению. Другие показания включают расстройства сна, десинхроноз и расстройства сексуальных функций.
Неврологические показания включают лечение болезни Гентингтона, двигательных расстройств, таких как дискинезии, включая другие хореи, а также первичные, вторичные и пароксизмальные дистонии, поздние двигательные расстройства, такие как поздняя дискинезия и поздняя дистония, а также другие двигательные расстройства, индуцированные лекарственными средствами. Синдром усталых ног, периодические подергивания ног и нарколепсию также можно лечить соединениями, включенными в изобретение. Они также могут улучшить умственную и двигательную функцию при болезни Паркинсона и при родственных паркинсонических синдромах, таких как множественные системные атрофии, синдром прогрессирующего супрануклеарного паралича, расстройство диффузных телец Леви и сосудистый паркинсонизм. Их также можно применять для уменьшения тремора разного происхождения. Соединения по изобретению можно также применять для лечения сосудистых головных болей, таких как мигрень и кластерная головная боль, как в качестве неотложного, так и профилактического лечения. Они могут улучшить реабилитацию после сосудистого или травматического повреждения головного мозга. Кроме того, их можно применять для облегчения боли при состояниях, характеризующихся повышенным мышечным тонусом.
Соединения по изобретению особенно пригодны для лечения расстройств центральной нервной системы и, в частности, для лечения расстройств, опосредованных дофамином. Их можно, например, применять для ослабления симптомов расстройств настроения, при ожирениях в качестве анорексического агента и при других нарушениях питания, для улучшения когнитивных функций и связанных с ними эмоциональных расстройств, для улучшения когнитивных и двигательных дисфункций, связанных с нарушениями развития, для улучшения всех симптомов психоза, включая шизофрению и шизофрениформные расстройства, для улучшения текущих симптомов, а также для предупреждения появления новых психотических эпизодов, для регуляции патологических расстройств вследствие приема пищи, кофе, чая, табака, алкоголя и вызывающих привыкание лекарственных средств и т.д.
Соединения по изобретению можно, следовательно, применять для лечения симптомов, например, при шизофрении и других психотических расстройствах, таких как кататоническая неорганизованная, параноидная, остаточная или дифференцированная шизофрения; шизофрениформном расстройстве; шизоаффективном расстройстве; бредовом расстройстве; кратковременном психотическом расстройстве; совместном психотическом расстройстве; психотическом расстройстве вследствие общего заболевания с бредом и/или галлюцинациями; расстройствах настроения, таких как депрессивные расстройства, например дистимическое расстройство или большое депрессивное расстройство; биполярных расстройствах, например биполярном расстройстве I, биполярном расстройстве II и циклотимическом расстройстве; расстройстве настроения вследствие общего заболевания с депрессивными и/или маниакальными признаками; а также расстройстве настроения, индуцированном веществами; тревожных расстройствах, таких как острое стрессовое расстройство, агорафобия без панического расстройства в анамнезе, тревожное расстройство вследствие общего заболевания, генерализованное тревожное расстройство, обсессивно-компульсивное расстройство, паническое расстройство с агорафобией, паническое расстройство без агорафобии, посттравматическое стрессовое расстройство, специфическая фобия, социофобия и тревожное расстройство, индуцированное веществами; расстройствах питания, таких как нервная анорексия, нервная булимия и ожирения; расстройствах сна, таких как диссомнии, например расстройство сна, связанное с дыханием, расстройство сна, связанное с циркадными ритмами, гиперсомния, инсомния, нарколепсия и десинхроноз; неклассифицированных расстройствах контроля над побуждениями, таких как интермиттирующее эксплозивное расстройство, клептомания, патологическая игромания, пиромания и трихотилломания; личностные расстройства, такие как параноидное, шизоидное или шизотипическое расстройство, антисоциальное, пограничное, мимическое и нарциссическое расстройство; а также избегании, зависимом, обсессивно-компульсивном расстройстве; расстройствах движения, индуцированных лекарственными средствами, таких как паркинсонизм, индуцированный нейролептиками, нейролептический злокачественный синдром, острая и поздняя дистония, индуцированная нейролептиками, акатизия, индуцированная нейролептиками, поздняя дискинезия, индуцированная нейролептиками, тремор, индуцированный лекарственными средствами, и дискинезии, индуцированные лекарственными средствами; расстройствах, связанных с веществами, таких как злоупотребление, зависимость, тревожное расстройство, интоксикация, интоксикационный делирий, психотическое расстройство, психотическое расстройство с бредом, расстройство настроения, персистентное амнестическое расстройство, персистентная деменция, персистентное расстройство восприятия, сексуальная дисфункция, расстройство сна, синдром отмены и делирий при синдроме отмены вследствие употребления алкоголя или злоупотребления алкоголем, амфетамина (или амфетаминоподобных веществ), кофеина, каннабиса, кокаина, галлюциногенов, ингаляционных средств, никотина, опиоидов, фенциклидина (или фенциклидиноподобных веществ), седативных веществ, снотворных веществ и/или анксиолитических веществ; расстройствах, обычно впервые диагностированных в младенчестве, детстве или подростковом возрасте, таких как умственная отсталость, расстройства обучения, расстройства двигательных навыков, например расстройство координации движений, связанное с развитием; коммуникативных расстройствах, например расстройстве экспрессивной речи, фонологическом расстройстве, расстройстве экспрессивно-рецептивной речи и заикании; общих расстройствах развития, например синдроме Аспергера, аутистическом расстройстве, детском дезинтегративном расстройстве и синдроме Ретта; синдроме дефицита внимания и расстройствах разрушительного поведения, например синдроме дефицита внимания/гиперактивности, кондуктивном расстройстве и оппозиционно-вызывающем расстройстве; нарушениях питания и потребления пищи в младенчестве или раннем детском возрасте, например нарушении питания в младенчестве или раннем детском возрасте, пикацизме, руминационном расстройстве; тиковых расстройствах, например хроническом двигательном или вокальном тиковом расстройстве и синдроме Туретта; других расстройствах младенчества, детства или подросткового возраста, например избирательном мутизме и стереотипическом расстройстве движения; делирии, деменции, амнестических и других когнитивных расстройствах, таких как болезнь Альцгеймера, болезнь Крейцфельдта-Якоба, вызывающая онемение травма, болезнь Гентингтона, ВИЧ-заболевание, болезнь Пика и деменция, связанная с заболеванием диффузных телец Леви; конверсионной истерии; состояниях, связанных с нормальным старением, таких как нарушения двигательных функций и умственных функций; болезни Паркинсона и родственных расстройствах, таких как множественные системные атрофии, например стриатонигральная дегенерация, оливопонтоцеребеллярная атрофия и синдром Шая-Дрейджера, прогрессирующий супрануклеарный паралич, кортикобазальная дегенерация и сосудистый паркинсонизм; треморах, таких как эссенциальный, ортостатический, тремор покоя, мозжечковый, а также вторичные головные боли при треморе, такие как мигрень, кластерная головная боль, головная боль напряжения и пароксизмальная головная боль; двигательных расстройствах, таких как дискинезии, например, при общем заболевании, вторичном по отношению к травме или сосудистому инсульту, гемибаллизм, атетоз, хорея Сиденгама и пароксизмальные заболевания; дискинезии; дистонии; синдром Экбома (усталых ног); болезни Вильсона; болезни Галлервордена-Шпатца; реабилитационной медицине, например для улучшения реабилитации после сосудистого или травматического повреждения головного мозга; боли при состояниях, характеризующихся повышенным мышечным тонусом, таких как фибромиалгия, миофасциальный синдром, дистония и паркинсонизм; а также при состояниях, относящихся к вышеописанным, которые попадают в более широкие категории, но не соответствуют критериям какого-либо конкретного расстройства в этих категориях.
Производные по данному изобретению включают их фармацевтически приемлемые соли присоединения кислоты. Под термином "фармацевтически приемлемая соль присоединения кислоты" подразумевают любую нетоксичную фармацевтически пригодную соль соединения, описанного выше, которая обладает желаемыми фармакологическими свойствами у млекопитающих. Получение таких солей хорошо известно специалистам в фармацевтической науке. Фармацевтически приемлемые соли присоединения кислоты вышеописанных соединений включают гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, нитрат, цитрат, тартрат, битартрат, лактат, фосфат, малат, малеат, фумарат, сукцинат, ацетат и памоат.
Также предложен способ преобразования пригодного предшественника в его N-оксидное лекарство/пролекарство, при котором этот предшественник подвергают взаимодействию с подходящим окисляющим агентом в подходящем растворителе.
Химия
Синтезы промежуточных соединений (соединений формул 1 и 2 ниже N-оксидов), используемых в качестве исходных веществ для N-окисления, описаны в патентных заявках WO 92/18475 и US 2003/0004169 А1.
Существует ряд окисляющих агентов, которые можно использовать для превращения третичных аминов в N-оксиды третичных аминов, мета-хлорпербензойная кислота удобна, поскольку она, как правило, быстро взаимодействует с получением N-оксида. Однако можно использовать другие органические перкислоты, такие как пермуравьиная кислота, перуксусная кислота, пербензойная кислота, пертрифторуксусная кислота, пермалеиновая кислота и перфталевая кислота. Альтернативно, окислитель может быть получен in situ путем растворения третичного амина в кислоте, такой как муравьиная кислота, уксусная кислота или трифторуксусная кислота, и добавления водного пероксида водорода в концентрации 3%-50%, предпочтительно в концентрации от 30% до 50%. Апротонный растворитель, такой как метиленхлорид, хлороформ или 1,2-дихлорэтан, или протонный растворитель, такой как CF3COOH, метанол, этанол, пропанол или третичный бутанол, можно использовать в качестве реакционной среды, или, если окислитель образуется in situ, возможно, в качестве реакционной среды можно использовать кислоту.
Вместо использования органической перкислоты, как описано выше, можно использовать пероксид, такой как пероксид водорода. Водный пероксид водорода можно использовать один в концентрациях от 3% до 50% либо его можно использовать в растворителе, таком как перечисленные выше. Другие окислители, которые можно использовать, включают озон, третичный бутилгидропероксид и куменгидропероксид.
Как правило, окислители используют при температурах между 0°С и точкой кипения растворителя, более конкретно между комнатной температурой и точкой кипения растворителя, и в течение промежутков времени от нескольких минут до трех суток, более конкретно от одного часа до 24 часов. Пероксид можно использовать в соотношении один эквивалент пероксида к одному эквиваленту амина, либо можно использовать избыток пероксида, например 10%-100% избыток или более. Для получения ди-N-оксидов необходимо по меньшей мере два эквивалента. Если в конце реакции присутствует избыток пероксида (проще всего обнаруживается крахмально-йодной бумагой), его можно ликвидировать добавлением неорганического восстановителя, такого как бисульфит натрия или сульфит натрия, металлического катализатора, такого как 5%-ная платина или палладий на углероде или глинозем, или органического восстановителя, такого как диметилсульфид или CS2.
Другими окислителями, которые можно использовать для получения оксидов третичных аминов, являются озон в растворителе, таком как хлороформ, метиленхлорид, фреон или метанол; озон, адсорбированный на силикагеле; и гидропероксиды, такие как третичный бутилгидропероксид, возможно в присутствии катализатора, такого как соединение ванадия.
Когда важна стоимость, например при получении в промышленном масштабе, предпочтительным реагентом является 30%-50%-ный водный пероксид водорода в третичном бутаноле в качестве растворителя.
Способы получения ряда соединений по данному изобретению продемонстрированы в приведенных ниже Примерах, которые не предназначены для ограничения объема настоящего изобретения.
Экспериментальный раздел
Общее
ИК-спектры получали на спектрометре Фурье-ИКС ATI-Mattson Genesis Series. ЯМР-спектры получали на спектрометре Varian Gemini 300. Химические сдвиги приведены в значениях δ (млн-1). Масс-спектры (ES (электрораспыление)) записывали на масс-спектрометре системы GCMS/MS РЕ SCIEX API 3000 LCMS/MS. Масс-спектры (EI (электроионизация)) записывали на системе GC-MS Shimadzu GC-17A GCMS-QP50000 CP-Sil 5-CB Lowbleed/MS 15 м/0,25 мм внутренний диаметр/0,10 мкм, автоматический дозатор/инжектор AOS-20. Газовую хроматографию проводили на газовом хроматографе HP 5890 Series II CP-Sil 5-CB Chrompack 15 м/0,25 мм ID/0,10 мкм. Каталитическое восстановление под давлением газообразного водорода проводили в аппарате Герхардта Парра. Оптическое вращение осуществляли на поляриметре Perkin-Elmer 241. HPLC проводили на колонке Waters Chiral РАК AD.
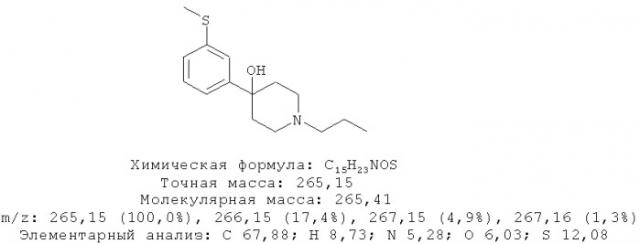
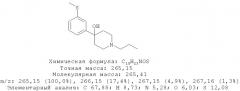
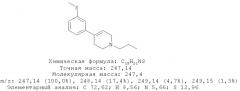
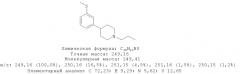
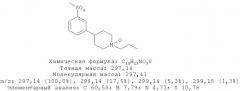
4-(3-Метилсульфанилфенил)-1-пропилпиперидин-4-ол (1)
3-Бромтиоанизол (960 мг, 4,73 ммоль) растворяли в 10 мл диэтилового эфира, высушенного на Na. 1-Пропил-4-пиперидон растворяли в 8 мл сухого диэтилового эфира. Примерно 10% раствора 3-бромтиоанизола в сухом диэтиловом эфире добавляли к магнию (344 мг, 14,15 ммоль) и нескольким кристаллам йода в высушенной трехгорлой колбе на 250 мл в атмосфере азота. Когда эта коричневая смесь становилась бесцветной, добавляли по ка