Малые молекулы рнк, опосредующие интерференцию рнк
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и биотехнологии и может быть использовано в медицине и в фармацевтической промышленности. Молекула РНК, способная к мишень-специфической интерференции РНК, представляет собой двухцепочечную молекулу РНК размером 23 нуклеотида, имеющую 3'-выступ из 1-5 нуклеотидов. Ее получают объединением двух цепей РНК и используют для получения фармацевтической композиции. При введении в многоклеточный эукариотический организм или в клетку многоклеточного эукариотического организма данная молекула РНК обеспечивает содействие мишень-специфической интерференции РНК и приводит к уменьшению уровня экспрессии гена-мишени или к нокауту гена-мишени. Способ содействия мишень-специфической интерференции РНК с помощью данной молекулы РНК применяют для определения или модуляции функции гена. Клетку, содержащую эндогенную нуклеиновую кислоту-мишень, молекулу РНК, способную к мишень-специфической интерференции РНК, и экзогенную нуклеиновую кислоту-мишень используют в аналитических процедурах. Применение изобретения обеспечивает молчание гена-мишени, опосредованное мишень-специфической интерференцией РНК. 8 н. и 32 з.п. ф-лы, 24 ил., 3 пр.
Реферат
Изобретение относится к последовательности и структурным признакам двухцепочечных (дц)РНК-молекул, требующихся для опосредования мишень-специфических модификаций нуклеиновых кислот, таких как РНК-интерференция и/или метилирование ДНК.
Термин «интерференция РНК» (РНКи) был создан после обнаружения, что инъецирование дцРНК в нематоду С. elegans приводит к специфической индукции молчания генов, имеющих высокую гомологию последовательности относительно введенной дцРНК (Fire et al., 1998). Затем РНКи наблюдали также у насекомых, лягушек (Oelgeschlager et al., 2000) и других животных, в том числе мышей (Svoboda et al., 2000; Wianny and Zernicka-Goetz, 2000), и она, вероятно, существует также у человека. РНКи тесно связана с посттранскрипционным механизмом превращения генов в молчащие гены (PTGS) посредством косупрессии в растениях и набухания в грибах (Catalanotto et al., 2000; Cogoni and Macino, 1999; Dalmay et al., 2000; Ketting and Plasterk, 2000; Mourrain et al., 2000; Smardon et al., 2000), и некоторые компоненты аппарата РНКи являются также необходимыми для посттранскрипционного индуцирования молчания генов косупрессией (Catalanotto et al., 2000; Dernburg et al., 2000; Ketting and Plasterk, 2000). Эта тема обсуждалась недавно (Bass, 2000; Bosher and Labouesse, 2000; Fire, 1999; Plasterk and Ketting, 2000; Sharp, 1999; Sijen and Kooter, 2000), см. Также весь выпуск Plant Molecular Biology, vol. 43, issue 2/3, (2000).
В растениях, наряду с PTGS, введенные трансгены могут также приводить к транскрипционному индуцированию молчания генов через РНК-управляемое метилирование ДНК цитозинов (см. ссылки в Wassenegger, 2000). Геномные мишени, такие короткие как 30 п.н., метилируются в растениях РНК-управляемым образом (Pelisser, 2000). Метилирование ДНК присутствует также и у животных.
Природная функция РНКи и косупрессии является, по-видимому, защитой генома против инвазии мобильными генетическими элементами, такими как ретротранспозоны и вирусы, которые продуцируют аберрантную РНК или дцРНК в клетке-хозяине, когда они становятся активными (Jensen et al., 1999; Ketting et al., 1999; Ratcliff et al., 1999; Tabara et al., 1999). Специфическая деградация мРНК предотвращает репликацию транспозонов и вирусов, хотя некоторые вирусы способны преодолевать или предотвращать этот процесс экспрессией белков, которые супрессируют PTGS (Lucy et al., 2000; Voinnet et al., 2000).
ДцРНК запускает специфическую деградацию гомологичных РНК только в районе идентичности с дцРНК (Zamore et al., 2000). Эта дцРНК процессируется до РНК-фрагментов размером 21-23 нуклеотидов (нт) и сайты расщепления РНК-мишени регулярно отстоят друг от друга на 21-23 нт. Таким образом, было сделано предположение, что фрагменты размером 21-23 нт являются «руководящими» РНК (направляющими РНК) для узнавания мишени (Zamore et al., 2000). Эти короткие РНК детектировались также в экстрактах, полученных из клеток Шнайдера S2 D. melanogaster, которые были трансфицированы дцРНК перед лизисом клеток (Hammond et al., 2000), однако фракции, которые проявляли последовательность-специфическую нуклеазную активность, также содержали большую фракцию остаточной дцРНК. Роль фрагментов размером 21-23 нт в руководстве расщеплением мРНК дополнительно поддерживается наблюдением, что фрагменты размером 21-23 нт, выделенные из процессированной дцРНК, способны, в некоторой степени, опосредовать специфическую деградацию мРНК (Zamore et al., 2000). Молекулы РНК сходного размера накапливаются также в ткани растений, которая проявляет PTGS (Hamilton and Baulcombe, 1999).
В данном изобретении авторы используют установленную in vitro систему Drosophila (Tuschl et al., 1999; Zamore et al., 2000) для дополнительного выяснения механизма РНКи. Авторы демонстрируют, что короткие РНК размером 21 и 22 нт, при спаривании оснований с 3'-выступающими концами, действуют как руководящие РНК в отношении последовательность-специфической деградации мРНК. Короткие дцРНК размером 30 п.н. являются неспособными опосредовать интерференцию РНК (РНКи) в этой системе, так как они уже не процессируются до РНК размером 21-22 нт. Кроме того, авторы определили сайты расщепления РНК-мишени относительно коротких (21 и 22 нт) интерферирующих РНК (siRNA) и обеспечили доказательство, что направление процессинга дцРНК определяет, может ли расщепляться смысловая или антисмысловая РНК-мишень продуцируемым комплексом siRNA-эндонуклеаза. Кроме того, siRNA могут быть важными инструментами для транскрипционной модуляции, например индуцирования молчания генов млекопитающих посредством управления метилированием ДНК.
Дополнительные эксперименты в системах культур клеток человека in vitro (клеток HeLa) показывают, что молекулы двухцепочечных РНК, имеющие длину предпочтительно 19-25 нт, имеют РНКи-активность (активность интерференции РНК). Таким образом, в противоположность результатам, полученным на Drosophila, имеющие длину 24 и 25 нт молекулы дцРНК также являются эффективными для иттерференции РНК (РНКи).
Целью, лежащей в основе данного изобретения, является обеспечение новых агентов, способных опосредовать мишень-специфическую интерференцию РНК или другие мишень-специфические модификации нуклеиновых кислот, такие как метилирование ДНК, причем указанные агенты имеют улучшенную эффективность и безопасность в сравнении с агентами предыдущего уровня техники.
Решение этой проблемы обеспечено выделенной двухцепочечной молекулой РНК, где каждая цепь РНК имеет длину 19-25, в частности 19-23 нуклеотида, где указанная молекула РНК способна опосредовать мишень-специфические модификации нуклеиновых кислот, в частности интерференцию РНК и/или метилирование ДНК. Предпочтительно, по меньшей мере одна цепь имеет 3'-выступ из 1-5 нуклеотидов, более предпочтительно из 1-3 нуклеотидов и наиболее предпочтительно из 2 нуклеотидов. Другая цепь может иметь тупые концы или имеет 3'-выступ до 6 нуклеотидов. Кроме того, если обе цепи дцРНК имеют длину точно 21 или 22 нуклеотида (нт), можно наблюдать некоторую интерференцию РНК, когда оба конца являются тупыми (выступ 0 нуклеотидов). Эта молекула РНК предпочтительно является синтетической молекулой РНК, которая по существу не содержит примесей, встречающихся в клеточных экстрактах, например из эмбрионов Drosophila. Кроме того, эта молекула РНК предпочтительно по-существу не содержит никаких неспецифических в отношении мишени примесей, в частности неспецифических в отношении мишени молекул РНК, например из примесей, встречающихся в клеточных экстрактах.
Далее, данное изобретение относится к использованию выделенных двухцепочечных молекул РНК, где каждая цепь РНК имеет длину 19-25 нуклеотидов, для опосредования последовательность-специфических модификаций нуклеиновых кислот, в частности интерференции РНК (РНКи), в клетках млекопитающих, в частности в клетках человека.
Неожиданно было обнаружено, что синтетические короткие двухцепочечные молекулы РНК, особенно с выступающими 3'-концами, являются последовательность-специфическими медиаторами РНКи и опосредуют эффективное расщепление РНК-мишени, причем сайт расщепления локализован вблизи центра района, охватываемого этой «руководящей» короткой РНК.
Предпочтительно, каждая цепь этой молекулы РНК имеет длину 20-22 нуклеотида (или 20-25 нуклеотидов в клетках млекопитающих), причем длина каждой цепи может быть одной и той же или различной. Предпочтительно длина 3'-выступа достигает 1-3 нуклеотида, причем длина выступа может быть одной и той же или различной. Эти РНК-цепи предпочтительно имеют 3'-гидроксильные группы; 5'-конец предпочтительно содержит фосфатную, дифосфатную, трифосфатную или гидроксильную группу. Большинство эффективных дцРНК состоят из двух состоящих из 21 нуклеотида цепей, которые спарены таким образом, что выступы из 1-3, в частности 2-3 нуклеотидов (нт), присутствуют на обоих концах дцРНК.
Реакция расщепления РНК-мишени, управляемая siRNA, является высоко последовательность-специфической. Однако не все положения siRNA равным образом способствуют узнаванию мишени. Ошибочные спаривания в центре siRNA-дуплекса являются наиболее критическими и по существу элиминируют расщепление РНК-мишени. В противоположность этому 3'-нуклеотид цепи siRNA (например, положение 21), который комплементарен одноцепочечной РНК-мишени, не способствует специфичности узнавания мишени. Далее, последовательность неспаренного 3'-выступа из 2 нт цепи siRNA с той же самой полярностью, что и РНК-мишень, не является критическим для расщепления РНК-мишени, так как только антисмысловая цепь siRNA “руководит” узнаванием мишени. Таким образом, из одноцепочечных выступающих нуклеотидов только предпоследнее положение антисмысловой siRNA (например, положение 20) должно спариваться со смысловой мРНК-мишенью.
Неожиданно двухцепочечные молекулы РНК данного изобретения проявляют высокую стабильность in vivo в сыворотке или среде для выращивания культур клеток. Для дополнительного усиления стабильности 3'-выступы могут быть стабилизированы против деградации, например они могут быть выбраны таким образом, что они состоят из пуриновых нуклеотидов, в частности аденозиновых или гуанозиновых нуклеотидов. Альтернативно, замена пиримидиновых нуклеотидов модифицированными аналогами, например замена уридина 3'-выступов из 2 нт 2'-дезокситимидином, является переносимой и не влияет на эффективность интерференции РНК. Отсутствие 2'-гидроксила значимо усиливает устойчивость к нуклеазам этого выступа в среде для культуры ткани.
В особенно предпочтительном варианте данного изобретения молекула РНК может содержать по меньшей мере один модифицированный аналог нуклеотида. Аналоги нуклеотидов могут быть локализованы в положениях, где мишень-специфическая активность, например опосредующая РНКи активность, по существу не подвергается действию, например в районе при 5'-конце и/или 3'-конце двухцепочечной молекулы РНК. В частности, эти выступы могут быть стабилизированы включением модифицированных аналогов нуклеотидов.
Предпочтительные аналоги нуклеотидов выбраны из рибонуклеотидов с модифицированным сахаром или модифицированным скелетом молекулы. Однако следует отметить, что рибонуклеотиды с модифицированными нуклеооснованиями, т.е. рибонуклеотиды, содержащие не встречающееся в природе нуклеооснование вместо природно встречающегося нуклеооснования, такие как уридины или цитидины, модифицированные в положении 5, например, 5-(2-амино)пропилуридин, 5-бромуридин; аденозины и гуанозины, модифицированные в положении 8, например, 8-бромгуанозин; деазануклеотиды, например 7-деазааденозин; О- и N-алкилированные нуклеотиды, например N6-метиладенозин, являются пригодными. В предпочтительных сахар-модифицированных рибонуклеотидах 2'-ОН-группа заменена группой, выбранной из Н, OR, R, галогена, SH, SR, NH2, NHR, NR2 или CN, где R обозначает С1-С6-алкил, алкенил или алкинил, а галоген обозначает F, Cl, Br или I. В предпочтительных скелет-модифицированных рибонуклеотидах фосфоэфирная группа, соединяющая с соседними рибонуклеотидами, заменена модифицированной группой, например фосфотиоатной группой. Следует отметить, что вышеупомянутые модификации могут комбинироваться.
Последовательность двухцепочечной молекулы РНК данного изобретения должна иметь достаточную идентичность относительно молекулы нуклеиновой кислоты-мишени для опосредования мишень-специфической РНКи и/или мишень-специфического метилирования ДНК. Предпочтительно, эта последовательность имеет идентичность по меньшей мере 50%, в частности по меньшей мере 70% относительно желаемой молекулы-мишени в двухцепочечной части этой молекулы РНК. Более предпочтительно, идентичность равна по меньшей мере 85%, и наиболее предпочтительно, 100% в двухцепочечной части этой молекулы РНК. Идентичность двухцепочечной молекулы РНК относительно заранее заданной молекулы нуклеиновой кислоты-мишени, например, молекулы мРНК-мишени, может быть определена следующим образом:
где I обозначает идентичность в процентах, n равно числу идентичных нуклеотидов в двухцепочечной части дцРНК и мишени, а L является длиной перекрывания последовательностей двухцепочечной части этой дцРНК и мишени.
Альтернативно, идентичность двухцепочечной молекулы РНК относительно последовательности-мишени может быть определена с включением 3'-выступа, в частности выступа, имеющего длину из 1-3 нуклеотидов. В этом случае идентичность последовательности предпочтительно равна по меньшей мере 50%, более предпочтительно 70% и наиболее предпочтительно по меньшей мере 85% относительно последовательности-мишени. Например, нуклеотиды из 3'-выступа и до 2 нуклеотидов из 5'- и/или 3'-конца двойной цепи могут быть модифицированы без существенной потери активности.
Двухцепочечная молекула РНК данного изобретения может быть получена с использованием способа, предусматривающего стадии:
(а) синтеза двух цепей РНК, каждая из которых имеет длину по меньшей мере 19-25, например 19-23 нуклеотида, где указанные цепи РНК способны образовывать двухцепочечную молекулу РНК, причем предпочтительно по меньшей мере одна цепь имеет 3'-выступ из 1-5 нуклеотидов,
(b) объединения этих синтезированных цепей РНК в условиях, в которых образуется двухцепочечная молекула РНК, которая способна опосредовать мишень-специфические модификации нуклеиновых кислот, в частности интерференцию РНК и/или метилирование ДНК.
Способы синтеза молекул РНК известны в данной области. В этом контексте, в частности, даются ссылки на способы химического синтеза, описанные Verma and Eckstein (1998).
Одноцепочечные РНК могут быть также получены ферментативной транскрипцией из синтетических ДНК-матриц или из ДНК-плазмид, выделенных из рекомбинантных бактерий. Обычно используют РНК-полимеразы фагов, такие как РНК-полимераза Т7, Т3 или SP6 (Milligan and Uhlenbeck (1989)).
Следующий аспект данного изобретения относится к способу опосредования мишень-специфической модификации нуклеиновых кислот, в частности интерференции РНК и/или метилирования ДНК в клетке или в организме, предусматривающему стадии:
(а) контактирования клетки или организма с двухцепочечной молекулой РНК данного изобретения в условиях, в которых могут происходить мишень-специфические модификации нуклеиновых кислот, и
(b) опосредования мишень-специфической модификации нуклеиновой кислоты, выполняемой этой двухцепочечной РНК в отношении нуклеиновой кислоты-мишени, имеющей часть последовательности, по существу соответствующую этой двухцепочечной РНК.
Предпочтительно, стадия контактирования (а) предусматривает введение двухцепочечной молекулы РНК в клетку-мишень, например, в выделенную клетку-мишень, например в клеточную культуру, одноклеточный микроорганизм или клетку-мишень или множество клеток-мишеней в многоклеточном организме. Более предпочтительно, стадия введения предусматривает опосредованную носителем доставку, например посредством липосомных носителей или посредством инъекции.
Способ данного изобретения может быть использован для определения функции гена в клетке или организме или даже для модуляции функции гена в клетке или организме, будучи способным опосредовать интерференцию РНК. Эта клетка является предпочтительно эукариотической клеткой или линией клеток, например растительной клеткой или клеткой животного, такой как клетка млекопитающего, например эмбриональной клеткой, плюрипотентной стволовой клеткой, опухолевой клеткой, например клеткой тератокарциномы или инфицированной вирусом клеткой. Организм предпочтительно является эукариотическим организмом, например растением или животным, таким как млекопитающее, в частности человек.
Ген-мишень, на который нацелена молекула РНК данного изобретения, может быть ассоциирован с патологическим состоянием. Например, этот ген может быть патоген-ассоциированным геном, например вирусным геном, опухоль-ассоциированным геном или геном, ассоциированным с аутоиммунным заболеванием. Ген-мишень может быть также гетерологичным геном, экспрессируемым в рекомбинантной клетке или генетически измененном организме. Посредством определения или модуляции, в частности ингибирования функции такого гена, могут быть получены ценная информация и терапевтические выгоды в области сельского хозяйства или в медицине или ветеринарии.
ДцРНК обычно вводят в виде фармацевтической композиции. Введение может проводиться известными способами, в которых нуклеиновую кислоту вводят в желаемую клетку-мишень in vitro или in vivo. Обычно используемые способы переноса генов включают в себя кальций-фосфатный, ДЭАЭ-декстрановый способы, способы электропорации и микроинъекции и вирусные способы (Graham, F.L. and van der Eb, A.J. (1973) Virol. 52, 456; McCutchan, J.H. and Pagano, J.S. (1968), J. Natl. Cancer Inst. 41, 351; Chu, G. et al (1987), Nucl. Acids Res. 15, 1311, Fraley, R. et al. (1980), J. Biol. Chem. 255, 10431; Capecchi, M.R. (1980), Cell 22, 479). Недавним дополнением к этому арсеналу способов для введения ДНК в клетки является применение катионных липосом (Felgner, P.L. et al. (1987), Proc. Natl. Acad. Sci USA 84, 7413). Коммерчески доступными формами катионных липидов являются Tfx 50 (Promega) или липофектамин 2000 (Life Technologies).
Таким образом, данное изобретение относится также к фармацевтическим композициям, содержащим в качестве активного агента по меньшей мере одну двухцепочечную молекулу РНК, описанную выше, и фармацевтический носитель. Эта композиция может быть использована для диагностических и для терапевтических применений в медицине или в ветеринарии.
Для диагностических или терапевтических применений эта композиция может быть в форме раствора, например инъекционного раствора, крема, мази, таблетки, суспензии или т.п. Композицию можно вводить любым подходящим способом, например инъекцией, пероральным, местным, назальным, ректальным введением и т.д. Носителем может быть любой подходящий фармацевтический носитель. Предпочтительно, используют носитель, который способен увеличивать эффективность молекул РНК в отношении вхождения в клетки-мишени. Подходящими примерами таких носителей являются липосомы, в частности катионные липосомы. Дополнительным предпочтительным способом введения является инъекция.
Следующим предпочтительным применением способа интерференции РНК является функциональный анализ эукариотических клеток или эукариотических организмов (не человека), предпочтительно клеток или организмов млекопитающих и наиболее предпочтительно клеток человека, например клеточных линий, таких как HeLa или 293, или грызунов, например, крыс и мышей. Трансфекцией подходящих двухцепочечных молекул РНК, которые гомологичны заранее заданным гену-мишени или молекулам ДНК-мишеням, кодирующим подходящую двухцепочечную молекулу РНК, может быть получен фенотип с нокаутом гена в клетке-мишени, например, в культуре клеток или в организме-мишени. Неожиданно было обнаружено, что присутствие коротких двухцепочечных молекул РНК не приводит к интерфероновой реакции клетки-хозяина или организма-хозяина.
Таким образом, следующим предметом данного изобретения является эукариотическая клетка или эукариотический организм (не человек), проявляющие фенотип со специфическим в отношении гена-мишени нокаутом, включающий в себя по меньшей мере частично недостаточную экспрессию по меньшей мере одного эндогенного гена-мишени, где указанные клетка или организм трансфицированы по меньшей мере одной двухцепочечной молекулой РНК, способной ингибировать экспрессию по меньшей мере одного эндогенного гена-мишени, или ДНК, кодирующей по меньшей мере одну молекулу двухцепочечной РНК, способную ингибировать экспрессию по меньшей мере одного эндогенного гена-мишени. Следует отметить, что данное изобретение обеспечивает возможность мишень-специфического нокаута нескольких различных эндогенных генов вследствие специфичности интерференции РНК (РНКи).
Фенотипы клеток или организмов (не человека) с геноспецифическим нокаутом, в частности клеток человека или млекопитающих (не являющихся человеком), могут быть использованы в аналитических процедурах, например, в функциональном и/или фенотипическом анализе сложных физиологических процессов, таком как анализ профилей экспрессии генов и/или протеомов (белковых эквивалентов генома). Например, можно получить фенотипы с нокаутом генов человека в культивируемых клетках, которые предположительно являются регуляторами процессов альтернативного сплайсинга. Среди этих генов находятся, в частности, члены семейства факторов сплайсинга SR, например, ASF/SF2, SC35, SRp20, SRp40 или SRp55. Кроме того, может анализироваться действие белков SR на профили мРНК заранее заданных альтернативно сплайсированных генов, таких как CD44. Предпочтительно, этот анализ проводят высокопроизводительными способами с использованием чипов на основе олигонуклеотидов.
С применением технологий нокаутов на основе РНКи экспрессию эндогенного гена-мишени можно ингибировать в клетке-мишени или организме-мишени. Эндогенный ген может быть комплементирован экзогенной нуклеиновой кислотой-мишенью, кодирующей белок-мишень или вариантную или мутированную форму этого белка-мишени, например геном или кДНК, которые могут быть необязательно слиты с дополнительной последовательностью нуклеиновой кислоты, кодирующей детектируемый пептид или полипептид, например аффинную метку, в частности множественную аффинную метку. Варианты или мутированные формы гена-мишени отличаются от эндогенного гена-мишени тем, что они кодируют генный продукт, который отличается от продукта эндогенного гена на уровне аминокислот заменами, инсерциями и/или делециями одной или множественных аминокислот. Эти варианты или мутированные формы могут иметь ту же самую биологическую активность, что и эндогенный ген-мишень. С другой стороны, вариант или мутированный ген-мишень могут также иметь биологическую активность, которая отличается от биологической активности эндогенного гена-мишени, например частично делетированную активность, полностью делетированную активность, усиленную активность и т.д.
Комплементация может выполняться коэкспрессией полипептида, кодируемого экзогенной нуклеиновой кислотой, например, слитого белка, содержащего белок-мишень и аффинную метку, и молекулы двухцепочечной РНК для нокаута эндогенного гена в клетке-мишени. Эта коэкспрессия может выполняться с использованием подходящего экспрессирующего вектора, экспрессирующего как полипептид, кодируемый экзогенной нуклеиновой кислотой, например модифицированный меткой белок-мишень, так и молекулу двухцепочечной РНК, или альтернативно, с использованием комбинации экспрессирующих векторов. Белки и белковые комплексы, при синтезе de novo в клетке-мишени, будут содержать продукт экзогенного гена, например модифицированный слитый белок. Во избежание супрессии экспрессии продукта экзогенного гена этой дуплексной молекулой РНКи нуклеотидная последовательность, кодирующая экзогенную нуклеиновую кислоту, может быть изменена на уровне ДНК (с индукцией или без индукции мутаций на уровне аминокислот) в части последовательности, которая гомологична молекуле двухцепочечной РНК. Альтернативно, эндогенный ген-мишень может быть комплементирован соответствующими последовательностями нуклеотидов из других видов, например из мыши.
Предпочтительными применениями клетки или организма данного изобретения является анализ профилей экспрессии генов и/или протеомов (белковых эквивалентов генома). В особенно предпочтительном варианте проводят анализ варианта или мутантной формы одного или нескольких белков-мишеней, причем указанные варианты или мутантные формы повторно вводят в клетку или организм с использованием экзогенной нуклеиновой кислоты-мишени, как описано выше. Комбинирование нокаута эндогенного гена и спасения с использованием мутированной, например частично делетированной экзогенной мишени, имеет преимущества по сравнению с использованием клетки с нокаутом гена. Кроме того, этот способ особенно пригоден для идентификации функциональных доменов белка-мишени. В следующем предпочтительном варианте проводят сравнение, например, профилей экспрессии генов и/или протеомов и/или фенотипических характеристик по меньшей мере двух клеток или организмов. Эти организмы выбраны из:
(i) контрольной клетки или контрольного организма без ингибирования гена-мишени,
(ii) клетки или организма с ингибированием клетки-мишени и
(iii) клетки или организма с ингибированием гена-мишени плюс комплементацией гена-мишени экзогенной нуклеиновой кислотой-мишенью.
Способ и клетка данного изобретения пригодны также в процедуре для идентификации и/или характеристики фармакологических агентов, например идентификации новых фармакологических агентов из коллекции тест-веществ и/или характеристики механизмов действия и/или побочных действий известных фармакологических агентов.
Таким образом, данное изобретение относится также к системе для идентификации и/или характеристики фармакологических агентов, действующих по меньшей мере на один белок-мишень, содержащей:
(а) эукариотическую клетку или эукариотический организм (не человека), способные экспрессировать по меньшей мере один эндогенный ген-мишень, кодирующий указанный белок-мишень,
(b) по меньшей мере одну двухцепочечную молекулу РНК, способную ингибировать экспрессию указанного по меньшей мере одного эндогенного гена-мишени, и
(с) тест-вещество или коллекцию тест-веществ, где фармакологические свойства указанных тест-веществ или указанной коллекции подлежат идентификации и/или характеристике.
Кроме того, описанная выше система предпочтительно содержит:
(d) по меньшей мере одну экзогенную нуклеиновую кислоту-мишень, кодирующую белок-мишень или вариант или мутированную форму этого белка-мишени, причем указанная экзогенная нуклеиновая кислота-мишень отличается от эндогенного гена-мишени на уровне нуклеиновой кислоты таким образом, что экспрессия этой экзогенной нуклеиновой кислоты-мишени существенно менее ингибируется двухцепочечной молекулой РНК, чем экспрессия эндогенного гена-мишени.
Кроме того, способ комплементации нокаута РНК может быть использован для препаративных целей, например для аффинной очистки белков или белковых комплексов из эукариотических клеток, в частности клеток млекопитающих и, более конкретно, клеток человека. В этом варианте данного изобретения экзогенная нуклеиновая кислота-мишень предпочтительно кодирует белок-мишень, который слит с аффинной меткой.
Препаративный способ может использоваться для очистки высокомолекулярных белковых комплексов, которые предпочтительно имеют массу ≥ 150 кД и, более предпочтительно, ≥ 500 кД, которые необязательно могут содержать нуклеиновые кислоты, такие как РНК. Конкретными примерами являются гетеротримерный белковый комплекс, состоящий из белков с М.м. 20 кД, 60 кД и 90 кД частицы нмРНП U4/U6, фактор сплайсинга SF3b из нмРНП U2 17S, состоящий из 5 белков, имеющих молекулярные массы 14, 49, 120, 145 и 155 кД, и частица три-нмРНП U4/U6/U5 25 S, содержащая молекулы нмРНК U4, U5 и U6 и приблизительно 30 белков, которая имеет молекулярную массу около 1,7 МД.
Этот способ пригоден также для функционального анализа протеома в клетках млекопитающих, в частности клетках человека.
Далее данное изобретение объясняется более подробно в следующих фигурах и примерах.
Подписи к фигурам
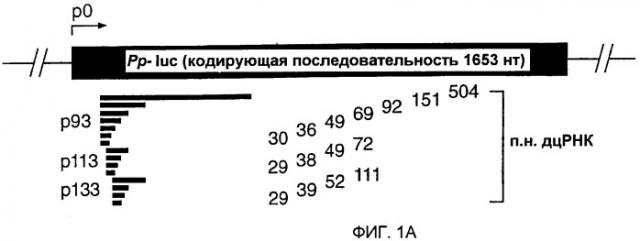
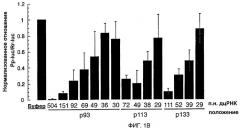
Фиг. 1: Двухцепочечная РНК с длиной всего лишь 38 п.н. может опосредовать интерференцию РНК (РНКи).
(А) Графическое представление дцРНК, используемых для нацеливания на мРНК Рр-luc. Получали три серии дцРНК с тупыми концами, охватывающими диапазон 29-504 п.н. Положение первого нуклеотида смысловой цепи дцРНК показано относительно стартового кодона мРНК Рр-luc (р1). (В) Анализ интерференции РНК (Tuschl et al., 1999). Отношение активности Рр-luc-мишени к активности контроля Rr-luc нормализовали относительно буферного контроля (черный столбец). ДцРНК (5 нМ) предынкубировали в лизате Drosophila в течение 15 минут при 25оС перед добавлением 7-метилгуанозин-кэппированных мРНК Рр-luc и Rr-luc (~50 пМ). Инкубирование продолжали еще в течение одного часа и затем анализировали двойным люциферазным анализом (Promega). Данные представлены в виде среднего из по меньшей мере четырех независимых экспериментов ± стандартное отклонение.
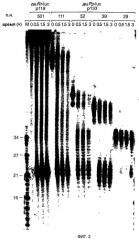
Фиг. 2: ДцРНК размером 29 п.н. уже не процессируется до фрагментов размером 21-23 нт. Временной ход образования 21-23-мера из процессинга 32Р-меченых внутри дцРНК (5 нМ) в лизате Drosophila. Указаны длина и источники этих дцРНК. Маркер размера РНК (М) наносили в левой дорожке и указаны размеры фрагментов. Двойные полосы при времени нуль обусловлены неполностью денатурированными дцРНК.
Фиг. 3: Короткие дцРНК расщепляют мРНК-мишень только один раз.
(А) Денатурирующий гель-электрофорез стабильных продуктов 5'-расщепления, получаемых посредством 1-часового инкубирования 10 нМ смысловой или антисмысловой РНК, 32Р-меченой при кэпе, 10 нМ дцРНК серии р133 в лизате Drosophila. Маркеры длин генерировали частичным расщеплением нуклеазой Т1 и частичным щелочным гидролизом (ОН) кэп-меченой РНК-мишени. Районы, на которые нацелены эти дцРНК, показаны в виде черных столбцов на обеих сторонах. Показано расстояние 20-23 нт между преобладающими сайтами расщепления для дцРНК с длиной 111 п.н. Горизонтальная стрелка указывает неспецифическое расщепление, не обусловленное интерференцией РНК (РНКи). (В) Положение сайтов расщепления на смысловой и антисмысловой РНК-мишенях. Последовательности кэппированных смысловой 177 нт и антисмысловой 180 нт РНК-мишеней представлены в антипараллельной ориентации, так что комплементарные последовательности противостоят друг другу. Районы, на которые нацелены эти различные дцРНК, показаны различно окрашенными стержнями, расположенными между смысловой и антисмысловой последовательностями-мишенями. Сайты расщепления показаны кружками: большой кружок для сильного расщепления, малый кружок для слабого расщепления. 32Р-радиоактивно меченая фосфатная группа указана звездочкой.
Фиг. 4: РНК-фрагменты размером 21 и 22 нт получены по РНКаза III-подобному механизму.
(А) Последовательности РНК из ~21 нт после процессинга дцРНК. РНК-фрагменты из ~21 нт, генерированные процессингом дцРНК, направленным образом клонировали и секвенировали. Олигорибонуклеотиды, происходящие из смысловой цепи дцРНК, показаны в виде синих линий, олигорибонуклеотиды, происходящие из антисмысловой цепи, в виде красных линий. Толстые стержни используются, если одна и та же последовательность присутствует во множественных клонах, причем число справа показывает частоту встречаемости. Сайты расщепления РНК-мишени, опосредованного дцРНК, показаны в виде оранжевых кружков, большой кружок для сильного расщепления, малый кружок для слабого расщепления (см. фиг. 3В). Кружки над смысловой цепью показывают сайты расщепления в смысловой мишени, а кружки ниже дцРНК показывают сайт расщепления в антисмысловой мишени. До пяти дополнительных нуклеотидов были идентифицированы во фрагментах из ~21 нт, происходящих из 3'-концов дцРНК. Эти нуклеотиды являются случайными комбинациями преимущественно остатков С, G или А и были, наиболее вероятно, добавлены безматричным образом во время Т7-транскрипции дцРНК-составляющих цепей. (В) Анализ с использованием двухмерной тонкослойной хроматографии (ТСХ) нуклеотидного состава РНК из ~21 нт. РНК из ~21 нт получали инкубированием радиоактивно меченой внутри дцРНК размером 504 п.н. Рр-luc в лизате Drosophila, очищали из геля и затем расщепляли до мононуклеотидов нуклеазой Р1 (верхний ряд) или рибонуклеазой Т2 (нижний ряд). ДцРНК радиоактивно метили внутри транскрипцией в присутствии одного из указанных α-32Р-нуклеозидтрифосфатов. Радиоактивность детектировали фосфор-томографией. Нуклеозид-5'-монофосфаты, нуклеозид-3'-монофосфаты, нуклеозид-5',3'-дифосфаты и неорганический фосфат показаны как pN, Np, pNp и pi, соответственно. Черные кружки показывают УФ-поглощающие пятна из нерадиоактивных нуклеотидов-носителей. 3',5'-бисфосфаты (красные кружки) идентифицировали комиграцией с радиоактивно мечеными стандартами, полученными 5'-фосфорилированием нуклеозид-3'-монофосфатов полинуклеотидкиназой Т4 с использованием γ-32Р-АТФ.
Фиг. 5: Синтетические РНК из 21 и 22 нт опосредуют расщепление РНК-мишени.
(А) Графическое представление контрольной дцРНК размером 52 п.н. и синтетических дцРНК из 21 и 22 нт. Смысловая цепь коротких интерферирующих РНК из 21 и 22 нт (siRNA) показана синим цветом, антисмысловая цепь - красным цветом. Последовательности siRNA происходят из клонированных фрагментов дцРНК размером 52 и 111 п.н. (фиг. 4А), за исключением антисмысловой цепи 22 нт дуплекса 5. siRNA в дуплексе 6 и 7 были уникальными в отношении реакции процессинга дцРНК 111 п.н. Два 3'-выступающих нуклеотида, показанные зеленым цветом, присутствуют в последовательности синтетической антисмысловой цепи дуплексов 1 и 3. Обе цепи контрольной дцРНК размером 52 п.н. получали транскрипцией in vitro, и фракция транскриптов может содержать безматричное добавление 3'-нуклеотидов. Сайты расщепления РНК-мишени, управляемые дуплексами siRNA, показаны оранжевыми кружками (см. подпись к фиг. 4А) и были определены, как показано на фиг. 5В. (В) Положение сайтов расщепления на смысловой и антисмысловой РНК-мишенях. РНК-последовательности-мишени являются такими же, как описанные на фиг. 3В. Контрольную дцРНК размером 52 п.н. (10 нМ) или РНК-дуплексы из 21 и 22 нт 1-7 (100 нМ) инкубировали с РНК-мишенью в течение 2,5 часов при 25оС в лизате Drosophila. Стабильные 5'-продукты расщепления разделяли на геле. Сайты расщепления показаны на фиг. 5А. Район, на который нацелена дцРНК размером 52 п.н., или смысловая (s) или антисмысловая (as) цепи, показаны сбоку от геля. Все сайты расщепления локализованы в районе идентичности этих дцРНК. Для точного определения сайтов расщепления антисмысловой цепи использовали более низкопроцентный гель.
Фиг. 6: Длинные 3'-выступы на коротких дцРНК ингибируют интерференцию РНК (РНКи).
(А) Графическое представление конструкций дцРНК размером 52 п.н. 3'-удлинения смысловой и антисмысловой цепей показаны синим и красным цветом, соответственно. Наблюдаемые сайты расщепления на РНК-мишенях представлены в виде оранжевых кружков, аналогично фиг. 4А, и были определены, как показано на фиг. 6В. (В) Положение сайтов расщепления на смысловой и антисмысловой РНК-мишенях. Последовательности РНК-мишеней являются такими же, как показанные на фиг. 3В. ДцРНК (10 нМ) инкубировали с РНК-мишенью в течение 2,5 часов при 25оС в лизате Drosophila. Стабильные 5'-продукты расщепления разделяли на геле. Главные сайты расщепления показаны горизонтальной стрелкой и также представлены на фиг. 6А. Область, на которую нацелена дцРНК размером 52 п.н., представлена в виде черного стержня на обеих сторонах геля.
Фиг. 7: Предлагаемая модель интерференции РНК (РНКи).
Предсказывается, что РНКи начинается с процессинга дцРНК (смысловая цепь изображена черным цветом, антисмысловая цепь красным цветом) до преимущественно коротких 21 и 22 нт интерферирующих РНК (siRNA). Короткие выступающие 3'-нуклеотиды, если они присутствуют на дцРНК, могут быть выгодными для процессинга коротких дцРНК. Белки процессинга дцРНК, которые еще должны быть охарактеризованы, представлены зелеными и синими овалами, и собираются на дцРНК асимметричным образом. В модели авторов это иллюстрируется связыванием гипотетического синего белка или домена белка с цепью siRNA в 3'-5'-направлении, тогда как гипотетический зеленый белок или домен белка всегда связан с противолежащей цепью siRNA. Эти белки или подсерия остаются связанными с дуплексом siRNA и сохраняют свою ориентацию, определяемую направлением реакции процессинга дцРНК. Только последовательность siRNA, связанная с синим белком, способна «руководить» (управлять) расщеплением РНК-мишени. Эндонуклеазным комплексом называется малый интерферирующий рибонуклеопротеиновый комплекс или siRNР. Здесь предполагается, что эндонуклеаза, которая расщепляет дцРНК, может также расщеплять РНК-мишень, возможно, временным смещением пассивной цепи siRNA, не используемой для узнавания мишени. Затем РНК-мишень расщепляется в центре района, узнаваемого последовательность-комплементарной «руководящей» siRNA.
Фиг. 8: Репортерные конструкции и siRNA-дуплексы.
(а) Иллюстрированы районы репортерного гена люциферазы светляка (Рр-luc) и морской фиалки (sea pansy) (Rr-luc) из плазмид pGL2-Control, pGL3-Control и pRL-TK (Promega). Указаны регуляторные элементы SV40, промотор тимидинкиназы HSV и два интрона (линии). Последовательность люциферазы GL3 на 95% идентична GL2, но RL является сов