Композиция клопидогреля и сульфоалкилового эфира циклодекстрина (варианты) и способы лечения заболеваний посредством названной композиции (варианты)
Иллюстрации
Показать всеНастоящее изобретение обеспечивает композиции, содержащие клопидогрель и сульфоалкиловый эфир циклодекстрина (САЭ-ЦД), предпочтительно сульфобутиловый эфир циклодекстрина. Композиции могут быть жидкими, суспензионными или твердыми. Композиции предназначены для приема внутрь, перорального или парентерального введения. САЭ-ЦД выполняет роль средства, способствующего растворению и стабилизации клопидогреля в водных средах. Повышается устойчивость клопидогреля к гидролитическому, термическому и фотолитическому разрушению. САЭ-ЦД дает улучшенные результаты по сравнению с другими производными циклодекстрина. Композиции по изобретению снижают скорость хиральной инверсии (S)-клопидогреля в (R)-клопидогрель. Они дают существенные фармакокинетические, фармакодинамические и/или терапевтические преимущества по сравнению с таблеточной композицией, вводимой перорально и не содержащей САЭ-ЦД. 9 н. и 49 з.п. ф-лы, 18 ил., 14 табл., 27 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции, содержащей клопидогрель и сульфоалкилциклодекстрин, к их применению при лечении расстройств и заболеваний, которые терапевтически реагируют на клопидогрель, и к другим способам их применения.
Уровень техники
Гидросульфат клопидогреля, метил-(+)-(3)-α-(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-ацетат сульфат (1:1), представляет собой ингибитор АДФ-индуцированной агрегации тромбоцитов, оказывающий прямое ингибирование на связывание аденозиндифосфата (АДФ) с его рецептором и последующую АДФ-опосредованную активацию комплекса гликопротеина GPIIb/IIIa. Клопидогрель селективно ингибирует связывание аденозиндифосфата (АДФ) с его рецептором тромбоцитов и последующую АДФ-опосредованную активацию комплекса гликопротеина GPIIb/IIIa, подавляя тем самым агрегацию тромбоцитов. Биопревращение клопидогреля необходимо, чтобы вызвать ингибирование агрегации тромбоцитов. Был выделен активный метаболит, ответственный за активность лекарства (Pereillo et al., Drug Metab. Disposition (2002), 30(11), 1288-1295). Клопидогрель также ингибирует агрегацию тромбоцитов, индуцируемую другими агонистами, помимо АДФ, за счет блокирования амплификации активации тромбоцитов при выделении АДФ. Клопидогрель не ингибирует активность фосфодиэстеразы.
Гидросульфат клопидогреля представляет собой порошок белого-грязно-белого цвета. Он в частности нерастворим в воде при нейтральном рН, но легко растворяется при рН 1. В патенте США №4847265 раскрывается декстроротационная форма клопидогреля. В патентах США №№7074928, 6767913, 6504030, 6429210, 6504030 раскрываются полиморфные формы гидросульфата клопидогреля. В патентах США №№6858734, 6800759 и 6737411 раскрываются различные способы приготовления клопидогреля. Солевые формы, полиморфные модификации и способы получения клопидогреля раскрыты в предыдущих публикациях патентов США №20060154957, №20060100231, №20060074242, №20060047121, №20060041136, №20050256152, №20050228012, №20050203122, №20050143414, №20050049275 и №20050049226. В международной публикации РСТ № WO 03/66637 раскрывается гидрохлоридная солевая форма клопидогреля и способ ее получения.
В настоящее время клопидогрель продается в США под торговым названием PLAVIX (Sanofi Aventis). Он поставляется в виде таблеток, содержащих 75 мг эквивалентов основания клопидогреля, хотя лекарство находится в виде гидросульфатной соли. Он также доступен в виде таблеток общего типа (Apotex, Inc.). В патенте США 6914141 раскрывается таблеточный состав, содержащий гидросульфат клопидогреля.
PLAVIX - это антитромбоцитарный препарат, одобренный Администрацией по контролю за продуктами питания и лекарствами США, для снижения атеротромботических исходов 1) у пациентов с историей недавнего инфаркта миокарда (ИМ), недавнего внезапного приступа или установленной болезнью периферических артерий (БПА) и 2) у пациентов с острым коронарным синдромом (нестабильной стенокардией/Q-необразующий ИМ), включая пациентов, которым оказывают медицинскую помощь, и пациентов, которым оказывают помощь через чрескожное вмешательство на коронарных сосудах (чрескожную транслюминальную коронарную ангиопластику (ЧКА), стент, атероэктомию и т.д.) или через аорто-коронарное шунтирование (АКШ). PLAVIX - отпускаемый по рецепту препарат, который при ежедневном приеме может способствовать снижению риска возникновения сердечного приступа и удара в будущем. В патенте США №5576328 раскрывается способ предотвращения вторичных ишемических исходов посредством введения клопидогреля после начала первичного ишемического исхода. В патенте США №6071514 раскрываются способы лечения тромботических расстройств посредством введения клопидогреля больным, нуждающимся в нем. Von Beckerath и соват. (Circulation (2005), 112, 2946-2950) раскрывают результаты клинического исследования по сравнению поглощения, метаболизма и антитромбоцитарных эффектов 300 мг, 600 мг и 900 мг ударных доз клопидогреля, вводимого путем приема внутрь дробленных таблеток Plavix®. Они сообщают, что максимальная АДФ-индуцированная агрегация тромбоцитов происходит за 4 часа. Plavix ингибировал агрегацию тромбоцитов, индуцированную 5 мкм АДФ, приблизительно на 23% (300 мг доза), 34% (600 мг доза), 39% (900 мг доза), при этом различия в антитромбоцитарном действии между 600 и 900 мг дозами оказались минимальными. Эти временные промежутки по существу схожи с временными промежутками, обычно наблюдаемыми после введения целых таблеток PLAVIX® (Weerakody et al. Am. J. Cardiol. 2007:100:331-336).
При клиническом регулировании таблетки PLAVIX® вводят через рот до проведения оперативных кардиологических процедур, таких как чрескожное вмешательство на коронарных сосудах (ЧВКС), для того чтобы уменьшить агрегацию тромбоцитов у пациента и тем самым снизить риск реокклюзии или рестеноза во время проведения процедуры или после нее. Количество клопидогреля, вводимого пациенту, связано с расчетным временем проведения процедуры для определенного пациента. В общем, чем больше количество вводимого клопидогреля, тем меньше времени требуется для достижения желаемого терапевтического эффекта (например, подавления агрегации тромбоцитов). Для средней дозы (300 мг клопидогреля в таблетке PLAVIX®) характерное время, необходимое для достижения желаемого терапевтического эффекта (например, подавления агрегации тромбоцитов) варьируется от двух до пяти часов. Если процедуру необходимо проводить незамедлительно (например, ЧВКС необходимо проводить не более, чем через два-три часа), то вводят большую дозу клопидогреля по сравнению с дозой, которую необходимо вводить в случае проведения процедуры через два, три или более часов. Например, пациенту, который подвергается проведению процедуры за 60-180 минут перед введением клопидогреля, можно вводить 600 мг дозу. В случае начала процедуры со 180 минуты или дольше после введения клопидогреля, пациенту можно вводить 300 мг дозу. Основанием использования такой схемы дозирования является наличие заметного эффекта насыщения дозы in vivo, в силу чего увеличение дозы не приводит к увеличению суммарной эффективности лекарства, но только к увеличению скорости терапевтического развития заболевания, т.е. к повышению скорости, с которой достигается целевое ингибирование агрегации тромбоцитов после введения лекарства. Тип используемого специфического протокола и время до и после введения большой или маленькой доз варьируются в различных учреждениях, но чем выше уровень используемой дозы, тем более быстро проводятся процедуры после дозировки.
Однако нежелательно вводить чрезмерно большие количества клопидогреля из-за его токсикологического действия. К побочным эффектам клопидогреля относятся кровоизлияние, расстройство желудка или боль в желудке, диарея, запор, головная боль, головокружение, быстропроходящая сыпь, гриппоподобные симптомы, боль в суставах или в спине, необычно долгое кровотечение, необычный или легкий кровоподтек или кровотечение, черный кал, рвота, боль в груди, припухлость, депрессия, лихорадка, продолжительная боль в горле, необычная слабость, изменения остроты зрения, невнятная речь, помрачение сознания, тяжелые высыпания, зуд, тяжелые головокружения или затрудненное дыхание. Более того, если у пациента имеется тяжелое кардиальное событие, например, ОКС (острый коронарный синдром), то его надо лечить как можно быстрее, для того чтобы минимизировать риск миокардиального поражения, который быстро увеличивается со временем. Клинический врач должен уметь диагностировать пациента как можно быстрее с целью определения надлежащего неотложного медицинского лечения настолько быстро, насколько это возможно. Целью является возможность излечения пациента, которому требуется ЧВКС в течение 9 минут после госпитализации из-за ОКС, но такой короткий промежуток времени нереален или ненадежен при использовании таблеток PLAVIX®. Более того, в то время как клопидогрель противопоказан в основных инвазивных неотложных хирургических процедурах, таких как аортокоронарное шунтирование (АКШ), он показан при минимально инвазивных неотложных процедурах, таких как ЧВКС. На данном этапе один из стандартных протоколов лечения включает в себя следующие стадии: 1) определение наличия у пациента ОКС; 2) оповещение зондовой лаборатории о прибытии пациента; 3) пероральное введение 300-600 мг клопидогреля (в виде таблетки(ок) PLAVIX®); 4) транспортировка пациента в зондовую лабораторию; 5) снятие коронарограммы; 6) определение того, какая из медицинских терапий по отдельности, ЧВКС или АКШ, является наиболее подходящей; и 7) если показано проведение отдельной медицинской терапии, то пациента лечат продолжительной (хронической) терапией клопидогрелем; или 8) если показано проведение ЧВКС, то проводится ЧВКС и пациента поддерживают с помощью продолжительной (хронической) терапии клопидогрелем; или 8) если показано проведение АКШ, то АКШ задерживают до тех пор, пока агрегация тромбоцитов у пациента не вернется к нормальному уровню. При проведении АКШ в течение 7 дней после принятия пациентом дозы клопидогреля высок риск обширного кровотечения, осложнений, связанных с кровоизлиянием, и появляется необходимость в переливании крови (Pickard и соавт. Pharmacotherapy (2008), 23, 376-392). К сожалению, при задержке приема таблеток PLAVIX® до тех пор, пока не будет определено, показано ли проведение ЧВКС вместо АКШ, у пациента, подвергающегося ЧВКС, существует повышенный риск реокклюзии или рестеноза. Кроме того, введение таблеток через рот пациенту, находящемуся под наркозом, затруднено, что часто встречается в случаях с больными, подвергающимися коронарографии.
Соответственно, для данной области терапии было бы очень полезным разработать состав, который бы обеспечивал более быстрое терапевтическое начало без необходимости в приеме таких излишних доз, которые вводят в настоящее время.
Клопидогрель можно принимать с другим лекарством для лечения расстройства или заболевания у больного. Клопидогрель, при принятии его вместе с аспирином, рекомендован людям, госпитализированным с болью в груди, связанной с сердцем, или имеющим определенный тип сердечного приступа - расстройство, которое на медицинском языке называется острым коронарным синдромом (ОКС). В патенте США №7018990 раскрывается совместное введение ингибитора фактора Ха и клопидогреля. В патенте США №6509348 раскрывается совместное введение антитромбоцитарного лекарства, блокирующего АДФ-рецептор, и антагониста тромбоксанового А2 рецептора и способа подавления образования тромбов за счет совместного введения. В патенте США №6248729 раскрывается совместное введение антитромбоцитарного лекарства, блокирующего АДФ-рецептор, и гипотензивного препарата для предотвращения церебрального инфаркта. В патенте США №5989578 раскрывается совместное введение клопидогреля и антитромбоцитарного средства. Совместное использование клопидогреля с другими лекарствами раскрывается в предыдущих публикациях США №20050043382 и №20040067995 и в статьях, опубликованных Wegert и соавт. (Int. J. Clin. Pharmacol. Ther. (2002), 40(4), 135-141) и Gurbel и соавт. (Circulation, (2005), 111(9):1153-1159).
В различных патентах и публикациях США раскрываются составы, содержащие клопидогрель, например, в патентах США №6923988, №6761903, №6720001, №6569463, №6451339, №6429210, №6383471, №6294192 и публикациях США №20060223845, №20060003002, №20040115287, №20030104048, №20020032149.
Циклодекстрины - это циклические углеводороды, получаемые из крахмала. Немодицифированные циклодекстрины отличаются по числу глюкопиранозных звеньев, соединенных вместе в цилиндрическую структуру. Родоначальные циклодекстрины содержат 6, 7 или 8 глюкопиранозных звеньев и называются α-, β- и γ-циклодекстринами соответственно. Каждое подзвено циклодекстрина содержит вторичные гидроксильные группы во 2- и 3-положениях и первичную гидроксильную группу в 6-положении. Циклодекстрины можно изобразить в виде полых усеченных конусов с гидрофильными внешними поверхностями и гидрофобными внутренними полостями. В водных растворах эти гидрофобные полости обеспечивают укрытие для гидрофобных органических соединений, которые могут заполнять все пространство или часть их структуры в этих полостях. Этот процесс, известный как образование комплексов включения, может приводить к заметному увеличению растворимости в воде и устойчивости закомплексованного лекарства, однако степень стабилизации будет варьироваться при переходе от одного лекарства к другому. Комплекс стабилизируется гидрофобными взаимодействиями, при этом стабилизация не включает образование каких-либо ковалентных связей.
Химическое модифицирование родоначальных циклодекстринов (обычно по гидроксильным компонентам) дало производные с немного улучшенной безопасностью при сохранении и улучшении комплексообразующей способности циклодекстрина. Среди многочисленных дериватизированных циклодекстринов, полученных на сегодняшний день, только два из них, по-видимому, являются рентабельными; это 2-гидроксипропильные производные (ГП-β-ЦД или ГПЦД), нейтральные молекулы, которые разработаны для коммерческого производства Janssen и др., и сульфоалкилэфирные производные (САЭ-β-ЦД или САЭ-ЦД), которые разработаны компанией CyDex Pharmaceuticals, Inc.
R=(-H)21-n или (-(СН2)4-SО3Nа)n,
где n=6,0-7,1
Сульфобутил-β-циклодекстрин (Captisol®)
САЭ-ЦД - это класс отрицательно заряженных циклодекстринов, которые отличаются природой алкильного спейсера, солевой формы, степенью замещения и природой исходного родоначального циклодекстрина. Натриевая соль сульфобутилэфирного производного бета-циклодекстрина, содержащая в среднем 7 заместителей на молекулу циклодекстрина (СБЭ7-β-ЦД), коммерциализирована компанией CyDex Pharmaceuticals, Inc. (Kansas) как CAPTISOL® циклодекстрин.
Анионный сульфобутилэфирный заместитель поразительно улучшает растворимость родоначального циклодекстрина в воде. Наоборот, нековалентное комплексообразование лекарств с CAPTISOL® циклодекстрином, как правило, позволяет повысить растворимость и устойчивость некоторых лекарств в водных растворах. Однако, улучшенные свойства САЭ-ЦД или ГП-β-ЦД в показателях связывания со специфическими лекарствами являются отчасти непредсказуемыми. Известно, что многие лекарства лучше связываются с САЭ-ЦД, тогда как другие лучше связываются с ГП-β-ЦД. Более того, CAPTISOL® циклодекстрин является относительно новым препаратом, и совместное его использование с клопидогрелем еще не оценивалось или не предлагалось в предшествующем уровне техники.
В различных ссылках на патенты, в которых раскрываются композиции, содержащие различные солевые, аморфные, кристаллические и/или полиморфные формы клопидогреля, необязательно в присутствии другого лекарства, высказывается мысль о возможном включении клопидогреля в такие композиции в виде комплекса с циклодекстрином. Однако, ни в одной из тех ссылок не описывается или не приводится в качестве примера САЭ-ЦД.
В словенском патенте №8121748, выданном 31 октября 2005 года Rudolf Rucman (DIAGEN D.O.O.), раскрываются комплексы включения клопидогреля, в виде свободного основания или солевой формы, и циклодекстрины, такие как β-ЦД, γ-ЦД, метилциклодекстрин и гидроксиалкилциклодекстрин, из которых последние два являются предпочтительными. В патенте также раскывается использование поли(винилпирролидона) с молекулярной массой 10000-40000 вместо циклодекстрина для солюбилизации клопидогреля. Kolbe и соавт. (J. Inclusion Phenomena and Macrocyclic Chemistry (2002 Dec), 44(1-4), рg. 183-184) раскрывают образование комплекса диметилциклодекстрина и основания клопидогреля в молярном соотношении 1:1. Комплекс осаждается из холодного раствора.
В публикации заявки на патент США №2004-0109888 под авторством Pun и соавт. раскрывается полимерный циклодекстриновый материал. В публикации заявки на патент США №2005-0109888 под авторством Fikstad и соавт. раскрывается "фармацевтическая композиция, содержащая: терапевтически эффективное количество лекарства, солюбилизатора и модулятора выделения, который способствует одновременному выделению лекарства и солюбилизатора.
В публикации заявки на патент США №2005-0276841 под авторством Davis и соавт. раскрывается "биоразлагаемое полимерное волокно с замедленным высвобожднием лекарства", при этом лекарство может быть закомплексовано циклодекстрином.
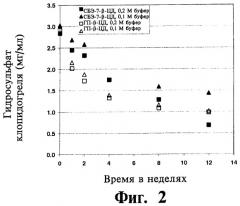
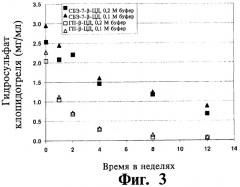
Известно, что клопидогрель обладает слабой химической устойчивостью в растворе. Его разложение обычно протекает по гидролитическому пути, при котором сложноэфирная форма превращается в производное карбоновой кислоты. Устойчивость клопидогреля к гидролизу зависит от рН, величина t90 составляет 52,7 дня при рН 5,6 в том случае, когда он хранится при 37°C в 0,1М фосфатном буфере (Drug Metab. Disposition (2000), 28(12), 1405-1410). Химически стойкий растворенный состав клопидогреля был бы полезен в данной области техники. Известно, что клопидогрель подвергается хиральной инверсии inversion in vivo и in vitro (Reist и соавт., Drug Metab. Dispos. (2000), 28(12), 1405-1410); однако (R)-энантиомер клопидогреля лишен антитромбоцитарной активности и может вызывать судороги у животных.
Вследствие того, что клопидогрель обладает токсикологическими свойствами и его, как правило, вводят в очень высоких дозах в условиях клинического процедурного кабинета, то желательно бы разработать состав, который бы позволял избегать введения ненужных больших количеств клопидогреля и в то же время обеспечивал бы необходимое повышение скорости терапевтического начала, т.е. желаемое снижение временного интервала после введения лекарства, за который это лекарство приводит к необходимому снижению агрегации тромбоцитов.
Раскрытие изобретения
Изобретение обеспечивает фармацевтическую композицию, содержащую клопидогрель (или его фармацевтически приемлемую соль), сульфоалкиловый эфир циклодекстрина (САЭ-ЦД) и необязательно один или несколько фармацевтиески приемлемых наполнителей. САЭ-ЦД в основном ответственен за солюбилизацию и стабилизацию клопидогреля, когда два этих вещества находятся в присутствии водной среды. Композиции изобретения снижают химическое разложение клопидогреля в растворе. Они также снижают скорость хиральной инверсии (S)-клопидогреля в (R)-клопидогрель. Даже если солевая форма клопидогреля может быть включена в текущий состав, от состава не требуется непременное выделение клопидогреля в сильнокислых условиях, поскольку в составе клопидогрель может использоваться скорее в виде свободного основания, а не в виде соли. Изобретение обеспечивает водный (необязательно прозрачный) жидкий состав, содержащий САЭ-ЦД, клопидогрель и водный жидкостный носитель. Состав изобретения может представлять собой состав однократного или многократного приема. Заявленный состав может также обладать самозащитой от микробного размножения в тех случаях, когда САЭ-ЦД присутствует в количествах, достаточных для остановки или снижения скорости микробного роста после заражения состава микробами. Настоящий состав также улучшает фотохимическую и термическую стойкость клопидогреля по сравнению с другими составами на основе циклодекстрина. Настоящее изобретение также обеспечивает раствор клопидогреля на основе САЭ-ЦД, который фармацевтически устойчив и не требует разведения перед введением.
В некоторых вариантах осуществления 1) сульфоалкиловый эфир циклодекстрина присутствует в количестве, достаточном для получения прозрачного раствора; 2) САЭ-ЦД присутствует в концентрации около 20-600 мг/мл, 50-500 мг/мл или 100-400 мг/мл (2-60%, 5-50% или 10-40% no отношению массы к объему, соответственно); 3)САЭ-ЦД - это СБЭх-β-ЦД, где x составляет от 6,0 до 7,1 или от 6,5 до 7; 4) САЭ-ЦД - это СБЭх-γ-ЦД, где x составляет от 6 до 8 или 6,5-7; 5) САЭ-ЦД - это соединение с формулой 1 (показанной ниже) или смесь этих соединений.
В некоторых вариантах осуществления 1) клопидогрель присутствует в терапевтически эффективных количествах; и/или 2) клопидогрель в виде эквивалентов свободного основания присутствует в концентрации около 1,5-20 мг/мл (около 4,7-62 мМ) или около 0,15-1,5 мг/мл (около 0,47-4,7 мМ). Изобретение также включает варианты изобретения, в которых: 1) молярное отношение САЭ-ЦД к клопидогрелю составляет, по меньшей мере, 6:1 или от 6:1 до 8:1 в тех случаях, когда рН равен или превышает 3,5; 2) молярное отношение САЭ-ЦД к клопидогрелю составляет менее 6:1 в тех случаях, когда рН составляет менее 3,5; 3) клопидогрель присутствует в концентрации около 7,5 мг/мл или менее в водном растворе, содержащем около 37% САЭ-ЦД (по отношению массы к объему) или менее при рН около 5,5; 4) клопидогрель присутствует в концентрации около 0,5 мг/мл или менее в водном растворе, содержащем около 2,5% САЭ-ЦД (по отношению массы к объему) или менее при рН около 5,5; 5) клопидогрель в виде эквивалентов свободного основания присутствует в концентрации около 0,15-20 мг/мл (около 0,47-62 мМ); или 6) клопидогрель в виде экивалентов гидросульфатной соли присутствует в концентрации около 0,2-26 мг/моль (0,47-62 мМ), 0,2-2 мг/мл (0,47-4,7 мМ) или 2-26 мг/мл (4,7-62 мМ).
В некоторых вариантах осуществления для состава не требуется разбавление перед введением его больному. В других вариантах осуществления жидкий состав может разводиться разбавителем на водной основе, не вызывая осаждение клопидогреля.
В некоторых вариантах осуществления состав, кроме того, содержит солюбилизатор, ароматизатор, подсластитель, агент, придающий вязкость, антиоксидант, буферное вещество, подкислитель, агент, усиливающий комплексообразование, лиофилизирующая добавка (например, наполнители или стабилизаторы), электролит, другое терапевтическое средство, подщелачивающий агент, противомикробное средство, противогрибковое средство или их комбинации.
В общем, жидкий состав обладает улучшенной фотохимической устойчивостью и подвергается меньшему фотолитическому разложению под воздействием люминесцентного излучения в сравнении с другим жидким составом, содержащим отличный циклодекстрин или производное циклодекстрина.
В некоторых вариантах осуществления состав обладает улучшенной химической стойкостью, например, улучшенной стойкостью к гидролизу клопидогреля, и подвергается меньшему гидролитическому разложению клопидогреля при воздействии водной среды по сравнению с другими составами, в которых САЭ-ЦД заменен на эквимолярные количества другого циклодекстрина, такого как ГП-β-ЦД.
Изобретение также обеспечивает способ приготовления водного (необязательно прозрачного) жидкого состава из воссоздаваемого твердого вещества, при этом способ включает в себя стадии: заготовки воссоздаваемого твердого вещества, содержащего клопидогрель, САЭ-ЦД и необязательно, по меньшей мере, один фармацевтический наполнитель, при этом твердое вещество воссоздается под действием водной жидкости, а молярное отношение САЭ-ЦД к клопидогрелю составляет, по меньшей мере, 6:1, по меньшей мере, от 6:1 до 8:1 или, по меньшей мере, 8:1 в том случае, когда рН водной жидкости превышает или равен 3,5; и воссоздания твердого вещества количеством водного жидкого носителя, по крайней мере, достаточным для суспендирования воссоздаваемого твердого вещества, посредством которого образуется водный (необязательно прозрачный) состав.
В некоторых вариантах осуществления жидкий состав приготовлен восстановлением воссоздаваемого твердого вещества, содержащего, по меньшей мере, САЭ-ЦД и клопидогрель, водный раствором, где определение воссоздаваемому твердому веществу было дано в этом документе. Наоборот, жидкий состав может быть лиофилизован или дегидратирован иным образом с образованием воссоздаваемого твердого вещества.
Некоторые варианты осуществления изобретения включают такие варианты, в которых: 1) жидким составом является суспензия; 2) количество добавляемого жидкого носителя достаточно для придания жидкому составу прозрачного вида; 3) концентрация клопидогреля в составе находится в диапазоне от 1,5 до 20 мг/мл или от 0,15 до 1,5 мг/мл; 4) рН состава приблизительно равен или меньше рКа клопидогреля; 5) рН состава приблизительно равен или больше рКа клопидогреля; 6) рН составляет от 4 до 8 в случае парентеральной доставки или при приеме через рот; 7) рН состава находится в диапазоне от 1 до 3, от 1 до 4, от 1 до 8, от 4 до 8 или от 4 до 6 в случае приема препарата через рот; 8) молярное отношение САЭ-ЦД к клопидогрелю составляет менее 6:1 в том случае, когда рН состава составляет менее 3,5; 9) молярное отношение САЭ-ЦД к клопидогрелю составляет, по меньшей мере, 6:1 или от 6:1 до 8:1 в том случае, когда рН состава равен или превышает 3,5; и/или 10) упомянутое молярное отношение составляет, по меньшей мере, 7,25:1 или 7,3:1 в том случае, когда рН состава равен или превышает 8; молярное отношение составляет, по меньшей мере, 6,5:1 или 6,6:1 в том случае, когда рН состава равен или превышает 5,5. Некоторые варианты осуществления изобретения включают такие варианты, в которых: 1) способ, кроме того, включает стадию перемешивания воссоздаваемого твердого вещества и водного жидкого носителя; и/или 2) после воссоздания жидкий состав готов для введения пациенту без необходимости в дополнительном разбавлении.
Изобретение также обеспечивает твердые лекарственные формы. Такие лекарственные формы можно вводить через рот, тонкую кишку, щеку, под язык или другими известными способами введения твердых лекарственных форм. К твердым лекарственным формам могут относиться таблетки, капсулы, порошки, воссоздаваемые твердые вещества и другие лекарственные формы такого типа. Парентеральное введение лекарственной формы можно проводить после растворения лекарственной формы в водном жидком носителе. Для твердых лекарственных форм, вводимых через рот, могут требоваться пониженные количества САЭ-ЦД в зависимости от целевого участка высвобождения лекарства в желудочно-кишечном тракте. В случае твердых лекарственных форм для приема внутрь, которые высвобождаются в области желудка, молярное отношение САЭ-ЦД к клопидогрелю может составлять менее 6 к 1, 5 к 1, 4 к 1, 3 к 1, 2 к 1, 1 к 1, 0,5 к 1, 0,25 к 1 и/или, по меньшей мере, 0,05 к 1. В случае твердых лекарственных форм для приема внутрь, которые высвобождаются в области(ях) после желудка, молярное соотношение САЭ-ЦД к клопидогрелю может составлять, по меньшей мере, 0,2 к 1, 0,5 к 1, 1 к 1, 2 к 1, 3 к 1, 4 к 1, 5 к 1, 6 к 1, 7 к 1, 8 к 1 и/или не более 100:1, 75:1, 40:1, 35:1, 30:1, 20:1, 15:1, 12:1 или не более 10:1.
Для получения отличных вариантов осуществления изобретения можно использовать комбинации различных верхних и нижних пределов молярного отношения САЭ-ЦД к клопидогрелю, изложенных в данном раскрытии. Изобретение также обеспечивает способ введения клопидогреля, который включает в себя введение готового к применению жидкого или твердого лекарственного состава для приема внутрь, содержащего сульфоалкиловый эфир циклодекстрина и клопидогрель или его фармацевтически приемлемую соль. Некоторые варианты осуществления способов изобретения включают такие варианты, в которых; 1) жидкий состав вводят парентерально, через тонкую кишку или через рот; 2) способ, кроме того, включает стадию разбавления концентрата, согласно изобретению, водным жидким носителем перед введением, что обеспечивает готовый к применению жидкий состав; 3) способ, кроме того, включает стадию образования жидкого состава при смешивании водного жидкого носителя с воссоздаваемым твердым веществом согласно изобретению; или 4) жидкий состав составляют так, как описывается в данном документе. Настоящее изобретение также обеспечивает способ лечения, предотвращения или снижения частоты появления болезни, расстройства и состояния с этиологией, связанной с агрегацией тромбоцитов, или появления болезни, расстройства и состояния, которое дает терапевтическую реакцию на терапию клопидогрелем, при этом способ включает в себя введение состава изобретения больному, нуждающемуся в нем. Некоторые варианты осуществления изобретения включают варианты, в которых тромботическое заболевание, расстройство или состояние выбрано из группы, состоящей из инфаркта миокарда, инсульта, отмирания сосудов у пациентов с установленной болезнью периферических артерий (БПА), вторичных ишемических исходов, острого коронарного синдрома (нестабильной стенокардии или Q-необразующего ИМ, сердечного приступа, стенокардии), преходящего ишемического нарушения (ПИН), цереброваскулярной болезни, сердечно-сосудистого заболевания, грудной жабы, тромбоза глубоких вен (ТГВ), легочной эмболии (ЛЭ), серповидно-клеточной анемии и аритмии сердца.
Изобретение также обеспечивает способ уменьшения времени терапевтического начала или времени, требуемого для достижения целевого терапевтического эффекта, обеспечиваемого клопидогрелем, который включает в себя парентеральное введение больному, нуждающемуся в этом, состава согласно изобретению или введение через рот или тонкую кишку больному, нуждающемуся в этом, состава согласно изобретению. Состав изобретения способствует снижению времени, требуемого для начала лечения и/или для достижения целевого терапевтического эффекта, по сравнению с твердой лекарственной формой, вводимой через рот. Состав изобретения также позволяет вводить пониженную дозу клопидогреля для достижения целевого терапевтического эффекта, например, целевого времени кровотечения или целевого ингибирования агрегации тромбоцитов, в сравнении с введением сравнительной твердой лекарственной формы, вводимой через рот и не содержащей САЭ-ЦД, для достижения того же самого целевого терапевтического эффекта.
Изобретение обеспечивает способ увеличения времени кровотечения у больного, который включает в себя введение нуждающемуся больному композиции, содержащей: САЭ-ЦД и не более 900 мг, 750 мг, 675 мг, 600 мг, 450 мг, 375 мг, 300 мг, 225 мг, 200 мг, 150 мг, 100 мг, 75 мг, 50 мг, 40 мг, 30 мг, 25 мг, 20 мг, 15 мг, 12.5 мг, 10 мг, 7,5 мг, 5 мг, 2 мг, 1 мг, 0,75 мг или 0,1 мг клопидогреля, или от 0,1 до 900 мг, от 0,1 до 100 мг, от 100 до 300 мг, около 300 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, от 50 до 600 мг, от 75 до 600 мг, от 150 до 600 мг или от 200 до 450 мг клопидогреля, посредством которого время кровотечения увеличивается, по меньшей мере, на 10%, на 15%, на 20%, на 25%, на 30%, на 40%, на 50%, на 75%, на 100%, на 150%, на 200%, на 250%, на 300%, на 400%, на 500%, на 700%, на 900% или на 1000% в течение периода, составляющего не более 200 минут, 150 минут, 120 минут, 100 минут, 90 минут, 75 минут, 60 минут, 50 минут, 45 минут, 40 минут, 30 минут, 15 минут, 10 минут, 7,5 минут, 5 минут, 2,5 минут, или не более 1 минуты, или, по меньшей мере, 10 секунд или от 10 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут после введения состава, при этом указанное увеличение определяется путем сравнения со временем кровотечения у больного до введения композиции. Верхний предел процентного увеличения времени кровотечения может составлять вплоть до 10000%, 9000%, 7500%, 5000%, 4000%, 2500% или вплоть до 1000%. Способ может включать в себя ежедневное или постоянное введение состава нуждающемуся больному на протяжении нескольких дней, недели, нескольких недель, месяца, нескольких месяцев, трех-двенадцати месяцев или более года.
Изобретение также обеспечивает способ увеличения времени кровотечения у больного, нуждающегося в этом, непосредственно в момент перед введением больному, проходящему медицинскую процедуру, при этом способ включает в себя введение больному состава, содержащего САЭ-ЦД и не более 900 мг, 750 мг, 675 мг, 600 мг, 450 мг, 375 мг, 300 мг, 225 мг, 200 мг, 150 мг, 100 мг, 75 мг, 50 мг, 40 мг, 30 мг, 25 мг, 20 мг, 15 мг, 12,5 мг, 10 мг, 7,5 мг, 5 мг, 2 мг, 1 мг, 0,75 мг или 0,1 мг клопидогреля или от 0,1 до 900 мг, от 0,1 до 100 мг, от 100 до 300 мг, около 300 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, от 50 до 600 мг, от 75 до 600 мг, от 150 до 600 мг или от 200 до 450 мг клопидогреля, при этом состав вводят не более чем за 200, 150, 100, 75, 60, 50, 40, 30, 15, 10, 7,5, 5 или 2,5 минуты до проведения процедуры, а время кровотечения у больного увеличивается, по меньшей мере, на 10, 15, 20, 25, 30, 40, 50, 75, 100, 150, 200, 250, 300, 400, 500, 700, 900 или 1000% в течение этого времени. Способ может включать резкое введение нуждающемуся больному одной или нескольких доз прямо перед прохождением больным медицинской процедуры. Способ может также включать резкое введение нуждающемуся больному одиночной дозы прямо перед прохождением больным медицинской процедуры, например, интервенционной или неинтервенционной процедуры. Изобретение обеспечивает способ снижения степени (или возможности) агрегации тромбоцитов в крови больного, нуждающегося в этом, который включает в себя введение больному состава, содержащего САЭ-ЦД и не более 900 мг, 750 мг, 675 мг, 600 мг, 450 мг, 375 мг, 300 мг, 225 мг, 200 мг, 150 мг, 100 мг, 75 мг, 50 мг, 40 мг, 30 мг, 25 мг, 20 мг, 15 мг, 12,5 мг, 10 мг, 7,5 мг, 5 мг, 2 мг, 1 мг, 0,75 мг или 0,1 мг клопидогреля или от 0,1 до 900 мг, от 0,1 до 100 мг, от 100 до 300 мг, около 300 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, от 50 до 600 мг, от 75 до 600 мг, от 150 до 600 мг или от 200 до 450 мг клопидогреля, посредством которого процентная агрегация тромбоцитов снижается, по меньшей мере, на 5, 10, 15, 30, 40, 50, 60, 70, 80, 90, 96, 98 или 100% за время не более 200 минут, 150 минут, 120 минут, 100 минут, 90 минут, 75 минут, 60 минут, 50 минут, 45 минут, 40 минут, 30 минут, 15 минут, 10 минут, 7,5 минут, 5 минут, 2.5 минуты или не более 1 минуты, или, по меньшей мере, 10 секунд или от 10 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут после введения состава.
Изобретение также обеспечивает способ снижения степени (или возможности) агрегации тромбоцитов, по меньшей мере, на 5, 10, 15, 30, 40, 50, 60, 70, 80, 90, 96, 98 или 100% у больного, нуждающегося в этом, при этом способ включает введение больному состава, содержащего САЭ-ЦД и не более 900, 750, 675, 600, 450, 375, 300, 225, 200, 150, 100, 75, 50, 40, 30, 25, 20, 15, 12,5, 10, 7,5, 5, 2, 1, 0,75 или 0,1 мг клопидогреля, или от 0,1 до 900 мг, от 0,1 до 100 мг, от 100 до 300 мг, около 300 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, от 50 до 600 мг, от 75 до 600 мг, от 150 до 600 мг или от 200 до 450 мг клапидогреля на ежедневной основе.
Степень или возможность агрегации тромбоцитов можно измерить in vivo или ex vivo (in vitro).
Хоть и состав вводят через рот, но прозрачный жидкий состав или лекарственная форма изобретения, в частности, пригодны для парентерального введения. В частности, парентеральное введение может понадобиться тогда, когда нежелательно вводить состав через рот, т.е. в таких случаях, как допроцедурное введение, послепроцедурное введение или другие способы введения, или тогда, когда больной нетрудоспособен или неспособен иным образом принимать дозу жидкого или твердого состава через рот. Процедурой, в частном случае, является медицинская процедура. Состав изобретения можно также вводить через рот.
Настоящее изобретение также обеспечивает способы приготовления водного раствора или твердой лекарственной формы клопидогреля или его фармацевтически приемлемой соли на основе САЭ-ЦД.
Изобретение также обеспечивает набор, который включает первую фармацевтическую композицию, содержащую САЭ-ЦД, и вторую фармацевтическую композицию, содержащую клопидогрель или его фармацевтически приемлемую соль.
Изобретение также обеспечивает состав с замаскированным вкусом для приема внутрь, содержащий сульфоалкиловый эфир циклодекстрина, клопидогрель, фармацевтически приемлемый носитель и необязательно один или несколько наполнителей. Если не указано как-то иначе, то термин "клопидогрель" включает свободное основание или солевую форму и рацемическую форму, оптически чистую (R) форму, оптически чистую (S) форму или оптически обогащенную форму соединения. Он также включает твердую, суспендированную или растворенную формы соединения. Солевая форма может присутствовать в виде полугидрата, гидрата или в безводном виде. Соль может также присутствовать в чистой кристаллической форме или в полиморфной форме.
Изобретение также обеспечивает способ повышения устойчивости клопидогреля в составе, содержащем клопидогрель, при этом способ включает в себя добавление САЭ-ЦД к составу в количестве, достаточном для образования комплекса с существенной порцией клопидогреля, содержащегося в составе, с помощью чего происходит стабилизация клопидогреля.
Изобретение включает способ стабилизации жидкого состава, содержащего клопидогрель и водный жидкий носитель, при этом способ включает в себя: добавление САЭ-ЦД к составу в количестве, достаточном для образования комплекса с существенной порцией клопидогреля, с помощью чего происходит стабилизация к