Композиции для ингаляции, содержащие кислоту монтелукаст и ингибитор pde-4 или ингаляционный кортикостероид
Иллюстрации
Показать всеИзобретение относится к области фармакологии и представляет собой медицинский препарат для лечения заболеваний дыхательной системы для одновременного, последовательного или раздельного введения путем ингаляции, содержащий кристаллический монтелукаст в виде кислоты и мометазона фуроат. Изобретение обеспечивает расширение ассортимента комбинированных лекарственных средств для лечения заболеваний дыхательной системы в виде ингаляции. 2 н. и 5 з.п. ф-лы, 17 табл., 1 ил., 5 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
К основным классам лекарственных средств, обычно используемым в лечении хронической астмы, относятся бронходилятаторы (β-агонисты, антихолинергические средства), кортикостероидные средства, стабилизаторы тучных клеток, модификаторы лейкотриена и метилксантины. Большинство этих средств вводят пациенту путем ингаляции либо в виде аэрозоля, либо в виде порошка, а некоторые с недавних пор введенные ингалируемые средства представляют собой сочетание активных агентов различных лекарственных классов; ADVAIR и SYMBICORT оба представляют собой комбинации кортикостероидного средства и β-агониста длительного действия. Монтелукаст натрия, антагонист лейкотриена, представляет собой активный агент в препарате SINGULAIR®, лекарственном средстве, утвержденном для лечения астмы и аллергического ринита. Несмотря на то, что монтелукаст доступен в виде таблеток и гранул для перорального применения, применение активной составляющей для ингаляции ранее не было изучено.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к лекарственному средству, содержащему монтелукаст в виде кислоты и второй активный агент в комбинированном средстве для введения путем ингаляции. Изобретение относится также к способу лечения астмы, с помощью таких ингалируемых комбинаций.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлен график порошковой рентгеновской дифракции кристаллического монтелукаста в виде кислоты.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к лекарственному средству, содержащему монтелукаст в виде кислоты и второй активный агент, выбранный из ингибитора ОРДЭ-4 и ингалируемого кортикостероидного средства, в виде комбинированного препарата для одновременного, последовательного или раздельного введения путем ингаляции.
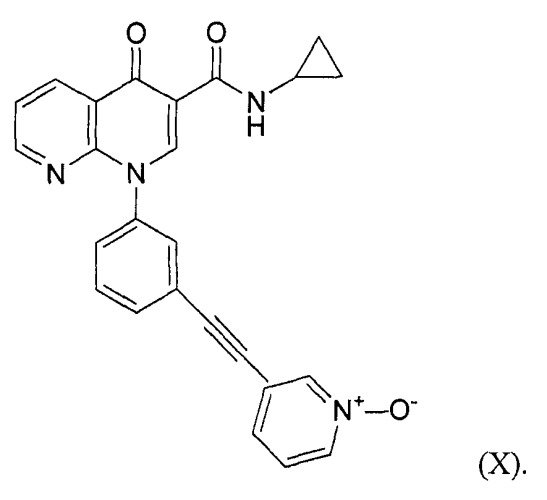
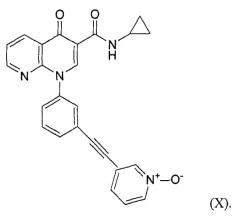
В одном из аспектов медицинский препарат содержит монтелукаст в виде кислоты и ингибитор PDE-4 N-циклопропил-1-[3-(1-оксидо-3-пиридинилэтинил)фенил]-1,4-дигидро[1,8]-нафтиридин-4-он-3-карбоксамид (далее в данном документе обозначаемый как соединение Х).
В другом аспекте медицинский препарат содержит монтелукаст в виде кислоты и ингалируемое кортикостероидное средство. В одном из вариантов осуществления ингалируемое кортикостероидное средство выбирают из мометазона фуроата и циклезонида.
В другом аспекте медицинский препарат содержит монтелукаст в виде кислоты и второй активный агент, выбранный из ингибитора PDE-4 и ингалируемого кортикостероидного средства, в котором по меньшей мере 95% указанного монтелукаста в виде кислоты и указанного второго активного агента имеют частицы величиной 10 микрон или меньше. Медицинский препарат по настоящему изобретению может быть дозирован, используя либо ингаляторы с отмеренной дозой под давлением (pMDI), либо сухие порошковые ингаляторы (DPI).
Настоящее изобретение дополнительно относится к применению монтелукаста в виде кислоты и второго активного агента, выбранного из ингибитора PDE-4 и ингалируемого кортикостероидного средства для получения комбинированного средства для применения ингаляционно для лечения заболеваний дыхательной системы.
Настоящее изобретение дополнительно относится к способу лечения заболеваний дыхательной системы, который содержит одновременное, последовательное или раздельное введение путем ингаляции пациенту, нуждающемуся в этом, терапевтически эффективного количества монтелукаста в виде кислоты и терапевтически эффективного количества второго активного агента, выбранного из ингибитора PDE-4 и ингалируемого кортикостероидного средства.
Настоящее изобретение дополнительно относится к сухому порошковому ингалятору, содержащему описанный выше медицинский препарат. Настоящее изобретение дополнительно относится к ингалятору с отмеренной дозой, содержащему описанный выше медицинский препарат.
Под используемым в данном документе термином «монтелукаст в виде кислоты» понимают кристаллический монтелукаст в виде кислоты, обладающий диаграммой рентгеновской порошковой дифракции, по существу показанной на фиг.1. Под термином «ингибиторы ОРДЭ-4» понимают соединения, которые ингибируют действие фермента фосфодиэстеразы-4, и к ним относятся без ограничения циломиласт, рофлюмиласт и соединение Х. Соединение Х, применение соединения и способы его получения описываются в патенте WO 03/018579, опубликованном 6 марта 2003 года, и патенте WO 2004/048377, опубликованном 10 июня 2004 года. К «ингалируемым кортикостероидным средствам» относятся, но ими не ограничиваясь, дексаметазон, флутиказона пропионат, беклометазон, будезонид, флунизолид, мометазона фуроат, циклезонид и триамцинолона ацетонид, а также производные каждого из указанных ингалируемых кортикостероидных средств; предпочтительными ингалируемыми кортикостероидными средствами являются мометазона фуроат, который представляет собой активный агент в продукте ASMANEX, и циклезонид, который представляет собой активный агент в продукте ALVESCO.
Массовое соотношение монтелукаста в виде кислоты и второго активного агента данного препарата находится в диапазоне от приблизительно 10:1 до приблизительно 1:10. В препарате, в котором второй активный агент представляет собой соединение Х, соотношение в основном находится в диапазоне от приблизительно 5:1 до приблизительно 1:5. В препаратах, где вторым активным агентом является мометазона фуроат, соотношение в основном находится в диапазоне от приблизительно 5:1 до 1:5. В препаратах, где вторым активным агентом является циклезонид, соотношение в основном находится в диапазоне от приблизительно 10:1 до приблизительно 1:1.
В одном из вариантов осуществления медицинский препарат адаптируют для применения с ингалятором с отмеренной дозой под давлением, который высвобождает отмеренную дозу лекарственного средства каждое приведение в действие. Препаративная форма для pMDI может существовать в виде растворов или суспензий в галогенированных углеводородных пропеллентах. Тип используемого в pMDI пропеллента переходит на гидрофторалканы (HFAs), также известные как гидрофторуглероды (HFCs), поскольку применение хлорфторуглеродов (известных также как фреоны или CFC) прекращено. В частности, в нескольких на сегодняшний день продаваемых фармацевтических продуктах для ингаляции используются 1,1,1,2-тетрафторэтан (HFA 134a) и 1,1,1,2,3,3,3-гептафторпропан (HFA 227). Композиция может включать другие фармацевтически приемлемые эксципиенты для ингаляторного применения, такие как этанол, олеиновую кислоту, поливинилпирролидон и подобные.
MDI под давлением обычно имеют два компонента. Во-первых, компонент контейнера, в котором частицы лекарственного средства хранятся под давлением в виде суспензии или раствора. Во-вторых, компонент емкости, используемой для удержания и приведения в действие контейнера. Как правило, контейнер будет содержать большое число доз препаративной формы, хотя также могут существовать контейнеры с одной дозой. Компонент контейнера, как правило, включает отверстие с клапаном, из которого содержимое контейнера может опорожняться. Аэрозольное лекарственное средство высвобождается из pMDI путем надавливания на компонент контейнера, направляя его в компонент емкости, таким образом, открывая отверстие с клапаном и вызывая переход частиц лекарственного средства из отверстия с клапаном через компонент емкости и выход из выходного отверстия емкости. При высвобождении из контейнера частицы лекарственного средства «распыляются», образуя аэрозоль. Предполагается, что пациент контролирует выход аэрозолированного лекарственного средства при его или ее ингаляции таким образом, что частицы лекарственного средства вовлекаются во вдыхаемый воздух пациента и доставляются в легкие. Как правило, в ингаляторах pMDI используются пропелленты для повышения давления содержимого контейнера и продвижения частиц лекарственного средства из выходного отверстия компонента емкости. В ингаляторах pMDI препаративная форма предлагается в виде жидкости или суспензии, и она находится в контейнере наряду с пропеллентом. Пропеллент может иметь большое число форм. Например, пропеллент может содержать сжатый газ или сжиженный газ.
В другом варианте осуществления медицинский препарат адаптируют для применения с сухим порошковым ингалятором. Ингаляторная композиция, подходящая для применения в ингаляторах DPI, как правило, содержит частицы активного ингредиента и частицы фармацевтически приемлемого носителя. Размер частиц активного вещества может варьировать от приблизительно 0,1 мкм до приблизительно 10 мкм; тем не менее, для эффективной доставки в дистальные отделы легкого размер по меньшей мере 95% частиц активных агентов составляет 5 мкм или меньше. Каждый активный агент может присутствовать в концентрации 0,01-99%. Как правило, тем не менее, каждый активный агент присутствует в концентрации от приблизительно 0,05 до 50%, чаще приблизительно 0,2-20% от общего веса композиции.
Как отмечено выше, помимо активных ингредиентов ингалируемый порошок предпочтительно включает фармацевтически приемлемый носитель, который может состоять из любого фармакологически инертного материала или комбинации материалов, которые приемлемы для ингаляции. Преимущественно, частицы носителя состоят из одного или нескольких кристаллических сахаров; частицы носителя могут состоять из одного или нескольких сахарных спиртов или многоатомных спиртов. Предпочтительно, чтобы частицы носителя представляли собой частицы декстрозы или лактозы, особенно лактозы. В вариантах осуществления настоящего изобретения, в которых применяются принятые сухие порошковые ингаляторы, такие как Rotahaler, Diskhaler и Turbohaler, размер частиц носителя может находиться в диапазоне от приблизительно 10 микрон до приблизительно 1000 микрон. В некоторых из этих вариантов осуществления размер частиц носителя может находиться в диапазоне от приблизительно 20 микрон до приблизительно 120 микрон. В некоторых других вариантах осуществления размер по меньшей мере 90% масс. частиц носителя составляет менее 1000 микрон и предпочтительно составляет от 60 микрон до 1000 микрон. Относительно большой размер этих частиц носителя дает хорошие характеристики потока и увлечения. При наличии носителя количество частиц носителя в основном будет составлять до 95%, например до 90%, преимущественно до 80% и предпочтительно до 50% масс. от общего веса порошка. Количество любого мелкодисперсного материала эксципиента при его наличии может составлять до 50% и преимущественно до 30%, особенно до 20% масс. от общего веса порошка.
Настоящее изобретение в одном из вариантов осуществления относится к композиции для применения в сухом порошковом ингаляторе, которая содержит монтелукаст в виде кислоты и соединение Х, и лактозу для ингаляции в качестве носителя, где указанная композиция адаптирована для одновременного, последовательного или раздельного введения активных агентов. Соотношение по массе лактозы к монтелукасту в виде кислоты составляет от приблизительно 1:1 до приблизительно 30:1, и к соединению Х составляет от приблизительно 20:1 до приблизительно 30:1. В одном случае массовое соотношение лактозы к монтелукасту в виде кислоты составляет от приблизительно 2:1 до приблизительно 25:1, и к соединению Х составляет от приблизительно 20:1 до приблизительно 25:1.
Настоящее изобретение в одном из вариантов осуществления относится к композиции для применения в сухом порошковом ингаляторе, которая содержит монтелукаст в виде кислоты и ингалируемое кортикостероидное средство, и лактозу для ингаляции в качестве носителя, где указанная композиция адаптирована для одновременного, последовательного или раздельного введения активных агентов. В таких композициях соотношение по массе лактозы к монтелукасту в виде кислоты составляет, как правило, от приблизительно 1:1 до приблизительно 30:1. В композиции, где ингалируемое кортикостероидное средство представляет собой мометазона фуроат, массовое соотношение лактозы к мометазона фуроату составляет от приблизительно 130:1 до приблизительно 4:1, и в одном из вариантов осуществления соотношение составляет от приблизительно 124:1 до приблизительно 60:1. В композиции, где ингалируемое кортикостероидное средство представляет собой циклезонид, массовое соотношение лактозы к циклезониду составляет от приблизительно 350:1 до приблизительно 100:1.
Порошок также может содержать мелкодисперсные частицы материала эксципиента, который может представлять собой, например, вещество, такое как одно из указанных выше, подходящее для применения в качестве материала носителя, особенно кристаллический сахар, такой как декстроза или лактоза. Мелкодисперсный материал эксципиента может быть таким же или отличаться от материала частиц носителя при наличии обоих. Размер частиц мелкодисперсного материала эксципиента обычно не должен превышать 30 мкм и предпочтительно не превышает 20 мкм. В некоторых случаях, например, если присутствующие какие-либо частицы носителя и/или какой-либо мелкодисперсный материал эксципиента состоят из вещества, самого способного индуцировать ощущение в орофарингеальной области, частицы носителя и/или мелкодисперсный материал эксципиента могут составлять индикаторный материал. Например, частицы носителя и/или какой-либо мелкодисперсный эксципиент могут содержать маннитол.
Препаративные формы, описанные в данном документе, также могут включать одну или несколько добавок в количестве от приблизительно 0,1% до приблизительно 10% масс. и предпочтительно от приблизительно 0,15% до 5%, самое предпочтительное от приблизительно 0,5% до приблизительно 2%. Добавки могут включать, например, стеарат магния, лейцин, лецитин и стеарилфумарат натрия. Если добавка представляет собой тонкоизмельченный лейцин или лецитин, ее предпочтительно добавляют в количестве от приблизительно 0,1% до приблизительно 10% масс., предпочтительно от приблизительно 0,5% до приблизительно 5%, предпочтительно приблизительно 2% тонкоизмельченного лейцина. Предпочтительно по меньшей мере 95% масс. тонкоизмельченного лейцина имеет диаметр частиц менее 150 микрон, предпочтительно менее 100 микрон и самое предпочтительное менее 50 микрон. Предпочтительно, чтобы масс-медианный диаметр тонкоизмельченного лейцина составлял менее 10 микрон.
При использовании в качестве добавки стеарата магния или стеарилфумарата натрия предпочтительно добавлять его в количестве от приблизительно 0,05% до приблизительно 5%, предпочтительно от приблизительно 0,15% до приблизительно 2%, самое предпочтительное от приблизительно 0,25 до приблизительно 0,5%.
В отношении размера частиц порошка, должно быть понятно, если не указано иного, что размер частиц представляет собой средневзвешенный размер частиц. Размер частиц может быть рассчитан способом лазерной дифракции. При наличии на поверхности частицы также индикаторного материала преимущественно величина покрытых частиц также находится в диапазонах предпочтительных размеров, указанных для непокрытых частиц.
Сухие порошковые фармацевтические композиции по данному изобретению могут быть получены, используя стандартные способы. Фармацевтически активные агенты, частицы носителя и другие эксципиенты при их наличии могут быть непосредственно смешаны, используя любое подходящее оборудование для смешивания, такое как барабанный смеситель. Конкретные компоненты препаративной формы могут быть смешаны в любом порядке. В некоторых случаях может быть целесообразным предварительное смешивание определенных компонентов. Порошковую смесь затем используют для заполнения капсул, блистеров, емкостей или других устройств для хранения для применения совместно с сухими порошковыми ингаляторами.
В сухом порошковом ингаляторе доза, предназначенная для введения, хранится в виде сухого порошка не под давлением, и при приведении ингалятора в действие частицы порошка вдыхаются пациентом. Ингаляторы DPI могут представлять собой устройства с одной дозой, в которых порошок содержится в отдельных капсулах, устройства с большим числом доз, в которых используется большое число капсул или блистеров, и коллекторные устройства, в которых порошок отмеряется во время дозирования из контейнера для хранения. Сухие порошковые ингаляторы могут представлять собой «пассивные» устройства, в которых для распыления порошка, чтобы доставить в легкие, используется дыхание пациента, или «активные» устройства, в которых для распространения порошка используется механизм, отличный от приведения в действие с помощью дыхания. К примерам «пассивных» устройств сухого порошкового ингалятора относятся Spinhaler, Handihaler, Rotahaler, Diskhaler, Diskus, Turbuhaler, Clickhaler и т.д. К примерам активных ингаляторов относятся ингалятор Nektar Pulmonary Inhaler (продукция фирмы Nektar Therapeutics), устройство Vectura Limited's AspirairTM, микродозный DPI (MicroDose) и Oriel DPI (продукция фирмы Oriel). Необходимо отметить, тем не менее, что композиции по настоящему изобретению могут вводиться с помощью как пассивных, так и активных устройств для ингаляции.
Другой аспект настоящего изобретения относится к способу лечения заболеваний дыхательной системы, который содержит одновременное, последовательное или раздельное введение путем ингаляции пациенту, нуждающемуся в этом, терапевтически эффективного количества монтелукаста в виде кислоты и терапевтически эффективного количества второго активного агента, выбранного из ингибитора PDE-4 и ингалируемого кортикостероидного средства. В одном из вариантов осуществления заболевание органов дыхания представляет собой астму. В другом варианте осуществления второй активный агент представляет собой фуроат мометазона или циклезонид, и заболевание органов дыхания представляет собой астму.
Препарат по настоящему изобретению может быть использован в лечении астмы, COPD, фиброза легких, кашля и других легочных патологий. Дозы конкретных активных агентов обычно такие же, как при использовании в виде самостоятельного терапевтического агента; комбинация активных агентов может быть синергичной, что приводит к снижению дозы одного или обоих активных агентов или к уменьшению частоты введения. Пероральная доза монтелукаста натрия для лечения астмы находится в диапазоне от 4 мг один раз в день для педиатрических пациентов до 10 мг один раз в день для взрослых пациентов. Доза монтелукаста в виде кислоты для лечения астмы, используя композицию для ингаляции по настоящему изобретению, может быть такой же или меньшей чем пероральная доза и может находится в диапазоне от приблизительно 100 мкг до приблизительно 10 мг в день; в одном из вариантов осуществления доза составляет от приблизительно 200 мкг до приблизительно 5 мг в день; в другом варианте осуществления доза составляет от приблизительно 250 мкг до приблизительно 2 мг в день; в другом варианте осуществления доза составляет от приблизительно 600 мкг до приблизительно 4 мг в день. Дозировка соединения Х описывается в патентах WO 03/018579 и WO 2004/048377. Дозировка фуроата мометазона может составлять от приблизительно 220 мкг до приблизительно 880 мкг в день и может быть ниже при использовании в сочетании с монтелукастом в виде кислоты; руководство по диапазону доз фуроата мометазона можно найти в патенте США 5889015. Дозировка циклезонида может составлять от приблизительно 80 до приблизительно 160 мкг в день и может быть ниже при использовании в сочетании с монтелукастом в виде кислоты; диапазон дозировки циклезонида можно найти в опубликованной заявке РСТ WO 2005025578. Комбинация по настоящему изобретению может быть введена один раз, дважды или трижды в день, и каждое введение может потребовать более одного впрыскивания в зависимости от препаративной формы, устройства и вводимой дозы. Ингалируемая доза для лечения COPD, фиброза легких, кашля и других лейкотриен-опосредованных патологий легких аналогична дозе, используемой для лечения астмы.
Следующие примеры представлены для иллюстрации изобретения и не предназначены для ограничения каким-либо образом объема формулы изобретения.
ПРИМЕР 1 - МОНТЕЛУКАСТ В ВИДЕ КИСЛОТЫ
Получение кристаллического монтелукаста в виде кислоты
В колбу Эрленмейера объемом 6 л, которая была загружена монтелукастом натрия (100 г, 0,165 моль), толуолом (2,4 л) и водой (1,6 л) добавляли уксусную кислоту (124 мл, 0,247 моль). Колбу защищали от света с помощью алюминиевой фольги, и смесь перемешивали с помощью магнитной мешалки в течение 10 мин. Водный слой отделяли, и органический слой отмывали водой (3×1 л). Органический слой перемешивали в темноте в течение 18 ч. Полученный осадок отфильтровывали и высушивали под вакуумом при 35°С для получения 62 г твердой фазы желтого цвета. Второй выход 14 г получали, экстрагируя продукт, отмытый водой, с помощью толуола (1×800 мл). Первый выход размалывали на струйной мельнице для получения 53 г материала по преимуществу с кристаллами неправильной формы < 5 микрон с некоторыми прямоугольниками величиной до 8×5 микрон. Материал, очищенный посредством HPLC, имел степень чистоты 99,8%.
Получение препаративных форм для сухой порошковой ингаляции (DPI)
Две препаративные формы получали аналогичным образом, смешивая в барабанном смесителе Turbula (типа T2F) в течение 15 минут при 32 об/мин лактозу для ингаляции и монтелукаст в виде кислоты. Производили две смеси, содержащие монтелукаст в виде кислоты в концентрации 4%, одну в масштабе 1 г и одну в масштабе 10 г. Одну смесь, содержащую монтелукаст в виде кислоты в концентрации 20%, производили в масштабе 10 г. Капсулы заполняли смесью в количестве 25 мг, эквивалентной 1 мг лекарственного средства при 4% масс. загрузке лекарственного средства и 5 мг при 20% масс. загрузке лекарственного средства. Препаративные формы описываются в таблице 1.
| Таблица 1 | ||||
| Препаративные формы для ингалятора DPI с загрузками лекарственным средством 4% и 20% | ||||
| Ингредиент | Функция | Препаративная форма | ||
| 4% масс. | 4% масс. | 20% масс. | ||
| Лактоза для ингаляции | Носитель | 96 | 96 | 80 |
| Монтелукаст в виде кислоты | API* | 4 | 4 | 20 |
| Масштаб партии (г) | - | 1 | 10 | 10 |
| Масса впрыска (мг) | - | 25 | 25 | 25 |
| Размер капсулы | - | 2 | 2 | 2 |
| Доза (мг) | - | 1 | 1 | 5 |
| *API = активный фармацевтический ингредиент |
Однородность смеси
Для оценки однородности смеси капсулы с каждой смесью открывали и промывали метанолом. Раствор обрабатывали ультразвуком в течение 5 минут при комнатной температуре, центрифугировали при 3000 об/мин в течение 15 минут, после чего анализировали, используя спектрофотометр UV-VIS при длине волны 346 нм.
Результаты по однородности смеси для смесей с 4% масс. и 20% масс. загрузками лекарственным средством обобщаются в таблице 2. Результаты показывают, что все смеси оказались однородными с содержанием лекарственного средства ±10% от номинальных доз. Результаты по однородности смеси для 4% масс. смесей не зависели от произведенного объема партии.
| Таблица 2 | ||||
| Оценка конкретных капсул для смесей I, II и III | ||||
| Смесь ID | Загрузка лекарственного средства(% масс.) | Масштаб партии (г) | Номер капсулы | Масса монтелукаста в виде кислоты, полученного из капсулы (мг) |
| I | 4 | 1 | 1 | 0,91 |
| 2 | 0,99 | |||
| 3 | 1,02 | |||
| II | 4 | 10 | А | 0,98 |
| В | 0,96 | |||
| III | 20 | 10 | А | 4,86 |
| В | 5,35 |
Однородность дозы
Однородность дозы определяли, используя устройство В (дозирующее устройство DUSA) при скорости потока не более 100 л/мин (тест описан в USP <601>). В настоящее время USP рекомендует выбор скорости потока, которая создает каплю под давлением 4 кПа через ингалятор. Используя Spinhaler®, капля под давлением 4 кПа и скорость потока 100 л/мин не могут быть достигнуты. Основываясь на рекомендациях Byron et al [Hindle and Byron, Int. J. Pharmaceutics, 116 (1995):169-177], необходимо выбрать скорость потока 100 л/мин, поскольку Spinhaler® представляет собой устройство низкого сопротивления.
Во время исследований с использованием DUSA в первом эксперименте, осуществленном с помощью Spinhaler®, достигали получения капли под давлением 4 кПа и скорости потока примерно 100 л/мин с соотношением Р3/Р2<0,5 (таблица 3). Для всех последующих экспериментов могла быть достигнута скорость потока лишь примерно 55 л/мин, тем не менее, с соотношением Р3/Р2>0,5. Для того чтобы убедиться, что последующие осуществленные эксперименты имеют скорость потока менее чем 100 л/мин, измеритель потока соединяли с входным отверстием контролера потока и скорость воздушного потока доводили до примерно 100 л/мин. Доведя скорость воздушного потока как описано выше, насос был способен продуцировать поток воздуха со скоростью звука через DUSA с соотношением Р3/Р2<0,5. После доставки впрыска все детали DUSA, включая адаптер загубника, промывали растворителем, разбавляли до подходящих объемов, обрабатывали ультразвуком и центрифугировали. Для определения количества лекарственного средства, задержанного в ингаляторе, все детали ингалятора промывали растворителем, включая внутреннюю часть капсулы. Образцы затем анализировали, используя спектрофотометр UV-VIS.
Массу впрыска получали, измерив снижение массы из-за приведения устройства в действие. Устройство тарировали, один «впрыск» выпускали в DUSA и устройство повторно взвешивали для получения массы доставленного впрыска. Дозу и массу впрыска считают приемлемыми, если они находятся в диапазоне от 75% до 125% от теоретических величин (USP<601>).
Результаты по однородности дозы для всех смесей суммируются в таблице 3.
| Таблица 3 | |||||||||
| Результаты по однородности дозы для препаративных форм I и III | |||||||||
| Носитель | Загрузка лекарственного средства (% масс.) | Тип устройства | Скорость потока (л/мин) | Продолжи-тельность (с) | Препаративная форма/капсула # | Масса впрыска (мг) | Количество полученного монтелукаста в виде кислоты (мг) | ||
| DUSA | ингаля-тор | Суммар-но | |||||||
| Лактоза для ингаляции | 4 | Spinhaler | 98,1 | 2,5 | I/A | 24,4 | 0,32 | 0,37 | 0,70 |
| 77,2 | 3,1 | I/B | 25,2 | 0,45 | 0,44 | 0,89 | |||
| 4 | Handihaler | 53,4 | 4,5 | I/C | 21,4 | 0,44 | 0,51 | 0,95 | |
| 55,2 | 4,3 | I/D | 25,8 | 0,65 | 0,23 | 0,88 | |||
| 20 | Spinhaler | 71,9 | 3,3 | III/A | 23,2 | 1,82 | 1,52 | 3,34 | |
| 65,6 | 3,7 | III/C | 16,7 | 1,91 | 2,86 | 4,78 |
В таблице 3 показано, что массы впрысков для обеих смесей с концентрацией 4% масс. попадали в заданный диапазон, тогда как масса впрыска для капсулы С для смеси с концентрацией 20% масс. оказалась за пределами диапазона 75-125% от теоретических величин. В процессе сбора лекарственного средства из DUSA и ингалятора DPI было обнаружено, что для смеси с концентрацией 20% масс. одна фракция порошка осталась в капсуле. Низкая масса впрыска и порошок, оставшийся в капсуле, могут быть объяснены тем фактом, что смесь с концентрацией 20% масс. содержала больше лекарственного средства, чем смесь с концентрацией 4% масс. Это может привести к неудовлетворительным характеристикам текучести препаративной формы с более высокой загрузкой лекарственного средства. Это объяснение может быть подкреплено морфологическим наблюдением, касающимся смеси с концентрацией 20% масс., в котором показано, что лекарственное средство имеет тенденцию к скоплению и взаимодействию между лекарственным средством и поверхностью лактозы, как описано выше. Средние массы впрысков, измеренные для смеси с концентрацией 4% масс. для капсул А и В при использовании Spinhaler®, и капсул С и D при использовании Handihaler®, оказались 24,8 мг и 23,6 мг, соответственно, по сравнению с 20,0 мг для смеси с концентрацией 20% масс. для капсул А и С при использовании Spinhaler®.
Среднее количество лекарственного средства, измеренного в DUSA, для капсул А и В, и С и D для смеси с концентрацией 4% масс. оказалось 38,5% и 54,5% от номинальной дозы, соответственно. Данные также показывают, что количество лекарственного средства, которое изгонялось из капсулы, оказалось выше при использовании Handihaler®, чем при использовании Spinhaler®. В отношении смеси с концентрацией 20% масс., масса лекарственного средства, извлеченного из DUSA, в процентах, составившая 37,3%, была близка к массе, наблюдаемой для смеси с концентрацией 4% масс.
Распределение частиц по аэродинамическому размеру
Устройство, использованное для определения распределения по аэродинамическому размеру, представляло собой каскадный импактор Андерсена (ACI) (аппарат 3). Посредством осаждения получали in vitro оценку фракции аэрозоля, которая была способна достичь альвеолярной области легкого. Эта величина представляет собой часть частиц, определяемых ниже пластины 2. Осаждение осуществляли при скорости потока и времени тестирования согласно способу, описанному в USP <601>. Поскольку Spinhaler® представляет собой устройство низкого сопротивления, представляется затруднительным получить каплю под давлением 4 кПа, осуществляли доведение скорости потока воздуха при введении контроля потока, как описано выше. Каждую пластину для осаждения покрывали силиконовой смазкой (продукция фирмы Dow Corning, 316) для предотвращения отскакивания частиц от пластин и возврата в воздушный поток. Все стадии проводили с того момента, когда скорость тестируемого потока была меньше 60 л/мин. Все детали импактора, включая ингалятор и капсулу, промывали растворителем, разводили до подходящих объемов, обрабатывали ультразвуком, центрифугировали и анализировали, используя спектрофотометр UV-VIS. Вдыхаемую часть оценивали количественно посредством in vitro фракции мелкодисперсных частиц и массы мелкодисперсных частиц. Тесты на однородность дозы и каскадное осаждение осуществляли при контролируемых температуре (20-25°С) и влажности (50% относительной влажности).
Данные относительно распределения по аэродинамическому размеру частиц для всех трех смесей представлены в таблице 4.
| Таблица 4 | |||||||
| Результаты по каскадному осаждению | |||||||
| Масштаб партии (г) | Загрузка лекарственного средства(% масс.) | Масса мишенной дозы (мг) | Устройство | Смесь ID/ капсула # | In vitro фракция мелкодисперсных частиц (%) | Масса мелкодисперсных частиц (мг) | Испускаемая доза (мг) |
| 1 | 4 | 1 | Handihaler | I/E | 30 | 0,17 | 0,55 |
| I/F | 30 | 0,11 | 0,37 | ||||
| 10 | 4 | 1 | Spinhaler | I/G | 22 | 0,03 | 0,13 |
| I/H | 37 | 0,08 | 0,22 | ||||
| 10 | 20 | 5 | Spinhaler | III/F | 77 | 0,05 | 0,06 |
| III/G | 28 | 0,53 | 1,91 | ||||
| III/H | 32 | 0,78 | 2,47 |
Среднее арифметическое фракции мелкодисперсных частиц, ингалируемой посредством Handihaler® и Spinhaler®, составляло 30% и 29,5%, соответственно для смеси с концентрацией 4% масс. В отношении смеси с концентрацией 20% масс., используя Spinhaler®, получали среднее арифметическое фракции мелкодисперсных частиц 45,3%. Кроме того, среднее арифметическое массы мелкодисперсных частиц для смеси с концентрацией 4% масс., ингалируемой с помощью Handihaler® и Spinhaler®, составляло 0,14±0,04 мг и 0,06±0,04 мг, соответственно. Для смеси с концентрацией 20% масс. была получена масса мелкодисперсных частиц 0,45±0,4 мг. Результаты указывают на то, что лекарственное средство диспергирует до максимальной величины в смеси с концентрацией 4% масс., ингалируемой с помощью Handihaler®. В отношении смеси с концентрацией 20% масс., испускаемая доза капсулы III/F оказалась крайне низкой, указывая на то, что порошок почему-либо не выталкивается эффективно из капсулы. Перед выпрыскиванием ингалятора проверяли ориентацию капсулы. Поэтому для подтверждения эффективности смеси с концентрацией 20% масс. начинали третье испытание. Данные, полученные для капсулы III/F, подтвердили, что фракция мелкодисперсных частиц при 20% масс. загрузке лекарственным средством почти равна фракции мелкодисперсных частиц для смеси с концентрацией 4% масс. при использовании ACI со Spinhaler®.
Характеристика/морфология смеси
Посредством снимков лактозы, полученных с помощью сканирующего электронного микроскопа (SEM), показано, что лактоза имеет пластинчатую морфологию с размером частиц до приблизительно 140 мкм и не содержит наблюдаемых агломератов. В отношении смеси 4% мелкодисперсного монтелукаста в виде кислоты с 96% лактозы, наблюдались небольшие частицы неправильной формы, объясняемые соединением монтелукаста в виде кислоты с размером частиц до приблизительно 10 мкм. Эти микроснимки SEM указывают на то, что лекарственное средство в значительной мере распределено между частицами лактозы. В отношении смеси 20% мелкодисперсного монтелукаста в виде кислоты с 80% лактозы в смесях наблюдались частицы лекарственного средства большего размера. По-видимому, лекарственное средство имеет тенденцию соединяться, и, по-видимому, фракция лекарственного средства аккумулируется на поверхности лактозы. Это явление также наблюдается для смеси с концентрацией 4% масс., но степень объединения менее выражена из-за более низкой загрузки лекарственным средством.
In vivo оценка препаративной формы DPI с монтелукастом в виде кислоты
Аллергическую модель овцы использовали для тестирования влияния ингалируемого монтелукаста в виде кислоты на раннюю астматическую реакцию (EAR), позднюю астматическую реакцию (LAR) и реакцию гиперреактивности дыхательных путей (AHR) на заражение аскаридами у аллергизированной овцы. Соединение вводили непосредственно в легкие, используя DPI Spinhaler, который присоединяли прямо к постоянной эндотрахеальной трубке. Капсулы, использованные в Spinhaler, содержали мелкодисперсную смесь 20% лекарственное средство/80% лактоза, соответствующую примерно 5 мг активного соединения. Соединение вводили в виде одной дозы за 30 минут до заражения аскаридами. Для улучшения доставки каждое приведение в действие Spinhaler синхронизировали с рядом циклов аспирации.
Дозы ингаляции выбирали на основе суммарно IV доз, вводимых в проведенных исследованиях овцы. Введение 3 или 9 капсул должно достичь суммарной ингалируемой дозы примерно 0,1 мг/кг или 0,3 мг/кг, соответственно. Доставленная означенная доза рассчитана на основе экспериментально определенной эффективности фракции мелкодисперсных частиц 30%. Уровни лекарственного средства в плазме измеряли в большом числе точек времени на протяжении исследования.
Начальные эксперименты (n=2) осуществляли при концентрации монтелукаста в виде кислоты 0,1 мг/кг. Эта доза привела к частичному ингибированию LAR и AHR, но не EAR. Второй ряд экспериментов (n=4) осуществляли при концентрации монтелукаста в виде кислоты 0,3 мг/кг. Было достигнуто заметное ингибирование всех трех фаз реакции. Полученные результаты обобщаются в таблице 5.
| Таблица 5 | |||
| Монтелукаст в виде кислоты у овцы, чувствительной к заражению аскаридами | |||
| Доза | Ингибирование EAR (%) | Ингибирование LAR (%) | Ингибирование AHR (%) |
| Примерно 0,3 мг/кг (9 капсул) | 47 | 79 | 76 |
| Примерно 0,1 мг/кг (3 капсулы) | 7 | 42 | 60 |
ПРИМЕР 2 - СОЕДИНЕНИЕ Х
Описание соединения Х
Три размолотых на струйной мельнице образца соединения Х изучали, используя порошковую рентгеновскую дифракцию (XRPD) и термогравиметрию (TGA), эти размолотые на струйной мельнице образцы обладали свойствами, аналогичными неразмолотым партиям. Образцы сохранили свою кристаллическую форму. С помощью SEM было показано, что размер частиц размолотого на струйной мельнице лекарственного средства оказался меньше по сравнению с неразмолотым лекарственным средством, несмотря на сохранение игольчатой морфологии. Размер частиц лекарственного средства находился в диапазоне от приблизительно 2-25 мкм в длину и приблизительно 2 мкм в ширину с агломератами до 50 мкм в д