Способ синтеза мандипропамида и его производных
Иллюстрации
Показать всеЗаявлен способ получения соединения формулы (I), где n равно 0, а значения заместителей R, R1 приведены в п.1 формулы изобретения, который включает: (i) этерификацию соединения формулы (V) со спиртом формулы , где m и m' независимо равны 0 или 1; при условии, что оба одновременно не равны 0 и значения А приведены в п.1 формулы изобретения с получением соединения формулы (III); (ii) реакцию соединения формулы (III) и соединения формулы (IV) с образованием соединения формулы (II); и (iii) реакцию соединения формулы (II) с , в котором L является уходящей группой, с образованием соединения формулы (I); так же заявлены промежуточные соединения формулы (II), формулы (III) и формулы (XII). 4 н. и 11 з.п. ф-лы, 19 пр., 1 ил.
Реферат
Настоящее изобретение относится к способу получения противогрибковых препаратов на основе производных фенилпропаргилового эфира и к способам получения некоторых промежуточных соединений.
Противогрибковые препараты на основе производных фенилпропаргилового эфира, которые можно получать согласно настоящему изобретению, описаны, например, в WO01/87822. Эти препараты на основе производных фенилпропаргилового эфира соответствуют формуле (А)
включая их оптические изомеры и смеси таких изомеров, в которой
RI представляет собой водород, алкил, циклоалкил или необязательно замещенный арил;
RII и RIII - каждый независимо представляет собой водород или алкил;
RIV является алкилом, алкенилом или алкинилом;
RV, RVI, RVII и RVIII - каждый независимо представляет собой водород или алкил;
RIX представляет собой водород, необязательно замещенный алкил, необязательно замещенный алкенил; или необязательно замещенный алкинил;
Rx представляет собой необязательно замещенный арил, необязательно замещенный гетероарил; и
Z представляет собой галоген, необязательно замещенный арилоксил, необязательно замещенный алкоксил, необязательно замещенный алкенилоксил, необязательно замещенный алкинилоксил, необязательно замещенную арилтиогруппу, необязательно замещенную алкилтиогруппу, необязательно замещенную алкенилтиогруппу, необязательно замещенную алкинилтиогруппу, необязательно замещенный алкилсульфинил, необязательно замещенный алкенилсульфинил, необязательно замещенный алкинилсульфинил, необязательно замещенный алкилсульфонил, необязательно замещенный алкенилсульфонил или необязательно замещенный алкинилсульфонил.
Разные способы получения соединений приведенной выше формулы (А) описаны в WO01/87822.
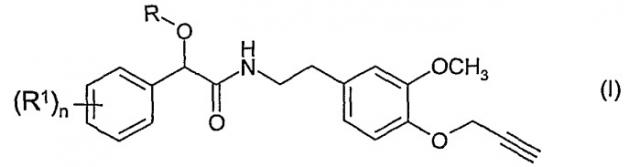
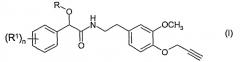
Настоящее изобретение относится к другому, альтернативному и предпочтительному пути синтеза фунгицидов на основе производных фенилпропаргилового эфира формулы (I)
в которой:
R представляет собой алкинил;
R1 представляет собой алкил, алкенил, алкинил, циклоалкил, циклоалкил-алкил, фенил и фенилалкил, причем каждая из указанных групп, в свою очередь, содержит один или более одинаковых или разных атомов галогенов; алкоксил; алкенилоксил; алкинилоксил; алкоксиалкил; галогеналкоксил; алкилтиогруппу; галогеналкилтиогруппу; алкилсульфонил; формил; алканоил; гидроксил; галоген; цианогруппу; нитрогруппу; аминогруппу; алкиламиногруппу; диалкиламиногруппу; карбоксил; алкоксикарбонил; алкенилоксикарбонил или алкинилоксикарбонил; и
n является целым числом 0-3.
Термины «алкил», «алкенил» или «алкинил» как в одном заместителе, так и в части другого заместителя представляют собой группы с 1-8 (2-8 в случае алкенила или алкинила) атомами углерода, лучше 1-6 (или 2-6) и предпочтительно 1-4 (или 2-4) атомами углерода.
Конкретные примеры R включают: этинил, проп-1-инил, проп-2-инил, бут-1-инил, бут-2-инил, l-метил-2-бутинил, гекс-1-инил, l-этил-2-бутинил или окт-1-инил. Наиболее предпочтительным является проп-2-инил.
Типичные примеры R1 включают: 4-хлор, 4-бром, 3,4-дихлор, 4- хлор-3-фтор, 3-хлор-4-фтор, 4-метил, 4-этил, 4-пропаргилоксил, 3-метил, 4-фтор, 4-этенил, 4-этинил, 4-пропил, 4-изопропил, 4-трет-бутил, 4-этоксил, 4-этинилоксил, 4-феноксил, 4-метилтиогруппу, 4-метилсульфонил, 4-цианогруппу, 4-нитрогруппу, 4-метоксикарбонил, 3-бром, 3-хлор, 2-хлор, 2,4-дихлор, 3,4,5-трихлор, 3,4-дифтор, 3,4-дибром, 3,4-диметоксил, 3,4-диметил, 3-хлор-4-цианогруппу, 4-хлор-3-цианогруппу, 3-бром-4-метил, 4-метокси-3-метил, 3-фтор-4-метоксил, 4-хлор-3-метил, 4-хлор-3-трифторметил, 4-бром-3-хлор, 4-трифторметил, 4-трифторметоксил, 4-метоксил. Лучше, когда R1 представляет собой 3-галоген, 4-галоген или 3,4-дигалоген; предпочтительно 4-хлор.
Когда n равен 2 или 3, группы R1 могут быть одинаковыми или разными. Лучше n, равный 1 или 2; предпочтительно 1.
Соответственно, первый вариант настоящего изобретения относится к способу получения соединения формулы (I), как описано выше, причем указанный способ включает:
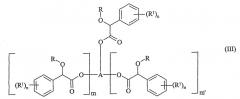
(i) реакцию соединения формулы (III)
в которой R, R1 и n определены выше;
m и m' независимо равны 0 или 1;
в случае, когда m и m' - оба равны 0, A является алкильной, алкенильной или алкинильной группой (лучше содержащей до восьми атомов углерода), необязательно замещенной одной или более группами, независимо выбранными из галогена, гидроксила, алкоксила, C1-4 диалкиламиногруппы или цианогруппы;
в случае, когда один из m и m' равен 0, а другой равен 1, A представляет собой алкандиильную, алкендиильную или алкиндиильную группу, содержащую по меньшей мере два атома углерода (лучше до восьми атомов углерода), необязательно замещенную одной или более группами, независимо выбранными из галогена, гидроксила, алкоксила, C1-4-диалкиламиногруппы или цианогруппы;
в случае, когда m и m' - оба равны 1, A представляет собой алкантриильную, алкентриильную или алкинтриильную группу, содержащую по меньшей мере три атома углерода (лучше до восьми атомов углерода), необязательно замещенную одной или более группами, независимо выбранными из галогена, гидроксила, алкоксила, C1-4-диалкиламиногруппы или цианогруппы;
и в которой, если группа А содержит три или более атомов углерода, один или более атомов углерода каждый может необязательно быть замещен атомом кислорода при условии, что по меньшей мере один атом углерода находится между двумя атомами кислорода в молекуле,
с соединением формулы (IV)
с образованием соединения формулы (II)
в которой R, R1 и n определены выше, и
(ii) реакцию соединения формулы (II), содержащего группировку , в которой L является уходящей группой, с образованием соединения формулы (I).
Под терминами «алкандиил» и «алкантриил» авторы понимают алкильную группу с двумя или тремя свободными валентностями соответственно (т.е. отсутствуют два или три атома водорода), лучше свободными валентностями при разных атомах углерода.
Под терминами «алкендиил» и «алкентриил» авторы понимают алкенильную группу с двумя или тремя свободными валентностями соответственно, лучше свободными валентностями при разных атомах углерода.
Под терминами «алкиндиил» и «алкинтриил» авторы понимают алкинильную группу с двумя или тремя свободными валентностями соответственно, лучше свободными валентностями при разных атомах углерода.
Подходящие уходящие группы L включают галогены, алкилсульфонаты, галогеналкилсульфонаты и необязательно замещенные арилсульфонаты; и предпочтительно, чтобы L представлял собой хлор или мезилат.
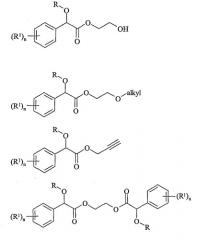
Примеры соединений формулы (III) включают следующие соединения:
Стадию (i) лучше проводить в интервале температур 50°-150°C. Реакцию можно проводить в расплаве или в присутствии инертного растворителя, например, толуола, ксилола, хлорбензола и т.п. Температура реакции зависит от реакционной способности сложного эфира. В случае сложных эфиров с низкой реакционной способностью, таких как метиловый эфир, этиловый эфир или бензиловый эфир, можно добавить спирт с высокой реакционной способностью типа диэтиламиноэтанола, этиленгликоль триэтаноламина или пропаргилового спирта или для понижения температуры реакции и во избежание побочных реакций напрямую использовать сложные эфиры указанных спиртов. Обычно температура реакции составляет 70°-120°C. При более высоких температурах образуется больше побочных продуктов.
Стадию (ii) лучше проводить в среде наиболее распространенных полярных и неполярных растворителей (например, в углеводородах типа толуола, ксилола или в хлорированных углеводородах, включая хлорбензол, или в простых эфирах, включая ТГФ, диоксан, анизол, или в нитрилах, например, ацетонитриле), или в смесях с водой в присутствии оснований, таких как гидроксиды щелочных металлов, гидроксиды щелочноземельных металлов или карбонаты. Лучше, если растворитель или смесь растворителей инертны по отношению к соединению (II) и основанию. Основание можно использовать в широком интервале концентраций, предпочтительно в интервале 1-2 моля на моль соединения (II). Полезно использовать катализатор межфазного переноса типа тройных аммониевых солей в интервале 0,5-10 мол.%. Лучше проводить реакцию в интервале температур 20-150°C, предпочтительно - в интервале 50-100°C.
Соединение формулы (III) можно получить из соединения формулы (V)
;
или из соединения формулы (VI)
или из соединения формулы (VII)
в которой R, R1, m, m', n и A определены выше, и X является уходящей группой. Подходящие уходящие группы включают галоген, такой как фтор, хлор или бром, или алкилсульфонат или арилсульфонат.
Соответственно, второй вариант изобретения предлагает способ получения соединения формулы (I), как описано выше, причем указанный способ включает
(i) (a) этерификацию соединения формулы (V), как описано выше;
или
(b) реакцию соединения формулы (VI), как описано выше, со спиртом формулы , в которой A, m и m' определены выше; или
(c) реакцию указанного выше соединения формулы (VII) со спиртом R-OH, в котором R определен выше, с образованием соединения приведенной выше формулы (III);
(ii) реакцию соединения формулы (III) с соединением указанной выше формулы (IV) с образованием соединения приведенной выше формулы (II); и
(iii) реакцию соединения формулы (II), содержащего группу, в которой L определен выше, с образованием соединения формулы (I).
Стадию (i)(a) лучше проводить в расплаве или в присутствии инертного растворителя, такого как толуол, ксилол, хлорбензол и т.д. Реакция ускоряется при добавлении катализатора, такого как серная кислота, метансульфоновая кислота или п-толуолсульфокислота. Для достижения высокой конверсии образующуюся по реакции воду предпочтительно удалять перегонкой или разлагать химически, например, добавлением, например, триметилового эфира ортомуравьиной кислоты. Реакцию лучше проводить при температуре 0°-150°C, предпочтительно в интервале 50°-100°C.
Стадию (i)(b) лучше проводить в растворителе, таком как углеводород, например, в гексане, циклогексане, метилциклогексане или толуоле; в хлоруглеводороде, например, дихлорметане или хлорбензоле; в простом эфире, например, диэтиловом, трет-бутилметиловом, в диоксане или тетрагидрофуране; или в воде. Можно также использовать в качестве растворителя сам спирт. Можно использовать и смеси таких растворителей. Реакцию проводят в присутствии кислоты, такой как органическая или неорганическая кислота, такой как галогенид водорода, например, хлорид водорода, бромид водорода, или такой как серная кислота или фосфорная кислота. Реакцию лучше проводить при температуре в интервале от -80°C до температуры кипения реакционной смеси, предпочтительно в интервале 0°-100°C.
Стадию (i)(c) лучше проводить в присутствии основания, такого как триалкиламин, в отсутствие воды. Реакцию лучше проводить в растворителе, например, в углеводороде, включая толуол, ксилол, или в хлорированном углеводороде, например, хлорбензоле, или в эфире, таком как ТГФ, диоксан, анизол, или в амиде, таком как ДМФА, в присутствии основания, например, карбоната калия, или спирта, например, пропаргилового спирта. Температура реакции составляет 0°-100°C.
Стадии (ii) и (iii) проводят, как описано выше.
Соединения формулы (V) можно получить из соединения формулы (VIII)
или соединения формулы (IX)
или соединения формулы (X)
в которой R1, n, X и Y определены выше, и каждый может быть одинаковым или разными и представляют собой алкоксигруппу или галоген; лучше C1-4 алкоксил или галоген, предпочтительно метоксил или хлор.
Соответственно, третий вариант изобретения предлагает способ получения соединения формулы (I), как описано выше, причем указанный способ включает
(i) (a) реакцию соединения формулы (VIII), как описано выше, со спиртом R-OH; или
(b) реакцию соединения формулы (IX), как описано выше, со спиртом R-OH в присутствии основания; или
(c) реакцию соединения формулы (X), как описано выше, со спиртом R-OH и тригалогенметаном или тригалогенуксусной кислотой в присутствии основания;
с образованием соединения формулы (V), как описано выше;
(ii) этерификацию соединения формулы (V) с образованием соединения формулы (III), как описано выше;
(iii) реакцию соединения формулы (III) с соединением формулы (IV), как описано выше, с образованием соединения формулы (II), как описано выше; и
(iv) реакцию соединения формулы (II) с соединением , в котором L определен выше, с образованием соединения формулы (I).
Стадию (i)(a) лучше проводить в присутствии основания, такого как гидроксид щелочного металла или третичный амин. Лучше использовать основание в соотношении 2-10 моль на моль соединения (VIII), предпочтительно 2,5-3,5 моль. Один моль основания расходуется на нейтрализацию карбоксильной кислотной группы соединения (VIII). Реакцию лучше проводить в интервале температур от -50°C до 120°C, предпочтительно в интервале от -10°C до 50°C. В качестве растворителя можно использовать спирт R-OH или дополнительный растворитель, такой как алифатический или ароматический углеводород, галогенированный ароматический углеводород, кетоны, простые эфиры, N-метилпирролидон (NMP) или диметилсульфоксид (ДМСО). Реакцию лучше проводить в отсутствие воды.
Стадию (i)(b) проводят в присутствии основания, такого как гидроксид щелочного или щелочноземельного металла, например, гидроксида натрия или гидроксида калия, алкоголятов натрия или калия, например, метоксида натрия или азотсодержащих соединений, например, l,8-диазабицикло-[5.4.0]-ундец-7-ена (DBU), l,4-диазабицикло-[2.2.2]-октана (DABCO) (известного также как триэтилендиамин). Можно использовать также смеси таких оснований. Реакцию лучше проводить при температуре от -80°C до 150°C, предпочтительно в интервале 30-100°C. Реакцию лучше проводить в растворителе, например, в полярном или неполярном органическом растворителе, таком как углеводороды, простые эфиры, амиды, например, ДМЭ, диглим, диоксан, ТГФ, анизол, N-метилпирролидон, ДМСО или спирт; спирт ROH также может быть растворителем.
Стадию (i)(c) лучше проводить при температурах от -80°C до 150°C, предпочтительно в интервале 0°-70°C. Тригалогенметаны являются производными метана, в которых три атома водорода замещены одинаковыми или разными галогенами типа фтора, хлора или брома. Примерами таких тригалогенметанов являются хлороформ, бромоформ, хлордибромметан или бромдихлорметан. Подходящие гидроксидные основания включают гидроксиды щелочных или щелочноземельных металлов, такие как гидроксид натрия или гидроксид калия. Реакцию лучше проводить в растворителе, таком как углеводород, например, гексан, циклогексан, метилциклогексан или толуол; хлоруглеводород, например, дихлорметан или хлорбензол; простой эфир, например, диэтиловый эфир, трет-бутилметиловый эфир, диоксан или тетрагидрофуран, или вода. Можно также использовать смеси растворителей. Спирт и/или тригалогенметан можно также использовать в качестве растворителя; в одном варианте спирт R-OH используют как растворитель; еще в одном варианте растворителем служит тригалогенметан.
Стадии (ii)-(iv) проводят, как описано выше.
Соединение определенной выше формулы (VI) можно получить из соединения формулы (XI)
в которой R, R1 и n - такие же, как указано выше, - либо напрямую, либо через соединение формулы (XII)
в которой R, R1 и n - такие же, как указано выше.
Соответственно, четвертый вариант изобретения предлагает способ получения соединения описанной выше формулы (I), причем указанный способ включает
(i) (a) реакцию соединения описанной выше формулы (XI) с цианирующим реагентом; или
(b) (i) реакцию соединения описанной выше формулы (XI) с хлорирующим реагентом с образованием описанного выше соединения формулы (XII) и последующей реакцией соединения формулы (XII) с цианирующим реагентом;
с образованием соединения описанной выше формулы (VI).
(ii) реакцию соединения формулы (VI) со спиртом формулы , в которой m, m' и A определены выше, с образованием описанного выше соединения формулы (III);
(iii) реакцию соединения формулы (III) с соединением описанной выше формулы (IV), с образованием соединения описанной выше формулы (II); и
(iv) реакцию соединения формулы (II) с, в котором L определен выше, с образованием соединения формулы (I).
Стадию (i)(a) лучше проводить в присутствии Бренстедовских кислот, таких как сильная минеральная кислота, например, хлорид водорода, бромид водорода или серная кислота, или Льюисовских кислот, таких как соединения элементов III группы, например, трифторид бора, соли металлов, например, соли цинка, такие как хлорид цинка (II), бромид цинка (II), соли железа, такие как хлорид железа (III), соли кобальта, такие как хлорид кобальта (II), соли сурьмы, такие как хлорид сурьмы (V), соли скандия, такие как трифлат скандия (III), соли иттрия, такие как трифлат иттрия (III), соли индия, такие как хлорид индия (III), соли лантана, такие как трифлат лантана (III), или соли висмута, такие как хлорид висмута (III), бромид висмута (III). Предпочтительно использовать кислоту в количествах меньше стехиометрических. Подходящие цианирующие реагенты включают цианид водорода, цианосиланы, такие как триалкилсилилцианид, например, триметилсилилцианид или аналогичные циангидрины. Реакцию предпочтительно проводить в растворителе, таком как углеводород, например, гексан, циклогексан, метилциклогексан или толуол; хлоруглеводород, например, дихлорметан или хлорбензол; простой эфир, например, диэтиловый, трет-бутилметиловый эфиры, диоксан или тетрагидрофуран; амид, например, N,N-диметиламид, N,N-диметилацетамид или N-метилпирролидон. Можно также использовать смеси растворителей. Реакцию лучше проводить в интервале температур от -80°C до 150°C, предпочтительно в интервале 0°-70°C.
Стадию (i)(b)(i) лучше проводить при температуре от -80°C до 100°C, предпочтительно в интервале 0°-25°C. В качестве хлорирующих реагентов лучше использовать органические хлориды, такие как низшие алканоилхлориды, например, ацетилхлорид, или хлориды неорганических кислот, например, тионилхлориды, сульфурилхлорид или оксихлорид фосфора. Можно также использовать смесь хлорирующих реагентов. Реакцию проводят в подходящем растворителе, таком как углеводород, например, гексан, циклогексан, метилциклогексан или толуол; хлоруглеводород, например, дихлорметан или хлорбензол; простой эфир, например, диэтиловый, трет-бутилметиловый эфиры, диоксан или тетрагидрофуран. Можно также использовать смеси растворителей.
Стадию (i)(b)(ii) проводят в подходящем растворителе, таком как углеводород, например, гексан, циклогексан, метилциклогексан или толуол; хлоруглеводород, например, дихлорметан или хлорбензол; простой эфир, например, диэтиловый, трет-бутилметиловый эфиры, диоксан или тетрагидрофуран; амиды, например, N,N-диметиламид, N,N-диметилацетамид или N-метилпирролидон; или вода. Можно также использовать смеси растворителей. Подходящие цианирующие реагенты включают цианиды металлов, такие как цианиды щелочных или щелочноземельных металлов, например, цианиды натрия или калия. Реакцию лучше проводить при температурах от -50°C до 100°C, предпочтительно - 0°-40°C.
Стадии (ii)-(iv) проводят, как описано выше.
Описанное выше соединение формулы (VII) можно получить из соединения формулы (XIII)
в которой R1, n и X - такие же, как описано выше, и W является галогеном, предпочтительно хлором.
Соответственно, пятый вариант изобретения предлагает способ получения описанного выше соединения формулы (I), причем указанный способ включает
(i) реакцию соединения описанной выше формулы (XIII) со спиртом формулы
, в которой A, m и m' определены выше, с образованием соединения описанной выше формулы (VII).
(ii) реакцию соединения формулы (VII) со спиртом R-OH, в котором R - такой же, как описано выше, с образованием соединения формулы (III), описанной выше;
(iii) реакцию соединения формулы (III) с соединением приведенной выше формулы (IV) с образованием соединения описанной выше формулы (II); и
(iv) реакцию соединения формулы (II) с соединением , в котором L определен выше, с образованием соединения формулы (I).
Стадию (i) лучше проводить в присутствии основания, такого как триалкиламин, в обычных условиях реакции хлорангидрида кислоты со спиртом. Например, растворитель может быть спиртом типа пропаргилового спирта, и температура реакции может составлять от -20°C до 150°C, предпочтительно в интервале 0°-60°C.
Стадии (ii)-(iv) проводят, как описано выше.
Соединения приведенной выше формулы (VIII) можно получить из соединения формулы (XIV)
в которой R1 и n определены выше.
Соответственно, шестой вариант изобретения предлагает способ получения соединения описанной выше формулы (I), причем указанный способ включает
(i) галогенирование соединения описанной выше формулы (XIV) с образованием соединения описанной выше формулы (VIII);
(ii) реакцию соединения формулы (VIII) со спиртом R-OH, в котором R определен выше, с образованием соединения приведенной выше формулы (V);
(iii) этерификацию соединения формулы (V) с образованием соединения приведенной выше формулы (III);
(iv) реакцию соединения формулы (III) с соединением описанной выше формулы (IV) с образованием соединения определенной выше формулы (III); и
(v) реакцию соединения формулы (II) с , в котором L определен выше, с образованием соединения формулы (I).
Стадию (i) можно проводить в расплаве или в инертном растворителе типа уксусной кислоты или большинства галогенированных ароматических и алифатических растворителей. Для ускорения реакции надо добавить катализатор типа красного фосфора, фосфортрихлорида или бромида, фосфорпентахлорида или бромида, тионилхлорида или тионилбромида, фосгена в количестве 0,01-1,0 моля на моль соединения (XIV), предпочтительно в интервале 0,1-0,5 моль. Галогенирование (XIV) можно осуществить с помощью брома, хлора или соответствующего сукцинимида в интервале температур 50°-200°C, предпочтительно 80°-150°C.
Стадии (ii)-(v) можно проводить, как описано выше.
Соединения описанной выше формулы (IX) можно получить из соединения описанной выше формулы (X) или соединения формулы (XV)
в которой R1 и n определены выше.
Соответственно, седьмой вариант изобретения предлагает способ получения соединения описанной выше формулы (I), причем указанный способ включает:
(i) (a) присоединение тригалогенметан-аниона к соединению описанной выше формулы (X); или
(b) присоединение тригалогенацетальдегида к соединению описанной выше формулы (XV);
с образованием соединения описанной выше формулы (IX);
(ii) реакцию соединения формулы (IX) со спиртом R-OH и тригалогенметаном в присутствии основания с образованием соединения определенной выше формулы (V);
(iii) этерификацию соединения формулы (V) с образованием соединения приведенной выше формулы (III);
(iv) реакцию соединения формулы (III) с соединением определенной выше формулы (IV) с образованием соединения определенной выше формулы (II); и
(v) реакцию соединения формулы (II) с соединением , в котором L определен выше, с образованием соединения формулы (I).
Стадию (i)(a) лучше проводить в растворителе, таком как углеводород, например, гексан, циклогексан, метилциклогексан или толуол; хлоруглеводород, например, дихлорметан или хлорбензол; простой эфир, например, диэтиловый, трет-бутилметиловый эфиры, диоксан или тетрагидрофуран; амид, например, N,N-диметилформамид, N,N-диметилацетамид или N-метилпирролидон; или вода. Можно также использовать смеси растворителей. Тригалогенметаны являются производными метана, в котором три атома водорода замещены одинаковыми или разными галогенами типа фтора, хлора или брома. Примерами таких тригалогенметанов являются хлороформ, бромоформ, хлордибромметан или бромдихлорметан. Можно также использовать соли щелочных или щелочноземельных металлов или тригалогенметанкарбоновых кислот в присутствии соответствующих тригалогенметанкарбоновых кислот, таких как натриевая соль трихлоруксусной кислоты или калиевая соль трихлоруксусной кислоты в присутствии трихлоруксусной кислоты. Реакцию лучше проводить в интервале температур от -80°C до 150°C, предпочтительно в интервале 0-70°C.
Стадию (i)(b) проводят в подходящем растворителе, таком как дисульфид углерода; хлоруглеводород, например, дихлорметан или хлороформ; ароматическое соединение, например, хлорбензол, дихлорбензол, трихлорбензол, нитробензол; простой эфир, например, диэтиловый, трет-бутилметиловый эфиры, диоксан или тетрагидрофуран. Можно также использовать смеси растворителей. Тригалогенацетальдегиды являются производными ацетальдегида, в котором три атома водорода замещены одинаковыми или разными атомами галогенов, таких как фтор, хлор или бром. Примерами таких тригалогенацетальдегидов являются трихлорацетальдегид, трибромацетальдегид, хлордибромацетальдегид или бромдихлорацетальдегид. Реакцию лучше проводить при температурах в интервале от -80°C до 150°C, предпочтительно с интервале от -10°C до 70°C.
Стадии (ii)-(v) проводят, как описано выше.
Соединения определенной выше формулы (XI) получают из соединений описанной выше формулы (X).
Соответственно, восьмой вариант настоящего изобретения предлагает способ получения соединения определенной выше формулы (I), причем указанный способ включает:
(i) реакцию соединения приведенной выше формулы (X) со спиртом R-OH в присутствии кислоты с образованием соединения приведенной выше формулы (XI);
(ii) (a) реакцию соединения формулы (XI) с цианирующим реагентом; или
(b) (i) реакцию соединения формулы (XI) с хлорирующим реагентом с образованием соединения приведенной выше формулы (XII) и последующей (ii) реакцией соединения формулы (XII) с цианирующим реагентом
с образованием соединения приведенной выше формулы (VI).
(iii) реакцию соединения формулы (VI) со спиртом формулы
, в которой A, m и m' определены выше, с образованием соединения приведенной выше формулы (III);
(iv) реакцию соединения формулы (III) с соединением описанной выше формулы (IV) с образованием соединения указанной выше формулы (II); и
(v) реакцию соединения формулы (II) с соединением , в котором L определен выше, с образованием соединения формулы (I).
Стадию (i) проводят в присутствии подходящего растворителя, такого как углеводород, например, гексан, циклогексан, метилциклогексан или толуол; хлоруглеводород, например, дихлорметан или хлорбензол; простой эфир, например, диэтиловый, трет-бутилметиловый эфиры, диоксан или тетрагидрофуран. В предпочтительном варианте спирт R-OH используют в качестве растворителя. Можно также использовать смеси растворителей. Реакцию проводят в присутствии кислоты, такой как Бренстедовская кислота, например, сильная минеральная кислота, в том числе хлорид водорода, бромид водорода или серная кислота; Льюисовская кислота, такая как соединения элементов III группы, например, трифторид бора; соль металла, например, соли цинка, такие как хлорид цинка (II), бромид цинка (II), соли железа, такие как хлорид железа (III), соли кобальта, такие как хлорид кобальта (II), соли сурьмы, такие как хлорид сурьмы (V), соли скандия, такие как трифлат скандия (III), соли иттрия, такие как трифлат иттрия (III), соли индия, такие как хлорид индия (III), соли лантана, такие как трифлат лантана (III), или соли висмута, такие как хлорид висмута (III), бромид висмута (III). Предпочтительно использовать кислоту в субстехиометрических количествах. Реакцию можно также проводить в присутствии ортоэфира, такого как ортоэфиры низших алкилкарбоновых кислот и низших алкиловых спиртов, например, триметилортоформиата, триметилортоацетата и триэтилортоформиата или триэтилортоацетата. Предпочтительно использовать ортоэфир, когда продукты реакции (сложный эфир и спирт) можно удалить из реакционной смеси дистилляцией. Реакцию лучше проводить при температурах от -80°C до температуры кипения реакционной смеси, предпочтительно в интервале 0°-100°C.
Стадии (ii)-(v) проводят, как описано выше.
Соединения указанной выше формулы (XIII) можно получить из соединений формулы (XVI)
в которой R1, W и n определены выше.
Соответственно, девятый вариант изобретения предлагает способ получения соединения приведенной выше формулы (I), причем указанный способ включает:
(i) галогенирование соединения приведенной выше формулы (XVI) с образованием соединения описанной выше формулы (XIII);
(ii) реакцию соединения формулы (XIII) со спиртом формулы
, в которой A, m и m' определены выше, с образованием соединения определенной выше формулы (VII).
(iii) реакцию соединения формулы (VII) со спиртом R-OH, в котором R определен выше, с образованием соединения описанной выше формулы (III);
(iv) реакцию соединения формулы (III) с соединением описанной выше формулы (IV) с образованием соединения приведенной выше формулы (II); и
(v) реакцию соединения формулы (II) с соединением , в котором L определен выше, с образованием соединения формулы (I).
Стадию (i) проводят, как описано в патенте Канады 967978, в расплаве или в инертном растворителе, таком как хлорированные углеводороды или хлорированные ароматические соединения, в интервале температур 50-150°C.
Стадии (ii)-(v) проводят, как описано выше.
Соединения формул (IV), (X), (XIV), (XV) и (XVI) известны в данной области, и их получение легко доступно для специалистов.
Альтернативно, соединения формулы (IV) можно получить новым способом согласно следующей схеме реакции:
Способы предшествующего уровня техники для получения соединений формулы (IVA) связаны со значительным количеством водных стоков и/или использованием дорогих катализаторов; водные стоки необходимо обрабатывать (путем разложения цианида хлорной известью или пероксидом водорода), что требует больших затрат и приводит к стокам, все еще содержащим токсичные компоненты.
В приведенной схеме соединение (IVB) превращают в соединение (IVA) с помощью одного из следующих способов:
(i) по реакции соединения (IVB) с цианидом, например, цианидом натрия или калия (предпочтительно в небольшом избытке) при pH 5-9, предпочтительно 6-7, с последующим снижением рН ниже 3 или
(ii) по реакции соединения (IVB) с HCN в органическом или водном растворителе; или
(iii) по реакции соединения (IVB) с ацетонциангидрином в присутствии каталитического количества цианида или обычного основания.
Соединение (IVA) затем восстанавливают с помощью H2/Pd-C и H2SО4/MeOH. В первом способе H2/Pd-C и H2SО4/MeOH добавляют вместе и способ осуществляют через промежуточное соединение (IVA''); во втором способе первым делом добавляют H2SО4/MeOH с образованием промежуточного соединения (IVA') и последующим восстановлением с помощью H2/Pd-C.
Таким образом, следующий вариант изобретения предлагает способ получения соединения (IV), причем указанный способ включает:
(i) реакцию соединения (IVB)
(a) с цианидом, например, цианидом натрия или калия (предпочтительно в небольшом избытке) при рН 5-9, предпочтительно 6-7, с последующим снижением рН ниже 3 или
(b) с HCN в органическом или водном растворителе; или
(c) с ацетонциангидрином в присутствии каталитического количества цианида или обычного основания;
с образованием соединения (IVA), и
(ii) восстановление соединения (IVA) с использованием H2/Pd-C и H2SО4/MeOH через промежуточные соединения (IVA') или (IVA'') и его таутомеров с образованием соединения (IV).
Промежуточные соединения (IVA') и (IVA'') и его «гидроксиенаминный» таутомер также являются новыми веществами и составляют следующий вариант изобретения.
Получение соединения формулы (II) из соединения формулы (III) также является новым предлагаемым способом и соответственно составляет следующий вариант настоящего изобретения.
Многие промежуточные соединения формулы (II), (III), (V), (VI), (VII), (XI) или (XII), особенно когда R1 представляет собой галоген, например, 4-хлор, также являются новыми и соответственно предлагают еще один вариант изобретения.
Схема реакций, изображающая все возможные описанные выше реакции, приведена на Фигуре 1.
Далее изобретение будет проиллюстрировано следующими примерами:
Пример 1: 1-(Бис-проп-2-инилоксиметил)-4-хлорбензол-(4-хлорбензальдегид-дипропаргилацеталь) (соединение формулы XI)
4-Хлорбензальдегид (14,3 г) добавляют к пропаргиловому спирту (56,6 г) и концентрированной соляной кислоте (0,1 мл). Реакционную смесь перемешивают и нагревают до 80°C. Затем непрерывно добавляют триметилортоформиат (11,9 г) в течение 1 часа. Реакционную смесь перемешивают при 85°C в течение 5 часов и часть веществ отгоняют. Реакционную смесь охлаждают до комнатной температуры. Добавляют трет-бутилметиловый эфир (200 мл). Органическую фазу промывают 40% раствором кислого сульфита натрия (2 x 200 мл), сушат (сульфат натрия) и упаривают. Получают 1-(бис-проп-2-инилоксиметил)-4-хлорбензол (18,8 г) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ (м.д.): 2,45 (т, 2H); 4,15 (дд, 2H); 4,3 (дд, 2H); 5,85 (с, 1H); 7,35 (д, 2H); 7,45 (д, 2H).
Пример 2: 1-Хлор-4-(хлорпроп-2-инилоксиметил)бензол (соединение формулы XII)
1-(Бис-проп-2-инилоксиметил)-4-хлорбензол (11,7 г) добавляют к ацетилхлориду (19,9 г) и тионилхлориду (0,2 мл) в течение 1 часа. С помощью периодического охлаждения поддерживают температуру 20°C. Реакционную смесь перемешивают при комнатной температуре в течение 20 часов. Реакционную смесь упаривают при 20-30°C в вакууме. Получают 1-хлор-4-(хлор-проп-2-инилоксиметил)бензол (13,4 г) в виде масла.
1H-ЯМР (CDCl3) δ (м.д.): 2,6 (т, 1H); 4,6 (д, 2H); 6,75 (с, 1H); 7,35 (д, 2H); 7,45 (д, 2H).
Пример 3: (4-Хлорфенил)-проп-2-инилоксиацетонитрил (соединение формулы VI)
1-Хлор-4-(хлорпроп-2-инилоксиметил)бензол (13,0 г) добавляют к цианиду натрия (3,1 г) в N,N-диметилформамиде (40 мл) в течение 2 часов при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и затем выливают в воду (200 мл), содержащую гидроксид натрия (4 г). Водную фазу экстрагируют трет-бутилметиловым эфиром (2 x 200 мл). Органические фазы промывают водой (2 x 50 мл), объединяют, сушат (сульфат натрия) и упаривают. Получают (4-хлорфенил)проп-2-инилоксиацетонитрил (9,2 г), очищают флэш-колоночной хроматографией на силикагеле с использованием смеси этилацетат/гексан в качестве элюата.
1H-ЯМР (CDCl3) δ (м.д.): 2,6 (т, 1H); 4,4 (д, 2H); 5,5 (с, 1H); 7,4-7,5 (м, 4H).
Пример 4: (4-Хлорфенил)-проп-2-инилоксиацетонитрил (соединение формулы VI)
В атмосфере азота триметилсилилциан