Новое трициклическое производное или его фармацевтически приемлемые соли, способ их получения и содержащая их фармацевтическая композиция
Иллюстрации
Показать всеНастоящее изобретение относится к новому трициклическому производному, представленному химической формулой 1, или к его фармацевтически приемлемым солям:
формула 1
где Y1, Y2 и Y3 независимо представляют собой H, C1-C10алкил с линейной или разветвленной цепью, гидрокси, C1-C10алкокси, -CCOR1, -NR2R3 или -A-B; A представляет собой -O-, -CH2-, -CH(CH3)-, -CH=N- или -CONH-; B представляет собой -(CH2)n1-Z, -(CH2)n2-NR2R3 или -(CH2)n3-OR1; Z представляет собой C5-C20арил, незамещенный или замещенный R5 и избирательно R6, C3-C10циклоалкил, незамещенный или замещенный R5 и избирательно R6, C1-C20 гетероциклическое соединение, незамещенное или замещенное R5 и избирательно R6; R1 представляет собой H или C1-C10алкил с линейной или разветвленной цепью; R2 и R3 независимо представляют собой H, C1-C10алкил с линейной или разветвленной цепью или -(CH2)n4R7; R5 представляет собой H, C1-C10алкил с линейной или разветвленной цепью, C5-C20арил или C1-C20гетероциклическое соединение; R6 представляет собой H или C1-C10алкил с линейной или разветвленной цепью; R7 представляет собой -NR8R9, -COOR1, -OR1, -CF3, -CN, галоген или Z; R8 и R9 независимо представляют собой H или C1-C10алкил с линейной или разветвленной цепью; n1-n4 представляют собой соответственно целое от 0 до 15; Y4 представляет собой H или C1-C10алкил с линейной или разветвленной цепью. Также изобретение относится к способам получения соединения формулы 1, к композициям, содержащим описанное выше соединение и с эффективной ингибирующей активностью относительно поли(АДФ-рибоза)полимераз (PARP). Технический результат: получены и описаны новые соединения, которые могут быть пригодными для предотвращения или лечения заболеваний, вызванных избыточной PARP активностью, особенно нейропатической боли, нейродегенеративных заболеваний, сердечно-сосудистых заболеваний, диабетической нейропатии, воспалительных заболеваний, остеопороза и рака, путем ингибирования активности поли(АДФ-рибоза)полимераз. 10 н. и 3 з.п. ф-лы, 123 пр., 7 табл., 2 ил.
Реферат
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к новому трициклическому производному, обладающему превосходной ингибирующей активностью поли(АДФ-рибоза)полимеразы, или его фармацевтически приемлемым солям, способу их получения и содержащей их фармацевтической композиции.
Уровень техники
Поли(АДФ-рибоза)полимеразу (PARP), которая представляет собой фермент в ядрах клеток, обнаруживают в большинстве эукариотических клеток, и она катализирует перенос АДФ-рибозного фрагмента к белку ядерного рецептора, используя никотинамидадениндинуклеотид (NAD+) в качестве субстрата, и вызывает образование гомо-АДФ-рибозного полимера, отходящего от белок-связанной линии. PARP состоит из 7 изозимов, включающих PARP-1, PARP-2, PARP-3, PARP-4 (Vault-PARP), танкилазу, такую как PARP-5 (TANK-1, TANK-2 и TANK-3), PARP-7 и PARP-10 [de la Lastra CA., et al., Curr Pharm Des., 13(9), 933-962, 2007]. Среди вышеуказанных, ядерный фермент поли(АДФ-рибоза)полимераза-1 (PARP-1) представляет собой основной фермент и составляет 97% поли(АДФ-рибоза)полимеразы, синтезируемой в мозге [Strosznajder R.P., et al. Mol Neurobiol., 31, (1-3), 149-167, 2005]. Среди многих функций PARP, в особенности PARP-1, основная функция заключается в содействии репарации ДНК путем АДФ-рибозилирования и регулировании ряда белков репарации ДНК. PARP активация в клетках огромным рядом повреждений ДНК приводит в результате к значительному снижению концентрации и значительной нехватке NDA+. PARP-1 представляет собой 116 кДа нуклеопротеин, который содержит три домена, которые включают N-концевой ДНК-связывающий домен, содержащий два цинковых пальца, домен самопроизвольной модификации и C-концевой каталитический домен. Поли(АДФ-рибоза)полимеразный фермент синтезирует поли(АДФ-рибозу), которая представляет собой полимер с разветвленной структурой, который может состоять из 200 или более фрагментов АДФ-рибозы. Поли(АДФ-рибоза)белковый рецептор может участвовать в прямом или косвенном поддержании целостности ДНК. Это включает гистон, топоизомеразу, ДНК и РНК полимеразу, ДНК лигазу, и Ca2+ и Mg2+-зависимую эндонуклеазу. PARP белки экспрессируются во многих тканях, особенно с большой концентрацией в иммунной системе, сердце, мозге и клеточных линиях микроорганизмов. Хотя PARP белки все-таки обладают минимальной PARP активностью в обычных биологических состояниях, PARP активность увеличивается вплоть до 500 раз при повреждении ДНК.
PARP активация и образование поли(АДФ-рибозных) реакционных продуктов вызывается разрушением ДНК после проведения химиотерапии, воздействия ионизирующего излучения, свободных кислородных радикалов или монооксида азота (NO). При повреждении ДНК, вызванном радиотерапией или химиотерапией, процесс переноса АДФ-рибозы клеток может способствовать устойчивости, которая может возникать в различных типах в процессе лечения рака, поскольку она связана с репарацией поврежденной ДНК. Следовательно, PARP ингибирование может сдерживать репарацию ДНК повреждения в клетках и может усиливать противораковый эффект терапии рака. Более того, недавно сообщалось, что танкираза, которая связывается с теломерным белком TRF-1, фактором негативного контроля длины теломера, имеет каталитический домен со значительной гомогенностью с PARP и обладает in vitro PARP активностью. Кроме того, предполагается, что функция теломера в клетках человека регулируется поли(АДФ-рибозил)ированием. PARP ингибитор является пригодным в качестве средства изучения функции регулирования длины теломера при регулировании теломерной активности танкиразой [BA., et al., Int J Biochem Cell Biol., 37, 1043-1053, 2005]. Например, PARP ингибитор можно применять для лечения рака сокращением жизненного цикла иммортализованных раковых клеток или применять в качестве регулятора жизненного цикла клетки или лекарственного средства против старения ввиду взаимосвязи между длиной теломера и старением клетки.
Также сообщалось, что PARP ингибирование может увеличивать устойчивость при повреждении мозга. Ишемическое повреждение мозга порождается обеднением NAD+, опосредованным поли(АДФ-рибоза)полимеразной активностью, и приводит в результате к недостатку энергии [Endres M., et al., J. Cereb Blood Flow Metab., 17(11), 1143-1151, 1997]. Рассматривая ишемию головного мозга, активация PARP в зависимости от ДНК повреждения действует на апоптоз, вызванный пароксизмом, повреждением мозга и нейродегенеративными заболеваниями. Считается, что апоптоз возникает в результате снижения энергии, соответствующего NAD+ потреблению в результате PARP реакции, катализируемой ферментами, и ДНК повреждение возникает в результате избыточного количества монооксида азота, генерируемого по мере активации синтетазы монооксида азота продуктами, возникшими в результате высвобождения глутаминовой кислоты из деполяризованных нервных окончаний. Недостаток кислорода в нейронах вызывает инсульт или ишемическое повреждение мозга, и затем нейрон высвобождает большое количество глутамата. Избыточное количество глутамата вызывает гиперстимуляцию (эксайтотоксичность) N-метил-D-аспартата (MMDA), альфа-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMPA), каинита и метаботропного рецептора глутамата (MGR), который открывает ионный канал и таким образом обеспечивает нерегулируемый поток ионов (например, допускающий Ca2+ и Na+ в клетки, вызывая K+ высвобождение из клеток), вызывая гиперстимуляцию нейронов. Гиперстимулированные нейроны вызывают большее высвобождение глутамата, генерируя цикл обратной связи или эффект «домино» и в конечном счете вызывая повреждение или смерть клетки с помощью генерирования протеазы, липазы и свободных радикалов. Чрезмерная активация глутаматных рецепторов связана с рядом невропатических заболеваний, включая эпилепсию, инсульт, болезнь Альцгеймера, болезнь Паркинсона, амиотрофический латеральный склероз (ALS), болезнь Хантингтона, шизофрению, хроническую боль, ишемию, повреждение нейронов после гипоксии, внешнее повреждение и нейрональное повреждениенейрональное повреждение.
PARP ингибитор можно применять для лечения не только заболеваний центральной нервной системы, но также заболеваний периферической нервной системы, таких как невропатическая боль, вызванная хронической компрессией (CCI) обычного седалищного нерва [Di Cesare Mannelli L., et al., Eur J Neurosci., 26(4), 820-827, 2007]. Точный механизм эффективности PARP ингибитора при лечении невропатической боли полностью еще не объяснен, но рассматривается положительно.
PARP ингибитор также оказывает влияние на лечение воспалительных симптомов, таких как артрит [SzabC., et al., Proc. Natl. Acid. Sci. USA 95(7), 3867-3872, 1998]. Поли(АДФ-рибоза) синтез участвует в индуцированной экспрессии многих генов, которые являются существенными для воспалительных реакций. PARP ингибитор ингибирует образование макрофагоцита, индуцируемой синтазы оксида азота (iNOS) из P-типа селектина и молекулы межклеточной адгезии (1cAM-1) на эндотелиальных клетках. Вышеуказанная активность является основой для сильного противовоспалительного эффекта PARP ингибитором. Более того, PARP ингибирование может ослаблять некроз, препятствуя транслокации и инфильтрации нейтрофилов в поврежденные ткани. Соответственно, PARP ингибитор является пригодным для лечения воспалительных симптомов.
PARP ингибирование является пригодным для защиты от ишемии миокарда [SzabC., Curr Vase Pharmacol., 3(3), 301-303, 2005] и реперфузионного повреждения [Zingarelli B., Cardiovascular Research, 36, 205-215, 1997]. Считается, что основная причина повреждений тканей заключается в сопутствующем образовании свободных радикалов в процессе реперфузии. В процессе ишемии и реперфузии некоторое типичное АТФ снижение во многих организмах может быть связано с NAD+ недостатком, который является результатом превращения поли(АДФ-рибозы). Соответственно, ожидается, что PARP ингибирование будет сохранять уровень клеточной энергии и впоследствии увеличивать выживаемость ишемической ткани после повреждения. Соответственно, PARP ингибитор является пригодным для лечения сердечно-сосудистых заболеваний.
Недавно было выдвинуто предположение об эффективности PARP ингибитора для лечения диабетической нейропатии [Obrosova IG., Diabetes. 54(12), 3435-3441, 2005].
До настоящего времени о разработке поли(АДФ-рибоза)полимеразы (PARP) сообщалось в следующих документах: INO-1001 (Inotek Pharmaceuticals) разрабатывается для лечения сердечно-сосудистых заболеваний и злокачественной меланомы. AG014699 (Pfizer) разрабатывается для лечения злокачественной меланомы. BS-201 и Bs-401 (Bipar Sciences) разрабатываются для лечения рака и рака поджелудочной железы соответственно. Кроме того, AstraZeneca разрабатывает AZD2281 для лечения рака молочной железы, и MGI Pharma проводит исследования сенсибилизирующего агента для радиотерапии и химиотерапия [News, Nature biotechnology, 24(10), 1179-1180, 2006].
Однако разработка ингибиторов поли(АДФ-рибоза)полимеразы (PARP) в связи с нейродегенеративными заболеваниями, которая не проведена в исследованиях до настоящего времени, весьма необходима, принимая во внимание увеличение популяции пожилого населения и для улучшения качества жизни.
Соответственно, первоочередным требованием является разработка ингибитора поли(АДФ-рибоза)полимеразы (PARP), который сможет снизить до минимума побочные эффекты, в частности на текущий момент, когда не разработаны достойные внимания способы лечения вышеупомянутых заболеваний.
Авторы настоящего изобретения исследовали низкомолекулярный PARP ингибитор, который можно применять для лечения различных заболеваний, являющихся результатом чрезмерной активации поли(АДФ-рибоза)полимеразы (PARP), получили новые трициклические производные, подтвердили превосходную PARP ингибирующую активность упомянутой композиции и таким образом завершили настоящее изобретение.
Техническая задача
Задача настоящего изобретения заключается в обеспечении новыми трициклическими производными с превосходной ингибирующей активностью поли(АДФ-рибоза)полимеразы, или их фармацевтически приемлемыми солями, способом их получения и содержащей их фармацевтической композицией.
Техническое решение
Для того чтобы достигнуть вышеупомянутой цели, настоящее изобретение обеспечивает новые трициклические производные или их фармацевтически приемлемые соли.
Кроме того, настоящее изобретение обеспечивает способ получения новых трициклических производных.
Кроме того, настоящее изобретение обеспечивает фармацевтическую композицию, содержащую новые трициклические производные или их фармацевтически приемлемые соли в качестве активного ингредиента, для предотвращения или лечения заболеваний, являющихся результатом чрезмерной активации поли(АДФ-рибоза)полимеразы.
Полезные эффекты
Трициклические производные согласно настоящему изобретению ингибируют активность поли(АДФ-рибоза)полимеразы (PARP), посредством чего они могут быть пригодны для предотвращения или лечения заболеваний, являющихся результатом чрезмерной активации PARP, и в частности, нейропатической боли, нейродегенеративных заболеваний, сердечно-сосудистых заболеваний, диабетической нейропатии, воспалительного заболевания, остеопороза и рака.
Краткое описание чертежей
ФИГ.1 является графическим представлением количества NAD(P)H в зависимости от концентрации соединения варианта осуществления настоящего изобретения.
ФИГ.2 является графическим представлением объема инфаркта в зависимости от дозы соединения варианта осуществления настоящего изобретения.
Лучший вариант осуществления
Ниже настоящее изобретение будет объяснено более подробно.
Настоящее изобретение относится к новым трициклическим производным или их фармацевтически приемлемым солям, представленным химической формулой 1.
Химическая формула 1
где каждый Y1, Y2 и Y3 независимо представляет собой H, С1-С10 алкил с линейной или разветвленной цепью, гидрокси, С1-С10 алкокси, -COOR1, -NR2R3 или -A-B;
A представляет собой -O-, -CH2-, -CH(CH3)-, -CH=N- или -CONH-;
B представляет собой -(CH2)n1-Z, -(CH2)n2-NR2R3 или -(CH2)n3-OR1;
Z представляет собой C5-C20 арил, незамещенный или замещенный R5 и избирательно R6, C3-C10 циклоалкил, незамещенный или замещенный R5 и избирательно R6, C1-C20 гетероциклическое соединение, незамещенное или замещенное R5 и избирательно R6;
R1 представляет собой H или С1-С10 алкил с линейной или разветвленной цепью;
каждый R2 и R3 независимо представляет собой H, С1-С10 алкил с линейной или разветвленной цепью или -(CH2)n4R7;
R5 представляет собой H, С1-С10 алкил с линейной или разветвленной цепью, C5-C20 арил или C1-C20 гетероциклическое соединение;
R6 представляет собой H или С1-С10 алкил с линейной или разветвленной цепью;
R7 представляет собой -NR8R9, -COOR1 , -OR1, -CF3, -CN, галоген или Z;
R8 и R9 независимо представляют собой H или С1-С10 алкил с линейной или разветвленной цепью;
n1-n4 представляют собой целое от 0 до 15 соответственно;
Y4 представляет собой H или С1-С10 алкил с линейной или разветвленной цепью.
Предпочтительно, Y1 и Y2 независимо представляют собой H, C1-C5 алкил с линейной или разветвленной цепью, гидрокси, C1-C5 алкокси, -COOR1, -NR2R3 или -A-B,
где A представляет собой -O-, -CH2-, -CH(CH3)-, -CH=N- или -CONH-;
B представляет собой -(CH2)n1-Z, -(CH2)n2-NR2R3 или -(CH2)n3-OR1;
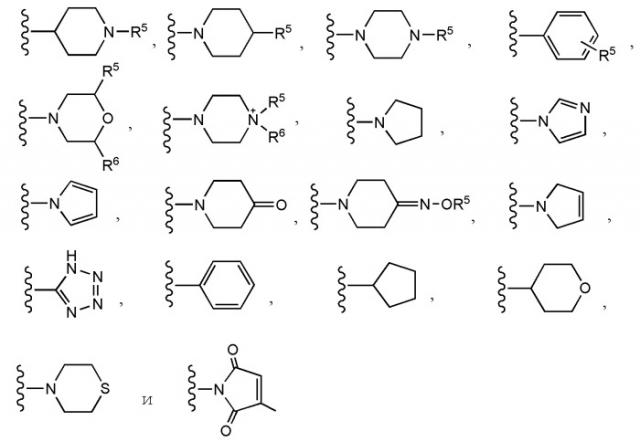
Z представляет собой группу, выбранную из группы, состоящей из структурных формул, представленных ниже:
где R1 представляет собой H или C1-C5 алкил с линейной или разветвленной цепью;
R2 и R3 независимо представляют собой H, C1-C5 алкил с линейной или разветвленной цепью или -(CH2)n4R7;
R5 представляет собой H, C1-C5 алкил с линейной или разветвленной цепью, фенил или морфолино;
R6 представляет собой H или C1-C5 алкил с линейной или разветвленной цепью;
R7 представляет собой -NR8R9, -COOR1, -OR1, -CF3, -CN, F, Cl или Z;
R8 и R9 независимо представляют собой H или C1-C5 алкил с линейной или разветвленной цепью;
n1-n4 представляют собой целое от 0 до 10 соответственно;
Y3 представляет собой H, гидрокси, C1-C5 алкокси или -O(CH2)n3-OR1;
Y4 представляет собой H или C1-C5 алкил с линейной или разветвленной цепью.
Более предпочтительно, Y1 и Y2 независимо представляют собой H, метил, этил, гидрокси, метокси, этокси, -COOR1, -NR2R3 или -A-B,
где A представляют собой -O-, -CH2-, -CH(CH3)-, -CH=N- или -CONH-;
B представляют собой -(CH2)n1-Z, -(CH2)n2-NR2R3 или - (CH2)n3-OR1;
Z представляет собой группу, выбранную из группы, состоящей из структурных формул, представленных ниже:
R1 представляет собой H, метил, этил или изопропил;
R2 и R3 независимо представляют собой H, метил, этил, пропил, изопропил, трет-бутил или -(CH2)n4R7;
R5 представляет собой H, метил, этил, пропил, фенил или морфолино;
R6 представляет собой H, метил или этил;
R7 представляет собой -NR8R9, -COOR1, -OR1, -CF3, -CN, F, Cl или Z;
R8 и R9 независимо представляют собой H или метил;
n1-n4 представляют собой соответственно целое от 0 до 5;
Y3 представляет собой H, гидрокси, метокси, этокси, пропокси или метоксиэтокси; и
Y4 представляет собой H, метил, этил или пропил.
Предпочтительно, соединение трициклических производных, представленных химической формулой 1 настоящего изобретения, включает:
1) 8-Метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
2) 10-Метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
3) 9-Метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
4) 9-Метил-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
5) Этил 5-оксо-1,2,3,4,5,6-гексагидробензо[h][1,6]нафтиридин-9-карбоксилат;
6) 9-Метокси-1-пропил-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
7) 1-Метил-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
8) 9-Метокси-1-метил-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
9) 1-Этил-9-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
10) 1-Метил-9-гидрокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
11) 9-(1-Пропилпиперидин-4-илокси)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
12) 9-(1-Метилпиперидин-4-илокси)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
13) 1-Метил-9-(пиперидин-4-илокси)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
14) 1-Метил-9-(1-метилпиперидин-4-илокси)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
15) 5-Оксо-N-[2-(пиперидин-1-ил)этил]-1,2,3,4,5,6-гексагидробензо[h][1,6]нафтиридин-9-карбоксамид;
16) 9-[2-(Диметиламино)этокси]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
17) 9-[2-(Пиперидин-1-ил)этокси]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
18) 9-(2-Метоксиэтокси)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
19) 9-[2-(Пиперазин-1-ил)этокси]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
20) 9-Этокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
21) 9-[3-(Пиперидин-1-ил)пропокси]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
22) 9-(2-Аминоэтокси)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
23) 9-[2-(4-Фенилпиперидин-1-ил)этокси]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
24) 9-(2-Гидроксиэтокси)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
25) 9-Пентокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
26) 9-[2-(Диэтиламино)этокси]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
27) 9-(2-Морфолиноэтокси)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
28) 1,1-Диэтил-4-[2-(5-оксо-1,2,3,4,5,6-гексагидробензо[h][1,6]нафтиридин-9-илокси]этил)пиперазин-1-ий;
29) 9-[4-(Пиперидин-1-ил)бутокси]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
30) 1-Метил-9-[2-(пиперидин-1-ил)этокси]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
31) 9-[2-(Диметиламино)этил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
32) 8-[2-(Диметиламино)этокси]-1,2,3,4,-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
33) 9-[3-(Диметиламино)пропил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
34) 8-[2-(Диметиламино)этокси]-1,2,3,4,5,6-гексагидробензо[h][1,6]нафтиридин-9-карбоксамид;
35) 8-[2-(Пиперидин-1-ил)этокси]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
36) 8-[3-(Диметиламино)пропокси]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
37) 8-(Диметиламино)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
38) 8-[1-(Диметиламино)этил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
39) 8-[1-(Метиламино)этил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
40) 8-Этил-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
41) 8-[(Диметиламино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
42) 8-[(Диэтиламино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
43) 8-[(Этиламино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
44) 8-(Пирролидин-1-илметил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
45) 8-[(Изопропиламино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
46) 8-[(Пропиламино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
47) 8-{[Этил(метил)амино]метил}-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
48) 8-(Пиперидин-1-илметил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
49) 8-(Морфолинометил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
50) 9-[(Диметиламино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
51) 8-{[Бензил(метил)амино]метил}-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
52) 8-[(Метиламино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
53) 8-{[(2-Гидроксиэтил)(метил)амино]метил}-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
54) 8-{[(2-(Диметиламиноэтил)(метил)амино]метил}-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
55) 8-[(4-Метилпиперазин-1-ил)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
56) 8-[(Метил(пропил)амино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
57) Этил-3-{метил[(5-оксо-1,2,3,4,5,6-гексагидробензо[h][1,6]нафтиридин-8-ил)метил]амино}пропионат;
58) 3-{Метил[(5-оксо-1,2,3,4,5,6-гексагидробензо[h][1,6]нафтиридин-8-ил) метил]амино}пропановая кислота;
59) 8-{[Изопропил(метил)амино]метил}-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
60) 8-{[(2-Метоксиэтил)(метил)амино]метил}-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
61) Этил-3-[(5-оксо-1,2,3,4,5,6-гексагидробензо[h][1,6]нафтиридин-8-ил)метиламино]пропионат;
62) 8-[(2,2,2-Трифторэтиламино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
63) 2-[(5-оксо-1,2,3,4,5,6-гексагидробензо[h][1,6]нафтиридин-8-ил)метиламино]ацетонитрил;
64) 8-[(1H-Имидазол-1-ил)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
65) 8-[(1H-Пиррол-1-ил)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
66) 8-[(Диметиламино)метил]-1-метил-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
67) 1-Метил-8-(пирролидин-1-илметил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
68) 8-[(Диэтиламино)метил]-1-метил-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
69) 1-Метил-8-(пиперидин-1-илметил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
70) 1-Метил-8-(морфолинометил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
71) 8-{[Этил(метил)амино]метил}-1-метил-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
72) 8-[(Диметиламино)метил]-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
73) 10-Метокси-8-[(метиламино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
74) 10-Метокси-8-(морфолинометил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
75) 8-[(Этиламино)метил]-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
76) 8-{[Этил(метил)амино]метил}-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
77) 10-Метокси-8-(пирролидин-1-илметил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
78) 10-Метокси-8-[(4-оксопиперидин-1-ил)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
79) 8-{[4-(Гидроксиимино)пиперидин-1-ил]метил}-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
80) 10-Метокси-8-[(4-(метоксиимино)пиперидин-1-ил)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
81) 10-Метокси-8-{[(2-метоксиэтил)(метил)амино]метил}-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
82) 8-[(2,5-Дигидро-1H-пиррол-1-ил)метил]-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
83) 8-{[(2-Изопропоксиэтил)(метил)амино]метил}-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
84) 10-Метокси-8-(пиперидин-1-илметил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
85) 8-{[(2-Хлорэтил)(метил)амино]метил}-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
86) 8-[(Диэтиламино)метил]-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
87) 8-[(трет-Бутиламино)метил]-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
88) 8-[(Изопропиламино)метил]-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
89) 8-[(Циклопентиламино)метил]-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
90) 8-[(2,6-диметилморфолино)метил]-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
91) Хлорид N-[(10-метокси-5-оксо-1,2,3,4,5,6-гексагидробензо[h][1,6]нафтиридин-8-ил)метил]-N,N-диметилциклопентанаминия;
92) 8-{[Циклопентил(метил)амино]метил}-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
93) 8-{[Изопропил(метил)амино]метил}-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
94) 8-{[(2-Фторэтил)(метил)амино]метил}-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
95) 8-[(1H-Тетразол-5-ил)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
96) 10-Метокси-8-[(морфолиноамино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
97) 10-Метокси-8-{[метил(морфолино)амино]метил}-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
98) (E)-10-Метокси-8-[(морфолиноимино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
99) 8-[(Диметиламино)метил]-10-гидрокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5-(6H)-он;
100) 8-[(Диметиламино)метил]-10-этокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
101) 10-Этокси-8-(морфолинометил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
102) 10-Этокси-8-(пиперидин-1-илметил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
103) 10-Этокси-8-[(метиламино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он,
104) 10-Этокси-8-[(этиламино)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
105) 8-(Гидроксиметил)-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
106) 10-Метокси-8-(тиоморфолинометил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
107) 10-Метокси-8-[(2-морфолиноэтиламино)метил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
108) 10-Метокси-8-[(4-морфолинопиперидин-1-ил)метил]-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
109) 8-(Аминометил)-10-метокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
110) 8-[(Диметиламино)метил)]-10-пропокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
111) 8-(Морфолинометил)-10-пропокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
112) 8-(Аминометил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
113) 8-(Аминометил)-10-этокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
114) 8-(Аминометил)-10-пропокси-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
115) 10-Метокси-8-{[метил(тетрагидро-2H-пиран-4-ил)амино]метил}-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
116) 8-[(Диметиламино)метил]-10-(2-метоксиэтокси)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он;
117) 10-(2-Метоксиэтокси)-8-(морфолинометил)-1,2,3,4-тетрагидробензо[h][1,6]нафтиридин-5(6H)-он; и
118) 1-[(10-Метокси-5-оксо-1,2,3,4,5,6-гексагидробензо[h][1,6]нафтиридин-8-ил)метиламино]-1H-пиррол-2,5-дион.
Настоящее изобретение обеспечивает способ получения соединения, представленного химической формулой 1.
Настоящее изобретение обеспечивает способ получения трициклических производных, представленных химической формулой 1. Предпочтительно, соединение химической формулы 1 можно получить, следуя реакционным схемам, описанным ниже, но не ограничиваясь ими. Соответственно, специалистам в данной области техники вполне понятно, что соединение химической формулы 1 настоящего изобретения можно получить различными способами известных технологий.
Следующие реакционные формулы относятся к последовательным стадиям способа получения соединений настоящего изобретения, и различные соединения настоящего изобретения можно получить, заменяя или модифицируя реагент, растворитель или последовательности реакций, используемых в процессе получения. Некоторые из соединений настоящего изобретения получали способами, которые не включены в объем формул реакций, описанных ниже, и конкретные способы получения данных соединений описаны соответственно в каждом из примеров, приведенных ниже.
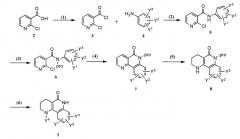
Способ получения 1
В одном варианте осуществления, трициклические производные или их фармацевтически приемлемые соли согласно настоящему изобретению можно получить способом, представленным реакционной формулой 1 ниже, способ включает стадии:
1) превращения карбоновой кислоты 2-хлорникотиновой кислоты, представленной химической формулой 2, в хлорангидрид карбоновой кислоты, представленный химической формулой 3 (стадия 1);
2) получения соединения химической формулы 5 реакцией амидирования хлорангидрида карбоновой кислоты химической формулы 3, полученного на стадии 1, анилином химической формулы 4, замещенным в мета- и/или пара-положении (стадия 2);
3) введения защитной группы в соединение химической формулы 5, полученное на стадии 2, для того чтобы получить N-защищенное соединение химической формулы 6 (стадия 3);
4) получения соединения химической формулы 7 циклизацией соединения химической формулы 6, полученного на стадии 3, в условиях металлического катализатора (стадия 4);
5) получения соединения химической формулы 8 путем восстановления ароматического кольца соединения химической формулы 7, полученного на стадии 4, в газообразном водороде в присутствии палладиевого (Pd) катализатора, или путем восстановления ароматического кольца соединения химической формулы 7, полученного на стадии 4, в газообразном водороде в присутствии палладиевого (Pd) катализатора и затем путем взаимодействия алкилгалогенидного соединения или арилгалогенидного соединения и основания (стадия 5); и
6) снятия защиты соединения химической формулы 8, полученного на стадии 5, для того чтобы получить трициклическое соединение химической формулы 1 (стадия 6).
Реакционная формула 1
где Y1-Y4 такие, как определено в формуле 1, и 'pro' представляет собой защитную группу, такую как арильная группа, бензильная группа, бензилоксиметильная группа, пара-метоксибензильная группа или метоксиметильная группа, предпочтительно пара-метоксибензильная группа или метоксиметильная группа.
Каждая стадия будет объяснена более подробно ниже.
На стадии 1 хлорангидрид кислоты (3) получают превращением коммерчески доступной 2-хлорникотиновой кислоты (2) в хлорангидрид кислоты, применяя реагент, такой как тионилхлорид или оксалилхлорид. Для реакции стадии 1 растворитель не применяют или применяют растворитель, такой как дихлорметан, хлороформ или толуол, который не оказывает отрицательного эффекта на реакцию. Температура реакции специально не ограничена, но в общем реакцию проводят при от комнатной температуры до повышенной температуры и желательно при повышенной температуре.
На стадии 2 соединение химической формулы 5 получают реакцией амидирования хлорангидрида кислоты химической формулы 3 и анилина химической формулы 4, замещенного в мета- и/или пара-положении. На данной стадии реакцию проводят без основания или в присутствии органического амина, такого как пиридин, триэтиламин, диэтилизопропиламин, который обычно применяют для реакции амидирования, используя дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир, толуол или N,N-диметилформамид, который не оказывает отрицательного эфекта на реакцию. Температура реакции конкретно не ограничена, но обычно реакцию проводят при от пониженной температуры до комнатной температуры.
На стадии 3 защитную группу вводят в соединение химической формулы 5, полученное на стадии 2, для синтезирования N-защищенного амидного промежуточного продукта химической формулы 6. Введенная защитная группа может включать алкоксиметил, включая метоксиметил (MOM), бензилоксиметил (BOM) или бензил (Bn) или п-метоксибензил (PMB). Основание, применяемое в реакции, может представлять собой гидрид натрия, трет-бутоксид калия, карбонат калия, и растворитель может представлять собой тетрагидрофуран, N,N-диметилформамид, ацетонитрил или толуол, который не оказывает отрицательного эффекта на реакцию. Температура реакции конкретно не ограничена, но обычно реакцию предпочтительно проводят при от пониженной температуры до повышенной температуры, и более предпочтительно, при пониженной температуре.
На стадии 4 лактам химической формулы 7 получают путем проведения циклизаций N-защищенного амидного промежуточного продукта, полученного на стадии 3, в присутствии металлического катализатора. На данной стадии палладий (0) обычно используют в качестве металлического катализатора, и можно использовать тетракистрифенилфосфин палладия(0) ((PPh3)4Pd), ацетат палладия (II) (Pd(OAc)2), трис(дибензилиденацетон) дипалладия(0) (Pd2dba3) и дихлорид бис(трифенилфосфин)палладия (II) (PdCl2(PPh3)2) отдельно или в комбинации с трибутилфосфином (Bu3P). Реакцию можно проводить без лиганда или с лигандом, обычно применяемым для циклизации в условиях металлического катализатора, включая, например, трифенилфосфин ((PPh3)4), 1,2-бис(дифенилфосфино)пропан (DPPP), (R)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил ((R)-BiNAP). Можно применять основание, включая карбонат калия, карбонат натрия, карбонат серебра, или диэтилизопропиламин для реакции, и реакцию проводят, используя растворитель, включая N,N-диметилформамид, бензол, ксилол или ацетонитрил, который не оказывает отрицательного эффекта на реакцию. Температура реакции конкретно не ограничена, но реакцию обычно проводят при от комнатной температуры до повышенной температуры, и предпочтительно при повышенной температуре.
На стадии 5, пиперидин-лактам (8) получают восстановлением ароматического кольца пиридин-лактама (7), полученного на стадии 4, в газообразном водороде в присутствии палладиевого (Pd) катализатора. На данной стадии можно применять органический растворитель, включая спирт, хлороформ, дихлорметан или этилацетат, который не оказывает отрицательного эффекта на реакцию, или их смесь. Температура реакции конкретно не ограничена, но реакцию обычно проводят при комнатной температуре.
Далее, кроме того, полученный пиперидин-лактам (8) и алкилгалогенидное соединение или арилгалогенидное соединение могут взаимодействовать в присутствии основания, такого как карбонат калия, для получения N-замещенного пиперидин-лактама (Y4=алкил или арил). Реакцию проводят в присутствии основания, которое применяют при стандартном алкилировании или аллилировании аминового соединения, и алкилгалогенида или арилгалогенида. Основание может быть одним из гидрида натрия, карбоната калия, карбоната натрия, карбоната цезия, алкоксида натрия или калия. Далее, реакцию желательно проводить в присутствии растворителя, который не оказывает отрицательного эффекта на реакцию, и растворитель может включать дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир, толуол, N,N-диметилформамид или ацетонитрил. Температура реакции конкретно не ограничена, но реакцию обычно проводят при от пониженной температуры до повышенной температуры, и предпочтительно, при комнатной температуре.
На стадии 6 трициклическое соединение химической формулы 1 получают снятием защиты пиперидин-лактама (8), полученного на стадии 5, способом, обычно известным в области органической химии.
Способ получения 2
В одном варианте осуществления, трициклические производные или их фармацевтически приемлемые соли можно получить способом, представленным реакционной формулой 2 ниже, причем способ включает стадии:
1) деметилирования соединения (7a), полученного на стадии 4, реакционной формулы 1 трибромидом бора для получения гидроксильного соединения (7a-1) (стадия 1);
2) взаимодействия гидроксильного соединения (7a-1), полученного на стадии 1, с алкилгалогенидным соединением, включая 4-бромпиперидин, или 2-хлорэтилпиперидином в присутствии основания, включая карбонат калия и каталитическое количество йодида натрия, для получения алкоксисоединения (7a-2) (стадия 2);
3) получения пиперидин-лактама (8a) восстановлением ароматического кольца пиридин-лактамного соединения (7a-2), полученного на стадии 2, в газообразном водороде в присутствии палладиевого (Pd) катализатора (стадия 3); и
4) снятия защиты соединения (8a), полученного на стадии 3, в кислых условиях, таких как хлороводородная кислота, для получения соединения химической формулы (1a) (стадия 4).
Реакционная формула 2
где 'pro' представляет собой метоксиметильную (MOM) группу, бензильную группу, пара-метоксибензильную (PMB) группу, R1 представляет собой такой, как определено в химической формуле 1, X обозначает уходящую группу, включая галоген, метансульфонильную группу, п-толуолсульфонильную группу или трифторметансульфонильную группу, и предпочтительно, галоген (хлор, бром, йод) или метансульфонильную группу, и формулу 1a включают в химическую формулу 1 по настоящему изобретению.
Согласно реакционной формуле 2 настоящего изобретения для получения соединения химической формулы (1a), вначале, на стадии 1, деметилилированное гидроксильное соединение (7a-1) получают, используя соединение (7a), полученное на стадии 4 реакционной формулы 1, применяя трибромид бора. Можно применять органический растворитель, такой как дихлорметан или хлороформ, который не оказывает отрицательного эффекта на реакцию. Температура реакции конкретно не ограничена, но реакцию обычно проводят при от пониженной температуры до повышенной температуры, и предпочтительно, при комнатной температуре.
На стадии 2 алкоксисоединение (7a-2) получают добавлением каталитического количества йодида натрия к гидроксисоединению (7a-1), полученному на стадии 1, и алкилга