Лиофилизированные днк-составы для увеличенной экспрессии плазмидной днк
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к лиофилизированному ДНК-составу для применения в способе лечения ишемического заболевания и к способу лечения ишемического заболевания у индивидуума. Лиофилизированный ДНК-состав содержит плазмидную ДНК, соль и углевод, где указанная плазмидная ДНК содержит ген HGF или его вариант и где указанный ген HGF или его вариант выбран из группы, состоящей из flHGF, dHGF, NK1, NK2, NK4 и их смеси. Способ лечения ишемического заболевания у человека или млекопитающего включает введение композиции, восстановленной из лиофилизированного ДНК-состава, путем прямой инъекции. Предложенное изобретение позволяет эффективно лечить ишемическое заболевание у человека или млекопитающего. 2 н. и 12 з.п. ф-лы, 5 ил., 2 табл., 5 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к составу ДНК, лиофилизированному из композиции, содержащей плазмидную ДНК, соль и углевода, где указанная плазмидная ДНК содержит ген HGF или его вариант.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Лиофилизация является, зачастую, предпочтительной технологией приготовления лекарственных веществ, поскольку в лиофилизированном состоянии повышается долгосрочная стабильность многих веществ. Однако для плазмидной ДНК лиофилизированные составы не являются составами выбора. В большинстве клинических испытаний, использующих в качестве вектора доставки голую (некомплексированная плазмида) ДНК, предпочтительным составом был жидкий состав.
Несмотря на то что лиофилизированная плазмидная ДНК может быть предпочтительной формой для хранения, считалось, что лиофилизированные составы плазмидной ДНК обуславливали уменьшение эффективности экспрессии гена. Лиофилизация является причиной удаления области гидратации вокруг молекулы. Для ДНК выяснено, что имеется приблизительно 20 молекул воды на нуклеотидную пару, наиболее прочно связанных с ДНК, которые никогда не образуют структуру, подобную льду, при низкотемпературном охлаждении. При дегидратации ДНК с помощью гигроскопичных солей при 0% влажности остается только пять или шесть молекул воды. Таким образом, лиофилизация может повысить стабильность ДНК при долгосрочном хранении, но также может служить причиной некоторого повреждения во время изначального процесса лиофилизации потенциально из-за изменений во вторичной структуре ДНК или концентрации реакционноспособных элементов, таких как загрязняющие металлы. Таким образом, грубая структурная перестройка плазмиды может являться потенциальным механизмом уменьшения эффективности экспрессии гена лиофилизированной плазмидной ДНК.
В работе Poxon et al, Pharmaceutical Development and Technology 5:115-122 (2000), авторы продемонстрировали, что лиофилизация плазмидной ДНК (pRL-CMV) приводит к статистически значимой потере эффективности трансфекции. Биофункциональный анализ, оценивающий трансфекционную активность, продемонстрировал потерю более чем 75% активности плазмидной ДНК после лиофилизации по сравнению с контрольной плазмидой, которая осталась в растворе. Несмотря на то что Poxon et al использовали углеводы для улучшения in vitro сниженной трансфекционной активности нетерапевтической плазмиды pRL-CMV, экспрессирующей люциферазу Renilla, хранящейся в ЭДТА буфере, Poxon et al не рассматривали in vivo применения лиофилизированных препаратов голой ДНК для лечения или профилактики заболевания.
В силу вышеизложенного в уровне техники существует необходимость в стабильном лиофилизированном составе, который не сказывается на эффективности экспрессии гена. Настоящее изобретение обеспечивает лиофилизированный состав плазмидной ДНК, который не только сохраняет биологическую активность экспрессируемого гена, но, в некоторых случаях, способен усилить биологическую активность.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к лиофилизированному ДНК-составу. В одном аспекте данного изобретения ДНК-состав, перед лиофилизацией, содержит плазмидную ДНК, соль и углевод; и данная плазмидная ДНК содержит ген HGF или его вариант. В другом аспекте данного изобретения данный ДНК-состав является лиофилизированным. В другом аспекте данного изобретения лиофилизированный ДНК-состав является восстановленным.
В одном варианте осуществления углевод в ДНК-составе по настоящему изобретению представляет собой моно-, олиго- или полисахарид, такой как сахароза, глюкоза, лактоза, трегалоза, арабиноза, пентоза, рибоза, ксилоза, галактоза, гексоза, идоза, манноза, талоза, гептоза, фруктоза, глюконовая кислота, сорбитол, маннитол, метил-α-глюкопиранозид, мальтоза, изоаскорбиновая кислота, аскорбиновая кислота, лактон, сорбоза, глюкаровая кислота, эритроза, треоза, аллоза, альтроза, гулоза, эритрулоза, рибулоза, ксилулоза, псикоза, тагатоза, глюкуроновая кислота, галактуроновая кислота, маннактуроновая кислота, глюкозамин, галактозамин, нейраминовая кислота, арабинаны, фруктаны, фуканы, галактаны, галактуронаны, глюканы, маннаны, ксиланы, леван, фукоидан, каррагинан, галактокаролаза, пектины, пектиновые кислоты, амилоза, пуллулан, гликоген, амилопектин, целлюлоза, декстран, циклодекстрин, пустулан, хитин, агароза, кератин, хондроитин, дерматан, гиалуроновая кислота, альгиновая кислота, ксаниановая камедь или крахмал.
В некоторых вариантах осуществления данного изобретения углеводом является сахароза или маннитол.
В другом варианте осуществления углевод в ДНК-составе по настоящему изобретению присутствует в количестве, выбранном из группы, состоящей из количества от приблизительно 0,05% до приблизительно 30%, от приблизительно 0,1% до приблизительно 15%, от приблизительно 0,2% до приблизительно 10%, от приблизительно 0,5% до 5%, от приблизительно 0,75% до 3%, от приблизительно 0,8% до 2% и от приблизительно 0,8% до 1,5%. В определенных вариантах осуществления данный углевод представляет собой сахарозу или маннитол. В некоторых других вариантах осуществления углевод в ДНК-составе находится в количестве приблизительно 1,1 %.
В другом варианте осуществления соль ДНК-состава выбрана из группы, состоящей из NaCl или KCl. В дополнительных вариантах осуществления данная соль в ДНК-составе присутствует в количестве, выбранном из группы, состоящей из количества приблизительно от 0,01% до 10%, приблизительно от 0,1% до 5%, приблизительно от 0,1% до 4%, приблизительно от 0,5% до 2%, приблизительно от 0,8% до 1,5%, приблизительно от 0,8% до 1,2% вес/объем. В некоторых вариантах осуществления данная соль в ДНК-составе присутствует в количестве приблизительно 0,9% вес/объем.
В другом варианте осуществления плазмидная ДНК по данному изобретению содержит ген HGF или его вариант. В некоторых вариантах осуществления ген HGF представляет собой ген HGF млекопитающего или его вариант. В дополнительных вариантах осуществления ген HGF представляет собой ген человека или его вариант. В некоторых аспектах данного изобретения ген HGF представляет собой гибридный ген HGF, например, гибридный ген HGF, содержащий кДНК HGF и природный или чужеродный интрон, или его фрагмент, например, природный интрон 4, или его фрагмент, гена HGF человека. В конкретных вариантах осуществления гибридный ген HGF содержит HGF-X2 (SEQ ID NO: 13), HGF-X3 (SEQ ID NO: 14), HGF- X6 (SEQ ID NO: 8), HGF-X7 (SEQ ID NO: 9) или HGF-X8 (SEQ ID NO: 10). В дополнительных вариантах осуществления плазмидная ДНК, содержащая гибридный ген HGF, выбрана из группы, состоящей из: pCK-HGF-X2, pCK-HGF-X3, pCK-HGF-X6, pCK-HGF-X7, pCK-HGF-X8, pCP-HGF-X2, pCP-HGF-X3, pCP-HGF-X6, pCP-HGF-X7 и pCP-HGF-X8, где HGF-X2, HGF-X3, HGF-X6, HGF-X7 и HGF-X8 соответствуют последовательностям SEQ ID NOs: 13-14 и 8-10 соответственно.
Лиофилизированные составы ДНК поддерживают или усиливают экспрессию плазмидной ДНК. В некоторых аспектах лиофилизированный состав ДНК обеспечивает усиленную биологическую активность экспрессируемого белка. В некоторых других аспектах данного изобретения усиленная экспрессия плазмидной ДНК, или увеличенная биологическая активность экспрессируемого белка, обусловлена присутствием углевода в составе. В некоторых вариантах осуществления этот углевод представляет собой сахарозу или маннитол.
Данное изобретение также обеспечивает восстановленный состав лиофилизированной плазмидной ДНК. В некоторых вариантах осуществления лиофилизированная ДНК восстановлена в фармацевтически приемлемом растворе. В дополнительных вариантах осуществления фармацевтически приемлемый раствор выбран из группы, состоящей из воды, PBS, TE, Tris буфера и физиологического раствора.
В другом варианте осуществления плазмидная ДНК в восстановленном лиофилизированном составе присутствует в конечной концентрации приблизительно 1 нг/мл, приблизительно 5 нг/мл, приблизительно 10 нг/мл, приблизительно 50 нг/мл, приблизительно 100 нг/мл, приблизительно 250 нг/мл, приблизительно 500 нг/мл, приблизительно 1 мкг/мл, приблизительно 5 мкг/мл, приблизительно 10 мкг/мл, приблизительно 50 мкг/мл, приблизительно 100 мкг/мл, приблизительно 200 мкг/мл, приблизительно 300 мкг/мл, приблизительно 400 мкг/мл, приблизительно 500 мкг/мл, приблизительно 600 мкг/мл, приблизительно 700 мкг/мл, приблизительно 800 мкг/мл, приблизительно 900 мкг/мл, приблизительно 1 мг/мл, приблизительно 2 мг/мл, приблизительно 2,5 мг/мл, приблизительно 3 мг/мл, приблизительно 3,5 мг/мл, приблизительно 4 мг/мл, приблизительно 4,5 мг/мл, приблизительно 5 мг/мл, приблизительно 5,5 мг/мл, приблизительно 6 мг/мл, приблизительно 7 мг/мл, приблизительно 8 мг/мл, приблизительно 9 мг/мл, приблизительно 10 мг/мл, приблизительно 20 мг/мл или приблизительно 30 мг/мл. В другом варианте осуществления конечная концентрация плазмидной ДНК в восстановленном лиофилизированном составе составляет приблизительно от 1 нг/мл до приблизительно 30 мг/мл. В некоторых аспектах конечная концентрация плазмидной ДНК в восстановленном лиофилизированном составе составляет от приблизительно 100 мкг/мл до приблизительно 2,5 мг/мл. В дополнительных аспектах конечная концентрация плазмидной ДНК в восстановленном лиофилизированном составе составляет от приблизительно 500 мкг/мл до приблизительно 1 мг/мл.
Настоящее изобретение также относится к способу лечения или профилактики ишемической болезни или заболевания печени у человека, включающему введение композиции, восстановленной из лиофилизированного состава ДНК гепатоцитарного фактора роста (HGF), где ДНК-состав содержит плазмидную ДНК, соль и углевод; и где данная плазмидная ДНК содержит ген HGF или его вариант. В некоторых аспектах композицию, восстановленную из лиофилизированного состава ДНК HGF, вводят прямой инъекцией.
Настоящее изобретение, кроме того, относится к способу получения лиофилизированного состава ДНК HGF, включающему: (a) получение ДНК-состава, содержащего плазмидную ДНК, соль и углевод, где плазмидная ДНК содержит ген HGF, или его вариант; и (b) лиофилизацию ДНК-состава.
Этапы лиофилизации могут включать подвергание ДНК-состава по данному изобретению процессу заморозки при минусовых температурах (например, -10°С до -50°С), и затем подвергание одному или нескольким циклам высушивания, которые содержат постепенное нагревание ДНК-состава до температуры приблизительно от 20°С до температуры приблизительно равной или ниже 30°С, при которых происходит лиофилизация в течение времени от приблизительно 50 до приблизительно 100 часов. В дополнительном аспекте данного изобретения способ лиофилизации включает: (a) получение водосодержащего ДНК-состава, содержащего плазмидную ДНК, соль и углевод, где плазмидная ДНК содержит ген HGF, или его вариант; (b) охлаждение раствора ДНК-состава до температуры от приблизительно -10°С до приблизительно -50°С, до тех пор, пока не замерзнет; (c) высушивание ДНК-состава путем нагревания до температуры от приблизительно 20°С до приблизительно 30°С; и (d) восстановление лиофилизированного ДНК-состава, имеющего влагосодержание от приблизительно 0,1 процента по весу до приблизительно 5 процентов по весу, исходя из общей массы восстановленного ДНК-состава.
В некоторых вариантах осуществления ДНК-состав лиофилизируют при условиях, включающих (a) от приблизительно 30 до приблизительно 50 часов при температуре выше или равной приблизительно -50°С и ниже, чем приблизительно 0°С, и (b) приблизительно от 20 часов до приблизительно 50 часов при температуре от выше, или равной, приблизительно 0°С до ниже, или равной, приблизительно 30°С, постепенно, где самая низкая (a) температура составляет от приблизительно -50°C до приблизительно -30°C, и самая высокая (b) температура составляет между приблизительно 20°С и 30°С. В одном аспекте ДНК-состав лиофилизирован при условиях -50°C в течение 4 часов, -40°C в течение 12 часов, -30°C в течение 6 часов, -20°C в течение 6 часов, -10°C в течение 6 часов, 0°C в течение 6 часов, 10°C в течение 6 часов и 30° C в течение 24 часов, постепенно. В другом аспекте ДНК-состав лиофилизирован в условиях 5°C в течение 1 минуты, -50°C в течение 2 часов, -40°C в течение 6 часов, -35°C в течение 3 часов, -30°C в течение 6 часов, -25°C в течение 3 часов, -20°C в течение 3 часов, -15°C в течение 3 часов, -10°C в течение 6 часов, -5°C в течение 3 часов, 0°C в течение 6 часов, и 30°C в течение 17 часов, постепенно. В другом аспекте ДНК-состав лиофилизирован в условиях 5°C в течение 1 минуты, -10°C в течение 1 минуты, -20°C в течение 1 минуты, -30°C в течение 1 минуты, -50°C в течение 1 минуты, -50°C в течение 2 часов, -45°C в течение 6 часов, -40°C в течение 3 часов, -35°C в течение 6 часов, -30°C в течение 3 часов, -25°C в течение 6 часов, -20°C в течение 3 часов, -15°C в течение 6 часов, -10°C в течение 3 часов, -5°C в течение 6 часов, 0°C в течение 12 часов, 10°C в течение 3 часов, 20°C в течение 6 часов и 30°C в течение 29 часов, постепенно.
Данное изобретение дополнительно относится к лиофилизированному составу нуклеиновых кислот или восстановленному лиофилизированному составу нуклеиновых кислот, как вышеупомянуто, где нуклеиновая кислота представляет собой РНК, кодирующую HGF, или его вариант.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Рассмотренные выше и другие объекты и характеристики настоящего изобретения станут очевидны из последующего описания данного изобретения в сочетании с прилагаемыми чертежами, на которых:
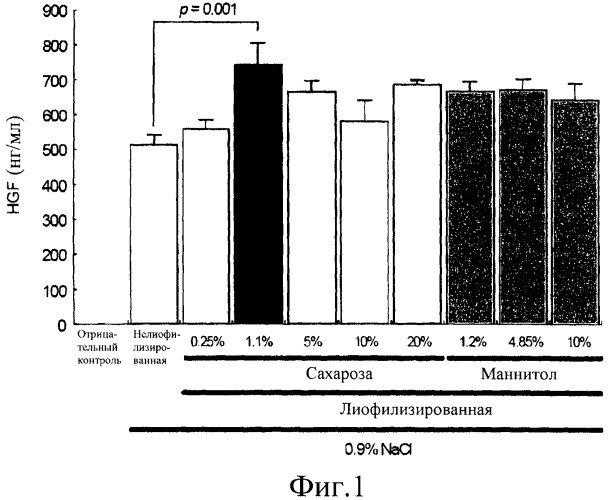
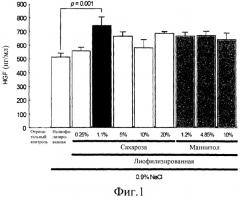
на фиг.1 представлена гистограмма сравнения экспрессии HGF in vitro среди различных составов. Уровни экспрессии HGF были измерены, используя ELISA в супернатантах культуры, выделенных из клеток 293Т, трансфицированных лиофилизированной плазмидной ДНК pCK-HGF-X7, находящейся в смеси с 0,9% NaCl, в конечной концентрации ДНК 0,5 мг/мл, с сахарозой 0,25% (столбик 3), 1,1% (столбик 4), 5% (столбик 5), 10% (столбик 6) или 20% (столбик 7) или с маннитолом 1,2% (столбик 8), 4,85% (столбик 9) или 10% (столбик 10). Контрольные реакции с отрицательным контролем (столбик 1) и нелиофилизированной ДНК (столбик 2) использовали для сравнения.
На фиг.2 представлена гистограмма сравнения экспрессии HGF in vivo между нелиофилизированной и лиофилизированной pCK-HGF-X7. Мышам в переднюю большеберцовую мышцу делали инъекцию 100 мкг нелиофилизированной pCK-HGF-X7, содержащей 0,9% NaCl (NL-HGF-X7), или pCK-HGF-X7, лиофилизированной с 1,1% сахарозой и 0,9% NaCl (L-HGF-X7). После безболезненного умерщвления мышей в День 7 уровни экспрессии HGF определяли посредством ELISA лизатов мышечной ткани. Уровни экспрессии HGF представлены для отрицательного контроля (столбик 1), нелиофилизированной pCK-HGF-X7, содержащей 0,9% NaCl (NL-HGF-X7; столбик 2), и для pCK-HGF-X7, лиофилизированной с 1,1% сахарозой и 0,9% NaCl (L-HGF-X7; столбик 3).
На фиг.3 представлена схема эксперимента с использованием модели ишемической болезни сердца у свиньи. NL-HGF-X7 представляет собой нелиофилизированную pCK-HGF-X7, содержащую 0,9% NaCl. L-HGF-X7 представляет собой pCK-HGF-X7, лиофилизированную с 1,1% сахарозой и 0,9% NaCl.
На фиг.4 представлена гистограмма, описывающая действие нелиофилизированной и лиофилизированной pCK-HGF-X7 на перфузию миокарда. Демонстрируется процент положительной динамики перфузии миокарда по сравнению с исходным уровнем при использовании модели ишемической болезни сердца у свиньи. Результаты представлены для свиней, которым сделали инъекцию только плазмиды (pCK; столбик 1), нелиофилизированной pCK-HGF-X7, содержащей 0,9% NaCl (NL-HGF-X7; столбик 2), и pCK-HGF-X7, лиофилизированной с 1,1% сахарозой и 0,9% NaCl (L-HGF-X7; столбик 3).
На фиг.5 представлена гистограмма, демонстрирующая воздействие нелиофилизированной и лиофилизированной pCK-HGF-X7 на утолщение стенки. Демонстрируется процент положительной динамики утолщения стенки в пограничной зоне ишемии левого желудочка, куда была сделана инъекция, по сравнению с исходным уровнем при использовании модели ишемической болезни сердца у свиньи. Результаты представлены для свиней, которым сделали инъекцию только плазмиды (pCK; столбик 1), нелиофилизированной pCK-HGF-X7, содержащей 0,9% NaCl (NL-HGF-X7; столбик 2), и pCK-HGF-X7, лиофилизированной с 1,1% сахарозой и 0,9% NaCl (L-HGF-X7; столбик 3).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Термин «ДНК», или «нуклеиновая кислота», или «фрагмент нуклеиновой кислоты» относится к любому одному или нескольким участкам нуклеиновой кислоты, например, фрагментам ДНК или РНК, находящимся в полинуклеотиде или конструкции. Нуклеиновая кислота, или ее фрагмент, может быть представлена линейной (например, мРНК) или кольцевой (например, плазмида) формой, а также двухнитевой или однонитевой формами. Под «изолированной» нуклеиновой кислотой или полинуклеотидом подразумевается молекула нуклеиновой кислоты, ДНК или РНК, которая была выделена из ее естественного окружения. Например, рекомбинантный полинуклеотид, содержащийся в векторе, рассматривается как изолированный в целях настоящего изобретения. Дополнительные примеры изолированного полинуклеотида включают рекомбинантные полинуклеотиды, содержащиеся в гетерологичных клетках-хозяевах, или очищенные (частично или в большей степени) полинуклеотиды в растворе. Изолированные молекулы РНК включают in vivo или in vitro транскрипты РНК полинуклеотидов по настоящему изобретению. Изолированные полинуклеотиды или нуклеиновые кислоты, в соответствии с настоящим изобретением, дополнительно включают такие молекулы, полученные синтетическим путем.
В настоящем документе «кодирующая область» представляет собой часть нуклеиновой кислоты, которая содержит в себе кодоны, транслируемые в аминокислоты. Несмотря на то что «стоп-кодон» (TAG, TGA, или TAA) не транслируется в аминокислоту, его можно рассматривать как часть кодирующей области, но любые фланкирующие последовательности, например, промотры, участки связывания рибосомы, терминаторы транскрипции и тому подобное, не являются частью кодирующей области. Две или несколько нуклеиновых кислот или фрагментов нуклеиновой кислоты по настоящему изобретению могут присутствовать в одной полинуклеотидной конструкции, например, в одной плазмиде, или в отдельных полинуклеотидных конструкциях, например, отдельных (различных) плазмидах. Кроме того, любая нуклеиновая кислота, или фрагмент нуклеиновой кислоты, может кодировать единственный HGF полипептид или фрагмент, производное, или его вариант, например, или может кодировать более чем один полипептид, например, нуклеиновая кислота может кодировать два или несколько полипептидов. Дополнительно, нуклеиновая кислота может включать регуляторный элемент, такой как промотор, участок связывания рибосом, или терминатор транскрипции, или может кодировать гетерогенные кодирующие области, слитые с кодирующей последовательностью HGF, например, специализированные элементы или мотивы, такие как секреторный сигнальный пептид или гетерогенный функциональный домен.
В случае с ДНК полинуклеотид, содержащий нуклеиновую кислоту, которая кодирует полипептид, обычно также включает промотор и/или другие контрольные элементы транскрипции или трансляции, функционально связанные с фрагментом нуклеиновой кислоты, кодирующим данный полипептид. Функциональная связь представляет собой связь фрагмента нуклеиновой кислоты, кодирующего генный продукт, например, полипептида, с одной или несколькими регуляторными последовательностями, таким образом, чтобы поместить экспрессию данного генного продукта под влияние или контроль данной регуляторной последовательности (последовательностей).
ДНК полинуклеотид по настоящему изобретению может представлять собой кольцевую или линеаризированную плазмиду или вектор, или другую линейную ДНК, которая может также быть неинфекционной и неинтегрированной (а именно не интегрируется в геном клеток позвоночного). Линеаризированная плазмида представляет собой плазмиду, которая ранее была кольцевой, но была линеаризирована, например, посредством расщепления эндонуклеазой рестрикции. Используемые в настоящем описании термины плазмида и вектор могут использоваться взаимозаменяемо.
Термин «лиофилизированная ДНК» относится к любой ДНК, которая получена в сухом виде посредством быстрого замораживания и обезвоживания, в замороженном состоянии в условиях глубокого вакуума. «Лиофилизация» или «лиофильная сушка» относится к процессу замораживания и высушивания раствора. Лиофилизированная ДНК зачастую получена готовой для использования посредством добавления стерильной дистиллированной воды.
«Вектор» относится к любому носителю для клонирования и/или переноса нуклеиновой кислоты в клетку-хозяина. Вектор может представлять собой репликон, к которому другой сегмент ДНК может быть присоединен, чтобы осуществить репликацию данного присоединенного сегмента. «Репликон» относится к любому генетическому элементу (например, плазмида, фаг, космида, хромосома, вирус), который действует как автономная единица репликации ДНК in vivo, а именно способна к репликации под собственным контролем. Термин «вектор» включает носители для встраивания данной нуклеиновой кислоты в клетку in vitro, ex vivo или in vivo. Большое число векторов, известных в уровне техники, можно использовать для манипуляций с нуклеиновыми кислотами, инкорпорации реакционных элементов промоторов в гены и тому подобное. Возможные векторы включают, например, плазмиды, такие как pBR322 или плазмидные производные pUC, или вектор Bluescript. Например, вставка фрагментов ДНК, соответствующих реакционным элементам и промоторам, в подходящий вектор может быть осуществлена посредством лигирования соответствующих фрагментов ДНК в выбранный вектор, который имеет комплиментарные «липкие» концы. Альтернативно, данные концы молекул ДНК могут быть ферментативно модифицированы, или любой сайт может быть получен посредством лигирующих нуклеотидных последовательностей (линкеры) в концах ДНК. Такие векторы могут быть сконструированы таким образом, чтобы содержать селектируемые маркеры генов, которые обеспечены для выбора клеток. Такие маркеры делают возможной идентификацию и/или выбор клеток-хозяев, которые экспрессируют белки, кодируемые данным маркером.
Дополнительные векторы включают липоплексы (катионный комплекс липосома-ДНК), полиплексы (катионный комплекс полимер-ДНК) и комплексы белок-ДНК. Кроме нуклеиновой кислоты вектор может также содержать в себе одну или несколько регуляторных областей, и/или селектируемые маркеры, пригодные для отбора, оценки и контроля результатов переноса нуклеиновой кислоты (перенос в какую ткань, длительность экспрессии и тому подобное).
Термин «плазмида» относится к экстрахромосомному элементу, зачастую несущему ген, который не является частью центрального метаболизма данной клетки, и обычно находится в виде кольцевых двухнитевых молекул ДНК. Такие элементы могут представлять собой автономно реплицирующиеся последовательности, последовательности, интегрирующиеся в геном, фаговые или нуклеотидные последовательности, линейные, кольцевые или сверхспиральные одно- или двухнитевых ДНК или РНК, полученных из любого источника, в которых некоторое количество нуклеотидных последовательностей соединено или рекомбинировано в уникальную конструкцию, которая обеспечивает введение в клетку промоторного фрагмента и последовательности ДНК для выбранного генного продукта наряду с подходящей 3'-нетранслируемой последовательностью. Используемый в настоящем документе термин «плазмида» относится к конструкции, состоящей из генетического материала (например, нуклеиновых кислот). Как правило, плазмида содержит участок начала репликации, который является функциональным в бактериальных клетках-хозяевах, например, Escherichia coli, и селектируемые маркеры для выявления бактериальных клеток-хозяев, содержащих данную плазмиду.
Плазмиды по настоящему изобретению могут включать генетические элементы, как описано здесь, организованные таким образом, что встроенные кодирующие последовательности могут быть транскрибированы и транслированы в эукариотических клетках. В некоторых вариантах осуществления, описанных здесь, плазмида представляет собой закрытую кольцевую молекулу ДНК.
Термин «экспрессия» относится к биологическому производству продукта, кодируемого кодирующей последовательностью. В большинстве случаев ДНК-последовательность, в том числе кодирующая последовательность, транскрибируется в форму матричной РНК (мРНК). Эта матричная РНК затем транслируется в форму полипептидного продукта, который обладает соответствующей биологической активностью. Также процесс экспрессии может включать дополнительные этапы преобразования продукта транскрипции РНК, такие как сплайсинг, для удаления интронов, и/или посттрансляционный процессинг полипептидного продукта.
Термин «экспрессирующий вектор» относится к вектору, плазмиде или носителю, сконструированному для обеспечения экспрессии встроенной нуклеотидной последовательности, после трансформации в клетку-хозяина. Клонируемый ген, а именно встроенная последовательность нуклеиновой кислоты, например, ген HGF, или его вариант, обычно помещается под контроль контрольных элементов, таких как промотор, минимальный промотор, энхансер или тому подобное. Области контроля инициации, или промоторы, пригодные для запуска экспрессии нуклеиновой кислоты в требуемой клетке-хозяине, многочисленны и хорошо известны специалисту в уровне техники. Фактически любой промотор, способный запускать экспрессию этих генов, может быть использован в экспрессирующих векторах, в том числе, но не ограничиваясь ими, вирусные промоторы, бактериальные промоторы, промоторы животного происхожления, промоторы млекопитающих, синтетические промоторы, конститутивные промоторы, тканеспецифические промоторы, промоторы, связанные с заболеванием или патогенезом, промоторы, специфические для дифференциации, индуцибельные промоторы, промоторы, регулируемые светом; в том числе, но не ограничиваясь ими, область раннего промотора SV40 (SV40), промотор, содержащий 3' длинный концевой повтор (LTR) вируса саркомы Рауса (RSV), E1A или главный поздний промотор (MLP) аденовируса (Ad), предранний промотор цитомегаловируса человека (HCMV), промотор тимидинкиназы (ТК) вируса простого герпеса (HSV), промотор IE1 бакуловируса, промотор фактора элонгации 1 альфа (EF1), промотор глицеральдегид-3-фосфат дегидрогеназы (GAPDH), промотор фосфоглицераткиназы (PGK), промотор убихитина С (Ubc), промотор альбумина, регуляторные последовательности промотора металлотионеина-L и области транскрипционного контроля мыши, широкораспространенные промоторы (HPRT, виментин, β-актин, тубулин и тому подобное), промоторы промежуточных филаментов (десмин, нейрофиламенты, кератин, GFAP и тому подобное), промоторы терапевтических генов (MDR, CFTR или типа фактора VIII и тому подобное), промоторы, связанные с заболеванием или патогенезом, и промоторы, которые демонстрируют тканеспецифичность и используются у трансгенных животных, такие как контрольная область гена эластазы I, который активен в ацинарных клетках поджелудочной железы; контрольная область гена инсулина, активного в бета-клетках поджелудочной железы, контрольная область гена иммуноглобулина, активного в лимфоидных клетках, контрольная область вируса опухоли молочной железы мышей, активного в тестикулярных клетках, клетках молочной железы, лимфоцитах и мастоцитах; контрольные области Apo AI и Apo AII гена альбумина, активного в печени, контрольная область гена альфа-фетопротеина, активного в печени, контрольная область гена альфа 1-антитрипсина, активного в печени, контрольная область гена бета-глобина, активного в миелоидных клетках, контрольная область гена основного миелинового белка, активного в клетках олигодендроглии головного мозга, контрольная область гена легкой цепи-2 миозина, активного в скелетной мускулатуре, и контрольная область гена
гонадотропин-высвобождающего гормона, активного в гипоталамусе, промотор пируваткиназы, промотор виллина, промотор интестинального белка, связывающего жирные кислоты, промотор β-актина гладкомышечной клетки и тому подобное. Кроме того, эти экспрессирующие последовательности могут быть модифицированы посредством добавления энхансера или регуляторных последовательностей и тому подобного. Неограничивающие примеры экспрессирующих векторов по данному изобретению включают в себя pCK (Lee et al, Biochem. Biophys. Res. Commun. 272:230 (2000); WO 2000/040737) и pCP (pCDNA3.1, Invitrogen, USA).
«Конструкция» в настоящем документе в широком смысле означает композицию, которая не встречается в природе. Конструкция может быть получена посредством синтетических технологий, например посредством получения рекомбинантной ДНК и экспрессии или методов химического синтеза для нуклеиновых или аминокислот. Конструкция также может быть произведена посредством добавления или присоединения одного вещества к другому таким образом, что полученный результат не встречается в природе в такой форме.
«Ген» означает полинуклеотид, содержащий нуклеотиды, который кодирует функциональную молекулу, в том числе функциональные молекулы, получаемые в результате только транскрипции (например, биоактивные виды РНК), или в результате транскрипции и трансляции (например, полипептид). Термин «ген» включает в себя нуклеиновые кислоты кДНК и геномную ДНК. «Ген» также относится к фрагменту нуклеиновой кислоты, который экспрессирует специфическую РНК, белок или полипептид, в том числе регуляторные последовательности, предшествующие (5' некодирующие последовательности) и последующие (3' некодирующие последовательности) данной кодирующей последовательности. «Нативный ген» означает ген, который в природе обнаружен со своими собственными регуляторными последовательностями. «Химерный ген» означает любой ген, который не является нативным геном, включающий в себя регуляторные и/или кодирующие последовательности, которые в природе вместе не встречаются. Соответственно, химерный ген может содержать в себе регуляторные последовательности и кодирующие последовательности, которые получены из различных источников, или регуляторные последовательности и кодирующие последовательности, полученные из одного и того же источника, но расположенные в порядке, отличном от такового, обнаруженного в природе. Химерный ген может содержать кодирующие последовательности, полученные из различных источников, и/или регуляторные последовательности, полученные из различных источников. «Эндогенный ген» означает нативный ген в его естественном расположении в геноме организма. «Чужеродный» ген или «гетерогенный» ген означает ген, который в нормальных условиях не обнаружен в организме-хозяине, но который встроен в данный организм-хозяина посредством генного переноса. Чужеродные гены могут содержать в себе нативные гены, встроенные в ненативный организм, или химерные гены. «Трансген» означает ген, который был встроен в данную клетку посредством процедуры генного переноса.
«Гетерогенная ДНК» относится к ДНК, которая по природе не содержится в данной клетке, или хромосомном участке данной клетки. Гетерогенная ДНК может содержать в себе ген, чужеродный данной клетке.
Выражения «выделенный» или «биологически чистый» относятся к веществу, которое в большей степени или преимущественно свободно от компонентов, которые обычно сопутствуют данному веществу в природных условиях. Таким образом, изолированные пептиды в соответствии с данным изобретением предпочтительно не содержат в себе веществ, обычно связанных с данными пептидами в естественных условиях.
Лиофилизированные ДНК-составы
ДНК-состав по изобретению, перед лиофилизацией, в своем составе имеет некоторые наполнители, в том числе углевод и соль.
Как описано в настоящем документе, стабильность лиофилизированного ДНК-состава для применения в качестве диагностического или терапевтического агента может быть увеличена посредством составления, до лиофилизиции, смеси данной ДНК с водным раствором, содержащим в себе стабилизирующее количество углевода.
Углевод в ДНК-составе по изобретению представляет собой моно-, олиго- или полисахарид, такой как сахароза, глюкоза, лактоза, трегалоза, арабиноза, пентоза, рибоза, ксилоза, галактоза, гексоза, идоза, манноза, талоза, гептоза, фруктоза, глюконовая кислота, сорбитол, маннитол, метил α-глюкопиранозид, мальтоза, изоаскорбиновая кислота, аскорбиновая кислота, лактон, сорбоза, глюкаровая кислота, эритроза, треоза, аллоза, альтроза, гулоза, эритрулоза, рибулоза, ксилулоза, псикоза, тагатоза, глюкуроновая кислота, галактуроновая кислота, маннуроновая кислота, глюкозамин, галактозамин, нейраминовая кислота, арабинаны, фруктаны, фуканы, галактаны, галактуронаны, глюканы, маннаны, ксиланы, леван, фукоидан, каррагинан, галактокаролоза, пектины, пектиновые кислоты, амилоза, пуллулан, гликоген, амилопектин, целлюлоза, декстран, циклодекстрин, пустулан, хитин, агароза, кератин, хондроитин, дерматан, гиалуроновая кислота, альгиновая кислота, ксантановая камедь или крахмал.
В одном аспекте данный углевод представляет собой маннитол или сахарозу.
Данный углеводный раствор перед лиофилизацией может представлять собой раствор углевода только в воде или может включать в себя буфер. Примеры таких буферов включают в себя PBS, HEPES, TRIS или TRIS/EDTA. Как правило, данный углеводный раствор объединен с данной ДНК до конечной концентрации сахарозы от приблизительно 0,05% до приблизительно 30%, обычно от приблизительно 0,1% до приблизительно 15% сахарозы, например от 0,2% до приблизительно 5%, 10% или 15% сахарозы, предпочтительно в диапазоне между приблизительно 0,5% и 10% сахарозы, от 1% до 5% сахарозы, от 1% до 3% сахарозы и наиболее предпочтительно приблизительно 1,1% сахарозы.
Соль в данной ДНК-композиции по данному изобретению представляет собой NaCl или KCl. В некоторых аспектах данная соль представляет собой NaCl. В дополнительных аспектах данная соль в данном ДНК-составе присутствует в количестве, выбранном из группы, включающей количества приблизительно от 0,001% до приблизительно 10%, приблизительно между 0,1% и 5%, приблизительно между 0,1% и 4%, приблизительно между 0,5% и 2%, приблизительно между 0,8% и 1,5%, приблизительно между 0,8% и 1,2% вес/объем. В некоторых вариантах осуществления данная соль в данном ДНК-составе присутствует в количестве приблизительно 0,9% вес/объем.
В ДНК-составе по данному изобретению конечная концентрация плазмидной ДНК составляет приблизительно от 1 нг/мл 30 нг/мл. Например, состав по настоящему изобретению может иметь конечную концентрацию плазмиды приблизительно 1 нг/мл, приблизительно 5 нг/мл, приблизительно 10 нг/мл, приблизительно 50 нг/мл, приблизительно 100 нг/мл, приблизительно 200 нг/мл, приблизительно 500 нг/мл, приблизительно 1 мкг/мл, приблизительно 5 мкг/мл, приблизительно 10 мкг/мл, приблизительно 50 мкг/мл, приблизительно 100 мкг/мл, приблизительно 200 мкг/мл, приблизительно 400 мкг/мл, приблизительно 500 мкг/мл, приблизительно 600 мкг/мл, приблизительно 800 мкг/мл, приблизительно 1 мг/мл, приблизительно 2 мг/мл, приблизительно 2,5 мг/мл, приблизительно 3 мг/мл, приблизительно 3,5 мг/мл, приблизительно 4 мг/мл, приблизительно 4,5 мг/мл, приблизительно 5 мг/мл, приблизительно 5,5 мг/мл, приблизительно 6 мг/мл, приблизительно 7 мг/мл, приблизительно 8 мг/мл, приблизительно 9 мг/мл, приблизительно 10 мг/мл, приблизительно 20 мг/мл, или приблизительно 30 мг/мл. В некоторых вариантах осуществления данного изобретения конечная концентрация ДНК составляет приблизительно от 100 мкг/мл до приблизительно 2,5 мг/мл. В конкретных вариантах осуществления данного изобретения конечная концентрация данной ДНК составляет приблизительно от 0,5 мг/мл до 1 мг/мл.
ДНК-состав по настоящему изобретению лиофилизирован в стандартных условиях, известных в уровне техники. Способ лиофилизации ДНК-состава по изобретению может включать в себя (a) помещение контейнера, например, флакона, с ДНК-составом, например, ДНК-составом, содержащим плазмидную ДНК, соль и углевод, где плазмидная ДНК содержит ген HGF или его вариант, в лиофилизатор, где лиофилизатор имеет температуру запуска приблизительно от 5°С до приблизительно -50°С; (b) охлаждение данного ДНК-состава до температур ниже нуля (например, от -10° C до -50°C); и (c) основательное высушивание ДНК-состава. Условия лиофилизации, например, температура и продолжительность, ДНК-состава по данному изобретению могут быть подобраны исполнителем, имеющ