Контрастное средство для t1 и/или t2 магнитно-резонансного сканирования и способ его получения
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и медицине и представляет собой контрастное средство для T1 и/или T2 магнитно-резонансного сканирования, состоящее из наноразмерного суперпарамагнитного порошка кубической кобальтовой феррошпинели CoxFe3-xO4, где 0.1≤x≤0.99, с размером частиц 3÷20 нм. Изобретение обеспечивает создание контрастного средства, обладающего одновременным воздействием на относительный позитивный T1 и негативный T2 контрасты при магнитно-резонансном сканировании. 2 н. и 2 з.п. ф-лы, 3 табл., 7 ил.
Реферат
Изобретение относится к медицине и биологии, а именно к созданию эффективных контрастных сред для получения магнитно-резонансных изображений, используемых в клинической диагностике.
Магнитно-резонансная томография представляет собой современный метод диагностической визуализации различных тканей, который позволяет выявлять опухоли, очаги воспаления, патологию сосудов и др. Этот метод основан на явлении ядерно-магнитного резонанса, которое состоит в избирательном резонансном поглощении веществом энергии электромагнитных волн и обусловлено ядерным парамагнетизмом. Ядра ряда атомов, в частности водорода, помещенные в сильное постоянное магнитное поле Но, под действием внешнего слабого радиочастотного магнитного поля H1, направленного перпендикулярно Но, поглощают энергию, а затем испускают ее в виде радиоволн. Этот резонансный эффект обусловлен тем, что ядро атома водорода - протон обладает магнитным моментом и способен изменять свое поглощение в магнитном поле, ориентируясь по направлению поля или против него, иначе говоря он переходит с одного энергетического уровня на другой, где его энергия больше.
Под действием высокочастотного импульсного электромагнитного поля протон поворачивается на 90°, если импульс короткий, и на 180°, если он длительный. После окончания импульса протон возвращается в исходное состояние, излучая при этом порцию энергии (релаксация протона). Релаксацию протона после поворота на 90° называют спин-спиновой релаксацией со временем Т2, а после поворота на 180° - спин-решетчатой релаксацией со временем T1. Эти две характеристики вместе с плотностью протонов в среде являются магнитно-резонансными характеристиками изучаемой среды, например, тканевой жидкости. При этом плотность протонов в среде определяется концентрацией элемента (водорода) в ней и характеризуется амплитудой зарегистрированного сигнала.
Основной вклад в создание магнитно-резонансного изображения вносят времена релаксации T1 и Т2, причем изображение на основе Т2 относится к изображению на основе T1, как негатив к позитиву.
Для улучшения качества изображений - усиления контраста используют магнитные вещества, способные изменять времена релаксации тканей. Вещества, которые служат контрастными средствами, обычно делят на три класса:
- первый класс включает ферромагнитные контрастные средства, уменьшающие время релаксации Т2;
- второй класс включает парамагнитные контрастные средства, уменьшающие время релаксации T1;
- третий класс контрастных средств включает суперпарамагнитные наноразмерные порошки.
При этом основные требования к наноразмерным магнитным порошкам, используемым в качестве контрастных средств, сводятся к следующему:
1. Контрастные средства должны иметь высокий магнитный момент, интенсивно реагировать на приложение внешнего магнитного поля и проявлять высокие эффекты магнитно-резонансного контраста.
2. Контрастные средства должны быть стабильными в водной и «in vivo» средах.
3. Контрастные средства должны обеспечивать соединение (конъюгацию) с биоактивными веществами.
4. Контрастные средства должны обладать высокой биосовместимостью и низкой токсичностью.
Наиболее контрастными средствами являются суперпарамагнитные наноразмерные порошки, которые были впервые применены в медицине в середине 1980 года (L.LaConte, N.Nitin, G.Bao. Magnetic nanopararticle probes. Nanotoday, May 2005, pp.32-38). Для усиления контраста были использованы кристаллические наночастицы магнетита (Fe2O3/Fe3O4), ядро которого состоит из оксида трехвалентного железа, покрытого слоем оксида двухвалентного железа. Такие наночастицы более эффективны в качестве усилителей контраста, так как их магнитный момент намного выше, чем у частиц микронного размера или хелатов парамагнитного иона, например гадолинийсодержащего препарата.
Одним из основных способов усиления контраста является увеличение магнитного момента вещества путем изменения его химического состава. Так при введении в оксид железа металлических добавок, например, марганца, магнитный момент повышается примерно на 10%, при этом контраст возрастает на 70-100% (KP 2006-0098213, 2006).
Контрастные средства, введенные в ткани организма, обычно изменяют время релаксации протонов воды, при этом скорости релаксации определяются, как и . Контрастные T1 - средства являются позитивными, заполняя ткани организма, они осветляют их. Соответственно, Т2 - средства являются негативными, они затемняют ткани, которые заполняют.
Подавляющее большинство контрастных средств обладают свойствами, присущими средствам с T1 - или Т2 - релаксацией. Например, коллоидальное контрастное средство на основе оксида железа является Т2 - средством и используется в основном при исследовании опухолей печени и лимфатических узлов.
Представляется актуальной и важной разработка контрастных средств, интенсивно воздействующих на величины T1 и Т2 и обладающих способностью влиять на оба вида релаксаций одновременно. Это позволит получать высококонтрастные изображения при малых дозах контрастных средств, что очень важно при их фармакологическом использовании. В результате при всех применениях магнитно-резонансной томографии можно использовать одно и то же контрастное средство, что сокращает необходимое оборудование, упрощает набор изображений и улучшает обслуживание пациентов.
Известны наноразмерные частицы магнетита размером 10-20 нм для использования в качестве контрастного средства магнитно-резонансных изображений или агломераты из них, заключенные в матрицу из карбогидратов и их производных, полиаминокислот или синтетических полимеров, стабилизированных ковалентными связями (WO 8502772, 1985).
Основной недостаток технического решения связан с тем, что предложенное средство обладает свойствами, присущими только одному типу релаксации. При этом технология введения контрастного средства в полимерную матрицу с равномерным его распределением представляется достаточно сложной. Следует отметить также, что в формуле и описании изобретения допускается использование агломератов большого размера, при применении которых понижается контраст изображения.
Известны биологически деградируемые суперпарамагнитные частицы размером от 1 до 500 нм в диаметре для использования в качестве магнитно-резонансных средств при получении «in vivo» магнитно-резонансных изображений органов и тканей животных или человека (US Patent 4770183, 1988). В качестве контрастных средств используют частицы оксида железа γ-Fe2O3 или Fe3O4 (SPIO - superparamagnetic iron oxide) с площадью поверхности более 75 м2/г и намагниченностью насыщения 5÷50 EMU/г с полимерным покрытием, выбранным из группы, включающей карбогидраты, протеины и композиты из этих веществ. Наноразмерные суперпарамагнитные частицы без покрытия получают смешением водных растворов хлоридов FeCl3 и FeCl2 в соляной кислоте (HCl) и последующим осаждением водным аммонием. Осадок - вещество типа геля подвергают воздействию центрифуги или магнитного поля. После этого гель для образования дисперсоидов пептизируют и смешивают с водным раствором гидроксида тетраметиламмония, подвергают воздействию центрифуги и вновь диспергируют в воде.
Недостаток этого технического решения связан с тем, что предложенное средство обладает свойствами, присущими только одному типу релаксации, а технология синтеза является сложной и многооперационной с использованием вредных веществ. Следует отметить также, что в формуле и описании изобретения допускается использование агломератов большого размера, при применении которых понижается контраст изображения.
Известны водные суспензии, состоящие из микросфер с диаметром менее 1.5 мкм (порядка 1 мкм), при этом микросферы составлены из биодеградируемого матричного материала с макрочастицами, обладающими суперпарамагнитными свойствами и состоящими из наночастиц магнетита диаметром в интервале от 5 до 20 нм (US Patent 4849210, 1989). Порошки или суспензии магнетита изготовлены Ferrofluidics Corporation, Burlington, Massachusetts. Использование таких микросфер для создания магнитно-резонансного контраста приводит к существенному уменьшению времени релаксации Т2.
Основной недостаток технического решения обусловлен тем, что предложенное средство обладает свойствами, присущими только одному типу релаксации.
Известны биодеградирующие суперпарамагнитные оксиды металлов, используемые в качестве контрастных средств для «in vivo» магнитно-резонансных изображений органов и тканей животных и человека (US Patent 4951675, 1990). Применяются оксиды железа, в частности Fe3O4 или γ-Fe2O3 в виде порошка, частицы которого имеют размер более 30 нм. Они связаны с полимером, в частности с полисахаридом, который осаждается из водных растворов, содержащих смесь солей железа и декстран с молекулярным весом в интервале от 5000 до 250000 дальтон. Способ получения наноразмерных порошков оксидов железа соответствует таковому, изложенному в US Patent 4770183,1988, и имеет те же недостатки.
Недостаток технического решения обусловлен тем, что предложенное средство (SPIO) обладает свойствами, присущими только одному типу релаксации. Кроме того, трудно предотвратить агломерацию магнитных наночастиц в процессе получения покрытий путем осаждения из водных растворов.
Известны наноразмерные частицы для магнитно-резонансных изображений, состав которых выбран из группы: переходные металлы, редкоземельные элементы, лантаниды, актиниды и их смеси, в частности соединения FeCO3, FeSi, Fe2P, FeS2, CrN, Gd2O3 и др., содержащей парамагнитные ионы, суперпарамагнитные и ферромагнитные частицы, полученные из коммерческих источников. Они затем были связаны с сульфатом сахарозы через такие протеины, как гамма-глобулин, фибриноген и др. (US Patent 5023072, 1991).
Основной недостаток технического решения обусловлен тем, что часть предложенных средств обладает свойствами, присущими только одному типу релаксации, по большинству других названных средств данные не приведены. Кроме того, при изготовлении контрастных средств используются сложные фармацевтические вещества, что приводит к существенному удорожанию технологического процесса.
Известны биодеградируемые суперпарамагнитные контрастные средства для магнитно-резонансных изображений, представляющие собой кристаллы оксида металла в виде агрегатов со средним диаметром около 50 нм и менее 400 нм, намагниченностью насыщения в интервале от 5 до 90 EMU/г при 300°С и магнитной прямоугольностью менее 0.1 (US Patent 5055288, 1991). При этом металл, оксид которого используется в качестве контраста, выбран из группы, включающей железо, кобальт, хром, медь, марганец, молибден, никель и вольфрам, а средний диаметр агрегатов частиц оксидов, полученных методом химического осаждения, выбран из группы, содержащей агрегаты с диаметром менее 300, 200, 100 и 50 нм.
Основной недостаток технического решения связан с тем, что большинство предложенных средств обладает свойствами, присущими только одному типу релаксации. Кроме того, допускается использование агрегатов значительного размера (200-300 нм), что может привести к понижению контраста изображений.
Известны контрастные агенты в виде суперпарамагнитной жидкости, включающей силанизированные агрегаты из биодеградируемых суперпарамагнитных кристаллов оксида металла (железа) с предельными средними диаметрами названных агрегатов около 400, 300, 200, 100 нм, измеренных методом светорассеяния (US Patent 5069216, 1991). Порошки получены методом химического осаждения.
Основной недостаток технического решения связан с тем, что предложенное средство обладает свойствами, присущими только одному типу релаксации, а размер агрегатов оксида металла велик (100-400 нм) и не позволяет получить максимальный контраст изображений.
Известны суперпарамагнитные коллоидные частицы размером 30-50 нм из кристаллического оксида железа для магнитно-резонансных изображений, полученные из слабомагнитного или немагнитного геля, который термической обработкой превращается в гомогенный суперпарамагнитный коллоид оксида металла, покрытый полимером, который является полисахаридом, выбранным из группы, включающей арабиногалактин, декстран, декстрин, диэтиламинодекстран и др. (US Patent 5262176, 1993).
Основной недостаток технического решения обусловлен тем, что предложенное средство обладает свойствами, присущими только одному типу релаксации. Следует отметить также, что в процессе покрытия коллоидных частиц размером 30-50 нм полисахаридами, перечисленными в формуле изобретения, возможно образование больших агрегатов, снижающих контрастные свойства изображений.
Известен метод усиления контраста магнитно-резонансных изображений, в котором используют полимерный матричный материал, выбранный из группы, включающей крахмал, хитозан, гепарин, декстран, декстрин, и содержащий магнитные частицы размером не более микрона, в частности частицы магнетита, размер которых составляет 10-20 нм (US Patent 6203777, 2001). Магнитные частицы получают из водных растворов хлоридов железа FeCl2 и FeCl3 методом осаждения, быстро добавляя NH4OH при рН более 10.
Основной недостаток технического решения связан с тем, что предложенное средство обладает свойствами, присущими только одному типу релаксации, а в процессе нанесения покрытия частиц полимером возможно образование агрегатов, снижающих контраст изображений.
Известны синтезированные методом золь-гель или осаждения суперпарамагнитные частицы оксида железа, покрытые различными компонентами, в частности декстраном, которые устойчивы при температурах в интервале от 50°С до 121°С и используются для получения магнитно-резонансных изображений (US Patent 6599498, 2003).
Основные недостатки технического решения связаны с тем, что предложенное средство обладает свойствами, присущими только одному типу релаксации, а метод получения контрастных средств является лабораторным.
Известны контрастные средства для магнитно-резонансных изображений, состоящие из суперпарамагнитного наноразмерного ядра из оксида железа с немагнитным покрытием на органической основе, включающей силан, модифицированный полиэтиленимином, при этом гидродинамический диаметр ядра с покрытием меньше 30, 50, 100 нм (WO 2007069040, 2007).
Основные недостатки технического решения обусловлены тем, что предложенное средство обладает свойствами, присущими только одному виду релаксации, а технология получения контрастного средства является очень сложной.
Известны наночастицы оксида марганца (MnO) размерами не более 30, 35, 40, 50 нм, покрытые слоем различных биосовместимых материалов, в частности слоями полиэтиленгликоля или декстрана толщиной между 5 и 10 нм, при этом общий диаметр комплекса наночастица - биосовместимый слой не должен превышать 500 нм, используемые в качестве T1-контрастного агента для клеточного материала (WO 2008093999, 2008). В ряде случаев биосовместимый слой связан с биоактивным слоем, который выбран из группы, содержащей фолиевую кислоту или пептиды, или лекарственные средства (цисплатин, доксирубицидин и др.).
Основной недостаток технического решения обусловлен тем, что предложенное средство обладает свойствами, присущими только одному типу релаксации, а именно T1.
Известны наноразмерные цинксодержащие частицы, в том числе оксида металла с повышенной намагниченностью насыщения и, соответственно, улучшенными контрастными эффектами (R1 или R2). Приведены составы наночастиц, все более усложненные за счет последовательного введения новых элементов, выбранных из группы, содержащей в разных случаях до 60 элементов (WO 2008127031, 2008). Названные наноразмерные частицы с гидродинамическим диаметром в воде от 1 нм до 500 мкм составляют гибридные структуры с био- и химически активными материалами, в частности с протеинами и антителами, а также различными функциональными группами. Синтез цинксодержащих наноразмерных порошков, покрытых димеркаптосукциновой кислотой (DMSA), включает введение хлоридов цинка (ZnCl2), железа (FeCl2) или марганца (MnCl2) и железа (асас) в раствор триоктиламина, который содержит олеиновую кислоту и олейамин. Реакция происходит при температуре 200 или 300°С в течение 2 часов и приводит к образованию наночастиц размером 15 нм, которые осаждаются избыточным количеством этанола. Другие составы синтезируют подобным способом, который усложняется по мере повышения числа элементов в веществе.
Основные недостатки технического решения обусловлены тем, что предложенное средство обладает свойствами, присущими только одному типу релаксации T1 или Т2, при этом технология его получения сложна и использует вредные вещества. Следует отметить также очень большой максимальный гидродинамический диаметр частиц, при таких значениях диаметров снижаются контрастные свойства изображений.
Известны магнитные мультимодальные наночастицы, включающие диэлектрическое ядро, состоящее из оксида и металлического покрытия на нем, используемые в качестве контрастного состава для магнитно-резонансных изображений (WO 2009032752, 2009). Мультимодальные наночастицы для магнитно-резонансных изображений синтезируют с использованием обратных мицелл и наполовину состоят из лантанида, включая Gd, Eu, Dy и Tb, или переходного металла, включая Mn, Fe и др., остальная половина составляет ядро из диоксида кремния (SiO2). В результате становится возможным использовать не только магнитные, но и оптические свойства наночастиц.
Основной недостаток технического решения обусловлен тем, что предложенное контрастное средство обладает свойствами, присущими только одному типу релаксации, а технология получения металлического покрытия на диэлектрическом ядре из диоксида кремния довольно сложна и включает использование вредных веществ.
Известны нанобиокомплексы, содержащие наночастицы размером от 1 до 1000 нм оксида марганца MnO или MnMO, в том числе MnM'FeO, где М и М' выбраны из примерно 40 элементов разных групп периодической таблицы Д.И.Менделеева (WO 2007064175, 2007). Специальным пунктом выделены соединения MnFeO, MnFeZnO и MnFeCuO, в которых соотношение металлических элементов меняется от 0 до 4. Оксид, содержащий марганец, является ядром нанобиокомплекса, которое в свою очередь связано с биоактивным материалом, таким как молекулы или биофункциональные средства (белки, витамины, различные лекарственные формы и т.д.). Эти нанобиокомплексы используются в частности как контрастные средства для Т2 спин-спиновой релаксации или для T1 спин-решеточной релаксации. Содержащие марганец наночастицы оксида показывают намного более сильное усиление сигнала спин-спиновой релаксации (R2 - коэффициент релаксационной способности около 360 L/mol/sec), чем наночастицы обычно используемого оксида железа. Способ синтеза наноразмерных частиц включает введение прекурсора в органический растворитель, содержащий поверхностный стабилизатор, и поддерживание условий (температуры и времени) протекания химической реакции, необходимой для роста, выделения и очистки наночастиц.
Основной недостаток технического решения обусловлен тем, что предложенные контрастные средства, содержащие оксид марганца, в котором марганец частично заменяют железом и другими элементами, выбранными из группы, содержащей до 40 элементов Периодической таблицы Д.И.Менделеева, в том числе MnFeO, MnFeZnO и MnFeCuO, в которых соотношение элементов-металлов изменяется от нуля до четырех, обладают свойствами, присущими только одному типу релаксации T1 или Т2. Сложной является также технология создания нанобиокомплекса, включающего белки, витамины и различные лекарственные формы.
Известны суперпарамагнитные однодоменные частицы размером в интервале 3-50 нм и стабильные деградирующие агрегаты размером в интервале 10-1000 нм, содержащие железо, гидроксид железа, гидрат оксида железа, γ-Fe2O3, магнетит (Fe3O4), смеси оксидов железа с формулой MOFe2O3, где M представляет собой двухвалентный ион металла, выбранный из группы, содержащей железо, кобальт, никель, марганец, бериллий, магний, кальций, барий, стронций, медь, цинк, платина и их смеси, оксиды с формулой Fe2O3·Me2O3, где Me представляет собой трехвалентный ион металла, выбранный из группы, содержащей алюминий, хром, висмут, редкоземельные металлы и их смеси (US Patent 6274121, 2001). Эти частицы стабилизированы в растворе с помощью различных веществ-стабилизаторов, позволяющих создать коллоидный раствор. Для получения наночастиц используют метод осаждения. Например, хлорид (III) железа и сульфат железа растворяют в дистиллированной воде, а затем добавляют каустическую соду при рН=9.5, соляную кислоту и нагревают до 100°С. После охлаждения промывают осадок.
Среди большого числа составов, перечисленных в патенте, упомянут также состав MOFe2O3, где M - двухвалентный ион кобальта, что соответствует формуле CoFe2O4, однако тип релаксации, определяющий контрастные свойства, не указан. Кроме того, техническим решением допускается использование больших агрегатов (до 1000 нм), что обычно приводит к снижению контрастных свойств изображений.
Известны магнитные частицы, содержащие средства для усиления изображений, в том числе магнитно-резонансных (US Patent 5746999,1998). В качестве магнитных частиц используют полученные методом со-осаждения суперпарамагнитные частицы магнетита размером в диаметре менее 50 нм (в основном 2-20 нм). Кроме частиц магнетита в детальном описании патента упоминаются частицы таких металлов, как железо, кобальт, никель и др., оксиды железа Fe2O3, γ-Fe2O3, двойные оксиды/двойные гидроксиды, содержащие двухвалентное и/или трехвалентное железо, ферриты с общей формулой mMO·nFe2O3, где M - двухвалентный ион металла или смесь двух двухвалентных ионов металла. Среди составов, перечисленных в патенте, упомянут состав mMO·nFe2O3, где M - двухвалентный ион металла, например кобальта. При m=1 и n=1 этот состав соответствует соединению CoFe2O4, однако тип релаксации, определяющий контрастные свойства, не указан.
Известны полученные методом со-осаждения из раствора хлоридов железа или хлорида и сульфата суперпарамагнитные однодоменные частицы размером в интервале 1-10 нм с увеличенной в интервале от 2 до 5 релаксационной способностью R1 и отношением R2/R1 меньше 5, имеющие на поверхности стабилизирующие вещества, предотвращающие агрегацию и седиментацию (US Patent 6638494, 2003). Эти частицы состоят из гидроксида железа, гидрат окиси железа, γ-Fe2O3, Fe3O4, смеси оксидов железа с общей формулой mMO·nFe2O3, где M - двухвалентный ион металла (Fe, Co, Ni, Mn, Be, Mg, Ca, Ba, Sr, Cu, Zn, Pt или их смеси); смеси оксидов с общей формулой mFe2O3·nM2O3, где M - трехвалентный ион металла (Al, Cr, Bi, редкоземельные металлы или их смеси) или железо, где m и n - целые числа в интервале от 1 до 6.
Основной недостаток технического решения обусловлен тем, что предложенное средство обладает свойствами, присущими только одному типу релаксации. Следует отметить также, что несмотря на то, что патент осуществляет защиту большого числа составов, соответствующих формуле mMO·nFe2O3 (M - двухвалентный ион металла, а m и n - целые числа), среди которых есть и состав CoFe2O4, в приведенных примерах обсуждается использование в качестве позитивной контрастной среды только наночастиц оксида железа, полученные методом со-осаждения.
Таким образом, применение суперпарамагнитных наночастиц лимитировано их контрастными свойствами, в основном все предлагаемые наночастицы являются Т2-контрастными средствами и не используются в качестве контраста при более коротком времени релаксации T1.
Наиболее близким техническим решением является нанокомплекс в качестве контрастного Т2 средства, состоящий из сферического ядра, выполненного из двуокиси кремния и золотой наноскорлупы, в которую заделаны магнитные наночастицы, выбранные из группы, состоящей из магнетита Fe3O4, маггемита, феррита кобальта CoFe2O4, оксида марганца MnO, феррита марганца MnFe2O4, сплавов Fe-Pt и Co-Pt, и кобальта (WO 2008/048074, 2008). Поверхность нанокомплекса связана с полиалкиленгликолем, который, в свою очередь, связан с лекарственной формой. Диаметры ядра и скорлупы нанокомплекса составляют от 50 до 500 нм, а диаметр магнитных частиц от 2 до 30 нм.
Основной недостаток известного технического решения обусловлен тем, что предложенное средство обладает свойствами, присущими только одному типу релаксации Т2, а технология получения нанокомплекса, состоящего из трех разных веществ, очень сложна.
Наиболее близким техническим решением, связанным со способом получения заявляемого контрастного средства для магнитно-резонансных изображений, является способ получения композиционного наноразмерного материала на основе оксида олова для адсорбции и десорбции ДНК/РНК (RU 2319153, 2007). Материал получают механохимическим синтезом из солевых систем в присутствии инертного разбавителя NaCl, при этом реагент хлорид олова является кристаллогидратом. Смесь реагентов (хлорид олова и карбонат натрия) герметизируют в закаленных стальных барабанах со стальными шарами. Механохимический синтез проводят в планетарной мельнице. Продукт выгружают и отмывают из него наночастицы.
Основной недостаток известного способа состоит в том, что получаемые магнитные частицы не обладают свойствами контрастных средств ввиду малого содержания магнитной фазы.
Задачей настоящего изобретения является создание контрастного средства, обладающего одновременным воздействием на относительный позитивный T1 и негативный Т2 контрасты при магнитно-резонансном сканировании.
Поставленная задача решается тем, что в качестве контрастного средства используют полученный механохимическим синтезом наноразмерный суперпарамагнитный порошок кубической кобальтовой феррошпинели с размером частиц 3-20 нм при содержании компонентов, соответствующих формуле CoxFe3-xO4, где 0.1≤х≤0.99, предпочтительно 0.6≤х≤0.98. Границы концентраций кобальта определяются условиями способа получения целевого продукта.
В результате многочисленных экспериментов по исследованию закономерностей механохимического синтеза солевых систем, содержащих хлориды металлов, поставленная задача решается также путем:
- выбора компонентов исходной реакционной смеси;
- выбора инертного компонента;
- выбора соотношения массы реакционной смеси к массе инертного компонента;
- определения оптимального времени механохимического синтеза;
- подбора соотношения масс порошка и шаров.
Получают наноразмерные частицы кобальтовой феррошпинели механохимическим синтезом с использованием в качестве основных реагентов хлоридов железа и кобальта в присутствии инертного компонента - хлорида натрия по следующей реакции:
2FeCl3+CoCl2+Са(ОН)2+3Na2CO3=CoxFe3-xO4+CaCl2+6NaCl+3CO2↑+H2O,
где 0.1≤x≤0.99. Предпочтительным является значение 0.6≤x≤0.98.
В качестве исходных материалов для синтеза применяют реактивы марок Ч, ХЧ и ЧДА, при этом хлориды железа и кобальта могут быть как кристаллогидратами, так и безводными солями. С целью изменения соотношения кобальта и железа в конечном продукте, предотвращения нагрева смеси реагентов и агрегации наночастиц дополнительно вводят инертный компонент - хлорид натрия в соотношении масса реакционной смеси: масса NaCl=1:(1÷5). Полученную смесь герметизируют в закаленных стальных барабанах со стальными шарами диаметром 4-5 мм. Механохимический синтез проводят в планетарной мельнице МПВ (ускорение 55-60 g). Непременными условиями для достижения заданного технического эффекта изобретения являются строгое соблюдение соотношений массы реакционной смеси к массе инертного компонента, равного (1:2)-(1:3), и масс порошка и шаров mп:mш, равного 1:20, осуществление механохимического синтеза в течение 10-60 мин. Полученный продукт после термической обработки при (100±20)°С в течение 0.5÷1 часа или без нее промывают на фильтре дистиллированной водой до полного удаления солей и высушивают при комнатной температуре, после чего, если необходимо, обрабатывают ультразвуком и центрифугируют (УЗДН-2Т и «Bekman J2-21»).
Фазовый состав, морфологию, дисперсность и параметры структуры наноразмерных порошков определяют с помощью рентгеноструктурного анализа (РСА, установка «Schimadzu XRD-6000», CuKα-излучение) и просвечивающей электронной микроскопии (ПЭМ, прибор ЭМ-125), площадь удельной поверхности (S) - методом тепловой десорбции азота («СОРБИ» N 4.1»), химический состав - методом рентгеновского флуоресцентного анализа (РФА, установка «Schimadzu XRD-1800») и атомно-эмиссионный спектрометрии с индуктивно-связанной плазмой (iCAP-6300 Duo, Thermo Scientific). Данные рентгеноструктурного анализа обрабатывают, используя программу полнопрофильного анализа POWDER CELL 2.5. Из значений площади удельной поверхности и плотности частиц рассчитывают их средний диаметр.
При исследовании магнитных свойств синтезированной феррошпинели кобальта используют методы анализа температурных зависимостей начальной магнитной проницаемости на частоте 10 кГц, а также кривых намагничивания и их производных, полученных в импульсных магнитных полях напряженностью до 3 Тл по методике, описанной в (В.Ю.Креслин, Е.П.Найден / ПТЭ, 2001, №5, с.63).
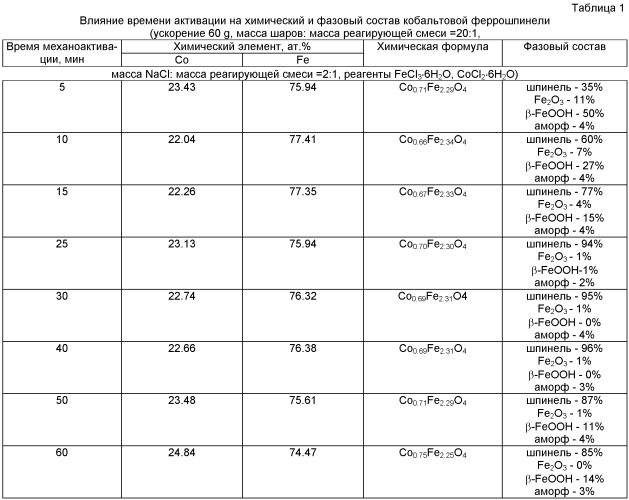
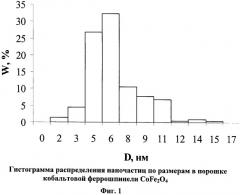
Исследование конечных продуктов механохимического синтеза показывает, что порошок состоит из слабосвязанных друг с другом наноразмерных сферических частиц с диаметром 3-20 нм (фиг.1). Конечный продукт в зависимости от условий содержит 60-96 об.% феррошпинели кобальта кубической сингонии и другие фазы (табл.1-3). Площадь удельной поверхности равна 113 м2/г, удельная намагниченность насыщения - 22-25 Гс·см3/г.
Химический состав порошка феррошпинели кобальта, изученный методом рентгенофлуоресцентного анализа, изменяют, используя различные виды (водные и безводные) хлоридов железа и кобальта, и соотношения массы реакционной смеси mсм.р. к массе инертного компонента mNaCl, разные продолжительности механохимического синтеза и термическую обработку продукта при (100±20)°С в течение 1 ч. (табл.1-3). Например, увеличение содержания инертного разбавителя с 1:2 до 1:3 при продолжительности механохимического синтеза 30 мин приводит к получению продукта практически стехиометрического состава (Co0.99Fe2.01O4) вместо продукта с химической формулой Со0.84Fe2.16O4 (табл.2). При дальнейшем увеличении содержания инертного компонента в реакционной смеси до 5:1 заметно уменьшается выход целевого продукта. В связи с этим нижнее граничное значение соотношения массы реакционной смеси к массе инертного компонента принято равным 1:3. Присутствие примесей марганца (~0.14 ат.%) и хрома (0.22-0.38 ат.%) вызвано в основном намолом материала мелющих тел - шаров из стали ШХ15. Выход конечного продукта также определяется условиями механохимического синтеза. При соотношении масс шаров или хлорида натрия к массе реакционной смеси, равном 20:1 и 2:1, соответственно, и продолжительности механохимической активации 5 мин и менее степень превращения мала, соответственно очень низок (35%) выход целевого продукта (табл.1). При дальнейшем увеличении продолжительности механохимической активации до 10 мин выход целевого продукта возрастает до 60% (нижнее значение), а после обработки в течение 25-40 мин выход составляет 94-96% (верхнее значение). В результате значение соотношения массы реакционной смеси к массе инертного компонента, равное 1:2, принято за верхнее граничное значение.
Продолжительность механохимической активации, равная 60 мин, при прочих равных условиях, определяется некоторым снижением выхода целевого продукта (до 85%) с ростом времени механической обработки. При дальнейшем увеличении продолжительности механохимического процесса выход продукта существенно не изменяется как при использовании безводного сырья, так и кристаллогидратов (табл.2 и 3). Таким образом, целесообразно осуществлять процесс механохимической активации в интервале параметров: отношение массы хлорида натрия к массе реакционной смеси равно (2:1)÷(3:1); продолжительность механохимической активации 10÷60 мин. Термическая обработка продукта механохимической активации при 100±20°С в течение 0.5÷1 ч способствует получению целевого продукта химического состава CoxFe3-xO4, где 0.1≤x≤0.99, и, как показано ниже, обладающего высокими контрастными свойствами при T1 и Т2-релаксации.
Суспензию частиц нанопорошков феррита кобальта в стабилизирующем буфере получают (рН=7) методом ультразвуковой дезинтеграции (Bandelin). Для приготовления наносуспензии, например, 100 мг наночастиц растворяют в стабилизирующем буфере (20 мМ цитрата натрия, 108 мМ хлорида натрия, 10 мМ HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) и сонифицируют (20 кГц, 50 В) в течение 5 минут. Во время сонификации крупные агрегаты наночастиц разбиваются и покрываются макромолекулами цитрата натрия, предотвращая обратную агрегацию. Неразбитые частицы осаждают в гравитационном поле 500 g.
Размер наночастиц в суспензии измеряют с помощью динамического светорассеяния (Dynamic Light Scattering Detector PD 2000 DLS Plus). Концентрацию ионов определяют flame-спектроскопией с помощью Varian Spectr AA 110 атомно-абсорбционного спектрометра.
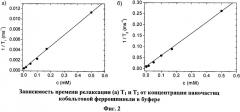
Времена релаксации T1 и Т2 измеряют для различных концентраций наночастиц магнитной феррошпинели в 1% агарозе при комнатной температуре при частоте 1Н ЯМР vH=100 MHz (фиг.2). Время T1 спин-решеточной релаксации измеряют с частотой релаксации TR=15 с и временем между импульсами 140µS-15 с.
Спин-спиновое время релаксации Т2 измеряют последовательным спин-эхо при времени повторения TR=500 мс при различном входящем времени эхо. Время эхо было от 15 мкс до 500 мс. Продольную (r1) и поперечную (r2) степени релаксации определяют в размере r1=22 s-1 mM-1, r2=503 s-1mM-1.
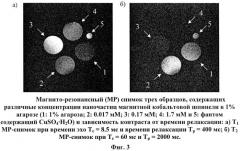
Возможность позитивного и негативного контрастирования наночастиц магнитной феррошпинели проверяют на магните 2.35 Т при комнатной температуре. Готовят T1 и Т2 снимки образцов 1% агарозных фантомов, содержащих различные концентрации наночастиц с использованием следующих параметров частоты спин. эхо: площадь обзора равна 3 см, толщина слайдов равна 1 мм, размер матрикса 256×256. Было использовано отношение TR/TE=60/2000 мс. Образец с концентрацией наночастиц 0.34 мМ показал полное исчезновение магнитно-резонансного (МР) сигнала (фиг.3, 4). Также потеря сигнала наблюдалась в образце с концентрацией наночастиц, равной 3.4 мМ. Для концентрации 0.034 мМ интенсивность сигнала была сопоставима с интенсивностью сигнала 1% агарозы. Результаты продемонстрировали возможность использования наночастиц в качестве контрастных агентов при выборе нужной концентрации.
Свойства наночастиц магнитной феррошпинели как T1 и Т2 контрастного агента также были продемонстрированы с использованием образца, содержащего 1% агарозу, в который локально добавлен раствор 0.34 мМ наночастиц. Наночастицы были инъецированы в середину агарозного фантома (фиг.5). На Т2 МР снимке негативный контраст наблюдался на той же позиции внутри образца. Это доказывает контрастный эффект наночастиц феррошпинели при концентрации 0.34 мМ. Параметры МР сканирования были те же, что и выше.
Аликвоту липидов (2.6 мМ фосфатидилхолина и 0.2 мМ 1,2-дистеарол-sn-глицеро-3-фосфоэтанламин-N-[метокси(полиэтиленгликоля)-2000] (Avanti Polar Lipids, Inc.)), растворенных в хлороформе помещают в вакуум для испарения растворителя с формированием сухих липидных пленок. Сухие пленки гидратируют добавлением стабилизированных наночастиц (3.4 мМ). Для достижения различных концентраций в липосомах могут быть использованы различные концентрации наночастиц. Экструзию дисперсии проводят через поликарбонатные мембраны 100 нм (фиг.6, 7).
Аликвоту липидов (2.6 мМ фосфатидилхолина и 0.2 мМ 1,2-дистеарол-sn-глицеро-3-фосфоэтаноламин-N-(метокси(полиэтиленгликоля)-2000] (Avant