Стабильные неводные фармацевтические композиции
Иллюстрации
Показать всеГруппа изобретений относится к неводной фармацевтической композиции, содержащей дегидратированный активный полипептид, содержащий 10-100 аминокислот, и по меньшей мере один полуполярный протонный органический растворитель, причем полипептид дегидратирован при заданном рН, отличающемся по меньшей мере на 1 единицу рН от pI полипептида в водном растворе и к способу получения композиции. Группа изобретений обеспечивает улучшенную стабильность неводной композиции терапевтического пептида. 2 н. и 37 з.п. ф-лы, 7 пр., 11 ил., 1 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к неводным фармацевтическим композициям и к их применению в способах лечения диабета и гипергликемии.
ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ УРОВЕНЬ ТЕХНИКИ
Обычно полипептиды обладают низкой растворимостью в большинстве неводных растворителей за исключением некоторых апротонных растворителей типа диметилсульфоксида (DMSO), диметилацетамида и диметилформамида. Однако токсичность этих апротонных растворителей делает их непригодными в какой-либо значительной степени для использования в фармацевтических композициях.
Известно (Klibanov и др. (J.Т.Chin, S.L.Wheeler, and A.M.Klibanov. Communication to the editor: On protein solubility in organic solvents. BIOTECHNOL. BIOENG. 44(1):140-145, 1994)), что в протонных, очень гидрофильных и полярных растворителях растворяется более чем 10 мг/мл лизоцима (лиофилизированного из водного раствора рН 6,0). Растворимость в индивидуальном растворителе (1,5-пентадиоле) значительно увеличивалась, если лизоцим перед растворением в пентадиоле подвергали сублимационной сушке из водных растворов, величины рН которых были смещены в область ниже изоэлектрической точки лизоцима. Никакой строгой корреляции между характеристиками растворителя и растворимостью лизоцима установить не смогли.
В WO 00/42993 описаны композиции для доставки макромолекул, причем макромолекулы растворены или диспергированы в низкотоксичном органическом растворителе, который может быть переведен в аэрозольное состояние для доставки в легкое пациента посредством ингаляции.
Многие органические полярные протонные растворители имеют тенденцию дестабилизировать полипептиды вследствие частичного разворачивания полипептидов, что зачастую усиливает процессы агрегации и химического расщепления, в значительной степени обусловленные более высокой конформационной подвижностью. Некоторые органические полярные протонные растворители типа этанола могли бы действовать даже в качестве денатурирующего агента для полипептидов. Кроме того, органические полярные протонные растворители зачастую содержат небольшие количества очень реакционно-способных примесей, таких как альдегиды и кетоны, которые нарушают стабильность полипептида. Поэтому приготовить неводный раствор полипептида с надлежащей стабильностью на протяжении срока годности - трудная задача.
Поскольку неводные растворы полипептидов могут далее быть преобразованы в раствор для дозирующих ингаляторов под давлением (pMDI), где полярное неводное вещество действует как сорастворитель для того, чтобы солюбилизировать полипептид в гидрофторалкане, их можно успешно использовать для легочного введения.
Кроме того, неводные растворы полипептидов могут быть преобразованы в микроэмульсии для перорального введения путем добавления детергентов и неполярных гидрофобных растворителей, таких как масла. Микроэмульсия могла бы защищать полипептид против протеолитического расщепления и усиливать системное всасывание полипептида из желудочно-кишечного тракта. Кроме того, ожидается, что гидролиз полипептидов сведется к минимуму в неводных композициях вследствие снижения активности воды.
Зачастую к неводным фармацевтическим композициям терапевтических пептидов необходимо применить обработку и добавление различных эксципиентов, чтобы улучшить их растворимость и их стабильность.
Срок годности жидких парентеральных композиций пептидов должен составлять по меньшей мере год, предпочтительно больше. Период использования (in-use period), когда продукт может подвергаться ежедневной транспортировке и встряхиванию при температуре окружающей среды, предпочтительно должен составлять несколько недель.
Таким образом, существует необходимость в неводных фармацевтических композициях терапевтических пептидов с улучшенной стабильностью.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
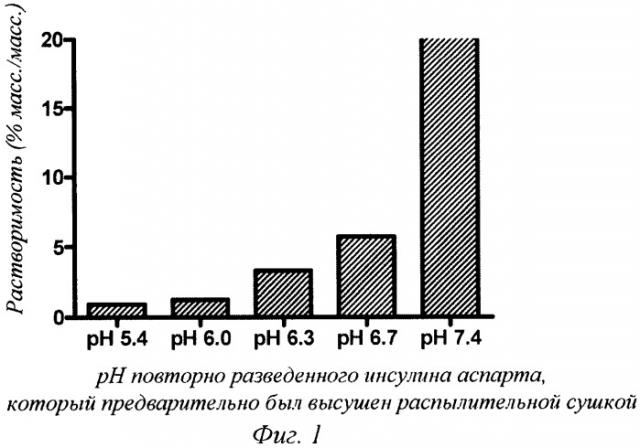
Фиг.1 - зависимость между растворимостью инсулина аспарта в пропиленгликоле при температуре окружающей среды от рН инсулина аспарта, повторно растворенного в воде (заданное значение рН (target рН)).
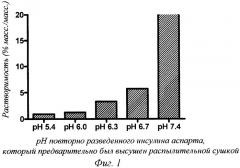
Фиг.2 - растворимость инсулина аспарта (заданное значение рН: 7,5) в различных полуполярных протонных растворителях при температуре окружающей среды.
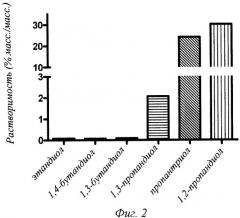
Фиг.3 - проницаемость человеческого инсулина в присутствии или в отсутствие 10% (об./об.) пропиленгликоля (PG) через мешочки из свежеиссеченного кишечника крысы (проксимальная тонкая кишка) через 2 часа инкубации в физиологической культуральной среде (рН 7,4) при 37°С.
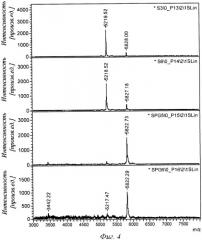
Фиг.4 - анализ с использованием MALDI (ионизации посредством лазерной десорбции из матрицы) показывает наличие прошедших (через мешочек) нерасщепленного инсулина аспарта (пик ~5828) и продукта его деградации (пик ~5218) для каждого из двух буферных контрольных образцов (S3 и S6) и для двух пропиленгликольсодержащих образцов (SPG5 и SPG6). Можно видеть, что в присутствии пропиленгликоля (PG) через слизистую оболочку кишечника проникает большее количество нерасщепленного инсулина.
Фиг.5 - снижение уровня глюкозы в крови (ммоль/л) после перорального введения человеческого A14GluB25HisдезB30 инсулина (8 мМ) с пропиленгликолем или без него. SPRD-крысам (Sprague-Dawley) введен объем дозировки 1,2 мл/кг путем использования кормления через желудочный зонд.
Фиг.6 - FUV CD (круговой дихроизм в дальней УФ-области) 0,2 мМ инсулина аспарта, рН 7,4 (сплошная линия), 0,2 мМ инсулина аспарта в 100%-ном пропиленгликоле (PG) (линия из точек), 0,2 мМ инсулина аспарта в 2%-ном PG после разведения из 100%-ого пропиленгликоля (PG) (пунктирная линия).
Фиг.7 - NUV CD (круговой дихроизм в ближней УФ-области) 0,2 мМ инсулина аспарта, рН 7,4 (сплошная линия), 0,2 мМ инсулина аспарта в 100%-ном пропиленгликоле (PG) (линия из точек), 0,2 мМ инсулина аспарта в 2%-ном пропиленгликоле (PG) после разведения из 100%-ого пропиленгликоля (PG) (пунктирная линия).
Фиг.8 - чистота инсулина аспарта (IA), солюбилизированного или в пропиленгликоле, или в 0,1 М ТРИС-буфере, рН 7,5, после инкубации при 25 и 40°С в течение до 4 недель включительно. Заданное значение рН для порошка инсулина аспарта составляло 7,5. Чистоту определяли, используя обращенно-фазовую хроматографию.
Фиг.9 - образование высокомолекулярного белка (HMWP) инсулина аспарта (IA), солюбилизированного или в пропиленгликоле, или в 0,1 М ТРИС-буфере, рН 7,5, после инкубации при 25 и 40°С в течение до 4 недель включительно. Заданное значение рН для порошка инсулина аспарта составляло 7,5. Количество HMWP определяли, используя стерическую эксклюзионную хроматографию.
Фиг.10 - образование позитивно окрашенных тиофлавином Т фибрилл инсулина аспарта (IA), солюбилизированного или в пропиленгликоле, или в 0,1 М ТРИС-буфере, рН 7,5, после инкубации при 40°С в течение до 4 недель включительно. Заданное значение рН для порошка инсулина аспарта составляло 7,5.
Фиг.11 - диаграмма, описывающая процесс формирования фибрилл.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном из аспектов изобретения предложена фармацевтическая неводная композиция, содержащая дегидратированный полипептид и по меньшей мере один полуполярный протонный органический растворитель, причем полипептид дегидратирован при заданном рН, отличающемся по меньшей мере на 1 единицу рН от рI полипептида в водном растворе.
В одном из аспектов изобретения предложена фармацевтическая неводная композиция, содержащая дегидратированный полипептид и по меньшей мере один полуполярный протонный органический растворитель, причем полипептид дегидратирован при заданном рН, отличающемся по меньшей мере на 1 единицу рН от рI полипептида в водном растворе, и где указанное заданное значение рН находится в диапазоне от примерно 6,0 до примерно 9,0.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения открыли, что полипептиды, такие как инсулиновые пептиды в твердом состоянии (дегидратированные), могут быть солюбилизированы до очень высокой степени в неводном полуполярном протонном растворителе посредством оптимизации рН указанных полипептидов в водном растворе перед дегидратированием, что дает возможность получения стабильных при хранении фармацевтических композиций. Такие фармацевтические композиции, например для перорального, легочного и назального применения, демонстрируют высокую химическую и/или физическую стабильность. Кроме того, композиции по изобретению, такие как пероральные фармацевтические композиции, в которых используют пропиленгликоль в качестве полуполярного протонного органического растворителя, могут показывать значительно улучшенную биодоступность.
В одном из аспектов изобретения предложена фармацевтическая неводная композиция, содержащая дегидратированный полипептид и по меньшей мере один полуполярный протонный органический растворитель, причем полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе.
В другом аспекте изобретения предложена фармацевтическая неводная композиция, содержащая дегидратированный полипептид и по меньшей мере один полуполярный протонный органический растворитель, причем полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе, при условии, что полипептид не является инсулинотропным пептидом, GLP-1(7-37) (GLP обозначает глюкагоноподобный пептид) или его аналогом либо производным, или эксендином или его аналогом либо производным.
В следующем аспекте изобретения предложена фармацевтическая неводная композиция, содержащая
a) дегидратированный терапевтически активный полипептид, и
b) по меньшей мере один полуполярный протонный органический растворитель,
причем полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе, и указанное заданное значение рН находится в диапазоне от примерно 6,0 до примерно 9,0.
В еще одном следующем аспекте изобретения предложена фармацевтическая неводная композиция, содержащая
a) дегидратированный терапевтически активный полипептид, и
b) по меньшей мере один полуполярный протонный органический растворитель,
причем полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе и указанное заданное значение рН находится в диапазоне от примерно 6,0 до примерно 9,0 при условии, что полипептид не является инсулинотропным пептидом, GLP-1 (7-37) или его аналогом либо производным, или эксендином или его аналогом либо производным.
В другом аспекте изобретения предложена фармацевтическая неводная композиция, содержащая смесь
a) дегидратированного терапевтически активного полипептида, содержащего 10-100 аминокислот, и
b) по меньшей мере одного полуполярного протонного органического растворителя,
причем полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе. В предпочтительном воплощении заданное значение рН находится в диапазоне от примерно 6,0 до примерно 9,0.
В еще одном другом аспекте изобретения предложена фармацевтическая неводная композиция, содержащая смесь
a) дегидратированного терапевтически активного полипептида, содержащего 10-100 аминокислот, и
b) по меньшей мере одного полуполярного протонного органического растворителя,
причем полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе. В предпочтительном воплощении заданное значение рН находится в диапазоне от примерно 6,0 до примерно 9,0 при условии, что полипептид не является инсулинотропным пептидом, GLP-1 (7-37) или его аналогом либо производным, или эксендином или его аналогом либо производным.
Термин "неводный", использованный в данном описании, относится к композиции, содержащей менее 10% (мас./мас.) воды. В более предпочтительном воплощении композиция по изобретению содержит менее 8% (мас./мас.) воды, в более предпочтительном воплощении менее 5% (мас./мас.) воды, в более предпочтительном воплощении менее 3% (мас./мас.) воды и в еще более предпочтительном воплощении менее 2% (мас./мас.) воды.
Термин "дегидратированный", использованный в данном описании в связи с полипептидом, относится к полипептиду, который высушен из водного раствора. Термин "заданное значение рН", использованный в данном описании, относится к значению рН водного раствора, которое будет установлено, когда дегидратированный полипептид будет повторно гидратирован в чистой воде до концентрации приблизительно 40 мг/мл или больше. Заданное значение рН обычно будет идентично значению рН водного раствора полипептида, из которого данный полипептид был получен в результате сушки. Однако значение рН раствора полипептида не будет идентично заданному значению рН, если раствор полипептида содержит летучие кислоты или основания. Обнаружено, что "предыстория" рН полипептида будет являться определяющим фактором того, какое количество полипептида может быть солюбилизировано в полуполярном протонном органическом растворителе.
Согласно данному изобретению полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе. Таким образом, в одном из аспектов изобретения заданное значение рН более чем на 1 единицу рН превышает изоэлектрическую точку полипептида. В другом аспекте изобретения заданное значение рН более чем на 1 единицу рН лежит ниже изоэлектрической точки полипептида. В предпочтительном аспекте заданное значение рН лежит более чем на 1,5 единицы рН выше или ниже рI полипептида. В еще более предпочтительном аспекте заданное значение рН лежит на 2,0 единицы рН выше или ниже рI полипептида. В следующем аспекте заданное значение рН лежит на 2,5 единицы рН выше или ниже рI полипептида. В еще одном следующем аспекте заданное значение рН лежит выше рI полипептида.
Под "летучим основанием" понимают основание, которое до некоторой степени будет выпариваться при нагревании и/или при пониженном давлении, например, основания, которые имеют давление паров выше 65 Па при комнатной температуре, или водную азеотропную смесь, включающую основание с давлением паров выше 65 Па при комнатной температуре. Примерами летучих оснований являются гидроксиды аммония, гидроксиды тетраалкиламмония, вторичные амины, третичные амины, ариламины, алифатические амины или бикарбонат аммония или их комбинация. Например, летучее основание может представлять собой бикарбонат, карбонат, аммиак, гидразин или такое органическое основание, как низшие алифатические амины, например триметиламин, триэтиламин, диэтаноламины, триэтаноламин и их соли. Другим летучим основанием может быть гидроксид аммония, этиламин или метиламин или их комбинация.
Под "летучей кислотой" понимают кислоту, которая до некоторой степени будет выпариваться при нагревании и/или при пониженном давлении, например, кислоты, которые имеют давление паров выше 65 Па при комнатной температуре, или водную азеотропную смесь, включающую кислоту с давлением паров выше 65 Па при комнатной температуре. Примерами летучих кислот являются угольная кислота, муравьиная кислота, уксусная кислота, пропионовая кислота и масляная кислота.
Термин "нелетучее основание", упомянутый в данном описании, означает основание, которое не выпаривается или только частично выпаривается при нагревании, например, основания с давлением паров ниже 65 Па при комнатной температуре. Нелетучее основание может быть выбрано из группы, состоящей из солей щелочных металлов, гидроксидов щелочных металлов, солей щелочноземельных металлов, гидроксидов щелочноземельных металлов и аминокислот или их комбинации. Примерами нелетучих оснований являются гидроксид натрия, гидроксид калия, гидроксид кальция и оксид кальция.
Термин "нелетучая кислота", упомянутый в данном описании, означает кислоту, которая не выпаривается или только частично выпаривается при нагревании, например кислоты с давлением паров ниже 65 Па при комнатной температуре. Примерами нелетучих кислот являются соляная кислота, фосфорная кислота и серная кислота.
Термин "рI полипептида", использованный в данном описании, относится к изоэлектрической точке полипептида.
Термин "изоэлектрическая точка", использованный в данном описании, означает величину рН, при которой общий отрицательный заряд макромолекулы, такой как пептид, равен нулю. В пептидах может быть несколько заряженных групп, и в изоэлектрической точке сумма всех этих зарядов равна нулю. При рН выше изоэлектрической точки общий заряд пептида будет отрицательным, тогда как при величинах рН ниже изоэлектрической точки общий заряд пептида будет положительным.
рI белка может быть определена экспериментально с использованием электрофоретических методик, таких как электрофокусирование.
Градиент рН устанавливают в антиконвекционной среде, такой как полиакриламидный гель. Когда белок вводят в данную систему, он будет двигаться под влиянием электрического поля, приложенного к гелю. Положительно заряженные белки будут мигрировать к катоду. В конечном счете, мигрирующий белок достигает точки в градиенте рН, где его общий электрический заряд равен нулю, и о нем говорят, что он будет фокусироваться. Это и есть изоэлектрическая точка (рI) белка. Белок фиксируют в геле и окрашивают. рI белка далее может быть определена путем сравнения положения белка в геле с положениями маркерных молекул с известными величинами pI.
Общий заряд белка при заданном значении рН может быть оценен теоретически специалистом в данной области техники с использованием общепринятых методов. По существу, общий заряд белка эквивалентен сумме парциальных зарядов заряженных аминокислот в белке: аспарагиновой аминокислоты (β-карбоксильная группа), глутаминовой аминокислоты (δ-карбоксильная группа), цистеина (тиоловая группа), тирозина (фенольная группа), гистидина (боковые цепи имидазола), лизина (ε-аминогруппа) и аргинина (гуанидиновая группировка). Кроме этого следует принимать во внимание заряд концевых групп белка (α-NH2 и α-СООН). Парциальный заряд способных к ионизации групп может быть рассчитан на основании характеристических величин рКа.
Сушка, т.е. дегидратирование полипептида, может быть осуществлена любым традиционным методом сушки, как, например, посредством распылительной, сублимационной, вакуумной, открытой и контактной сушки. В одном из аспектов изобретения раствор полипептида сушат распылительной сушкой с получением содержания воды ниже примерно 10%. Содержание воды может составлять ниже примерно 8%, ниже примерно 6%, ниже примерно 5%, ниже примерно 4%, ниже примерно 3%, ниже примерно 2% или ниже примерно 1%, что рассчитано/измерено в тесте на потери при сушке (гравиметрически), как указано в экспериментальной части.
В одном из аспектов изобретения полипептид сушат распылительной сушкой. В следующем аспекте изобретения полипептид сушат сублимационной сушкой.
В одном из аспектов изобретения растворимость, полученная в результате предварительной обработки полипептида путем дегидратирования при выбранном заданном значении рН в органическом растворителе, составляет по меньшей мере 20 мг/мл. В следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 30 мг/мл. В еще одном следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 40 мг/мл. В еще одном следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 50 мг/мл. В еще одном следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 60 мг/мл. В еще одном следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 70 мг/мл. В еще одном следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 80 мг/мл. В еще одном следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 100 мг/мл.
Термин "полуполярный протонный органический растворитель", использованный в данном описании, относится к гидрофильному, смешивающемуся с водой углеродсодержащему растворителю, который содержит связь O-Н или N-H, или его смесям. Полярность отражена в диэлектрической постоянной или дипольном моменте растворителя. Полярность растворителя определяет, какой тип соединений он способен растворять и с какими другими растворителями или жидкими соединениями он может смешиваться. Обычно полярные растворители наилучшим образом растворяют полярные соединения, а неполярные растворители наилучшим образом растворяют неполярные соединения: "подобное растворяется в подобном". Сильно полярные соединения типа неорганических солей (например, хлорид натрия) растворяются только в очень полярных растворителях.
Полуполярные растворители определены в данном описании как растворители с диэлектрической постоянной в диапазоне 20-50, тогда как полярные и неполярные растворители определяются как растворители с диэлектрической постоянной выше 50 и ниже 20 соответственно. Примеры полуполярных протонных растворителей приведены в Таблице вместе с водой в качестве вещества сравнения.
| Диэлектрические постоянные (статическая диэлектрическая проницаемость) выбранных полуполярных органических протонных растворителей и воды в качестве вещества сравнения (Handbook of Chemistry and Physics, CMC Press; диэлектрические постоянные измеряют в статических электрических полях или при относительно низких частотах, где не происходит никакой релаксации) | |
| Растворитель (температура, Кельвин) | Диэлектрическая постоянная, ε* |
| Вода (293,2) | 80,1 |
| Пропантриол [глицерин] (293,2) | 46,53 |
| Этандиол [этиленгликоль] (293,2) | 41,4 |
| 1,3-Пропандиол (293,2) | 35,1 |
| Метанол (293,2) | 33,0 |
| 1,4-Бутандиол (293,2) | 31,9 |
| 1,3-Бутандиол (293,2) | 28,8 |
| 1,2-Пропандиол [пропиленгликоль] (303,2) | 27,5 |
| Этанол (293,2) | 25,3 |
| Изопропанол (293,2) | 20,18 |
В настоящем контексте 1,2-пропандиол и пропиленгликоль используются взаимозаменяемо. В настоящем контексте пропантриол и глицерин используются взаимозаменяемо. В настоящем контексте этандиол и этиленгликоль используются взаимозаменяемо.
В одном из аспектов изобретения растворитель выбран из группы, состоящей из полиолов. Термин "полиол", использованный в данном описании, относится к химическим соединениям, содержащим множественные гидроксильные группы.
В следующем аспекте изобретения растворитель выбран из группы, состоящей из диолов и триолов. Термин "диол", использованный в данном описании, относится к химическим соединениям, содержащим две гидроксильные группы. Термин "триол", использованный в данном описании, относится к химическим соединениям, содержащим три гидроксильные группы.
В следующем аспекте изобретения растворитель выбран из группы, состоящей из глицерина (пропантриола), этандиола (этиленгликоля), 1,3-пропандиола, метанола, 1,4-бутандиола, 1,3-бутандиола, пропиленгликоля (1,2-пропандиола), этанола и изопропанола или их смесей. В следующем аспекте изобретения растворитель выбран из группы, состоящей из пропиленгликоля и глицерина. В предпочтительном аспекте изобретения растворителем является глицерин. Этот растворитель является биологически совместимым даже при высоких дозах и обладает высокой способностью к растворению инсулиновых пептидных соединений. В другом предпочтительном аспекте изобретения растворитель выбран из группы, состоящей из пропиленгликоля и этиленгликоля. Эти растворители имеют низкую вязкость, являются биологически совместимыми в умеренных дозах и обладают очень высокой способностью к растворению инсулиновых пептидов.
В предпочтительном случае растворители должны иметь высокую степень чистоты с низким содержанием, например, альдегидов, кетонов и других восстанавливающих примесей, чтобы свести к минимуму химическое повреждение солюбилизированного полипептида, обусловленное, например, реакцией Майара (Maillard reaction). К композициям, содержащим полуполярный протонный органический растворитель(и), такой как полиолы, можно добавить акцепторные молекулы типа глицилглицина и этилендиамина для уменьшения повреждений полипептида, тогда как для снижения скорости образования дополнительных восстанавливающих примесей можно добавить антиоксиданты.
В одном из аспектов изобретения органический растворитель присутствует в фармацевтической композиции в количестве по меньшей мере 20% мас./мас. В следующем аспекте изобретения органический растворитель присутствует в количестве по меньшей мере 30% мас./мас. В следующем аспекте изобретения органический растворитель присутствует в количестве по меньшей мере 40% мас./мас. В следующем аспекте изобретения органический растворитель присутствует в количестве по меньшей мере 50% мас./мас. В следующем аспекте изобретения органический растворитель присутствует в количестве по меньшей мере 80% мас./мас.
Обнаружено, что для увеличения стабильности во время хранения фармацевтической композиции заданное значение рН предпочтительно следует подвести до попадания в диапазон от примерно 6,0 до примерно 9,0. В одном из аспектов изобретения заданное значение рН составляет от примерно 6,0 до примерно 9,0, как например, от примерно 6,2 до примерно 8,4, от примерно 6,4 до примерно 8,7, от примерно 6,5 до примерно 8,5, от примерно 7,0 до примерно 8,5 или от примерно 7,2 до примерно 8,3. В одном аспекте заданное значение рН составляет выше примерно 7,4, выше примерно 7,6, выше примерно 7,8, выше примерно 8,0, выше примерно 8,2, выше примерно 8,4 или выше примерно 8,6. Считается, что повышенная стабильность во время хранения обуславливается меньшей тенденцией полипептидов к образованию фибрилл после дегидратирования, как описано выше.
Термин "стабильная во время хранения фармацевтическая композиция", использованный в данном описании, означает фармацевтическую композицию, которая стабильна в течение по меньшей мере периода времени, соответствующего требованиям контролирующих органов применительно к терапевтическим белкам. Предпочтительно, стабильная во время хранения фармацевтическая композиция стабильна в течение по меньшей мере одного года при 5°С. Стабильность во время хранения включает химическую стабильность, а также физическую стабильность. Химическая нестабильность включает расщепление ковалентных связей, например, гидролиз, рацемизацию, окисление или перекрестное сшивание. Химическую стабильность композиций оценивают посредством обращенно-фазовой (RP-HPLC) и стерической эксклюзионной (SE-HPLC) высокоэффективной жидкостной хроматографии. В одном из аспектов изобретения содержание образовавшихся из пептида примесей в течение срока годности составляет менее 10% от общего содержания пептида. В следующем аспекте изобретения содержание образовавшихся из пептида примесей в течение срока годности составляет менее 5%. RP-HPLC-анализ обычно проводят в смесях вода-ацетонитрил или вода-этанол. В одном воплощении растворитель на стадии RP-HPLC будет содержать соль, такую как Na2SO4, (NH4)2SO4, NaCl, KCl и такие буферные системы, как фосфат, цитрат и малеиновая кислота. Необходимая концентрация соли в растворителе может составлять от примерно 0,1 М до примерно 1 М, предпочтительно от 0,2 М до 0,5 М, наиболее предпочтительно от 0,3 до 0,4 М. Увеличение концентрации соли требует увеличения концентрации органического растворителя, чтобы достичь элюирования с колонки за подходящий промежуток времени.
Физическая нестабильность вовлекает конформационные изменения, касающиеся нативной структуры, включая потерю структуры более высокого порядка, агрегацию, образование фибрилл, выпадение в осадок или адсорбцию на поверхностях. Например, известно, что инсулиновые пептиды и соединения амилина имеют склонность к нестабильности, обусловленной образованием фибрилл. Физическую стабильность композиций можно оценивать традиционными методами, например посредством визуальной проверки, нефелометрии и анализа с использованием тиофлавина Т, после хранения композиции при разных температурах в течение различных периодов времени.
Конформационную стабильность можно оценить с применением методов кругового дихроизма и ЯМР (ядерного магнитного резонанса), как описано, например в Hudson and Andersen, Peptide Science, vol.76 (4), pp.298-308 (2004).
Термин "терапевтически активный полипептид" или "терапевтические полипептиды", использованный в данном описании, относится к полипептиду, способному излечивать, ослаблять или частично подавлять клинические проявления определенного заболевания и его осложнений.
В следующем аспекте изобретения термин "терапевтически активный полипептид" или "терапевтические полипептиды", использованный в данном описании, означает полипептид, который разрабатывается для терапевтического применения или который разработан для терапевтического применения.
Количество, достаточное для достижения этой цели, определяют как "терапевтически эффективное количество".
Эффективные количества для каждого назначения будут зависеть от тяжести заболевания или повреждения, а также массы и общего состояния здоровья субъекта. Очевидно, что определение соответствующей дозировки может быть достигнуто в результате рутинного экспериментирования, путем построения матрицы величин и тестирования различных точек в этой матрице, все это доступно обычным специалистам с подготовкой врача и ветеринара.
Термины "полипептид" и "пептид" используются в данном описании взаимозаменяемо для обозначения соединения, состоящего по меньшей мере из пяти структурных составляющих - аминокислот, соединенных пептидными связями. Структурные составляющие - аминокислоты - могут быть из группы аминокислот, кодируемых генетическим кодом, и они могут представлять собой природные аминокислоты, не кодируемые генетическим кодом, а также синтетические аминокислоты. Природными аминокислотами, которые не кодируются генетическим кодом, являются, например гидроксипролин, γ-карбоксиглутаминовая аминокислота, орнитин, фосфосерин, D-аланин и D-глутаминовая кислота. Синтетические аминокислоты включают аминокислоты, получаемые химическим синтезом, т.е. D-изомеры аминокислот, кодируемых генетическим кодом, такие как D-аланин и D-лейцин, Aib (α-аминоизомасляная кислота), Abu (α-аминомасляная кислота), Tle (тpeт-бутилглицин), β-аланин, 3-аминометилбензойная кислота, антраниловая кислота.
Получение полипептидов и пептидов хорошо известно в данной области техники. Полипептиды или пептиды могут быть получены, например, классическим пептидным синтезом, например твердофазным пептидным синтезом с использованием химии t-Boc (трет-бутилоксикарбонил) или Fmoc (9-флуоренилметилоксикарбонил), или с применением других хорошо устоявшихся методик, см., например Greene и Wuts, "Protective Groups in Organic Synthesis", John Wiley & Sons, 1999. Полипептиды или пептиды также могут быть получены способом, который включает в себя культивирование клеток хозяина, содержащих последовательность ДНК, кодирующую данный (поли)пептид, и способных экспрессировать данный (поли)пептид в подходящую питательную среду в условиях, позволяющих осуществлять экспрессию пептида. Для (поли)пептидов, содержащих остатки неприродных аминокислот, рекомбинантная клетка должна быть модифицирована таким образом, чтобы неприродные аминокислоты оказались включенными в данный (поли)пептид, например, посредством получения мутантных форм тРНК.
Термин "фармацевтическая композиция", использованный в данном описании, означает продукт, содержащий терапевтически активный полипептид вместе с фармацевтическими эксципиентами, такими как поверхностно-активное вещество, буфер, консервант и модификатор тоничности, при этом указанная фармацевтическая композиция полезна для лечения, предупреждения или уменьшения тяжести заболевания или расстройства путем введения указанной фармацевтической композиции субъекту. Таким образом, фармацевтическая композиция также известна в данной области техники в качестве фармацевтического препарата. Следует понимать, что значение рН фармацевтической композиции, которая должна быть подвергнута повторному разведению, равно величине рН, которое получается после измерения в повторно разведенной композиции, полученной в результате повторного разведения в предписанной для повторного разведения жидкости при комнатной температуре.
Термин "фармацевтически приемлемый", использованный в данном описании, означает удовлетворение требованиям обычных фармацевтических применений, т.е. не вызывание никаких серьезных неблагоприятных событий у пациентов и т.д.
Термин "буфер", использованный в данном описании, относится к химическому соединению в фармацевтической композиции, которое снижает тенденцию к изменению рН композиции в течение времени, что в противном случае может происходить в результате химических реакций. Буферы включают химические соединения, такие как фосфат натрия, трис, глицин и цитрат натрия.
Термин "консервант", использованный в данном описании, относится к химическому соединению, которое добавляют к фармацевтической композиции для предупреждения или замедления микробиологической активности (роста и метаболизма). Примерами фармацевтически приемлемых консервантов являются фенол, мета-крезол и смесь фенола и мета-крезола.
Термин "стабилизатор", использованный в данном описании, относится к химическим соединениям, добавленным к пептидсодержащим фармацевтическим композициям для того, чтобы стабилизировать пептид, т.е. увеличить срок годности и/или время использования таких композиций. Примерами стабилизаторов, используемых в фармацевтических композициях, являются L-глицин, L-гистидин, аргинин, глицилглицин, этилендиамин, цитрат, EDTA (этилендиаминтетрауксусная кислота), полиэтиленгликоль, карбоксиметилцеллюлоза и поверхностно-активные вещества и антиоксиданты, подобные альфа-токоферолу и L-аскорбиновой кислоте.
Термин "поверхностно-активное вещество", использованный в данном описании, относится к любому веществу, в частности, детергенту, который может адсорбироваться на поверхностях и границах раздела фаз, типа жидкость-воздух, жидкость-жидкость, жидкость-контейнер или жидкость-любое твердое вещество. Поверхностно-активное вещество может быть выбрано из детергента, такого как этоксилированное касторовое масло, полигликозилированные глицериды, ацетилированные моноглицериды, сложные эфиры жирных кислот и сорбитана, полисорбат, как например, полисорбат-20, полоксамеры, как например, полоксамер 188 и полоксамер 407, сложные эфиры жирных кислот и полиоксиэтиленсорбитана, производные полиоксиэтилена, как например, алкилированные и алкоксилированные производные (твины, например Твин-20 или Твин-80), моноглицериды или их этоксилированные производные, диглицериды или их полиоксиэтиленовые производные, глицерин, холевая кислота или ее производные, лецитины, спирты и фосфолипиды, глицерофосфолипиды (лецитины, кефалины, фосфатидилсерин), глицерогликолипиды (галактопиранозид), сфингофосфолипиды (сфингомиелин) и сфингогликолипиды (церамиды, ганглиозиды), DSS (докузат натрия, регистрационный номер по CAS (Chemical abstract service) [577-11-7]), докузат кальция (регистрационный номер по CAS [128-49-4]), докузат калия (регистрационный номер по CAS [7491-09-0]), SDS (додецилсульфат натрия) или лаурилсульфат натрия, дипальмитоил-фосфатидиловая кислота, каприлат натрия, конъюгаты желчных кислот и их солей и глицина или таурина, урсодезоксихолевая кислота, холат натрия, дезоксихолат натрия, таурохолат натрия, гликохолат натрия, N-гексадецил-N,N-диметил-3-аммонио-1-пропансульфонат, анионные (алкил-арил-сульфонаты) моновалентные поверхностно-активные вещества, пальмитоил-лизофосфатидил-L-серин, лизофосфолипиды (например, сложные 1-ацил-sn-глицеро-3-фосфатные эфиры этаноламина, холина, серина или треонина), алкил -, алкоксил - (сложный алкиловый эфир), алкокси - (простой алки