Антигипоксическое средство
Иллюстрации
Показать всеПредложено антигипоксическое средство, отличающееся тем, что представляет собой комплексное соединение двухвалентного цинка, замещенного 3-гидроксипиридина и диорганодихалькогенида - гексакис(3-гидрокси-2-этил-6-метилпиридинато)[трис(дибензилдиселенидо)]дицинк(II) пентадека-семигидрат формулы [Zn(II)]2A6B3·15,5H2O (он же πQ1983). Показано: эффективность эталонных антигипоксантов (амтизола, бемитила) заметно уступала πQ1983 по всем критериям резистентности к остро нарастающей гипоксии; в отличие от эталонных антигипоксантов, πQ1983 остается эффективным после приема внутрь; снижает ректальную температуру, замедляет частоту сердечных сокращений, снижает частоту и глубину дыхания, уменьшает потребность организма в кислороде; увеличивает в условиях формирования остро нарастающего гипоксического состояния период активной деятельности коры головного мозга. 4 ил., 3 табл.
[Zn(II)]2А6В3·15,5H2O,
где A:
а B:
Реферат
Изобретение относится к химическим веществам, обладающим антигипоксической активностью, которые могут найти применение в области медицины, в частности в фармакологии, нормальной физиологии и патофизиологии.
Перспективным способом повышения устойчивости человека к гипоксии является ограничение уровня его физической активности, что предопределяет экономный расход доступного для дыхания кислорода, повышение эффективности использования энергетического ресурса. Это может быть достигнуто путем применения энергостабилизирующих веществ, относящихся к классу антигипоксантов.
К наиболее известным на сегодняшний день представителям класса энергостабилизирующих веществ относят производные тиомочевины - амтизол и бемитил. Названные вещества признаны Фармакологическим комитетом Минздрава РФ в качестве эталонных и широко используются для проведения сравнительных исследований путем сопоставления их антигипоксического эффекта с таковым вновь синтезированных химических соединений.
Амтизол (3,5-диамино-1,2,4-тиадиазол) уменьшает потребность организма в кислороде посредством ослабления дыхательного контроля в тканях, торможения нефосфорилирующих видов окисления, повышения степени сопряжения окисления с фосфорилированием в митохондриальной окислительной цепи. Метаболические эффекты вещества частично обусловлены его способностью активировать антиоксидантные системы, что способствует стабилизации мембранных и внутриклеточных процессов. Ранее применение амтизола было затруднено из-за нестабильности его ампульных растворов. В настоящее время создана стабильная лекарственная форма амтизола в виде стерильного лиофилизированного порошка для инъекций.
Бемитил (2-этилтиобензимидазол), как и амтизол, демонстрирует феномен энергосбережения, что, по-видимому, связано с усилением образования митохондриальных белков, повышением сопряжения между процессами окисления и фосфорилирования, а также с активацией антиоксидантных ферментов. К существенным недостаткам бемитила и амтизола следует отнести их неэффективность при приеме внутрь.
Таким образом, на сегодняшний день арсенал антигипоксических веществ, которые могли бы быть использованы, прежде всего, в практике экстремальной медицины, невелик. Большинство фармакологических веществ, зарекомендовавших себя как корректоры острых гипоксических состояний, обладают серьезными побочными эффектами, нередко токсичны и теряют свой эффект в случае их приема per os (внутрь).
Задачей настоящего изобретения является расширение арсенала эффективных отечественных препаратов, обладающих антигипоксической активностью за счет новых комплексных химических соединений, относящихся к категории так называемых физиологически совместимых антиоксидантов, на основе биометаллов и органических лигандов, с возможностью их применения per os.
Данная задача решается тем, что предложено антигипоксическое средство, представляющее собой комплексное соединение двухвалентного цинка, замещенного 3-гидроксипиридина и диорганодихалькогенида - гексакис(3-гидрокси-2-этил-6-метилпиридинато)[трис(дибензилдиселенидо)]дицинк(II) пентадекасемигидрат формулы
[Zn(II)]2A6B3·15,5H2O,
где A:
а B:
Данное соединение (лабораторный шифр вещества - πQ1983), ранее не описанное в патентной и технической литературе, синтезировано в Российском онкологическом научном центре им. Н.Н.Блохина РАМН.
Синтез гексакис(3-гидрокси-2-этил-6-метилпиридинато)[трис(дибензилдиселенидо)]дицинк(II) пентадекасемигидрата (вещество πQ1983) можно осуществить любым известным в литературе методом синтеза комплексных соединений. В данной патентной разработке описан способ, не сопровождающийся образованием побочных или летучих продуктов.
Синтез осуществляется следующим образом. Смешивают 2,08 г 3-гидрокси-2-этил-6-метилилпиридина, 2,58 г дибензилдиселенида и 1,11 г ацетата цинка дигидрата в смеси 20 мл этилового спирта и 5 мл деионизованной воды и перемешивают при температуре 60-70°С в течение трех часов. Затем отгоняют растворители в вакууме (10-15 торр) и доводят остаток до постоянного веса. Выход 5,70 г. Т. разл. 117-119°С. Найдено, %: C 47,63; H 6,17, N 3,52. Вычислено, %: C 47,97; H 6,04; N 3,73.
Соединение представляет собой порошок желтовато-коричневого цвета, слабо растворимый в воде, растворимый в спирте. Молекулярная масса 2242,318 D.
Вещество πQ1983 было подвергнуто биологическим испытаниям в условиях формирования у животных (мышь, кошка) состояния остро нарастающей экзогенной гипоксии, где было впервые выявлено его антигипоксантное действие.
Опыты были поставлены на 67-и мышах-самцах массой 20-25 г и 24-х кошках-самцах массой 3,5-4,0 кг. Количество мышей в контрольных и опытных группах составляло не менее 7 особей. Все экспериментальные животные содержались в обычных условиях вивария. Эксперименты были проведены в соответствии с международными стандартами по гуманному обращению с лабораторными животными.
Сравнение антигипоксических эффектов гексакис(3-гидрокси-2-этил-6-метилпиридинато)[трис(дибензилдиселенидо)]дицинк(II) пентадекасемигидрата и эталонных антигипоксантов (амтизол, бемитил) проводили на мышах, подвергавшихся воздействию острой гипоксии с гиперкапнией (ОГ+Гк). За 60 минут до помещения мышей в условия эксперимента животным опытных групп вводили внутрибрюшинно или внутрь по 0,3 мл водного раствора изучаемого вещества в виде мелкодисперсной суспензии, приготовленной с добавлением твина-80. Животным соответствующих контрольных групп вводили по 0,3 мл растворителя. У всех мышей перед введением веществ и непосредственно пред помещением в условия ОГ+ГК измеряли ректальную температуру электротермометром.
Острую гипоксию с гиперкапнией у мышей моделировали путем их помещения в стеклянные герметичные емкости объемом 0,25 л (Методические рекомендации по экспериментальному изучению препаратов, предлагаемых для клинического изучения в качестве антигипоксических средств. Под. ред. Л.Д.Лукьяновой. - М., 1990. - 18 с.). В ходе опыта регистрировали электрокардиограмму (ЭКГ) - кривую электрической активности миокарда и пневмобарограмму (ПБГ) - кривую дыхания, что позволяло объективизировать оценку резистентности животных к ОГ+Гк. Параллельно определяли динамику потребления мышами кислорода с помощью электронного газоанализатора (АНКАТ-7631М, Россия).
Введение гексакис(3-гидрокси-2-этил-6-метилпиридинато)[трис (дибензилдиселенидо)]дицинк(II) пентадекасемигидрата внутрибрюшинно и внутрь в дозе 50 мг/кг сопровождалось существенным изменением ректальной температуры, которая через 60 мин уменьшалась соответственно на 6,4 и 5,2°С. В контроле 37,8°С и 37,5°С (табл.1).
К этому моменту частота следования кардиоциклов по данным регистрации ЭКГ замедлялась с 625±14/мин до 368±12/мин (после внутрибрюшинного введения) и с 643±18/мин до 464±15/мин (после введения внутрь), частота дыхательных волн уменьшалась соответственно с 343±9/мин до 178±8/мин и с 376+10/мин до 202±9/мин (табл.1).
Понижение ректальной температуры в сочетании с динамикой ЭКГ и ПБГ позволило сделать заключение о замедлении метаболизма у мышей опытных групп по сравнению с контрольными значениями.
В условиях ОГ+Гк продолжительность жизни мышей по данным регистрации дыхательной активности (появление первого агонального вдоха) составила для обеих контрольных групп соответственно 34,5±2,3 мин и 35,2±2,9 мин (табл.2).
На фоне действия вещества πQ1983 устойчивость мышей к гипоксии значительно возрастала (табл.2 и 3). Так, после его внутрибрюшинного введения в дозе 50 мг/кг продолжительность жизни мышей увеличивалась до 147,3±8,4 мин, т.е. в 4 раза. В свою очередь после введения изученного вещества внутрь в той же дозе показатель увеличивался в 3,5 раза и составлял 121,4±6,3 мин.
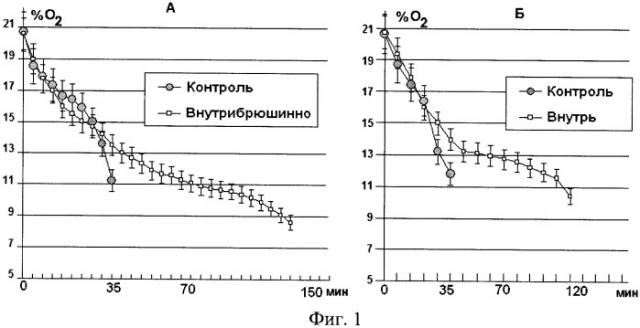
В ходе изучения динамики потребления мышами кислорода было установлено, что на фоне действия гексакис(3-гидрокси-2-этил-6-метилпиридинато)[трис(дибензилдиселенидо)]дицинк(II) пентадекасемигидрата скорость потребления кислорода животными опытных групп была значительно ниже, чем в контрольных, что обеспечило возможность продолжительного сохранения активного состояния жизненно-важных функциональных систем организма (сердечно-сосудистой, дыхательной) и способствовало повышению выживаемости животных в условиях непрерывно ухудшающихся характеристик потребляемого воздуха (фиг.1).
После помещения животных в условия ОГ+Гк скорость потребления кислорода в обеих опытных группах также была существенно ниже в сравнении с контрольными показателями, что способствовало экономному расходованию его наличного запаса по мере формирования у мышей критического состояния. В частности, спустя 60 мин после введения вещества внутрь скорость потребления кислорода составляла всего 45% от контрольного показателя.
Следует подчеркнуть, что эффективность эталонных антигипоксантов (амтизола, бемитила), как видно из таблиц 2 и 3, выявлялась только после их внутрибрюшинного введения и заметно уступала веществу πQ1983 по всем критериям резистентности мышей к остро нарастающей гипоксии.
С целью подтверждения факта наличия антигипоксической активности гексакис(3-гидрокси-2-этил-6-метилпиридинато)[трис(дибензил-диселенидо)]дицинк(II) пентадекасемигидрата были выполнены опыты на животных с более высоким, чем у мышей уровнем организации ЦНС - на кошках.
Вещество πQ1983 кошкам вводили в желудок через эластичный зонд в дозе 50 мг/кг, предварительно растворив в 3-х мл дистиллированной воды за 3 часа до помещения в условия ОГ+Гк.
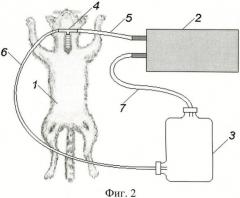
Состояние острой экзогенной нормобарической гипоксии с гиперкапнией у кошек моделировали путем создания замкнутого контура, включавшего в себя собственно животное, аппарат искусственной вентиляции легких и дыхательную емкость объемом 5 л (фиг.2).
Из дыхательной емкости воздух порционно забирался с помощью аппарата искусственной вентиляции легких и затем через эластичную трубку ритмично нагнетался в легкие кураризированного животного. Во время пассивного выдоха, отработанный воздух поступал по отводящей трубке обратно в емкость (Способ моделирования гипоксии с гиперкапнией у животного. Патент РФ №2251158).
Устойчивость животных к состоянию ОГ+Гк оценивали по динамике изменения усредненных соматосенсорных вызванных потенциалов. Предварительный этап проходил в условиях этаминал-натриевого наркоза (40 мг/кг внутрибрюшинно). Проекцию соматосенсорной коры определяли по данным Kuypers (1960) и Kusava et al. (1966). Для монополярного отведения вызванных потенциалов использовали игольчатые электроды. Индифферентный электрод укрепляли в костях лобной пазухи. Амплитуда раздражающих импульсов не превышала 5-9 В (0,05-0,10 мс).
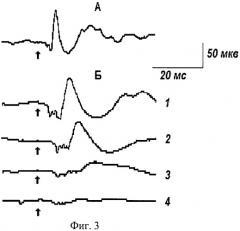
На фиг.3А представлен исходный усредненный вызванный потенциал на одиночное раздражение лучевого нерва. Видно, что по мере перехода животного из стартового состояния в состояние ОГ+Гк (фиг.3-Б - 1, 2, 3, 4) амплитуда всех компонентов вызванного потенциала достоверно уменьшается, при этом их длительность значимо увеличивается. Наиболее отчетливые изменения вызванного потенциала отмечали в его первичной негативной волне.
Было принято, что уменьшение первичной негативной волны в пределах 90-55% от исходного значения характеризует легкую 1-ю стадию ОГ+Гк (фиг.3-Б-1). Уменьшение первичной негативной волны в пределах 50-30% от исходной величины характеризует среднюю 2-ю стадию ОГ+Гк (фиг.3-Б-2). Уменьшение первичной негативной волны в пределах 25-10% от исходного уровня характеризует глубокую 3-ю стадию ОГ+Гк (фиг.3-Б-3). Наконец, уменьшение первичной негативной волны в пределах от 5% вплоть до полного ее исчезновения характеризует предтерминальную 4-ю стадию ОГ+Гк (фиг.3-Б-4).
В наших экспериментах легкая стадия гипоксии у животных контрольной группы (n=11) обычно развивалась через 7,3±1,2 мин после инициации модельных условий, средняя стадия - спустя 34,1±3,3 мин, глубокая - через 50,8±3,5 мин, тогда как предтерминальная стадия развивалась, как правило, через 55,8±3,8 мин.
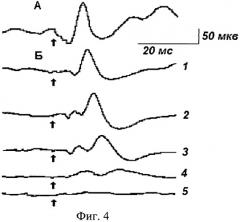
В серии опытов с применением в качестве антигипоксанта гексакис(3-гидрокси-2-этил-6-метилпиридинато)[трис(дибензилдиселенидо)]ди-цинк(II) пентадекасемигидрата, спустя 3 часа после его введения внутрь (n=13) было отмечено уменьшение амплитуды первичной негативной волны на 28%, увеличение ее латентного периода на 34% (фиг.4-А, Б-1).
Как было установлено, в соответствии с динамикой первичной негативной волны состояние ОГ+Гк у кошек на фоне вещества πQ1983 (опытная группа) развивается значительно медленнее. Так, легкую (1-ю) стадию гипоксии регистрировали в среднем через 12,4±2,3 мин после помещения животных в условия опыта. Среднюю (2-ю) стадию ОГ+Гк регистрировали через 40,7±3,9 мин, глубокую (3-ю) - через 86,1±6,3 мин. Переход в предтерминальную (4-ю) стадию отмечали значительно позже в сравнении с контролем, как правило, спустя 154,0±13,6 мин от момента помещения животных в модельные условия.
По итогам описанной серии опытов было установлено, что на фоне действия гексакис(3-гидрокси-2-этил-6-метилпиридинато)[трис(дибен-зилдиселенидо)]дицинк(II) пентадекасемигидрата продолжительность активного функционирования соматосенсорной коры кошек в условиях ОГ+Гк увеличивалась в 2,9 раза в сравнении с группой контроля.
В ходе представленного исследования было достоверно доказано, что вещество πQ1983 обладает антигипоксантными свойствами. По эффективности и широте действующих доз изученное вещество значительно превосходит эталонные антиоксиданты амтизол и бемитил на модели ОГ+Гк, причем в отличие от последних оказывает защитное действие и после приема внутрь. Механизм действия гексакис(3-гидрокси-2-этил-6-метилпиридинато)[трис(дибензилдиселенидо)]дицинк(11) пентадекасеми-гидрата, вероятно, связан с обратимым угнетением энергетического обмена, что подтверждается снижением ректальной температуры у мышей, замедлением частоты работы сердца, уменьшением объемов дыхания, а также снижением потребности животных в кислороде. Следует подчеркнуть, что защитный эффект вещества πQ1983 наблюдался не только на мышах, но и на кошках.
Таким образом, выявлено, что комплексное соединение двухвалентного цинка, замещенного 3-гидроксипиридина и диорганодихалькогенида (селенсодержащего лиганда) - гексакис(3-гидрокси-2-этил-6-метилпиридинато)[трис(дибензилдиселенидо)]дицинк(II) пентадекасемигидрат (вещество πQ1983):
1. увеличивает продолжительность жизни мышей в условиях остро нарастающей экзогенной гипоксии после внутрибрюшинного введения и введения внутрь;
2. превосходит по эффективности препараты сравнения - антигипоксанты амтизол и бемитил - при их применении в равных дозировках. Причем, в отличие от эталонных антигипоксантов, вещество πQ1983 остается эффективным после приема внутрь;
3. снижает ректальную температуру, замедляет частоту сердечных сокращений, снижает частоту и глубину дыхания, уменьшает потребность организма в кислороде;
4. увеличивает в условиях формирования остро нарастающего гипоксического состояния период активной деятельности коры головного мозга.
В связи с этим гексакис(3-гидрокси-2-этил-6-метилпириди-нато)[трис(дибензилдиселенидо)]дицинк(II) пентадекасемигидрат может найти применение как перспективный антигипоксант при угрозе развития различных острых гипоксических состояний.
Антигипоксическое средство
| Таблица 1 | |||
| Группы мышей | Температура, °С | ЭКГ (частота), цикл/мин | ПБГ (частота), волн/мин |
| Контроль 1 | 37,8 | 625±14 | 343±9 |
| Внутрибрюшинно | 31,4 | 368±12 | 178±8 |
| Контроль 2 | 37,5 | 643±18 | 376±10 |
| Внутрь | 32,3 | 464±15 | 202±9 |
| Таблица 2 | |||||
| № n/n | Вещество | Доза мг/кг | Продолжительность жизни (мин) | n | p |
| 1 | Контроль | - | 34,5±2,3 | 7 | - |
| 2 | πQ1983 | 50 | 147,3±8,4 | 8 | p<0,05 |
| 3 | Амтизол | 50 | 67,6±5,4 | 9 | p<0,05 |
| 4 | Бемитил | 50 | 58,5±3,0 | 9 | p<0,05 |
| Таблица 3 | |||||
| № n/n | Вещество | Доза мг/кг | Продолжительность жизни (мин) | n | p |
| 1 | Контроль | - | 35,2±2,9 | 7 | - |
| 2 | πQ1983 | 50 | 121,4±6,3 | 10 | p<0,05 |
| 3 | Амтизол | 50 | 37,6±3,1 | 9 | p>0,05 |
| 4 | Бемитил | 50 | 34,5±3,5 | 8 | p>0,05 |
Антигипоксическое средство, отличающееся тем, что представляет собой комплексное соединение двухвалентного цинка, замещенного 3-гидроксипиридина и диорганодихалькогенида - гексакис(3-гидрокси-2-этил-6-метилпиридинато)[трис(дибензилдиселенидо)]дицинк(II) пентадекасемигидрат формулы[Zn(II)]2А6В3·15,5H2O,где A: а B: