Производные 6-1н-имидазохиназолина и хинолина - ингибиторы мао для лечения депрессии
Иллюстрации
Показать всеДанное изобретение относится к области фармацевтики и медицины и касается применения соединений формулы (I), их фармацевтически приемлемых солей и сольватов для лечения депрессии и родственных расстройств, болезни Паркинсона, токсикомании, толерантности к морфину и зависимости от морфина. 6 з.п. ф-лы, 5 табл., 33 пр.
Реферат
Данное изобретение относится к производным 6-(1Н-имидазо-1-ил)-2-арил- и 2-гетероарилхиназолина и хинолина, действующим как ингибиторы моноаминоксидазы (МАО) и лиганды имидазолинового рецептора, к способу их получения и к применению таких соединений, их фармацевтически приемлемых солей и сольватов и соответствующих фармацевтических композиций для фармакологического лечения депрессии и родственных расстройств, болезни Паркинсона, токсикомании, толерантности к морфину и зависимости от морфина.
Уровень техники
Депрессия представляет собой общее и опасное расстройство настроения, которое воздействует на эмоцию, познавательную способность и поведение; вместо четко определенного заболевания депрессия охватывает широкий спектр расстройств, включающих от ощущения несчастья до более тяжелых расстройств, приводящих к нетрудоспособности, таких как клиническая депрессия (также называемая большим депрессивным расстройством или униполярной депрессией), дистимическое расстройство, биполярное расстройство, атипическая депрессия, психотическая депрессия, послеродовая депрессия и сезонное аффективное расстройство (A. Doris et al. Depressive illness, Lancet, 1999, 354, 9187, 1369). Согласно Всемирной организации здравоохранения (ВОЗ/WHO), депрессия характеризуется пониженным настроением, потерей интереса или удовольствия, ощущениями виновности или низкого самоуважения, нарушениями сна и/или аппетита, слабой сконцентрированностью. Большое депрессивное расстройство, также известное как большая депрессия, представляет собой самый обычный тип депрессии с приблизительно 10-25% риском в течение жизни для населения промышленных стран. Оно характеризуется комбинацией симптомов и состояний с потерей трудоспособности, которые серьезно мешают работе и семейной жизни, традиционным особенностям (привычкам) ко сну и приему пищи и всему здоровью пациента. Дистимическое расстройство, также называемое дистимией, характеризуется длительными менее тяжелыми симптомами, которые могут не лишать человека трудоспособности, но могут мешать хорошему самочувствию человека, таким образом влияя на социальную жизнь. Биполярное расстройство, также называемое маниакально-депрессивным заболеванием, характеризуется чередующимися изменениями настроения от экстремальных высоких уровней (например, мания) до экстремально низких уровней (например, депрессия). Атипическая депрессия представляет собой подтип дистимии и большой депрессии, характеризующийся реактивностью настроения и вегетативными симптомами, подобными перееданию и чрезмерному сну. Психотическая депрессия имеет место, когда тяжелое депрессивное заболевание сопровождается некоторой формой психоза, галлюцинациями и бредом. Послеродовая депрессия, которой подвержены 10-15% женщин, диагностируется, если большой депрессивный эпизод происходит в пределах одного месяца после рождения ребенка, данное заболевание имеет симптомы, аналогичные клинической депрессии. Сезонное аффективное расстройство характеризуется началом депрессивного заболевания в течение зимних месяцев. Депрессивные и тревожные симптомы часто перекрываются. Тревожные расстройства включают посттравматическое стрессовое расстройство, паническое расстройство, агорафобию, социальную фобию, обсессивно-компульсивное расстройство. Паническое расстройство классифицируется как тревожное расстройство, так как тревога является преобладающим симптомом, панические атаки представляют собой последовательность дискретных эпизодов панического расстройства. Развитие тяжелых фобических симптомов соответствует эскалации по частоте и интенсивности панических атак, ведущих к тяжелому с потерей трудоспособности расстройству, которое влияет на профессиональную, социальную и семейную жизнь пациента. Депрессия может представлять собой основное состояние или может сосуществовать с другими серьезными медицинскими заболеваниями, такими как заболевание сердца, удар, рак, диабет и болезнь Паркинсона. Клинические исследования показали, что люди, которые имеют депрессию кроме другого серьезного медицинского заболевания, имеют тенденцию к проявлению более тяжелых симптомов как депрессии, так и медицинского заболевания, более тяжелой адаптации к их медицинскому состоянию и более высоким медицинским затратам, чем затраты без сопутствующей депрессии. Исследования подтвердили, что лечение депрессии может также помогать в улучшении результата лечения сопутствующего заболевания. Злоупотребление алкоголем, табаком и лекарственными средствами также может сосуществовать с депрессией. Фактически, статистическое изучение показало, что сосуществование расстройств настроения распространено среди людей, вовлеченных в злоупотребление алкоголем, табаком и лекарственными средствами. Депрессивные расстройства являются экстремально общими, воздействующими ежегодно на примерно 120 миллионов человек в мире. Согласно ВОЗ депрессия является ведущей причиной нетрудоспособности, и она представляет собой четвертый наиболее важный вклад в глобальное бремя болезни. Заболеваемость и смертность среди пациентов с депрессией выше, чем среди обычных пациентов. Согласно Национальному институту психического здоровья (National Institute of Mental Health (NIMH)) недавние исследования показали, как лица с большой депрессией с вероятностью более чем в четыре раза страдали бы от сердечного приступа по сравнению с контролями без депрессии. Согласно NIMH прямые и непрямые социальные затраты на депрессию доходили в течение 1990 года до примерно 30 миллиардов долларов США, при этом непрямые затраты выражаются сниженной производительностью рабочих и нарушением персональных, профессиональных и семейных взаимоотношений. Аналогичная оценка в Европе в течение 2004 года показала социальные затраты в 118 миллиардов евро, причем депрессия выделяется в качестве самого дорогостоящего расстройства головного мозга в Европе.
Согласно моноаминовой гипотезе, депрессия вызвана дисбалансом данных нейротрансмиттеров в головном мозге. Одна фармакологическая стратегия, нацеленная на преодоление данного дисбаланса, состоит в ингибировании фермента моноаминоксидазы (МАО; ЕС 1.4.3.4). Моноаминовые нейротрансмиттеры: серотонин (5-НТ), норэпинефрин (NE) и допамин широко распределены в мозге и включены в регуляцию настроения, познавательной способности, сна, страха и социального поведения. Дисфункции в механизмах контролирования данных нейротрансмиттеров часто связаны с самыми главными психиатрическими расстройствами, и лекарственные средства, нацеленные на моноаминовые нейротрансмиттеры, были исследованы и широко исследованы для лечения депрессии. МАО представляет собой FAD-зависимый фермент (флавопротеин), расположенный в основном во внешних митохондриальных мембранах нейронов и глиальных клетках, а также в других клетках периферии (т.е. эпатоциты), где она катализирует окислительное деаминирование нейротрансмиттера, ксенобиотических и эндогенных аминов. Антидепрессантный подход для ингибиторов МАО основан на факте, что ингибированием активности фермента предотвращена деактивация данных эндогенных нейротрансмиттеров, таким образом повышается как их синаптическая концентрация, так и длительность действия. Существуют две изоформы МАО: МАО-А, которая предпочтительно деаминирует серотонин, норэпинефрин и эпинефрин, а также амины, присутствующие в пище, подобные тирамину, и МАО-В, которая предпочтительно деаминирует допамины, фенилэтиламины и бензиламины (B.H. Moussa, British J. Pharmacology, 2006, 147, S287-296). Первое поколение ингибиторов МАО, неселективно и необратимо блокировавших обе изоформы МАО, приводило к побочным эффектам, таким как гипертонический криз (также называемый “сырный синдром”), особенно из-за ингибирования МАО-А, что блокирует каскад запуска метаболизма тирамина, в котором избыточные количества норэпинефрина могут вести к гипертоническому кризу. Второе поколение обратимых ингибиторов МАО-А, таких как моклобемид и брофаромин, проявляло в клинических опытах потенциальную антидепрессантную активность, но незначительную предрасположенность вызывать после проглатывания тирамина гипертонический криз в терапевтической дозировке (Bonnet U., CNS Drug Review, 2003, 9, 1, 97-140). Это потому, что обратимость допускает конкуренцию и таким образом проглоченный тирамин способен вытеснять ингибитор от фермента. Селективные обратимые ингибиторы МАО-В не вызывают гипертонический криз. Недавние исследования подтверждают, что тревожные расстройства также могут быть связаны с дисфункцией нейротрансмиссии серотонина и дисбалансами в метаболизме катехоламина. Эффективность ингибиторов МАО в лечении тревожных расстройств показана несколькими клиническими опытами и отдельными сообщениями (J. Clin. Psychiatry, 2006, 67, S12:20-26). Ингибиторы МАО-В пролонгируют активность как эндогенно, так и экзогенно полученного допамина, что делает их вариантом либо для монотерапии на ранней стадии болезни Паркинсона (PD), либо для дополнительной терапии у пациентов, лечившихся леводопой. Эффективность данного подхода к МАО-В для лечения PD клинически доказана опытами, включающими два утвержденных в США ингибитора МАО-В, расагилин и селегилин, а также использование сафинамида при присутствии в фазе III. Все данные лекарственные средства давали симптоматическое ослабление боли при использовании в качестве монотерапии или вспомогательной терапии, причем еще проявляют потенциал в качестве агентов, модифицирующих заболевание.
Имидазолиновые рецепторы, семейство неадренергических рецепторов, впервые идентифицированные Bousquet в 1984, широко распределены как в центральной, так и в периферической системе. Были идентифицированы три основных подкласса имидазолиновых связывающих сайтов (IBS): I1-IBS, который предпочтительно связывает клонидин, расположен на мембране нейронов и включен в центральное регулирование давления крови, I2-IBS, который предпочтительно связывает идазоксан, расположен преимущественно во внешней мембране митохондрии, и I3-IBS, который был идентифицирован в поджелудочной железе. Исследования по выделению белка показали, что МАО-А и МАО-В, обе, представляют собой I2-связывающие белки. Дополнительные фармакологические исследования показывали, как агонисты в I2-IBS способны ингибировать активность МАО, таким образом предоставляя альтернативный подход к ингибиторам МАО для контролирования активности как МАО-А, так и МАО-В. На нескольких моделях животных было показано, как лиганды I2-IBS способны модулировать центральные моноаминовые уровни, а также недавно было показано, как изменения в плотности I2-IBS могут быть повышены у пациентов с депрессией. Агмантин представляет собой эндогенный амин, образуемый при декарбоксилировании аргинина, который недавно предложен в качестве нейротрансмиттера в ЦНС/CNS. Недавно для агмантина и других селективных агонистов I2-IBS, таких как 2-BFI (2-бензофуранилимидазолин) и норгарман (β-карболин), были опубликованы антидепрессантные свойства на некоторых моделях животных, подтверждающие таким образом in vivo, что I2-имидазолиновый рецептор представляет собой новую фармакологическую мишень для лечения депрессии и родственных расстройств (MP Zeadan, Eur. J. Pharmacology, 2007, 565, 1-3, 125-31).
Синдром отмены наркотиков и алкоголя часто сопровождается атипической депрессией, которая вызывает возобновление потребления алкоголя и наркотиков, в соответствии с этим лечение антидепрессантами, включающее лечение ингибиторами МАО, в целом можно рассматривать как фармакологический подход для лечения злоупотребления наркотиками и алкоголем. Однако в некоторых случаях ингибиторы МАО, как было показано доклиническими и клиническими опытами, даже лучше чем другие лекарственные антидепрессанты по нескольким причинам.
Никотин вызывает толерантность и привыкание действием на центральные допаминергические пути метаболизма, таким образом, только 50% снижение в потреблениях никотина может запускать абстинентные симптомы, такие как тревожность, депрессивные симптомы, расстройства познавательной способности, расстройства сна. Применение ингибиторов МАО в качестве новой фармакотерапии для лечения зависимости от курения основано как на компенсационном действии данных лекарственных средств на допаминергический путь, так и на антидепрессивных эффектах, что должно исключать эпизоды ремиссии (T.P. George et al., Clin. Pharmacol. Ther., 2008, 83, 4, 619-21).
Злоупотребление кокаином представляет собой серьезную проблему для здоровья во многих частях мира, до настоящего времени нет утвержденных фармакологических терапий, чтобы преодолеть кокаиновую зависимость. Доклинические изучения наводят на мысль, что кокаиновая зависимость может быть обусловлена ингибированием транспортера допамина, проявляемым кокаином, который вызывает допаминовый усиленный эффект. Ингибиторы МАО и особенно ингибиторы МАО-В, как показано предварительными опытами с ингибитором МАО-В селегилином, повышая уровни моноаминов, могут помогать в преодолении кокаиновой зависимости путем противодействия снижению уровня допамина вследствие синдрома отмены наркотика (E.J. Houtsmeller, Psychopharmacology, Berl., 2004, 172, 1, 31-40).
Доклинические модели главное внимание уделяли тому, как лиганд I2-IBS усиливает анальгезирующее действие морфина и ингибирует толерантность и зависимость от опиоидов (A. Mirales et al., Eur. J. Pharmacology, 2005, 22, 518, 2-3, 234-242). Агмантин и 2-BFI наряду с другими агонистами I2-IBS были показаны для потенцирования аналгезии, вызываемой опиоидами, и ослабления развития толерантности и зависимости, в то время как антагонист I2-IBS, такой как идазоксан, полностью обращал данные эффекты. Интересно, что аналогичные эффекты потенцирования морфиновой аналгезии и предотвращения толерантности и зависимости наблюдались также в моделях на животных с ингибиторами МАО (A. Wasik et al., J. Physiol. Pharmacol., 2007, 58, 2, 235-52; K.Grasing et al., Behav. Pharmacol., 2005, 16, 1, 1-13), и подтверждены клинически для моклобемида, обратимого ингибитора МАО-А (G. Vaiva, Prog. Neuropsychopharmacol. Biol. Psychiatry, 2002, 26, 3, 609-11).
Описание изобретения
В своей предыдущей патентной заявке WO2008/014822 авторы описали производные 2-арил- и 2-гетероарил-6-(1Н-имидазо-1-ил)хиназолина и хинолина для лечения боли и воспалительных нарушений. Позже авторы открыли, что производные 2-арил- и 2-гетероарил-6-(1Н-имидазо-1-ил)хиназолина и хинолина формулы (I) удивительным образом наделены отличными свойствами по ингибированию МАО и являются потенциальными агонистами I2-IBS. В соответствии с этим, данное изобретение относится к применению соединений формулы (I), их фармацевтически приемлемых солей и/или сольватов и соответствующих фармацевтических композиций для фармакологического лечения депрессии, включающей большое депрессивное расстройство, дистимическое расстройство, биполярное расстройство типа II, маниакальную депрессию, тревожные расстройства, включающие посттравматическое стрессовое расстройство, паническое расстройство.
Согласно целесообразности, сообщенной в уровне техники, данное изобретение еще относится к применению соединений формулы (I), их фармацевтически приемлемых солей и/или сольватов и соответствующих фармацевтических композиций для фармакологического лечения болезни Паркинсона. В другом варианте осуществления данное изобретение относится к применению соединений формулы (I), их фармацевтически приемлемых солей и/или сольватов и соответствующих фармацевтических композиций из них для фармакологического лечения синдромов отмены и чтобы избежать эпизодов ремиссии по алкоголизму, курению и наркомании, включая злоупотребление кокаином. В другом варианте осуществления данное изобретение относится к применению соединений формулы (I), их фармацевтически приемлемых солей и/или сольватов и соответствующих фармацевтических композиций, где соединения формулы (I) использованы индивидуально или в комбинации с морфином или другими опиоидными лекарственными средствами для усиления опиоидного фармакологического действия и/или для снижения дозировки опиоидного лекарственного средства. В другом варианте осуществления данное изобретение относится к применению соединений формулы (I), их фармацевтически приемлемых солей и/или сольватов и соответствующих фармацевтических композиций из них для лечения толерантности и зависимости из-за применения опиоидных лекарственных средств.
Соединения формулы (I):
в которой
- Х независимо выбран из -СН группы или атома азота (-N);
- W независимо выбран из арильной группы, гетероарильной группы или гетероарильной группы формулы II:
- когда W представляет собой арильную группу, он является незамещенным или замещенным фенилом с одним или более заместителями, независимо выбираемыми из галогена (-F, -Cl, -Br), трифторметила (-CF3), алкила (-R2), гидроксила (-OH), алкокси (-OR2), трифторметокси (-OCF3), циано (-CN), карбоксамидо (-CONHR3, или -NHCOR3, или -CONR2R3, или -NR2COR3), карбонила (-CO-R3), алкилтио или тиола (-SR3), сульфинила (-SOR3) и сульфонила (-SO2R3), причем R2 и R3 принимают значения, определенные ниже;
- когда W представляет собой гетероарильную группу, он независимо выбран из следующих гетероциклов с пятью или шестью атомами: 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, пиррол-2-ил, пиррол-3-ил, пиридин-4-ил, пиридин-3-ил, пиримидин-4-ил. Гетероциклическое кольцо может быть замещено одним или двумя заместителями, независимо выбираемыми из R1, алкокси (-OR2) или гидрокси (-OH), причем R1 и R2 принимают значения, определенные ниже;
- когда W представляет собой гетероарильную группу формулы (II), он является бензоконденсированным 5- или 6-членным гетероциклом, в котором
- Z и Y независимо выбраны из атома кислорода (-O-), атома серы (-S-) или групп -CHR3-, -CR3=, -NH-, -N=;
- Q независимо выбран из групп -CHR3, -CH=, -CR3=, -CHR3-CH2-;
при условии, что комбинация Y, Z, Q групп дает 1,3-бензодиоксол, бензофуран, 2,3-дигидробензофуран, бензотиофен, 2,3-дигидробензотиофен, индол, 2,3-дигидроиндол, бензимидазол, бензоксазол, бензотиазол, 2Н-3,4-дигидробензопиран, [1,4]-бензодиоксин, 2,3-дигидро-[1,4]-бензодиоксин (1,4-бензодиоксан);
- R1 независимо выбран из водорода (-Н), С1-С4 алкила, гидроксиметила (-CH2OH), аминометила (-CH2NH2), алкиламинометила [CH2NH(R2)] или диалкиламинометила [CH2N(R2)2], трифторметила (-CF3). C1-C4 алкильная группа представляет собой нормальную или разветвленную насыщенную или ненасыщенную C1-C4 углеводородную цепь. При условии, что в соединениях формулы (I) не более чем две R1 группы, замещающие имидазольное кольцо, представляют собой одновременно C1-C4 алкил или трифторметил (-CF3) и только одна R1 группа представляет собой гидроксиметил (-CH2OH), аминометил (-CH2NH2), алкиламинометил [CH2NH(R2)] или диалкиламинометил [CH2N(R2)2];
- R2 представляет собой С1-С6 алкильную цепь, где С1-С6 алкильная цепь имеет те же значения, как определено для С1-С4 цепи, но необязательно замещенной арилом, причем арил принимает значения, определенные выше;
- R3 независимо выбран из водорода, С1-С4 алкила, определенного выше для R1.
Соединения формулы (I), определенные выше, имеют таутомеры, объем данного изобретения включает все возможные таутомеры соединений формулы (I).
Определенные выше соединения формулы (I), когда W представляет собой арил или гетероарил формулы (I), включены в объем соединений формулы (I) в предыдущей заявке данных авторов WO 2008/014822, однако некоторые из них являются новыми соединениями, ранее не описанными в примерах патентной заявки данных авторов WO 2008/014822.
В следующем варианте осуществления данное изобретение относится к этим новым соединениям, их фармацевтически приемлемым солям и/или сольватам и соответствующим фармацевтическим композициям и их применению для фармакологического лечения тех заболеваний, которые детализированы для соединений формулы (I).
Данные новые соединения представляют собой:
[6-(2-метил-1Н-имидазол-1-ил)-2-фенил]хиназолин
[6-(2-метил-1Н-имидазол-1-ил)-2-(4-метоксифенил)]хиназолин
[6-(4-метил-1Н-имидазол-1-ил)-2-фенил]хиназолин
[6-(5-метил-1Н-имидазол-1-ил)-2-фенил]хиназолин
[6-(4-метил-1Н-имидазол-1-ил)-2-(4-метоксифенил)]хиназолин
[6-(4-метил-1Н-имидазол-1-ил)-2-(3-метоксифенил)]хиназолин
[6-(4-метил-1Н-имидазол-1-ил)-2-(2-метоксифенил)]хиназолин
[6-(4-1Н-имидазол-1-ил)-2-(1,3-бензодиоксол-5-ил)]хиназолин
[6-(4-метил-1Н-имидазол-1-ил)-2-(4-фторфенил)]хиназолин
[6-(4-метил-1Н-имидазол-1-ил)-2-(4-метансульфонилфенил)]хиназолин
[6-(1Н-имидазол-1-ил)-2-(4-метоксифенил)]хинолин
[6-(1Н-имидазол-1-ил)-2-(2-метоксифенил)]хинолин
[6-(1Н-имидазол-1-ил)-2-(1,3-бензодиоксол-5-ил)]хинолин
[6-(1Н-имидазол-1-ил)-2-(4-фторфенил)]хинолин
[6-(1Н-имидазол-1-ил)-2-(4-диметиламинофенил)]хинолин
[6-(1Н-имидазол-1-ил)-2-(4-трифторметоксифенил)]хинолин
[6-(1Н-имидазол-1-ил)-2-(2-метил-4-трифторметоксифенил)]хинолин
[6-(1Н-имидазол-1-ил)-2-(4-диметиламинофенил)]хинолин
[6-(1Н-имидазол-1-ил)-2-(4-метансульфонилфенил)]хинолин
[6-(2-метил-1Н-имидазол-1-ил)-2-(4-метоксифенил)]хинолин
[6-(2-метил-1Н-имидазол-1-ил)-2-(2-метоксифенил)]хинолин
[6-(4-метил-1Н-имидазол-1-ил)-2-фенил]хинолин
[6-(4-метил-1Н-имидазол-1-ил)-2-(4-метоксифенил)]хинолин
[6-(4-метил-1Н-имидазол-1-ил)-2-(4-фторфенил)]хинолин
[6-(4-метил-1Н-имидазол-1-ил)-2-(4-метилтиофенил)]хинолин.
Названные выше соединения формулы (I), когда W представляет собой гетероарил, определенный выше, не охватываются структурной формулой соединений формулы (I) в предыдущей заявке данных авторов WO 2008/014822.
В следующем варианте осуществления данное изобретение относится к этим новым соединениям формулы (I), где W представляет собой гетероарил, определенный выше, их фармацевтически приемлемым солям и сольватам, соответствующей фармацевтической композиции и их применению для фармакологического лечения тех заболеваний, которые детализированы для соединений формулы (I).
Согласно данному изобретению соединения формулы (I) могут быть использованы в виде свободного основания, в виде фармацевтически приемлемой соли или в виде сольватной или гидратной формы. Соли соединений формулы (I) представляют собой фармацевтически приемлемые аддитивные соли с неорганическими и органическими кислотами. Репрезентативные, но не ограничивающие примеры неорганических солей соединений формулы (I) представляют собой гидрохлорид, гидросульфат, сульфат, гидрофосфат и фосфат. Соответствующие репрезентативные, но не ограничивающие примеры органических солей представляют собой метансульфонат, малеат, сукцинат, фумарат, тартрат, малонат и оксалат.
Способы получения соединений формулы (I) широко описаны в предыдущей заявке данных авторов WO 2008/014822, однако для тех соединений формулы (I), где имидазолильная группа замещена (R1 не является водородом), часто получены очень низкие выходы и сложные реакционные смеси, когда использованы способы получения соединений формулы (I), опубликованные в WO 2008/014822. В другом варианте осуществления данное изобретение относится к новым, более практичным и полезным способам для получения соединений формулы (I), отличающимся более высокими средними выходами и более простыми процедурами для выделения и очистки продукта.
В другом варианте осуществления данное изобретение относится к фармацевтическим композициям для соединений формулы (I), применимым для фармакологического лечения тех заболеваний, которые детализированы выше. В объеме данного изобретения термин «фармацевтическая композиция (лекарственный продукт)» относится к любой пероральной или парентеральной лекарственной форме, подходящей для лечения вышеприведенных патологий, которая содержит эффективное количество по меньшей мере одного из активных ингредиентов (лекарственных веществ), соединений формулы (I), их солей или сольватов и фармацевтически приемлемый носитель, эксципиенты или разбавители, определенные ниже, для перорального или парентерального введения.
Репрезентативные, но не ограничивающие примеры соединений формулы (I) представлены в таблице 1.
| Таблица 1 | |||
| Название | Структура | Мол. масса | Пример |
| [6-(1H-имидазол-1-ил)-2-фенил]хиназолин | 272,31 | 1 | |
| [6-(2-метил-1H-имидазол-1-ил)-2-фенил]хиназолин | 286,34 | 2 | |
| [6-(2-метил-1H-имидазол-1-ил)-2-(4-метоксифенил)]хиназолин | 316,37 | 3 | |
| [6-(4-метил-1H-имидазол-1-ил)-2-фенил]хиназолин | 286,34 | 4 | |
| [6-(5-метил-1H-имидазол-1-ил)-2-фенил]хиназолин | 286,34 | 5 | |
| [6-(4-метил-1H-имидазол-1-ил)-2-(4-метоксифенил)]хиназолин | 316,37 | 6 | |
| [6-(4-метил-1H-имидазол-1-ил)-2-(2-метоксифенил)]хиназолин | 316,37 | 7 | |
| [6-(4-метил-1H-имидазол-1-ил)-2-(3-метоксифенил)]хиназолин | 316,37 | 8 | |
| [6-(4-метил-1H-имидазол-1-ил)-2-(1,3-бензодиоксол-5-ил)]хиназолин | 330,35 | 9 | |
| [6-(4-метил-1H-имидазол-1-ил)-2-(4-фторфенил)]хиназолин | 304,33 | 10 |
| [6-(4-метил-1H-имидазол-1-ил)-2-(4-метансульфонилфенил)]хиназолин | 364,43 | 11 | |
| [6-(4-метил-1H-имидазол-1-ил)-2-(3-фурил)]хиназолин | 276,30 | 12 | |
| [6-(1H-имидазол-1-ил)-2-(1,3-бензодиоксол-5-ил)]хиназолин | 316,32 | 13 | |
| [6-(1H-имидазол-1-ил)-2-(бензофуран-5-ил)]хиназолин дигидрохлорид тригидрат | 439,30 | 14 | |
| [6-(1H-имидазол-1-ил)-2-(2,3-дигидро-1,4-бензодиоксин-6-ил)]хиназолин | 330,35 | 15 | |
| [6-(1H-имидазол-1-ил)-2-(1,3-бензодиоксол-5-ил)]хинолин дигидрохлорид | 351,79 | 16 | |
| [6-(1H-имидазол-1-ил)-2-фенил]хинолин | 271,32 | 17 | |
| [6-(1H-имидазол-1-ил)-2-(4-метоксифенил)]хинолин дигидрохлорид | 374,27 | 18 | |
| [6-(1H-имидазол-1-ил)-2-(2-метоксифенил)]хинолин дигидрохлорид | 374,27 | 19 | |
| [6-(1H-имидазол-1-ил)-2-(3-фурил)]хинолин дигидрохлорид | 334,20 | 20 | |
| [6-(1H-имидазол-1-ил)-2-(4-фторфенил)]хинолин дигидрохлорид | 362,31 | 21 |
| [6-(1H-имидазол-1-ил)-2-(4-диметиламинофенил)]хинолин тригидрохлорид | 423,77 | 22 | |
| [6-(1H-имидазол-1-ил)-2-(4-трифторметоксифенил)]хинолин дигидрохлорид | 428,24 | 23 | |
| [6-(1H-имидазол-1-ил)-2-(2-метил-4-трифторметоксифенил)]хинолин дигидрохлорид | 442,27 | 24 | |
| [6-(1H-имидазол-1-ил)-2-(4-метансульфонилфенил)]хинолин дигидрохлорид | 422,33 | 25 | |
| [6-(2-метил-1H-имидазол-1-ил)-2-(4-метоксифенил)]хинолин дигидрохлорид | 388,38 | 26 | |
| [6-(2-метил-1H-имидазол-1-ил)-2-(2-метоксифенил)]хинолин дигидрохлорид | 388,38 | 27 | |
| [6-(4-метил-1H-имидазол-1-ил)-2-(фуран-3-ил)]хинолин дигидрохлорид | 348,31 | 28 | |
| [6-(2-метил-1H-имидазол-1-ил)-2-(фенил)]хинолин дигидрохлорид | 358,35 | 29 | |
| [6-(4-метил-1H-имидазол-1-ил)-2-фенил]хинолин дигидрохлорид | 285,35 | 30 | |
| [6-(4-метил-1H-имидазол-1-ил)-2-(4-метоксифенил)]хинолин дигидрохлорид | 388,38 | 31 |
| [6-(4-метил-1H-имидазол-1-ил)-2-(4-фторфенил)]хинолин дигидрохлорид | 376,34 | 32 | |
| [6-(4-метил-1H-имидазол-1-ил)-2-(4-метилтиофенил)]хинолин дигидрохлорид | 404,34 | 33 |
Получение соединений изобретения
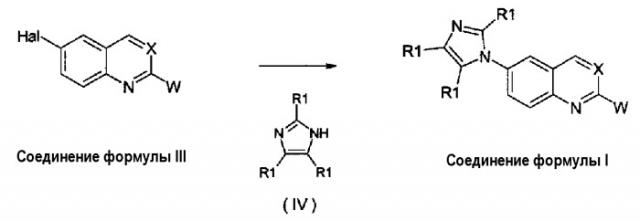
Соединения формулы (I) могут быть получены, как описано в WO 2008/014822, взаимодействием соединения формулы (III) с производным имидазола формулы (IV), как указано на схеме 1, в которой X, W и R1 имеют те же значения, которые определены выше для соединений формулы (I), и Hal представляет собой атом галогена, такой как фтор, хлор, бром и йод, обычно фтор или бром.
Схема 1:
Взаимодействие соединения формулы (III) может быть осуществлено использованием производного имидазола формулы (IV) либо в виде свободного основания, либо в виде его соли со щелочным металлом (соль натрия, лития или калия) согласно общим условиям реакции, описанным в WO 2008/014822, или, точнее, использованием CuI или Cu2O в качестве катализатора, диметилэтилендиамина или 4,7-диметокси-1,10-фенантролина в качестве лигандов и диглима в качестве растворителя, карбоната цезия в качестве основания при температуре примерно 150°С в течение 20-50 часов.
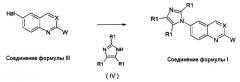
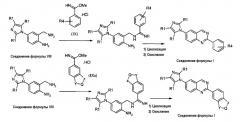
Когда Х представляет собой атом азота, соединения формулы (III) могут быть получены из известных диаминов формулы (V), как показано на схеме 2.
Схема 2:
Там, где Y, Q и Z имеют те же значения, как для соединений формулы (I), R4 представляет собой любой из заместителей, данных выше в качестве заместителей для арильной группы в соединениях формулы (I). Соединения формулы (V) получены согласно известным способам, соединения формулы (VI) и (VIa) представляют собой известные соединения или получены согласно известным способам. Для стадий циклизации и окисления могут быть использованы условия реакций, описанные ранее в WO 2008/014822, однако более высокие выходы могут быть получены для большинства случаев при применении условий реакции, сообщенных в примере 1. Данная улучшенная синтетическая процедура также состоит из более простых операций, таким образом приводящих к более практическому синтетическому способу.
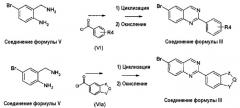
В альтернативном случае, соединение формулы (III), где X представляет собой атом азота (-N), может быть получено циклизацией диамина формулы (V) с ортоэфиром формулы (VII) или (VIIa), как описано на схеме 3.
Схема 3:
где R4, Y, Q и Z принимают значения, которые описаны выше. Реакцию циклизации ортоэфиров формулы (VII) и (VIIa) с бисаминами формулы (V) выполняют в толуоле или другом инертном органическом растворителе, используя кислотный катализатор, обычно п-толуолсульфоновую кислоту при температуре кипения с обратным холодильником в течение примерно 50 часов. Стадия окисления может быть выполнена при использовании MnO2 в дихлорметане.
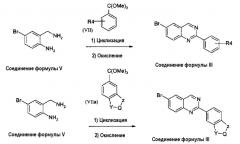
В альтернативном случае, соединения формулы (I), где X представляет собой атом азота (-N), могут быть получены циклизацией диамина формулы (VIII) с солями Пиннера формулы (IX) или (IXa), как описано на схеме 4.
Схема 4:
Реакция конденсации и циклизации бисаминов формулы (VIII) с солями Пиннера формулы (IX) или формулы (IXa), где R4, Y, Q и Z принимают значения, указанные выше, может быть осуществлена нагреванием реакционной смеси в спиртовом растворителе, таком как метанол, этанол или пропанол, при температуре кипения с обратным холодильником в течение примерно 1 часа. Образовавшийся промежуточный амидин затем циклизуется в соответствующий дигидрохиназолин нагреванием в уксусной кислоте. Окисление дигидрохиназолинового промежуточного продукта до соответствующего соединения формулы (I) достигается использованием MnO2 в инертном органическом растворителе, таком как дихлорметан.
Соли Пиннера формулы (IX) и (IXa) получают известными процедурами, обычно барботированием безводной хлористоводородной кислоты в спиртовой раствор соответствующего нитрила при температуре от -20°С до 0°С. Образовавшуюся соль Пиннера кристаллизуют из простого эфира, обычно трет-бутилметилового эфира.
Соединения формулы (VIII) получают согласно схеме 5, восстановлением нитрила формулы (X), который, в свою очередь, получают восстановлением соответствующего нитропроизводного формулы (XI), где R1 принимает значения как для соединений формулы (I). Соединения формулы (XI) получают нуклеофильным замещением на 5-фтор-2-цианонитробензоле с помощью имидазолилпроизводного формулы (IV).
Схема 5:
Каталитическое восстановление соединения формулы (X) для получения соединения формулы (VII) может быть выполнено с использованием в качестве катализатора никеля Ренея при давлении водорода примерно 60 бар/0,6 МПа, в метаноле или этаноле, содержащем примерно 10% аммиака (газ), при температуре 30-60°С. Превращение цианопроизводного формулы (XI) в соединение формулы (X) может быть осуществлено при использовании SnCl2 в концентрированной HCl при температуре, изменяющейся от -10°С до 0°С. Производные формулы (XI) получают взаимодействием 5-фтор-2-цианонитробензола с имидазолилпроизводными формулы (IV), в органическом растворителе, обычно ацетонитриле, при температуре 50-90°С. Когда заместитель R1 в соединении формулы (IV) находится в положении -4 и заместители R1 в других положениях представляют собой атомы водорода, могли быть получены региоизомеры соединений формулы (XI). Данные региоизомеры могут быть разделены колоночной хроматографией и/или кристаллизацией.
Соединения формулы (I), где X представляет собой -CH группу, могут быть получены из соединения формулы (XII) взаимодействием с боронатом формулы (XIII) или (XIIIa), как дано на схеме 6.
Схема 6:
где R1, R4, W, Y, Z и Q принимают значения, которые описаны выше. Аналогичный подход, который использует конденсацию Сузуки для получения соединений формулы (I), определенной в настоящем описании, но исходя из производных 2-хлор-6-имидазолилхинолина, ранее был опубликован в патентной заявке данных авторов WO 2008/014822. Однако использование трифлатной группы вместо атома хлора, как опубликовано ранее, заметно повышает выходы реакции конденсации, а также имеются более высокие выходы по приготовлению соединений формулы (XII) в сравнении с соответствующими 2-хлорпроизводными. Взаимодействие соединения формулы (XII) с боронатом формулы (XIII) или (XIIIa) проводят в инертном органическом растворителе, таком как толуол, диметоксиэтан или тетрагидрофуран, в присутствии основания, такого как карбонат калия или карбонат цезия, с палладиевым катализатором. Тетракистрифенилфосфинпалладий или соль палладия и соответствующий лиганд могут быть использованы в качестве катализатора. Соединения формулы (XIII) или (XIIIa) являются коммерчески доступными соединениями или могут быть получены согласно способам, хорошо известным в данной области.
В альтернативном случае, соединения формулы (I) могут быть получены взаимодействием соединений формулы (XII) с арилгалогенидами, обычно арилбромидами, производными форму