Полимерные наночастицы, покрытые оксидом магнитного металла, и их применение
Иллюстрации
Показать всеИзобретение относится к наночастицам для доставки лекарственного вещества, причем наночастицы состоят из хелатирующего металл полимера, и активного агента, представляющего собой родственный TNF лиганд, индуцирующий апоптоз (TRAIL), где активный агент ковалентно связан с полимером. Изобретение также относится к фармацевтической композиции для индуцирования апоптоза в раковой клетке, уменьшения роста опухоли и/или ингибирования роста опухоли, которая включает указанные наночастицы и фармацевтически приемлемый носитель. Заявлен также способ приготовления наночастицы, который включает смешивание водного раствора хелатирующего металл полимера с растворимой солью металла, оксидирование ионов металла и образование наночастицы путем доведения pH до основного. Далее повторяют стадии добавления металла, оксидирования и доведения раствора до основного pH. Затем проводят функционализацию наночастицы и ее контактирование с TRAIL с последующим блокированием остающихся активных сайтов на поверхности наночастицы. Изобретение обеспечивает достижение эффективного апоптоза за счет стабилизации TRAIL, предотвращение его расщепления и уменьшения необходимого для апоптоза количества TRAIL. 3 н. и 24 з.п. ф-лы, 40 ил., 8 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение обеспечивает наночастицы, состоящие из полимера, являющегося веществом, образующим комплексы с металлом, покрытого оксидом магнитного металла, где по меньшей мере одно активное вещество ковалентно связано с данным полимером, а также фармацевтические композиции и их применения.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Наночастицы представляют собой сферические частицы размером от нескольких нанометров до 0,1 мкм. Полимерные частницы наномасштаба с узким распределением по размеру обычно создаются посредством методов контролируемого осаждения или технологий гетерофазной полимеризации, например, посредством методов оптимальной или обратной эмульсионной полимеризации. Когда размеры твердых веществ уменьшают до порядка нанометров, их свойства подвергаются коренным изменениям. Важно иметь в виду, что чем меньше размер частиц, тем большая часть их конституэнтных атомов находится на поверхности. Наночастицы, в частности, размером меньше приблизительно 20 нм, преимущественно проявляют свойства поверхности и границы раздела фаз, которые не наблюдаются у исходных веществ, например, более низкие точки плавления и кипения, более низкая температура спекания и сниженное сопротивление текучести.
Ввиду их сферической формы и большой площади поверхности, частицы наномасштаба могут обеспечивать аккуратные решения различных проблем в науке о материалах, например, использование композиционных материалов, катализа, пространственных структур и фотонных материалов, и могут быть в дальнейшем использованы в биомедицинских применениях, например, для специфического мечения и разделения клеток, выращивания клеток, аффинной хроматографии, диагностики, специфической очистки крови путем гемоперфузии, доставки и контролируемого высвобождения лекарственного средства (Bockstaller et al., 2003; Hergt et al., 2004; Margel et al., 1999). Для каждого практического применения требуются наночастицы с различными оптимальными физическими и химическими свойствами. Уже описаны синтез и применение многочисленных типов частиц нано-масштаба с различной химией поверхности, например, многообразие поверхностных функциональных групп, таких как гидроксильная группа, карбоксильная группа, пиридин, амид, альдегид и фенил-хлорметил (Margel et al., 1999). Такие наночастицы предназначены для различных промышленных и медицинских применений, например, иммобилизации ферментов, синтеза олигонуклеотидов и пептидов, доставки лекарственного средства, специфического мечения и разделения клеток, медицинской диагностической визуализации, биологических клеящих веществ и негорючих полимеров (Bunker et al., 1994; Szymonifka and Chapman, 1995; Margel et al., 1999; WO 2004/045494; Galperin et al., 2007).
Особенный интерес представляют наночастицы с магнитными свойствами, которые обычно используют для отделения данных частиц и/или их конъюгатов от нежелательных соединений с помощью магнитного поля. Благодаря своим магнитным свойствам, эти частицы имеют несколько дополнительных важных применений, таких как магнитная регистрация, магнитная сварка, защита от электромагнитного излучения и биомедицинские применения. Наночастицы оксида магнитного железа, а именно магнетида и оксимагнетида, являются основными частицами, которые были изучены для биомедицинских применений, например, для магнитной гипертермии, магнитной целевой доставки лекарственного средства, магнитного разделения клеток и в качестве контрастных веществ при МРТ (Lacoste et al. 1993; Green-Sadan et al. 2005; Leemputten and Horisberger, 1974; Hergt et al. 2004). Наночастицы оксида магнитного железа являются нетоксичными и поддаются биологическому разложению, и уже одобрены для клинического применения в качестве контрастных веществ при МРТ. Эти наночастицы обычно получают посредством добавления в водный раствор, содержащий стехиометрические концентрации ионов двухвалентного и трехвалентного железа, и полимерный стабилизатор, такой как декстран, в который добавляют основание, например, NaOH или аммиак, до тех пор, пока не достигнуто щелочное значение рН (обычно выше 8,0). Полученные наночастицы, покрытые оксидом магнитного железа, затем отмывают различными способами, например, с использованием магнитных колонок или диализа. За прошедшие несколько лет были приложены значительные усилия для синтеза эффективных магнитных наночастиц оксида железа, однако большинство из этих наночастиц обладают существенными недостатками, такими как широкое распределение размеров, что считается токсичным для медицинских применений in vivo, выщелачивание ионов железа и нестабильности относительно процессов агглютинации.
WO 99/062079 и соответствующая заявка EP 1088315B1 того же Заявителя, полностью включенные в настоящее описание посредством ссылки, как если бы полностью раскрытые в настоящем описании, раскрывают новые единообразные магнитные комплексные наночастицы желатин/оксид железа, полученные посредством контролируемого образования активных центров оксида железа на полимере, хелатирующем ионы железа, например, желатине, растворенном в водном растворе, с последующим поэтапным наращиванием тонких слоев пленки оксида железа на данных ядрах желатин/оксида железа. Эти магнитные наночастицы можно изготовить с очень узким распределением размеров в диапазоне приблизительно от 10 нм до 100 нм.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение обеспечивает наночастицы, состоящие из полимера, который является веществом, хелатирующим металл, покрытого оксидом магнитного металла, где по меньшей мере одно действующее вещество ковалентно связано с данным полимером.
В других аспектах настоящее изобретение обеспечивает фармацевтические композиции, включающие наночастицы, согласно вышеприведенному определению, и фармацевтически приемлемый носитель, а также различные способы их применения.
Данные фармацевтические композиции по настоящему изобретению можно применять, наряду с прочим, для выявления опухоли; уменьшения или ингибирования роста опухоли, или для уменьшения или ингибирования роста опухолевых клеток, оставшихся у пациента, после удаления опухоли хирургическим путем; уменьшения или ингибирования роста опухоли и контролирования ее размера; оценки восприимчивости опухолевых клеток к обработке испытываемым соединением. Дополнительно, эти композиции можно использовать для выявления очага воспаления и лечения данного воспаления, а также для лечения сахарного диабета 2 типа, ожирения и анорексии.
В следующем аспекте настоящее изобретение обеспечивает наночастицу, состоящую из полимера, являющегося веществом, хелатирующим металл, покрытого оксидом магнитного металла, где по меньшей мере одно вещество, имеющее противоопухолевую активность, выбранное из пептида, пептидомиметика, полипептида или малой молекулы, связано с внешней поверхностью данного оксида магнитного металла. Настоящее изобретение дополнительно обеспечивает фармацевтические композиции, включающие эти наночастицы и фармацевтически приемлемый носитель, для уменьшения или ингибирования роста опухоли, а также различные способы их применения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
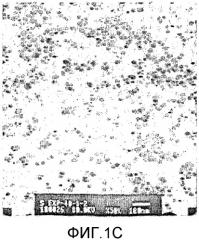
На фиг.1А-1D представлены полученные с помощью трансмиссионной электронной микроскопии (ТЕМ) микроснимки магнитных композитных наночастиц желатин/оксид железа с увеличенным средним диаметром, изготовленных как описано в примере 1, посредством повторения процесса нанесения тонкого магнитного покрытия на этапе роста 4, 5, 6 и 7 раз (1A, 1B, 1C и 1D), соответственно.
На фиг.2 представлена гистограмма диаметра композитных наночастиц желатин/оксид железа, полученных как описано в примере 1, и диспергированных в воде.
На фиг.3A-3B представлены полученные посредством ТЕМ высокого разрешения (HTEM) (3A) и структурной электронографии (ED) (3B) изображения магнитных композитных наночастиц желатин/оксид железа, полученных как описано в примере 1.
На фиг.4 представлено рентгеновское дифракционное (XRD) изображение магнитных композитных наночастиц желатин/оксид железа, полученных как описано в примере 1.
На фиг.5 представлен мессбауэровский спектр магнитных композитных наночастиц желатин/оксид железа, полученных как описано в примере 1.
На фиг.6 представлена петля магнитизации (VSM) при комнатной температуре, полученная для магнитных композитных наночастиц желатин/оксид железа, полученных как описано в примере 1.
На фиг.7 изображен этап образования активных центров при получении меченных флуоресцентным красителем магнитных композитных наночастиц желатин/оксид железа, приготовленных как описано в примере 2.
На фиг.8 изображена стабильность несвязанного родственного фактору некроза опухоли лиганда, индуцирующего апоптоз (TRAIL) в сравнении с TRAIL, конъюгированным с магнитными композитными наночастицами желатин/оксид железа (NP-TRAIL), при 10°C в течение 35 дней.
На фиг.9A-9B изображен апоптоз клеток глиомы человека A172 (9A) и глиомных сфероидов, образованных из первичных опухолей HF2020 (9B), индуцированный посредством магнитных композитных наночастиц желатин/оксид железа (NP), несвязанного TRAIL (100 нг/мл) и конъюгированных с TRAIL магнитных композитных наночастиц желатин/оксид железа (NP-TRAIL, 10 нг/мл).
На фиг.10 представлено действие несвязанного TRAIL и конъюгированных с TRAIL магнитных композитных наночастиц желатин/оксид железа (NP-TRAIL) на апоптоз глиомных сфероидов, образованных из образцов глиомы человека HF1254, HF1308 и HF2020. Сфероиды помещали в 24-луночные планшеты и обрабатывали средой (контроль), TRAIL (100 нг/мл), магнитными композитными наночастицами желатин/оксид железа (NP) и конъюгированными с TRAIL магнитными композитными наночастицами (NP-TRAIL, 10 нг/мл). Клеточную гибель определяли через 24 часа обработки, используя анализ LDH. Результаты представлены как среднее±SE между тремя экземплярами в двух различных экспериментах.
На фиг.11 представлен цитотоксический эффект несвязанного TRAIL (100 нг/мл) и конъюгированных с TRAIL магнитных композитных наночастиц желатин/оксид железа (NP-TRAIL, 10 нг TRAIL/мл) на клетки глиомы U87, A172 и U251, а также на первичные клеточные культуры клеток глиомы HF1308, HF1254 и HF1316. В качестве контроля использовали магнитные композитные наночастицы желатин/оксид железа в чистом виде (NP) или PBS (контроль). Клеточную гибель определяли посредством анализа FACS через 24 часа обработки.
На фиг.12 представлен цитотоксический эффект конъюгированных с TRAIL магнитных композитных наночастиц желатин/оксид железа с наличием или без флуоресцентной метки, на клетки A172. Клетки A172 инкубировали в течение 5 ч. с контрольными наночастицами (NP-контроль), конъюгированными с TRAIL наночастицами без флуоресцентной метки (NP-TRAIL), контрольными наночастицами, меченными родамином (NPR-контроль) или конъюгированными с TRAIL меченными родамином наночастицами (NPR-TRAIL). Клеточный апоптоз определяли, используя окрашивание пропидиумом йодидом и анализ FACS, и результаты представлены как среднее±SE в трех независимых экспериментах.
На фиг.13 представлена специфическая интернализация конъюгированных с TRAIL меченных родамином магнитных композитных наночастиц желатин/оксид железа (NPR-TRAIL) клетками глиомы, по сравнению с нормальными астроцитами. NPR-TRAIL инкубировали с клетками A172 и с нормальными астроцитами в течение 30 мин, и иммунофлуоресценцию данных клеток определяли, используя конфокальный микроскоп. Результаты представляют один из трех экспериментов, продемонстрировавших аналогичные результаты.
На фиг.14 изображено синергетическое действие γ-облучения и конъюгированных с TRAIL магнитных композитных наночастиц желатин/оксид железа (NP-TRAIL) на клеточные линии глиомы U87, A172, U251 и LN-18. Клетки инкубировали с NP-TRAIL (5 нг TRAIL/мл) или с магнитными композитными наночастицами желатин/оксид железа в чистом виде (NP) в течение 24 ч, или облучали γ-облучением (10 Гр в течение 2 ч), а затем обрабатывали с NP-TRAIL (NP-TRAIL+Rad, 5 нг TRAIL/мл) или только NP (NP-Rad) в течение 24 ч. Клеточный апоптоз определяли посредством анализа FACS.
На фиг.15 показано, что и cRGD-пептид (cRGD), и конъюгированные с cRGD-пептидом магнитные композитные наночастицы желатин/оксид железа (NP-cRGD), индуцируют аутофагию, а именно, увеличивают неравномерное окрашивание, в клетках глиомы U251, по сравнению с контролем, или клетками, обработанными только магнитными композитными наночастицами желатин/оксид железа (NP).
На фиг.16 изображено действие конъюгированных с TRAIL магнитных композитных наночастиц желатин/оксид железа (NP-TRAIL) на апоптоз клеточной линии карциномы шейки матки HeLa, клеточной линии рака молочной железы MCF-7 и клеток рака легких A549. Эти различные клеточные линии инкубировали с TRAIL (100 нг/мл), NP-TRAIL (50 нг TRAIL/мл), наночастицами в чистом виде (NP) или PBS (контроль), в течение 24 ч, и результаты представлены как среднее±SE.
На фиг.17A-17B представлено синергетическое действие γ-облучения и конъюгированных с TRAIL магнитных композитных наночастиц желатин/оксид железа (NP-TRAIL) на сфероиды глиомы стволовых клеток, образованных из образцов опухоли 2355 (17A) и 2303 (17B). Клетки обрабатывали либо TRAIL (100 нг/мл), наночастицами в чистом виде (NP) (контроль)или NP-TRAIL (50 нг/мл) в течение 24 ч, затем собирали супернатанты и проводили анализ LDH. Для оценки эффекта совместного действия облучения (IR) и TRAIL, клетки сначала облучали излучением 5 Гр и через 4 ч обрабатывали либо TRAIL, либо NP-TRAIL в течение дополнительных 24 ч. Клеточную гибель определяли, используя уровни LDH в культуральных супернатантах. Результаты представляют один из трех аналогичных экспериментов, который был проведен в трех параллелях.
На фиг.18 показано действие IL-12 и конъюгированных с IL-12 магнитных композитных наночастиц желатин/оксид железа (NP-IL-12) на апоптоз клеток рака яичников. Клетки рака яичников обрабатывали только средой, IL-12 (50 нг/мл), наночастицами в чистом виде (NP, 50 мкг/мл), или NP-IL-12 (50 нг связанного IL-12/мл), инкубировали в течение 24 ч, а затем проводили оценку клеточной гибели, используя анализ LDH.
На фиг.19 представлены срезы опухоли крыс, обработанных либо конъюгированными с TRAIL магнитными композитными наночастицами желатин/оксид железа (NP-TRAIL), или наночастицами в чистом виде (NP). Клетки глиомы человека U251 использовали в качестве ксенотрансплантата в головной мозг крыс, ожидали развитие опухолей в течение 7 дней, после чего либо NP, либо NP-TRAIL инъецировали интракраниально в область опухоли. Степень клеточного апоптоза в опухолях контрольных крыс, обработанных с использованием PBS (не представлено), NP или NP-TRAIL определяли через 7 дней после обработки, и клеточный апоптоз был определен посредством окрашивания TUNEL (коричневое окрашивание), которое специфически выявляет апоптотические клетки.
На фиг.20 представлено действие конъюгированных с TRAIL магнитных композитных наночастиц (NP-TRAIL) на выживаемость крыс с имплантами U251 человека. Наночастицы в чистом виде (NP), NP-TRAIL или PBS инъецировали непосредственно в опухоль через 7 дней после имплантации опухолевых клеток, за животными наблюдали на предмет выявления признаков патологического состояния и/или заболеваемости, и в момент их проявления безболезненно умерщвляли.
На фиг.21A-21C представлено действие конъюгированных с TRAIL магнитных композитных наночастиц (NP-TRAIL) (21C) в сравнение с применением наночастиц в чистом виде (NP) (21B) или PBS (21A), на опухолевый объем в момент заболеваемости. Во время умерщвления, крысам проводили перфузию формалином, извлекали головной мозг и проводили окрашивание гематоксилин-эозином. Представлены характерные срезы опухолевого объема. Номера над сериями изображений означают день, на который произвели умерщвление.
На фиг.22 показано, что применение конъюгированных с TRAIL магнитных композитных наночастиц желатин/оксид железа (NP-TRAIL) приводит к снижению в целом опухолевой нагрузки, по сравнению с применением наночастиц в чистом виде (NP) или PBS. Крысам интракраниально имплантировали клетки человека U251, и через 7 дней вводили NP-TRAIL, NP или PBS. На 21 день животных безболезненно умерщвляли, выделяли ткани головного мозга и изготавливали срезы для определения объема. В этом исследование предметные стекла были сфотографированы при одинаковых настройках для всех предметных стекол. Объем определяли, измеряя наибольшую ширину и высоту опухоли для каждого 15-го среза толщиной 5 мкм. Определяли объем для каждого среза и умножали на число срезов до следующего измеренного среза, до тех пор, пока не достигли конца опухоли.
На фиг.23 представлена способность магнитных композитных наночастиц желатин/оксид железа (NP) сопрягаться с областями опухолевого роста. Через 7 дней после имплантации опухолевых клеток U251, меченные родамином NP (NPR) имплантировали в противоположное полушарие головного мозга крыс. Через четыре дня животных безболезненно умерщвляли, головной мозг удаляли и мгновенно замораживали для изготовления срезов и визуализации. На панелях A, D и G представлены изображения NPR в мозолистом теле поблизости от места инъекции NPR; на панелях B, E и H изображены участки имплантации NPR; и на панелях C, F и I представлены изображения NPR в мозолистом теле поблизости от области опухолевых клеток. Увеличение 4X (панели A, B, C); 10X (панели D, E, F); и 20X (панели G, H, I).
На фиг.24 показано, что применение конъюгированных с TRAIL магнитных композитных наночастиц желатин/оксид железа (NP-TRAIL) ведет к образованию больших областей деструкции ткани, что в частности, показано на панелях b, d и f, чего не наблюдали ни при применении наночастиц в чистом виде (NP), ни при применении PBS. Крысам линии nude имплантировали опухоли U251n в день 0; в день 7 внутрь новообразования вводили NP-TRAIL, NP в чистом виде или PBS; в день 14 животных умерщвляли и собирали ткани. NP-TRAIL (панели a-f); NP (панели g-l); PBS (панели m-r). Увеличение 1X (панели a, c, e, g, i, k, m, o, q); 10X (панели b, d, f, h, j, l, n, r). Стрелками указана нижняя часть опухолевой массы.
На фиг.25 показана повышенная деструкция опухолевых клеток у крыс, получавших конъюгированные с TRAIL магнитные композитные наночастицы желатин/оксид железа (NP-TRAIL) по сравнению с только наночастицами (NP) или PBS. Животным имплантировали клетки человека U251n в день 0, в день 7 им вводили PBS, NP или NP-TRAIL. На 14 день животных безболезненной умерщвляли и ткани мозга окрашивали гематоксилином и эозином. PBS (панели a-b); NP (панели c-e); NP-TRAIL (панели f-h). Увеличение 40X.
На фиг.26A-26B показано, что конъюгированные с TRAIL магнитные композитные наночастицы желатин/оксид железа (NP-TRAIL) (26B) индуцируют сигнал более низкой интенсивности как на границе, так и внутри опухоли, по сравнению с наночастицами в чистом виде (NP) (26A), как показано посредством МРТ, свидетельствуя о том, что NP-TRAIL подходят к границе и проникают внутрь ксенотрансплантатов глиомы человека, имплантированных крысам линии nude. Клетки глиомы человека U251n были имплантированы крысам линии nude, и через 11 дней интракраниально в противоположную опухоли сторону вводили NP или NP-TRAIL. MP-изображения получали через 8 дней. На каждой фигуре представлены 4 последовательных среза МРТ, для каждого среза имеется 4 изображения с различным временем задержки эхо-импульса (TE). Более длинное TE (нижнее правое изображение в маленьком квадрате). Значительная потеря интенсивности сигнала (черный) из-за железа. R - право; L - лево; IS - область инъекции (слева); Tm - опухоль (справа); LV - боковой желудочек; и 3V - 3-ий желудочек.
На фиг.27 представлена способность конъюгированных с TRAIL меченных родамином магнитных композитных наночастиц желатин/оксид железа (NPR-TRAIL) быть поглощенными опухолевыми клетками in vivo. Меченные родамином магнитные композитные наночастицы желатин/оксид железа (NPR) в чистом виде, или NPR-TRAIL были имплантированы непосредственно в опухолевую массу через 7 дней после имплантации опухолевых клеток GFP-U251. Через четыре дня животных безболезненно умерщвляли, головной мозг извлекали и быстро замораживали для изготовления срезов и визуализации (красное окрашивание и зеленое окрашивание означает присутствие NPR и опухолевых клеток GFP-U251, соответственно). Как показано на панелях G, Н и I, NPR-TRAIL были обнаружены не только в областях опухолевых масс, но также колокализованы вместе с опухолевыми клетками (панель I). Однако NPR в чистом виде обнаружены в областях опухолевых масс, но не колокализованы с опухолевыми клетками (панели D, E и, в частности, F). Контрольных животных обрабатывали с использованием PBS.
На фиг.28 показано, что конъюгированные с cRGD-пептидом меченные родамином магнитные композитные наночастицы желатин/оксид железа (NPR-cRGD) мигрируют по направлению к опухолевым клеткам in vivo. Через 7 дней после имплантации в головной мозг крысам линии nude опухолевых клеток GFP-U251, NPR-cRGD (10 мкл, содержащие 0,05 мг наночастиц, связанных с приблизительно 2 мкг cRGD-пептида) инъецировали в противоположную сторону. Через четыре дня животных безболезненно умерщвляли, головной мозг извлекали и мгновенно замораживали для изготовления срезов и визуализации (красное окрашивание и зеленое окрашивание означает присутствие меченных родамином магнитных композитных наночастиц желатин/оксид железа (NPR) и опухолевых клеток GFP-U251, соответственно).
На фиг.29 показано, что конъюгированные с cRGD-пептидом магнитные композитные наночастицы желатин/оксид железа (NPR-cRGD) и конъюгированные с TRAIL меченные родамином магнитные композитные наночастицы желатин/оксид железа (NPR-TRAIL) мигрируют по направлению к области повреждения in vivo. Повреждение было вызванно посредством инъекции PBS с помощью иглы в левую часть головного мозга, и последующие 4 дня в противоположную сторону головного мозга вводили 5 мкл (25 мкг) меченных родамином магнитных композитных наночастиц желатин/оксид железа (NPR) отдельно, NPR-TRAIL (50 нг связанного TRAIL), и NPR-cRGD. Через 4 дня животных безболезненно умерщвляли и флуоресценцию NPR наблюдали посредством флуоресцентного микроскопа. Как показано, незначительное количество NPR присутствовало в другой части головного мозга, но их распределение было обширным. NPR-TRAIL располагались, главным образом, вдоль участка повреждения. В отличие от этого, NPR-cRGD были распределены по всему участку повреждения головного мозга, а также вдоль мозолистого тела.
На фиг.30A-30B представлено действие TRAIL (10-100 нг/мл), магнитных композитных наночастиц желатин/оксид железа (NP) и конъюгированных с TRAIL магнитных композитных наночастиц желатин/оксид железа (NP-TRAIL, 10-40 нг связанных с TRAIL/мл), как в присутствии, так и в отсутствии ингибитора протеасом (PS, 5 мМ), на опухолевые клетки карциномы мочевого пузыря TSU-PR1 (30A), а также на клетки рака молочной железы MDA-MB и нормальные клетки молочной железы MCF10A (30B). Клеточную гибель определяли через 24 ч, используя анализ LDH. 100% клеточная гибель была определена в клетках, обработанных с помощью Triton X-100, и результаты были стандартизированы.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение обеспечивает наночастицы, состоящие из полимера, который является веществом, хелатирующим металл, покрытого оксидом магнитного металла, где по меньшей мере одно активное вещество ковалентно связано с данным полимером.
Магнитные композитные наночастицы полимер/оксид металла по настоящему изобретению основаны на магнитных композитных наночастицах полимер/оксид металла, раскрытых в WO 99/062079, включенном в настоящее описание полностью в качестве ссылки; однако дополнительно включающие по меньшей мере одно активное вещество, которое ковалентно связано с данным полимером внутри данной наночастицы. Такие наночастицы можно получить посредством любого подходящего способа, известного в уровне техники, например, с помощью процесса, подробно описанного далее в примерах 1-3, а именно посредством контролируемого образования активных центров оксида магнитного металла, например, оксида железа, на полимере, хелатирующем металл, например желатине, с которым ковалентно связано по меньшей мере одно активное вещество, где указанный полимер растворен в водном растворе, с последующим поэтапным наращиванием тонких слоев пленок оксида металла на данном ядре полимер/оксид металла. Как показано в этих примерах выход составляет почти 100%.
В примерах 1-2 ниже описывается получение магнитных наночастиц по настоящему изобретению, состоящих из желатина в качестве полимера, хелатирующего металл, и оксида железа в качестве оксида магнитного металла. Как показано в этих примерах, данные магнитные наночастицы по настоящему изобретению можно изготовить с очень узким распределением размеров и с размером в диапазоне от приблизительно 10 нм до приблизительно 100 нм. Более того, эти примеры, в частности, демонстрируют однородность, атомный порядок, магнитные характеристики и кристаллические свойства данных наночастиц. Наночастицы по настоящему изобретению являются супемагнетиками, а именно: они намагничиваются в присутствии магнитного поля, но в отсутствии магнитного поля не наблюдается остаточный магнетизм.
Анализ поверхности магнитных композитных наночастиц желатин/оксид железа, выполненный как описано в примерах 1-2, демонстрирует присутствие желатина и внутри, и на поверхности данной наночастицы. Обнаружено, что поверхностный желатин обеспечивает дополнительную стабилизацию против аггломерации наночасти, а также функциональные группы, такие как карбоксилат и первичные амины, посредством которых соответствующие лиганды могут быть ковалентно связаны.
Предпочтительно размер наночастиц по настоящему изобретению менее 300 нм, более предпочтительно, менее 100 нм.
В соответствии с настоящим изобретением полимер, хелатирующий металл, используемый для получения наночастиц по настоящему изобретению, может быть полимером, имеющим функциональные группы, способные связывать ионы металлов, в частности ионы железа, выбранные из амино, гидроксильной, карбоксилатной, -SH, эфирной, иминнной, фосфатной или сульфидной групп. В предпочтительных вариантах осуществления данный полимер, хелатирующий металл, отобран из желатина, полиметиленимина, хитозана или полилизина, более предпочтительным является желатин.
В одном варианте осуществления данный оксид магнитного металла, покрывающий вышеуказанный полимер, хелатирующий металл, представляет собой оксид железа, или феррит, происходящий из оксида железа. Оксид железа может представлять собой магнетит, оксимагнетит или их смесь, и данный феррит является оксидом по формуле (Fe,M)3O4, где М представляет собой ион металла переходной валентности, предпочтительно выбранный из Zn2+, Co2+, Mn2+ или Ni2+. В предпочтительном варианте осуществления данный оксид магнитного металла, используемый для изготовления наночастиц по настоящему изобретению, представляет собой оксид железа.
В соответствии с настоящим изобретением по меньшей мере одно активное вещество, ковалентно связанное с полимером, хелатирующим металл, может быть выбрано, без ограничений, из флуоресцентного красителя, контрастного вещества, пептида, пептидомиметика, полипептида или малой молекулы.
В одном варианте осуществления данной активное вещество, ковалентно связанное с полимером, хелатирующим металл, представляет собой флуоресцентный краситель. Примеры флуоресцентных красителей включают, но не ограничиваются перечисленным, родамин или флуоресцеин.
В другом варианте осуществления данное активное вещество, ковалентно связанное с полимером, хелатирующим металл, представляет собой контрастное вещество, а именно соединение, используемое для улучшения видимости внутренних органов либо при рентгенологическом исследовании, либо при магнитно-резонансной томографии (МРТ). Примеры контрастных веществ для рентгенологического исследования включают, но не ограничиваются перечисленным, контрастные вещества на основе сульфата бария, которые нерастворимы в воде, вводимые в организм только через пищеварительный тракт, либо путем глотания, либо с помощью клизмы, и растворимые в воде контрастные вещества на основе йода, которые можно использовать почти во всем организме, в частности внутривенно, а также внутриартериально, интратекально (позвоночник), и внутрибрюшинно. Общеупотребительными йодсодержащими контрастными веществами являются диатризоат (Гипак 50), метризоат (Изопак Коронар 370), йоксаглат (Гексабрикс), йопамидол (Isovue 370), йогексол (Омнипак 350), йоксилан (Оксилан), йопромид и йодиксанол (Визипак 320).
В следующем варианте осуществления данное активное вещество, ковалентно связанное с полимером, хелатирующим металл, представляет собой пептид или пептидомиметик.
Мотив аргинин-глицин-аспарагиновая кислота (Arg-Gly-Asp; RGD) компонентов внеклеточного матрикса, таких как фибронектин и витронектин, связывается с интегринами, и интегринопосредованная адгезия вызывает внутриклеточные сигнальные события, которые регулируют клеточную сохранность, пролиферацию и миграцию. Данные, полученные в результате скрининга посредством методов фагового дисплея для RGD-содержащих пептидов, показали их селективное связывание с эндотелиальной выстилкой кровеносных сосудов опухоли. RGD-пептиды также задерживают передачу сигналов, воздействуют на клеточную миграцию, и индуцируют регрессию опухолевых клеток или апоптоз. Связываясь с интегрином либо эндотелиальных, либо опухолевых клеток, пептиды RGD способны модулировать движение клеток in vivo, ингибируя присоединения опухолевая клетка-внеклеточный матрикс и опухолевая клетка-эндотелиальная клетка, которые являются обязательными для процессов метастазирования. Несколько исследований показали, что RGD-содержащие соединения могут препятствовать процессам метастазирования опухолевых клеток in vitro и in vivo. Пептиды, которые являются специфическими для характериных интегринов, представляют собой значительный интерес и возможное медицинское значение. Интегрин αvβ3 был первым интегрином, для которого доказана связь с опухолевым ангиогенезом, и RGD-пептиды, которые специфически блокируют интегрин αvβ3, являются перспективными в качестве ингибиторов опухолевого и ретинального ангиогенеза, остеопороза и для направленной доставки лекарственного средства в сосудистую сеть опухоли. Соответственно, большой объем работы был проделан для конструирования и получения интегрин-связывающих пептидов и пептидомиметиков.
В одном предпочтительном варианте осуществления данный пептид или пептидомиметик представляет собой, таким образом, пептид или пептидомиметик, содержащий циклический RGD (cRGD), или пептид или пептидомиметик, содержащий ациклический RGD. В более предпочтительном варианте осуществления, данный cRGD-пептид представляет собой cRGD-пептид с последовательностью цикло(Arg-Gly-Asp-D-Phe-Lys) (SEQ ID NO:1).
В еще одном варианте осуществления данное активное вещество, ковалентно связанное с полимером, хелатирующим металл, представляет собой полипептид.
Родственный фактору некроза опухоли лиганд, индуцирующий апоптоз (TRAIL, также называемый лиганд Apo-2, Apo-2L или TRAIL/Apo2L), является членом семейства факторов некроза опухоли (TNF) цитокинов, способен инициировать апоптоз посредством взаимодействия его рецепторов смерти. Дополнительными членами этого семейства являются, например, TNFα (также называемый TNF), TNFβ, TL1A (TNF-подобный лиганд), лимфотоксин-β (LTβ), лиганд CD30, лиганд CD27, лиганд CD40, лиганд OX-40, лиганд 4-1BB, лиганд Apo-1 (также называемый лиганд Fas или лиганд CD95), лиганд Apo-3 (также называемый лиганд RANK, ODF или TRANCE) и TALL-1 (также называемый BlyS, BAFF или THANK) (WO 2004/001009; Wang and El-Deiry, 2003).
TRAIL представляет собой трансмембранный белок типа II, изначально идентифицированный и клонированный на основе гомологичности последовательности его внеклеточного домена с CD95L (идентичность 28%) и TNF (идентичность 23%). Естественная последовательность полипептида TRAIL человека состоит из 281 аминокислоты; однако некоторые клетки могут вырабатывать природную растворимую форму данного полипептида, посредством ферментативного расщепления внеклеточной области полипептида. Как и большинство других членов семейства TNF, TRAIL образует гомотримеры, которые связывают рецепторные молекулы, каждый на границе между двумя его субъединицами. Действительно, TRAIL, как и большинство лигандов семейства TNF, находится и в мембран-ассоциированной, и в растворимой формах, которые могут обладать различной биоактивностью. Четыре члена семейства TNF, а именно лиганд Fas, TNFα, TL1A и TRAIL, выделяются своей способностью индуцировать апоптоз. В отличие от других членов семейства TNF растворимая форма TRAIL (sTRAIL) обладает уникальной особенностью структуры, в которой остатки цистеина вместе взаимодействуют с атомом Zn, который является необходимым для стабильности трехзвенного полимера и оптимальной биологической активности. Функциональные исследования показали, что TRAIL обладает потенциальной способностью индуцировать апоптоз, in vitro, в разнообразных опухолевых клеточных линиях, в том числе опухолях толстой кишки, легких, молочной железы, предстательной железы, мочевого пузыря, почек, яичников и опухолях мозга, а также при меланоме, лейкемии и множественной миеломе, но не в большинстве нормальных клетках, что выделяет его потенциальное терапевтическое применение при лечении рака (WO 2004/001009; Wang and El-Deiry, 2003; Ashkenazi et al., 1999; Carlo-Stella et al., 2007; Smyth et al., 2003). Существует всего лишь несколько веществ, которые на самом деле специфичны для раковых клеток с точки зрения эффективности или индукции клеточной гибели, как TRIAL. В отличие от других членов семейства TNF, чья экспрессия сильно регулируется, и которые зачастую только временно экспрессируются на активированных клетках, мРНК TRIAL нерегулируемо экспрессируется в широком диапазоне тканей. Несмотря на то, что главной биологической функцией TRIAL считается индукция апоптоза, полная физиологическая роль этого лиганда еще полностью не изучена. Кажется вероятным, что экспрессия TRIAL клетками природными киллерами (NK) печени регулируется посредством IFNγ, секретируемым NK-клетками аутокринно, поскольку большая часть NK-клеток конститутивно продуцирует и TRIAL и IFNγ у мышей дикого типа и мышей с дефицитом Т-клеток. Исследования на мышах с нокаут геном показали, что TRIAL играет важную роль в противоопухолевом контроле иммунными клетками, и что он опосредует апоптоз тимоцитов и является важным в индукции аутоиммунных заболеваний.
TRAIL индуцирует апопотоз, взаимодействуя со своими рецепторами. До настоящего времени выявлено четыре гомологичных рецептора человека для TRIAL, включающие DR4, KILLER/DR5, DcR1 (Trail-R3 TRID) и DcR2 (TRAIL-R4), а также пятый растворимый рецептор, называемый остеопротегерин (OPG), первоначально обозначаемый как рецептор RANKL/OPGL. И DR4, и DR5 содержат мотив консервативного домена смерти (DD) и могут давать сигнал для апоптоза. Другие три рецептора выступают в роли «ложных» для их способности ингибировать TRIAL-индуцированный апоптоз в случае сверхпродукции. Ложный рецептор 1 (DcR1) и DcR2 имеют близкую гомологичность с внеклеточными доменами DR4 и DR5. DcR2 имеет укороченный, нефункциональный цитоплазматический DD, в то время, как DcR1 не имеет цитозольную область и заякорен на плазматической мембране посредством гликофосфолипидного компонента. Физиологическая значимость OPG, в качестве рецептора для TRIAL, неясна, потому что аффинность для этого лиганда при физиологических температурах очень низка. Возможным объяснением селективной противоопухолевой активности TRIAL является то, что эти ложные рецепторы предпочтительно экспрессируются в нормальных клетках по сравнению с опухолевыми клетками, и препятствуют действию TRIAL (WO 2004/001009; Wang and El-Deiry, 2003; Carlo-Stella, 2007; Shah et al., 2003). Другим возможным объяснением является то, что большинство опухолевых клеточных линий экспрессируют агонисты рецепторов к TRIAL, но не экспрессируют, или экспрессируют неопределяемые уровни, антагонистов рецепторов, в то время как было обнаружено, что нормальные клетки экспрессируют антагонисты рецептров к TRIAL, и следовательно, TRAIL может позволить селективное уничтожение только опухолевых клеток (Wei et al., 2006).
Несмотря на ранее полученные многообещающие результаты, недавние исследования выявили несколько устойчивых к TRIAL раковых клеток в различных опухолях. Показано, что резистентность раковых клеток к TRIAL возникает посредством модуляции различных молекулярных мишеней, которые могут включать дифференциальную экспрессию рецепторов смерти. Основываясь на молекулярном анализе сигнальных путей рецепторов смерти было разработано несколько новых способов увеличения эффективности TRIAL, в том числе применение стандартных противоопухолевых лекарственных средств или о