Способ получения веществ, стимулирующих клеточное дыхание
Иллюстрации
Показать всеИзобретение относится к получению содержащих динитрофенольный фрагмент 2-гидрокси-3,5-динитро-N-(салицилиден)-анилину или 2-гидрокси-3,5-динитро-N-(4-диметиламинобензилиден)-анилину, рассеивающих протонный градиент, создаваемый дыханием, и влияющих на окислительное фосфорилирование в митохондриях, взаимодействием 2-амино-4,6-динитро фенола и салицилового альдегида или п-диметиламино бензальдегида. 5 ил.
Реферат
Изобретение относится к области медицины, а также к биохимии и может быть использовано для получения биологически активных веществ, стимулирующих клеточное дыхание, в лабораторных и промышленных условиях.
Известен способ получения препарата, стимулирующего клеточное дыхание (патент №2066995, от 12.10.1993 г., кл. А61К 35/14). Сущность способа в том, что ферментативный гидролиз сыворотки крови телят проводят с использованием бактериальной эндопротеазы в определенных условиях до получения субстанции препарата гидролизатов.
Известны также азометины, обладающие рострегулирующей активностью (патент №2146251, №2146252 от 18.01.1999 г.). Производные 6-метил-1,2,4-триазинона-5 обладают положительной рострегулирующей активностью и могут быть рекомендованы в сельском хозяйстве для повышения урожая культур.
Задача - получение соединений, обладающих стимулирующим действием на клеточное дыхание.
Сущность способа в том, что получены различные азометины, содержащие динитрофенольный фрагмент, соединенный с различными радикалами, рассеивающие протонный градиент, создаваемый дыханием, и влияющие на окислительное фосфорилирование в митохондриях.
Получают азометины реакцией пикраминовой кислоты с ароматическими альдегидами. Азометины - обширный класс соединений, синтезировано их достаточное множество. Среди них найдено множество соединений, обладающих биологической активностью, много лекарственных препаратов. Основное применение они находят в органическом синтезе, главным образом для получения вторичных аминов и гетероциклических соединений.
Нами синтезированы азометины на основе ароматических аминов и замещенных бензальдегидов.
2-гидрокси-3,5-динитро-N-(салицилиден)-анилин нами получен реакцией 2-амино-4,6-динитрофенола (пикраминовой кислоты) с салициловым альдегидом. Реакция протекает в течение 2-х часов на водяной бане при 75°С
В ИК-спектре полученного соединения обнаружена интенсивная полоса в области 1610 см-1, принадлежащая валентным колебаниям азометиновой группы.
В результате аналогичной реакции между 2-амино-4,6-динитрофенолом и парадиметиламинобензальдегидом образуется 2-гидрокси-3,5-динитро-N-(4-диметиламинобензилиден)-анилин:
В ИК-спектре полученного азометина обнаружена интенсивная полоса в области 1610 см-1, принадлежащая азометиновой группе.
Полученные соединения представляют собой окрашенные в оранжевый цвет кристаллические вещества, растворимые в спирте, хлороформе, бензоле.
Таким образом, общим в структуре исследуемых соединений является наличие динитрофенольного фрагмента.
Динитрофенол является довольно сильной кислотой и, следовательно, способен к обратимому связыванию протонов:
В то же время этот фрагмент гидрофобен и поэтому способствует проникновению через биомембрану. Объединение этих двух свойств делает производные 2,4-динитрофенола (ДНФ) разобщителями окислительного фосфорилирования.
Присоединение радикала R к динитрофенольному фрагменту существенно не изменяет способности этого фрагмента к диссоциации, поэтому производные динитрофенола также способны к разобщению окислительного фосфолирования. Скорость дыхания в разобщенном состоянии определяется активностью переносчиков электронов электрон-транспортной цепи или активностью фермента, поставляющего восстановительные эквиваленты в электрон-транспортную цепь. В нашем случае это сукцинатдегидрогеназа, поскольку в качестве субстрата использовался сукцинат.
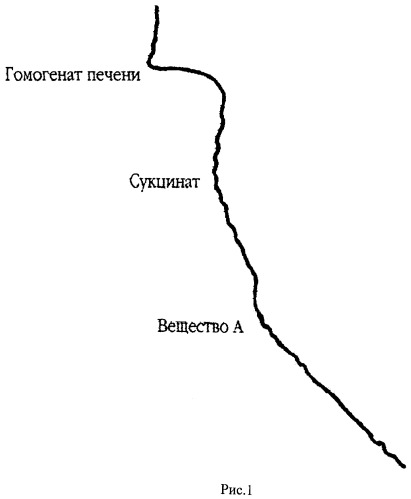
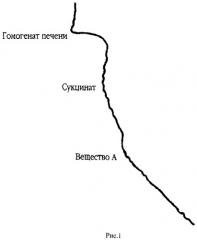
На рис.1 представлена кривая кинетики потребления кислорода гомогенатом печени крыс в полярографической ячейке с электродом Кларка в качестве регистрирующего датчика. По оси абсцисс откладывается величина тока восстановления кислорода на электроде Кларка, по оси ординат отложено время. Скорость потребления кислорода определяется по тангенсу угла наклона кривой к оси ординат (V=dc/dt, V - скорость потребления, с - концентрация кислорода в ячейке, t - время). В ячейку последовательно добавляют буфер, гомогенат печени крыс, субстракт окисления (сукцинат), вещество А (2-гидрокси-3,5-динитросалицилиденанилина).
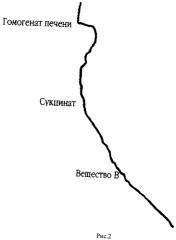
На рис.2 представлена кривая кинетики потребления кислорода гомогенатом печени крыс в полярографической ячейке с электродом Кларка в качестве регистрирующего датчика. По оси абсцисс откладывается величина тока восстановления кислорода на электроде Кларка по оси ординат отложено время. Скорость потребления кислорода определяется по тангенсу угла наклона кривой к оси ординат (V=dc/dt, V - скорость потребления, с - концентрация кислорода в ячейке, t - время). В ячейку последовательно добавляют буфер, гомогенат печени крыс, субстракт окисления (сукцинат), вещество В (2-гидрокси-3,5-динитро-N-(4-диметиламинобензилиден)-анилина).
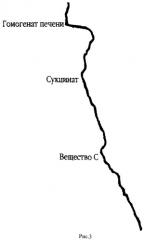
На рис.3 представлена кривая кинетики потребления кислорода гомогенатом печени крыс в полярографической ячейке с электродом Кларка в качестве регистрирующего датчика. По оси абсцисс откладывается величина тока восстановления кислорода на электроде Кларка, по оси ординат отложено время. Скорость потребления кислорода определяется по тангенсу угла наклона кривой к оси ординат (V=dc/dt, V - скорость потребления, с - концентрация кислорода в ячейке, t - время). В ячейку последовательно добавляют буфер, гомогенат печени крыс, субстракт окисления (сукцинат), вещество С (4-метокси-5-амино-6-тио-(2,4-динирофенил)-пиримидина).
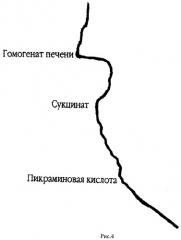
На рис.4 представлена кривая кинетики потребления кислорода гомогенатом печени крыс в полярографической ячейке с электродом Кларка в качестве регистрирующего датчика. По оси абсцисс откладывается величина тока восстановления кислорода на электроде Кларка, по оси ординат отложено время. Скорость потребления кислорода определяется по тангенсу угла наклона кривой к оси ординат (V=dc/dt, V - скорость потребления, с - концентрация кислорода в ячейке, t - время). В ячейку последовательно добавляют буфер, гомогенат печени крыс, субстракт окисления (сукцинат), пикраминовую кислоту.
На рис.5 представлена кривая кинетики потребления кислорода гомогенатом печени крыс в полярографической ячейке с электродом Кларка в качестве регистрирующего датчика. По оси абсцисс откладывается величина тока восстановления кислорода на электроде Кларка, по оси ординат отложено время. Скорость потребления кислорода определяется по тангенсу угла наклона кривой к оси ординат (V=dc/dt, V - скорость потребления, с - концентрация кислорода в ячейке, t - время). В ячейку последовательно добавляют буфер, гомогенат печени крыс, субстракт окисления (сукцинат), АДФ (аденозиндифосфорную кислоту), разобщитель (ДНФ, 2,4-динитрофенол). Чем сильнее разобщитель, тем сильнее ускоряется потребление кислорода.
В качестве стандарта для сравнения разобщающих способностей использовался ДНФ, так как это наиболее широко используемый в молекулярной биоэнергетике разобщитель. Известно, что в концентрации 10-4 моль/л ДНФ практически полностью разобщает окисление с фосфорилированием, то есть синтез АТФ в присутствии ДНФ практически отсутствует, а скорость дыхания максимальна. Следует, однако, отметить, что при достаточно долгом разобщенном дыхании в определенных условиях окисление сукцината может приводить к накоплению в митохондриях щавелевоуксусной кислоты (ЩУК), которая в микромолярных концентрациях сильно ингибирует активность сукцинатдегидрогеназы, что может приводить к практически полному подавлению дыхания. Условия, при которых в митохондриях накапливается ЩУК, состоят в том, что скорость образования ЩУК должна превышать скорость ее утилизации, либо в результате переаминирования, либо конденсацией с ацетил-К0А и образованием лимонной кислоты. Чтобы исключить ЩУКовое торможение, в среду инкубации добавляли глутамат, который в реакции переаминирования с ЩУК дает аспартат и α-кетоглутарат, которые не являются ингибиторами сукцинатдегидрогеназы. ДНФ в концентрации 10-4 моль/л ускоряет дыхание на 50% по сравнению с начальной скоростью дыхания на сукцинате. Вещество А в той же концентрации увеличивает скорость на 103% и таким образом оно является лучшим стимулятором дыхания по сравнению с ДНФ. Если предположить, что ДНФ полностью разобщает дыхание с фосфорилированием, то увеличение скорости дыхания в присутствии вещества А по сравнению с ДНФ может быть обусловлено либо повышением активности переносчиков электрон-транспортной цепи, либо активацией сукцинатдегидрогеназы. Вещество А по сравнению с ДНФ обладает дополнительным объемным гидрофобным радикалом, что должно увеличивать его растворимость в липидах мембран. Поэтому можно предположить, что концентрация вещества А во внутренней мембране митохондрий будет выше, чем концентрация ДНФ. Это, с одной стороны, может ускорить транспорт протонов через мембрану, а с другой стороны, привести к изменению фазового состояния липидов внутренней мембраны митохондрий. Например, это может привести к увеличению жидкостности (уменьшению вязкости) липидов мембраны.
Поскольку предполагается, что лимитирующей стадией электронного транспорта является перенос электронов от коэнзима-Q на цитохромную цепочку, причем скорость переноса определяется скоростью диффузии коэнзима-Q в мембране, то уменьшение вязкости должно привести к увеличению скорости диффузии коэнзима-Q, а следовательно, и скорости дыхания.
Вещество В ускоряет дыхание на 72%. Оно отличается от вещества А тем, что к ароматическому радикалу присоединена N(СН3)2 группа. Молекулярные веса веществ А и В близки и довольно близки их эффекты на скорость дыхания, различие, которое имеется, обусловлено, видимо, какими-то специфическими взаимодействиями с участниками электрон-транспортной цепи.
Наибольший стимулирующий эффект наблюдается для пикраминовой кислоты, которая по сравнению с ДНФ имеет добавочную NH2-группу, расположенную рядом с ОН-группой. Она увеличивает скорость дыхания на 144%. Это видимо приводит к увеличению константы диссоциации ОН-группы, при этом способность связывать и освобождать протон увеличивается, а это, в свою очередь, увеличивает протонофорную и, следовательно, разобщающую способности.
Из приведенных результатов видно, что вариация в химической структуре радикалов, соединенных с динитрофенольным фрагментом, влияет на стимулирующий эффект соединения. Мы выяснили, что эта зависимость величины эффекта от структуры связана не только с разобщающим действием этих соединений, но и с возможным их влиянием на электронный транспорт во внутренней мембране митохондрии и активность ферментов, поставляющих восстановительные эквиваленты (электроны) в электрон-транспортную цепь.
Скорость дыхания в разобщенном состоянии определяется активностью переносчиков электронов электрон-транспортной цепи.
Опыты проводили на гомогенате крыс. Крысу декапитировали и выделяли исследуемый орган - печень. Ткань промывали ледяным физиологическим раствором. Извлеченную из раствора ткань промакивали фильтровальной бумагой и взвешивали навеску в 1 грамм. Затем ткань измельчали ножницами. Готовили 10% гомогенат (1 г ткани + 9 мл среды выделения). Для этого использовали гомогенизатор Поттера с тефлоновым пестиком, гомогенизировали при 800 об/мин в течение 0,5 минуты.
Все операции проводились на холоде, кроме того стакан, тефлоновый пестик, пипетки и среду выделения предварительно охлаждали.
Состав среды выделения:
| Сахароза | - 0,2 М |
| ЭДТА | - 1 мМ |
| Hepes | - 10 мМ |
| KCl | - 50 мМ |
рН среды выделения доводили от 2,5Н NaOH до 7,5.
Определение скорости дыхания гомогената ткани крысы проводили полярографическим методом. Измерение дыхания проводили на полярографе ZP - 7. Среда инкубации:
| Сахароза | - 0,2 М |
| ЭДТА | - 1 мМ |
| Hepes | - 10 мМ |
| KCl | - 50 мМ |
| KH2PO4 | - 2 мМ |
Дыхательный субстрат - сукцинат натрия (конечная концентрация 1 мМ); глутамат натрия (конечная концентрация 1 мМ).
Исследуемое вещество (конечная концентрация 10-4 М).
pH реактивов доводили от 2,5Н NaOH до 7,5.
В полярографическую ячейку с электродом через специальные отверстия шприцом вносили 1 мМ среды инкубации 26°С и включали самописец. В ячейку помещали магнитную мешалку. Через полминуты вносили микропипеткой 0,2 мл гомогената ткани.
В этих условиях регистрация продолжалась 0,5 минут, затем вносили 50 мкл сукцината Na. Еще через минуту добавляли 20 мкл исследуемого вещества. Регистрация проводилась трижды, и затем брали среднее.
Предлагаемый способ позволяет получить вещества, которые повышают эффективность потребления кислорода гомогенатами ткани печени крыс, что влияет на клеточное дыхание.
Азометины, содержащие динитрофенольный фрагмент, соединенный с различными радикалами, обладают стимулирующим эффектом на потребление кислорода гомогенатами ткани печени крыс. Величина эффекта зависит от структуры радикала, связанного с динитрофенольным фрагментом. Предполагается, что исследуемые вещества не только рассеивают протонный градиент, создаваемый дыханием, но оказывает влияние и на других участников окислительного фосфорилирования в митохондриях.
Способ получения веществ, стимулирующих клеточное дыхание, содержащих динитрофенольный фрагмент, таких как 2-гидрокси-3,5-динитро-N-(салицилиден)-анилин или 2-гидрокси-3,5-динитро-N-(4-диметиламинобензилиден)-анилин, рассеивающих протонный градиент, создаваемый дыханием и влияющих на окислительное фосфорилирование в митохондриях, взаимодействием 2-амино-4,6-динитрофенола и салицилового альдегида или п-диметиламинобензальдегида.