Соединения, связывающие домен bir белков iap
Иллюстрации
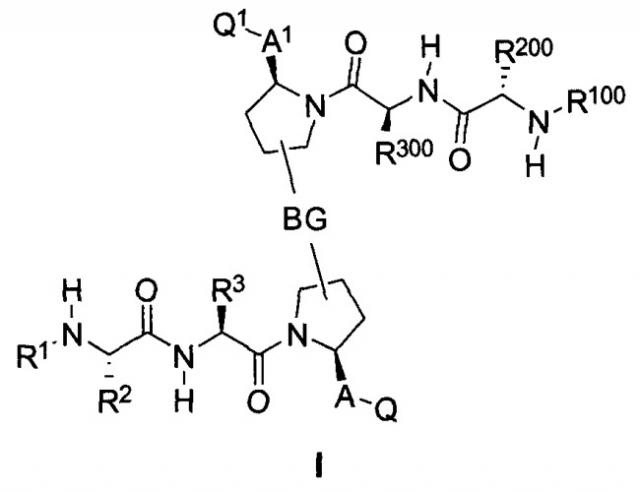
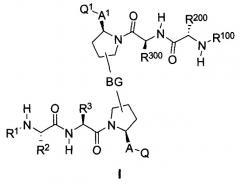
Показать всеИзобретение относится к соединениям формулы (I) или (II)
включая его энантиомер или диастереомер, где значения R1, R2, R3, R100, R200, R300, A, A1, BG, Q и Q1 приведены в пункте 1 формулы. Соединения могут быть использованы для лечения пролиферативных расстройств, например рака. 13 н. и 29 з.п. ф-лы, 29 схем, 7 ил., 7 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к мостиковым соединениям, которые связываются с доменами BIR белков IAP и применимы для лечения пролиферативных расстройств и расстройств, связанных с нарушением регуляции апоптоза, таких как рак.
УРОВЕНЬ ТЕХНИКИ
Апоптоз или запрограммированная смерть клеток, как правило, имеет место при нормальном развитии и деятельности здоровых тканей в многоядерных организмах. Апоптоз является сложным процессом, который приводит к удалению поврежденных, больных или избыточно развитых клеток в отсутствие признаков воспаления или некроза.
Известно, что нарушение регуляции естественных сигнальных путей апоптоза чаще всего происходит при раке и лимфопролиферативных синдромах, а также при аутоиммунных расстройствах, таких как рассеянный склероз, при нейродегенеративных заболеваниях и при воспалении. Кроме того, были описаны изменения в апоптической реакции хозяина при развитии или наличии вирусных или бактериальных инфекций.
Каспазы представляют собой семейство протеолитических ферментов класса цистеин протеаз, которые, как известно, инициируют и осуществляют апоптоз. В нормальных клетках каспазы представлены в виде неактивных проферментов, которые подвергаются каталитической активации после поступления внешних сигналов, например, сигналов, являющихся результатом вызываемой лигандами активации рецептора смерти, например, цитокинов или иммунологических агентов или же из-за высвобождения митохондриальных факторов, таких как цитохром C, после генотоксического, хемотоксического или радиационного поражения клеток. Белки-ингибиторы апоптоза (IAP) образуют семейство белков, которые способны связываться с каспазами и ингибировать их активность, подавляя тем самым клеточный апоптоз. Благодаря ключевой роли в регулировании активности каспаз IAP способны ингибировать программируемую смерть клеток, возникающую под действием широкого спектра пусковых механизмов, которые включают утрату гомеостатических или эндогенных механизмов регулирования клеточного роста, а также химиотерапевтические лекарственные средства и радиационное облучение.
IAP содержат от одного до трех гомологичных структурных доменов, известных как повторяющиеся бакуловирусные домены IAP (BIR). Кроме того, на C-конце они могут включать цинксодержащий пальцеобразный домен RING («цинковый палец»), обладающий способностью вызывать убиквитинилацию IAP-связывающих молекул за счет его функции E3 лигазы. Каждый из человеческих IAP, а именно XIAP, HIAP1 (именуемый также cIAP2) и HIAP2 (cIAP1), имеет три BIR домена и карбоксиконцевой цинковый палец RING. Другой IAP, а именно NAIP, имеет три домена BIR (BIR1, BIR2 и BIR3), но не содержит домена RING, тогда как Livin, TsIAP и MLIAP содержат один домен BIR и домен RING. Связанный с X-хромосомой ингибитор апоптоза (XIAP) представляет собой пример IAP, который может ингибировать инициатор каспазы, известной как каспаза-9 и эффектор каспаз, а именно каспазу-3 и каспазу-7, за счет непосредственного связывания. Кроме того, он может индуцировать уничтожение каспаз с помощью опосредованного убиквитинилацией протеасомного сигнального пути за счет E3 лигазной активности «цинкового пальца» домена RING. Именно через домен BIR3 XIAP связывается с каспазой-9 и ингибирует ее активность. Линкерный домен BIR2 XIAP ингибирует активность каспаз-3 и -7. Домены BIR XIAP также связывали с взаимодействиями IAP с факторами, связанными с рецепторами факторов некроза опухолей (TRAF)-1 и 2, и с TAB1, в качестве адапторных белков, осуществляющих передачу сигнала выживания с помощью активации NFkB. Таким образом, IAP осуществляют непосредственное торможение каскада апоптоза путем предотвращения действия или ингибирования активных каспаз, а также путем перенаправления передачи клеточного сигнала в режим обеспечения выживания.
Прогресс в области лечения рака привел к новой парадигме в биологии рака, согласно которой неоплазия может рассматриваться как неспособность раковых клеток реализовывать нормальные сигнальные пути апоптоза. Нормальные клетки получают непрерывные сигналы от окружающих тканей с помощью различных внутриклеточных и внеклеточных факторов и «кончают самоубийством», если их удалить из этого окружения. Эта индукция апоптоза достигается за счет активации каскада каспаз. Однако раковые клетки приобретают способность преодолевать или обходить эту регуляцию апоптоза и продолжать неадекватную пролиферацию. Большинство способов лечения рака вызывает по меньшей мере частичную апоптическую реакцию в раковой клетке-мишени, приводя к ремиссии или началу регресса опухоли. Однако во многих случаях оставшиеся клетки, которые устойчивы к апоптозу, способны избегать действия терапии и продолжать процесс онкогенного/генетического перерождения, который приводит к опасности появления метастатического заболевания с высокой устойчивостью к действию лекарственных средств, которое преодолевает возможности современной медицины эффективно лечить данное заболевание. Кроме того, большинство способов лечения рака, включая радиационную терапию и традиционную химиотерапию, действительно вызывают апоптоз раковых клеток, но, кроме того, приводят к повреждению обычных клеток из-за недостаточной специфичности методик, которая не позволяет им вызывать апоптоз только в раковых клетках. Важно улучшить специфичность/эффективность проапоптических средств, применяемых для лечения рака и, конечно, других пролиферативных расстройств, с целью достижения преимуществ, вытекающих из уменьшения побочных эффектов, связанных с введением этих средств. Следовательно, обнаружение новых средств стимулирования апоптоза в раковых клетках является важнейшей потребностью медицины, и решение этой проблемы даст возможность разработать абсолютно новые способы лечения рака.
Растущий объем данных показывает, что раковые клетки могут избегать апоптоза за счет непрерывной избыточной экспрессии одного или нескольких белков, входящих в семейство белков IAP, что зафиксировано во многих первичных образцах биопсии опухолей, а также для наиболее известных линий раковых клеток. Эпидемиологические исследования показали, что избыточная экспрессия различных IAP связана с плохим клиническим прогнозом и продолжительностью жизни. В случае XIAP это показано для таких разных видов рака, как лейкемия и рак яичников. Избыточная экспрессия HIAP1 и HIAP2 вследствие распространенной амплификации участка хромосомы 11q21-q23, который охватывает оба белка, наблюдалась при различных злокачественных заболеваниях, в т.ч. медуллобластомах, карциномах почечных клеток, глиобластомах и карциномах желудка. Молекулы, осуществляющие отрицательную регуляцию (X)IAP, такие как XAF, по-видимому, являются супрессорами опухолей, содержание которых очень часто уменьшается при клинических случаях рака. Так, благодаря их способности подавлять активацию и деятельность природных медиаторов апоптоза, т.е. каспаз, IAP могут непосредственно способствовать прогрессированию опухолей и их устойчивости к введению фармацевтических средств. Стимулирование апоптоза в раковых клетках с применением эффективных малых молекул, которые связываются со специфическими доменами IAP, является предметом настоящего изобретения.
Авторы настоящего изобретения и другие исследователи показали решающее значение отдельных доменов BIR для воздействия на антиапоптическую функцию IAP. Авторы настоящего изобретения предположили, что антагонисты IAP, которые могут связываться с индивидуальными доменами BIR, могли бы прекращать антиапоптическую функцию IAP. В самом деле, индивидуальные BIR играют роль наиболее важных сайтов связывания для N-концевых остатков каспаз 3, 7 и 9 соответственно Ser-Gly-Val-Asp, Ser-Gly-Pro-Ile и Ala-Thre-Pro-Ile, и такое связывание крайне необходимо для реализации функции IAP по ингибированию каспаз. Связывание N-концевых AxPy тетра-пептидных остатков с XIAP приводит к высвобождению активных каспаз 3, 7 и 9. В случае других IAP, например, c-IAP1 и c-IAP2, функции BIR при связывании лиганда, по-видимому, заключаются в том, чтобы направлять активацию убиквитин-лигазной функции домена RING белков IAP или индивидуальных IAP самих по себе на связанную мишень, чтобы вызывать уничтожение протеосомами. В другом случае малые молекулы-антагонисты IAP должны являться отличными проапоптическими агентами, обладающими потенциальной применимостью при раке, различных пролиферативных расстройствах и воспалении.
Митохондриальный белок млекопитающих, а именно вторичный митохондриальный активатор каспаз (SMAC), который является антагонистом функции IAP, в основном связывается с сайтами BIR3 или BIR2 соответствующих белков IAP через AxPy аминоконцевой тетрапептид. Четыре белка дрозофил, индуцирующих смерть клеток, а именно Reaper, HID, Grim и Sickle, которые противодействуют способности IAP дрозофил ингибировать каспазы, также связываются с доменами BIR аналогичных IAP дрозофил через короткий аминоконцевой тетрапептид AxPy, т.е. последовательность, которая встроена в BIR-связывающий карман и нарушает взаимодействия IAP-каспазы.
Общая топология индивидуальных доменов BIR является весьма консервативной среди человеческих IAP и среди индивидуальных доменов BIR человеческих IAP, причем каждый BIR представляет собой цинксодержащий пальцеобразный полипептидный домен, соединенный с координированным атомом Zn с помощью двух остатков цистеина и остатка гистидина. Рентгеноструктурные кристаллографические исследования доменов BIR2 и BIR3 XIAP выявляют очень важный связывающий карман для фрагмента AXPY на поверхности каждого из доменов BIR. В обоих доменах BIR2 и BIR3 имеются чередования в промежуточных аминокислотных последовательностях, которые формируют связывающий карман и бороздку. Подобным же образом авторы настоящего изобретения описали гомологичные домены в BIR других IAP, а именно cIAP1 и cIAP2. Это открывает возможность получения различных классов природных и синтетических связывающихся соединений, которые будут обладать различной специфичностью и сродством к связыванию в отношении каждого из доменов BIR для каждого из IAP. Понимание пути, которым такие соединения будут воздействовать на биологические функции IAP в раковых клетках по сравнению с нормальными клетками, является основной перспективой в открытии новых средств лечения рака и других пролиферативных расстройств, при которых наблюдается нарушение регуляции функции IAP. Именно авторы настоящего изобретения обнаружили, что некоторые классы BIR-связывающих соединений могут связываться с BIRs IAP с неожиданно высокой селективностью и эффективностью, что приводит для определенных структурных классов к получению значительной терапевтической пользы, которая теоретически является следствием либо утраты функции IAP, либо уменьшения содержания клеточного белка IAP, либо обеих указанных причин.
Был описан ряд пептидных AxPy-подобных и AxPy пептидных соединений, модифицированных гетероциклическими фрагментами, которые активируют клеточную каспазу 3, по имеющимся данным за счет связывания с BIR3 XIAP. Для ознакомления с последними обзорами см.: Elmore et al., Annual Reports in Medicinal Chemistry, 40 (2006) 245-262; Sun et al., Bioorg. Med. Chem. Let. 15 (2005) 793-797; Oost et al., J.Med.Chem., 2004, 47(18), 4417-4426; Park et al., Bioorg. Med. Chem. Lett. 15(2005) 771-775; Franklin et al., Biochemistry, Vol. 42, No. 27, 2003, 8223-8231; Kip et al., Biochemistry 2002, 41, 7344-7349; Wu et al., Chemistry and Biology, Vol.10, 759-767 (2003); Glover et al., Analytical Biochemistry, 320 (2003) 157-169; опубликованную заявку на патент США номер 20020177557; и опубликованную заявку на патент США номер 20040180828; опубликованную заявку на патент США номер US2006/0025347A1; опубликованную заявку на патент США номер US2005/0197403A1; и опубликованную заявку на патент США номер US2006/0194741A1.
Путем замещения флуоресцентно-меченого зонда было показано, что упомянутые выше соединения эффективно нацелены на изолированный домен BIR3 XIAP и, по-видимому, вызывают апоптоз в выбранном наборе линий раковых клеток в диапазоне низких микромолярных-наномолярных концентраций. Эти соединения проявили плохую активность in vivo, вероятно, из-за ограниченной биодоступности и, следовательно, могут иметь ограниченное терапевтическое применение.
Таким образом, домены BIR IAP представляют собой привлекательную цель для открытия и разработки новых терапевтических средств, в особенности для лечения пролиферативных расстройств, например рака.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения ранее раскрыли ряд соединений, которые связываются с фрагментом BIR белков IAP и индуцируют апоптоз в различных линиях раковых клеток (опубликованная заявка на патент США номер 20060264379). Отличительной особенностью этих соединений является наличие центрального пирролидинового фрагмента. В настоящей заявке авторы сообщают, что соединение двух BIR-связывающих фрагментов с помощью замещенного пирролидина, при надлежащем выборе участка, ориентации и химической природы соединительного фрагмента, дает возможность получить новые и явно предпочтительные классы соединений, причем увеличение эффективности против различных линий раковых клеток достигает 1000 раз по сравнению с немостиковыми BIR-связывающими соединениями, что является следствием инициирования апоптоза, и эти соединения проявляют эффективность, стабильность и фармацевтические свойства, необходимые для лечении раковых заболеваний у людей. Химическая природа мостиковой группы может быть преимущественно выбрана таким образом, чтобы вызвать преобразование высокой собственной (суб-наномолярной) внутриклеточной эффективности в эффективность порядка мкг/кг при ингибировании и/или подавлении активности IAP в нескольких моделях in vivo человеческих раковых заболеваний на основе ксенотрансплантата. Кроме того, описанные соединения обладают фармацевтически приемлемой стабильностью в ряде тканей и жидких сред млекопитающих и имеют фармацевтические свойства, которые гарантируют достаточную растворимость и биодоступность при применении различных путей введения, подходящих для клинического применения. Указанное введение приводит к получению длительных in vivo эффектов у млекопитающих, зафиксированных в нормальных и опухолевых тканях.
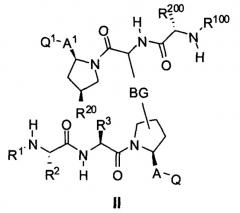
В одном из вариантов осуществления настоящего изобретения разработаны изомеры, энантиомеры, диастереомеры или таутомеры соединений, представленных формулой (I) или (II)
где
m равно 0, 1 или 2;
Y означает NH, O или S;
BG означает
1) -X-L-X1-;
X и X1 независимо выбраны из
1) O,
2) NR13,
3) S,
4) -C1-C6алкила-,
5) -C1-C6алкил-O-,
6) -C1-C6алкил-NR13-,
7) -C1-C6алкил-S-,
8)
9)
10)
11)
12)
13)
14) или
15)
L выбран из
1) -C1-C20алкила-,
2) -C2-C6алкенила-,
3) -C2-C4алкинила-,
4) -C3-C7циклоалкила-,
5) -арила-,
6) -бифенила-,
7) -гетероарила-,
8) -гетероциклила-,
9) -C1-C6алкил-(C2-C6алкенил)-C1-C6алкила-,
10) -C1-C6алкил-(C2-C4алкинил)-C1-C6алкила-,
11) -C1-C6алкил-(C3-C7циклоалкил)-C1-C6алкила-,
12) -C1-C6алкиларил-C1-C6алкила-,
13) -C1-C6алкилбифенил-C1-C6алкила-,
14) -C1-C6алкилгетероарил-C1-C6алкила-,
15) -C1-C6алкилгетероциклил-C1-C6алкила-,
16) -C1-C6алкил-Y-C1-C6алкила-,
17) -арил-Y-арила-,
18) -гетероарил-Y-гетероарила,
19) -гетероциклил-Y-гетероциклила,
20) или
21)
где алкил, алкенил, алкинил и циклоалкил необязательно замещены одним или несколькими заместителями R6, и арил, бифенил, гетероарил и гетероциклил необязательно замещены одним или несколькими заместителями R10;
Q и Q1 независимо выбраны из
1) NR4R5,
2) OR11 или
3) S(O)mR11; или
Q и Q1 независимо выбраны из
1) арила или
2) гетероарила, где арил и гетероарил необязательно замещены одним или несколькими заместителями R10;
A и A1 независимо выбраны из
1) -CH2-,
2) -CH2CH2-,
3) -CH(C1-C6алкил)-,
4) -CH(C3-C7циклоалкил)-,
5) -C3-C7циклоалкила-,
6) -CH(C1-C6алкил-C3-C7циклоалкил)-,
7) -C(O)- или
8) -C(O)OR13;
R1 и R100 независимо выбраны из
1) H или
2) C1-C6алкила, необязательно замещенного одним или несколькими заместителями R6;
R2 и R200 независимо выбраны из
1) H или
2) C1-C6алкила, необязательно замещенного одним или несколькими заместителями R6;
R3 и R300 независимо представляют собой C1-C6алкил, необязательно замещенный одним или несколькими заместителями R6;
Каждый из R4 и R5 независимо выбран из
1) H,
2) галогеналкила,
3) ←C1-C6алкила,
4) ←C2-C6алкенила,
5) ←C2-C4алкинила,
6) ←C3-C7циклоалкила,
7) ←C3-C7циклоалкенила,
8) ←арила,
9) ←гетероарила,
10) ←гетероциклила,
11) ←гетеробициклила,
12) ←C(O)R11,
13) ←C(O)O-R11,
14) ←C(=Y)NR8R9 или
15) ←S(O)2-R11,
где алкил, алкенил, алкинил, циклоалкил, циклоалкенил необязательно замещены одним или несколькими заместителями R6; и где арил, гетероарил, гетероциклил и гетеробициклил необязательно замещены одним или несколькими заместителями R10;
R6 представляет собой
1) галоген,
2) NO2,
3) CN,
4) галогеналкил,
5) C1-C6алкил,
6) C2-C6алкенил,
7) C2-C4алкинил,
8) C3-C7циклоалкил,
9) C3-C7циклоалкенил,
10) арил,
11) гетероарил,
12) гетероциклил,
13) гетеробициклил,
14) OR7,
15) S(O)mR7,
16) NR8R9,
17) NR8S(O)2R11,
18) COR7,
19) C(O)OR7,
20) CONR8R9,
21) S(O)2NR8R9,
22) OC(O)R7,
23) OC(O)Y-R11,
24) SC(O)R7 или
25) NC(Y)NR8R9,
где арил, гетероарил, гетероциклил и гетеробициклил необязательно замещены одним или несколькими заместителями R10;
R7 представляет собой
1) H,
2) галогеналкил,
3) C1-C6алкил,
4) C2-C6алкенил,
5) C2-C4алкинил,
6) C3-C7циклоалкил,
7) C3-C7циклоалкенил,
8) арил,
9) гетероарил,
10) гетероциклил,
11) гетеробициклил,
12) R8R9NC(=Y) или
13) C1-C6алкил-C2-C4алкенил или
14) C1-C6алкил-C2-C4алкинил,
где алкил, алкенил, алкинил, циклоалкил, циклоалкенил необязательно замещены одним или несколькими заместителями R6; и где арил, гетероарил, гетероциклил и гетеробициклил необязательно замещены одним или несколькими заместителями R10;
каждый из R8 и R9 независимо представляет собой
1) H,
2) галогеналкил,
3) C1-C6алкил,
4) C2-C6алкенил,
5) C2-C4алкинил,
6) C3-C7циклоалкил,
7) C3-C7циклоалкенил,
8) арил,
9) гетероарил,
10) гетероциклил,
11) гетеробициклил,
12) C(O)R11,
13) C(O)Y-R11 или
14) S(O)2-R11,
где алкил, алкенил, алкинил, циклоалкил, циклоалкенил необязательно замещены одним или несколькими заместителями R6; и где арил, гетероарил, гетероциклил и гетеробициклил необязательно замещены одним или несколькими заместителями R10;
или же R8 и R9 совместно с атомом азота, к которому они присоединены, образуют пяти-, шести- или семичленный гетероцикл, необязательно замещенный одним или несколькими заместителями R6;
R10 представляет собой
1) галоген,
2) NO2,
3) CN,
4) B(OR13)(OR14),
5) C1-C6алкил,
6) C2-C6алкенил,
7) C2-C4алкинил,
8) C3-C7циклоалкил,
9) C3-C7циклоалкенил,
10) галогеналкил,
11) OR7,
12) NR8R9,
13) SR7,
14) COR7,
15) C(O)OR7,
16) S(O)mR7,
17) CONR8R9,
18) S(O)2NR8R9,
19) арил,
20) гетероарил,
21) гетероциклил или
22) гетеробициклил,
где алкил, алкенил, алкинил, циклоалкил и циклоалкенил необязательно замещены одним или несколькими заместителями R6;
R11 представляет собой
1) галогеналкил,
2) C1-C6алкил,
3) C2-C6алкенил,
4) C2-C4алкинил,
5) C3-C7циклоалкил,
6) C3-C7циклоалкенил,
7) арил,
8) гетероарил,
9) гетероциклил или
10) гетеробициклил,
где алкил, алкенил, алкинил, циклоалкил, циклоалкенил необязательно замещены одним или несколькими заместителями R6; и где арил, гетероарил, гетероциклил и гетеробициклил необязательно замещены одним или несколькими заместителями R10;
R12 представляет собой
1) галогеналкил,
2) C1-C6алкил,
3) C2-C6алкенил,
4) C2-C4алкинил,
5) C3-C7циклоалкил,
6) C3-C7циклоалкенил,
7) арил,
8) гетероарил,
9) гетероциклил,
10) гетеробициклил,
11) C(O)-R11,
12) C(O)O-R11,
13) C(O)NR8R9,
14) S(O)m-R11 или
15) C(=Y)NR8R9,
где алкил, алкенил, алкинил, циклоалкил, циклоалкенил необязательно замещены одним или несколькими заместителями R6; и где арил, гетероарил, гетероциклил и гетеробициклил необязательно замещены одним или несколькими заместителями R10;
каждый из R13 и R14 независимо представляет собой
1) H или
2) C1-C6алкил или
R13 и R14 объединены с образованием гетероцикла или гетеробицикла;
R20 представляет собой
1) H,
2) NH2 или
3) NHFmoc;
или пролекарства; или соединения формул (I) или (II), меченные обнаруживаемой меткой или аффинной меткой.
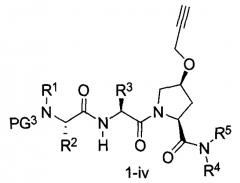
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 1-iv:
где PG3, R1, R2, R3, R4 и R5 определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 2-iv:
где PG4, R1, R2, R3, R4 и R5 определены выше.
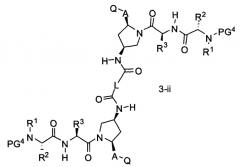
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 3-ii:
где PG4, R1, R2, R3, A и Q определены выше, и L представляет собой -(CH2)r-, -(CH2)r-Y-(CH2)r-, -алкил-арил-алкил-, -алкил-гетероарил-алкил-, циклоалкил, арил или гетероарил.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 4-i:
где PG4, PG400, L, R1, R100, R2, R200, R3, R300, A, A1, Q и Q1 определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 6-ii:
где PG4, PG400, R1, R100, R2, R200, R3, R300, A, A1, Q и Q1 определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 7-v:
где PG4, PG400, L, R1, R100, R2, R200, R3, R300, A, A1, Q и Q1 определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 8-ii:
где PG4, r, L, R100, R200, A1 и Q1 определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 8-iii:
где PG4, r, L, R1, R100, R2, R200, R3, A, A1, Q и Q1 определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 17-i:
где PG4, L, R1, R100, R2, R200, R3, R300, A, A1, Q и Q1 определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 18-i:
где PG4, L, R1, R100, R2, R200, R3, R300, A, A1, Q и Q1 определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 19-2:
где PG1, PG2, L, X определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 19-3:
где PG2, L и X определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 19-8:
где PG4, L, X, X1, R1, R100, R2, R200, R3, R300, R4, R400, R5 и R500 определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 20-1a:
где PG1, L, X, X1, R4 и R5 определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 20-2:
где PG4, L, X и X1 определены выше.
В другом аспекте настоящего изобретения разработано промежуточное соединение, представленное формулой 20-4:
где PG4, L, X, X1, R1, R100, R2, R200, R3, R300, R4, R400, R5 и R500 определены выше.
В другом аспекте настоящего изобретения разработан способ получения описанных выше по тексту заявки соединений формулы (I), причем способ включает
a) сшивание двух промежуточных соединений, представленных формулой 1-iv:
где PG3, R1, R2, R3, A и Q определены выше,
в растворителе; и
b) удаление защитных групп с целью получения соединения формулы (I).
В другом аспекте настоящего изобретения разработан способ получения описанных выше по тексту заявки соединений формулы (I), причем способ включает
a) взаимодействие промежуточного соединения, представленного формулой 2-iv:
где PG4 представляет собой защитную группу и R1, R2, R3, A и Q определены выше,
с активированной дикислотой (0,5 экв.) в растворителе; и
b) удаление защитных групп с целью получения соединения формулы (I).
В другом аспекте настоящего изобретения разработан способ получения фармацевтически приемлемых солей соединений формул (I) и (II) путем обработки соединений формул (I) и (II) 1-2 эквивалентами фармацевтически приемлемых кислот, определенных в настоящей заявке.
В другом аспекте настоящего изобретения разработана фармацевтическая композиция, включающая описанное выше соединение, смешанное с фармацевтически приемлемым носителем, разбавителем или наполнителем.
В другом аспекте настоящего изобретения разработана фармацевтическая композиция, подходящая для введения в качестве средства лечения пролиферативного расстройства у субъекта, включающая терапевтически эффективное количество описанных выше соединений.
В другом аспекте настоящего изобретения разработана фармацевтическая композиция, включающая соединение формулы (I) в комбинации с одним или несколькими агонистами рецепторов смерти, например агонистом рецептора TRAIL.
В другом аспекте настоящего изобретения разработана фармацевтическая композиция, включающая соединение формулы (I) в комбинации с любым терапевтическим средством, которое усиливает реакцию одного или нескольких агонистов рецептора смерти, например цитотоксичных цитокинов, таких как интерфероны.
В другом аспекте настоящего изобретения разработан способ получения фармацевтической композиции, причем способ включает смешивание описанного выше соединения с фармацевтически приемлемым носителем, разбавителем или наполнителем.
В другом аспекте настоящего изобретения разработан способ лечения болезненного состояния, характеризуемого недостаточным апоптозом, причем способ включает введение субъекту при наличии необходимости терапевтически эффективного количества описанной выше фармацевтической композиции с целью лечения болезненного состояния.
В другом аспекте настоящего изобретения разработан способ модулирования функции IAP, причем способ включает введение в контакт клетки и соединения по настоящему изобретению, чтобы таким образом предотвратить связывание BIR-связывающего белка с доменом BIR IAP, модулируя, тем самым, функцию IAP.
В другом аспекте настоящего изобретения разработан способ лечения пролиферативных заболеваний, причем способ включает введение субъекту при наличии необходимости терапевтически эффективного количества описанной выше фармацевтической композиции с целью лечения пролиферативного заболевания.
В другом аспекте настоящего изобретения разработан способ лечения рака, причем способ включает введение субъекту при наличии необходимости терапевтически эффективного количества описанной выше фармацевтической композиции с целью лечения рака.
В другом аспекте настоящего изобретения разработан способ лечения рака, причем способ включает введение субъекту при наличии необходимости терапевтически эффективного количества описанной выше фармацевтической композиции в комбинации или последовательно со средством, выбранным из
a) модуляторов рецептора эстрогенов,
b) модуляторов рецептора андрогенов,
c) модуляторов рецептора ретиноидов,
d) цитотоксических средств,
e) антипролиферативных средств,
f) ингибиторов пренилпротеинтрансферазы,
g) ингибиторов HMG-CoA редуктазы,
h) ингибиторов ВИЧ-протеазы,
i) ингибиторов обратной транскриптазы,
k) ингибиторов ангиогенеза,
l) агонистов PPAR-γ,
m) агонистов PPAR-δ
n) ингибиторов естественной мультилекарственной устойчивости,
o) противорвотных средств,
p) средств, применяемых при лечении анемии,
q) средств, применяемых при лечении нейтропении,
r) средств для улучшения иммунитета,
s) ингибиторов протеасом,
t) ингибиторов HDAC,
u) ингибиторов хемотрипсиноподобной активности протеасом; или
v) ингибиторов E3 лигазы;
w) модуляторов иммунной системы, таких как, но не ограничиваясь перечисленными, интерферон-альфа, бацилла Кальметта-Герена (BCG), а также ионизирующая радиация (UVB), которая может вызвать выделение цитокинов, например интерлейкинов, TNF или вызвать выделение лигандов рецептора смерти, например TRAIL;
x) модуляторов рецепторов смерти TRAIL и агонистов TRAIL, таких как гуманизованные антитела HGS-ETR1 и HGS-ETR2;
или же в комбинации или последовательно с радиационной терапией с целью лечения рака.
В другом аспекте настоящего изобретения разработан способ лечения или профилактики пролиферативных расстройств у субъекта, причем способ включает введение субъекту терапевтически эффективного количества описанной выше композиции.
В другом аспекте настоящего изобретения упомянутый способ дополнительно включает введение субъекту терапевтически эффективного количества химиотерапевтического средства до, одновременно с или после введения композиции.
В еще одном аспекте указанный способ включает, кроме того, введение субъекту терапевтически эффективного количества агонистов рецепторов смерти до, одновременно с или после введения композиции. Агонист рецептора смерти представляет собой TRAIL или агонист рецептора смерти представляет собой антитело против TRAIL. Агонист рецептора смерти, как правило, вводят в количестве, которое вызывает синергический эффект.
В еще одном аспекте изобретение относится к применению описанных выше соединений с целью производства лекарственного препарата, предназначенного для лечения или профилактики болезненного состояния, характеризуемого недостаточным апоптозом.
В еще одном аспекте изобретение относится к применению описанных выше соединений с целью производства лекарственного препарата, предназначенного для лечения или профилактики пролиферативного расстройства.
В еще одном аспекте изобретение относится к применению описанных выше соединений в комбинации с другими средствами с целью производства лекарственного препарата, предназначенного для лечения или профилактики пролиферативных расстройств, где упомянутые другие средства выбраны из
a) модуляторов рецептора эстрогенов,
b) модуляторов рецептора андрогенов,
c) модуляторов рецептора ретиноидов,
d) цитотоксических средств,
e) антипролиферативных средств,
f) ингибиторов пренилпротеин трансферазы,
g) ингибиторов HMG-CoA редуктазы,
h) ингибиторов ВИЧ-протеазы,
i) ингибиторов обратной транскриптазы,
k) ингибиторов ангиогенеза,
l) агонистов PPAR-γ,
m) агонистов PPAR-δ,
n) ингибиторов естественной мультилекарственной устойчивости,
o) противорвотных средств,
p) средств, применяемых при лечении анемии,
q) средств, применяемых при лечении нейтропении,
r) средств для усиления иммунитета,
s) ингибиторов протеасом,
t) ингибиторов HDAC,
u) ингибиторов хемотрипсиноподобной активности протеасом; или
v) ингибиторов E3 лигазы;
w) модуляторов иммунной системы, таких как, но не ограничиваясь перечисленными, интерферон-альфа, бацилла Кальметта-Герена (BCG), а также ионизирующая радиация (UVB), которая может вызвать выделение цитокинов, например интерлейкинов, TNF или вызвать выделение лигандов рецептора смерти, например TRAIL;
x) модуляторов рецепторов смерти TRAIL и агонистов TRAIL, таких как гуманизованные антитела HGS-ETR1 и HGS-ETR2;
или же в комбинации или последовательно с радиационной терапией.
В еще одном аспекте изобретение относится к применению описанных выше соединений в комбинации с агонистами рецептора смерти с целью производства лекарственного препарата, предназначенного для лечения или профилактики пролиферативных расстройств у субъекта.
В еще одном аспекте разработана фармацевтическая композиция, включающая описанные выше соединения, смешанные с фармацевтически приемлемым носителем, разбавителем или наполнителем, предназначенная для лечения или профилактики болезненного состояния, характеризуемого недостаточным апоптозом.
В еще одном аспекте разработана фармацевтическая композиция, включающая описанные выше соединения в комбинации с любым соединением, которое увеличивает содержание в крови одного или нескольких агонистов рецепторов смерти, предназначенная для профилактики или лечения пролиферативных расстройств.
В еще одном аспекте разработан способ получения фармацевтической композиции, причем способ включает смешивание описанных выше соединений с фармацевтически приемлемым носителем, разбавителем или наполнителем.
В другом аспекте настоящего изобретения разработан зонд, причем зонд представляет собой соединение приведенных выше формул (I) или (II), где соединение мечено обнаруживаемой меткой или афинной меткой.
В другом аспекте настоящего