((бициклогетероарил)имидазолил)метилгетероарильные соединения как агонисты адренергических рецепторов
Иллюстрации
Показать всеНастоящее изобретение относится к новым производным имидазола общей формулы , где А представляет собой пиридинил; и В представляет собой конденсированную кольцевую систему, состоящую из: а) фенильного кольца, присоединенного к остатку молекулы, б) второго гетероциклического пяти- или шестичленного кольца, конденсированного с фенильным кольцом и имеющего один атом азота или кислорода, и к его таутомерным формам. Технический результат: получены новые производные имидазола, являющиеся антагонистами адренергических рецепторов. 5 з.п. ф-лы, 1 табл.
Реферат
Перекрестные ссылки
В этой заявке заявляется о приоритете заявки на патент США номер 60/939781, поданной 23 мая 2007, которая включена здесь ссылкой во всей полноте.
Предшествующий уровень техники
Адренергические рецепторы человека представляют собой важные мембранные белки, которые делятся на два обширных класса: альфа- и бета-адренергические рецепторы. Оба типа опосредуют действие периферийной симпатической нервной системы при связывании катехоламинов, норэпинефрина и эпинефрина.
Норэпинефрин продуцируется адренергическими нервными окончаниями, в то время как эпинефрин продуцируется мозговым веществом надпочечника. Сродство к связыванию адренергических рецепторов для этих соединений образует одну основу классификации: альфа-рецепторы склонны к более сильному связыванию норэпинефрина, чем эпинефрина, и намного более сильному, чем синтетическое соединение изопротеренол. Предпочтительное сродство к связыванию этих гормонов совершенно отличается для бета-рецепторов. Во многих тканях функциональные отклики, например, при сокращении гладкой мускулатуры, вызванном активацией альфа-рецептора, противоположны откликам, вызванным связыванием бета-рецептора.
Впоследствии, функциональное различие между альфа- и бета-рецепторами было дополнительно изучено и уточнено фармакологической характеристикой этих рецепторов для различных источников из животных и тканей. В результате альфа- и бета-адренергические рецепторы были дополнительно разделены на подтипы α1, α2, β1 и β2. Были изучены функциональные различия между рецепторами α1 и α2, и были разработаны соединения, которые обеспечивают селективное связывание между этими двумя подтипами. Так, в опубликованной заявке на международный патент WO 92/0073 сообщалось о селективной способности R(+)-энантиомера теразозина селективно связываться с адренергическими рецепторами подтипа α1. Было обнаружено, что α1/α2-селективность этого соединения является очень важной, потому что, как упоминалось, стимуляция агонистом α2-рецепторов ингибирует секрецию эпинефрина и норэпинефрина, тогда как антагонизм α2-рецептора, как упоминалось, увеличивает секрецию этих гормонов. Таким образом, применение неселективных альфа-адренергических блокаторов, таких как феноксибензамин и фентоламин, как упоминалось, ограничивается их опосредованной α2-адренергическими рецепторами индукцией увеличенной концентрации катехоламина в плазме и сопутствующими физиологическими осложнениями (ускоренный сердечный ритм и сокращение гладкой мускулатуры). Для дополнительной общей информации по α-адренергическим рецепторам, направляем читателя к публикации Robert R.Ruffolo, Jr., α-Adrenoreceptors: Molecular Biology, Biochemistry and Pharmacology, (Progress in Basic and Clinical Pharmacology series, Karger, 1991), где исследованы основы разделения на подклассы α1/α2, молекулярная биология, сигнальная трансдукция, взаимосвязи структуры агониста и активности, функции рецептора и лечебные применения соединений, проявляющих сродство к α-адренергическому рецептору.
Клонирование, секвенсирование и экспрессия подтипов альфа-рецептора из тканей животных привели к разделению адренорецепторов α1 на подклассы α1А, α1B и α1D. Аналогично адренорецепторы α2 были разделены на рецепторы α2А, α2B и α2C. По-видимому, каждый подтип рецептора α2 обладает своей собственной фармакологической и тканевой специфичностью. Соединения, обладающие определенной специфичностью для одного или более чем одного из этих подтипов, могут оказаться более специфичными терапевтическими агентами для данного медицинского показания, чем панагонист рецептора α2 (например, лекарственное средство клонидин) или панантагонист.
Среди других показаний, таких как лечение глаукомы, гипертонии, сексуальной дисфункции и депрессии, имеются определенные соединения, обладающие активностью в отношении агонистов адренергических альфа2-рецепторов, известные как болеутоляющие средства. Однако многие соединения, обладающие такой активностью, не обеспечивают желаемую активность и специфичность при лечении расстройств, смодулированных альфа2-адренорецепторами. Например, найдено, что многие соединения являются эффективными агентами при лечении боли и, как часто обнаруживается, имеют нежелательные побочные эффекты, например, вызывают гипотонию и оказывают седативный эффект в эффективных дозах при систематическом применении. Имеется потребность в новых лекарственных препаратах, которые обеспечивают обезболивание, не вызывая этих нежелательных побочных эффектов. Кроме того, имеется потребность в агентах, которые проявляют активность против боли, в частности хронической боли, например, хронической невропатической и висцеральной боли.
Описание изобретения
В данном документе описано соединение формулы
где А представляет собой моноциклический гетероарил, имеющий 0, 1, 2 или 3 заместителя; и
В представляет собой конденсированную кольцевую систему, состоящую из:
- фенильного кольца, присоединенного к остатку молекулы,
- второго гетероциклического пяти- или шестичленного кольца, конденсированного с фенильным кольцом,
- 0, 1, 2 или 3 заместителей, присоединенных к фенильному кольцу, или ко второму кольцу, или же к обоим кольцам;
где каждый заместитель независимо состоит из от 0 до 8 атомов углерода, от 0 до 3 атомов кислорода, от 0 до 3 атомов галогена, от 0 до 2 атомов азота, от 0 до 2 атомов серы и от 0 до 24 атомов водорода.
Если не оговорено особо, ссылку на соединение следует рассматривать широко, включая фармацевтически приемлемые соли, пролекарства, таутомеры, альтернативные твердые формы и нековалентные комплексы химического объекта изображенной структуры или химического названия.
Фармацевтически приемлемая соль представляет собой любую соль исходного соединения, которая пригодна для введения животному или человеку. Фармацевтически приемлемая соль также относится к любой соли, которая может образоваться в естественных условиях в результате введения кислоты, другой соли или пролекарства, которые превращаются в кислоту или соль. Соль представляет собой объединение ионной формы соединения, например, сопряженной кислоты или основания, с соответствующим количеством противоионов. Соли могут образовываться из или включать одну или более чем одну депротонированную кислотную группу, одну или более чем одну протонированную основную группу (например, амин), или обе группы (например, цвиттерионы).
Пролекарство представляет собой соединение, которое превращается в терапевтически активное соединение после введения. Без ограничения возможностей данного изобретения, указанное превращение может произойти путем гидролиза сложноэфирной группы или какой-нибудь другой биологически нестабильной группы. Получение пролекарств хорошо известно в технике. Например, дополнительные детали по данному предмету представлены в публикации "Prodrugs and Drug Delivery Systems," являющейся главой книги Richard В.Silverman, Organic Chemistry of Drug Design and Drug Action, 2d Ed., Elsevier Academic Press: Amsterdam, 2004, pp.496-557.
Таутомеры представляет собой изомеры, которые находятся в быстром равновесии друг с другом. Часто, но не обязательно, они включают перенос протона, атома водорода или гидрид-иона. Например, подразумевается, что структуры в указанном документе включают, но не ограничиваются ими, таутомерные формы, показанные ниже.
Если стереохимия не оговорена в явном виде, подразумевается, что структура включает все возможные стереоизомеры, чистые или в любой возможной смеси.
Альтернативные твердые формы представляют собой твердые формы, отличные от тех, которые могут получиться, если следовать методикам, описанным в данном документе. Например, альтернативные твердые формы могут представлять собой полиморфы, различные виды аморфных твердых форм, стекла и т.п.
Нековалентные комплексы представляют собой комплексы, которые могут образоваться между данным соединением и одной или более дополнительными химическими частицами, которые не участвуют в ковалентном связывании между соединением и дополнительными химическими частицами. Они могут иметь или не иметь определенного отношения между соединением и дополнительными химическими частицами. Примеры могут включать сольваты, гидраты, комплексы с переносом заряда и т.п.
А представляет собой моноциклический гетероарил, означающий ароматическое кольцо с одним или более атомами азота, серы или кислорода в кольце. Типичные примеры гетероарила включают пиридил, тиенил, фурил, пирролил, пирролидинил, имидазолил, оксазолил, тиазолил, пиразолил, пиримидинил и пиразинил. А может быть незамещенной или замещенной заместителями, вплоть до трех.
В представляет собой конденсированную кольцевую систему, состоящую из: фенильного кольца, присоединенного к остатку молекулы; второго гетероциклического пяти- или шестичленного кольца, конденсированного с фенильной группой; и 0, 1, 2 или 3 заместителей, присоединенных к фенильному кольцу, или второму кольцу, или же к обоим кольцам.
Другими словами, рассматриваются структуры типа тех, которые представлены ниже. Связь "а" соединяет фенильное кольцо В с остальной частью молекулы. Второе гетероциклическое пяти- или шестичленное кольцо, конденсированное с фенильной группой, представлено Z. Наконец, R1 R2 и R3 представляют собой атомы водорода или заместители, с учетом ограничений, описанных в данном документе.
Гетероциклическое пяти- или шестичленное кольцо имеет по меньшей мере один атом азота, серы или кислорода в кольце. Оно может быть гетероароматическим или неароматическим. Заместители могут присоединяться к фенильному кольцу, гетероароматическому кольцу, или же заместители могут присоединяться к обоим кольцам.
Типичные примеры В включают: хинолинил, хиноксалинил, индолил, бензотиенил, бензофурил, бензофуранил, бензодиоксолил, 2,3-дигидробензо[b][1,4]диоксин-6-ил и т.п.
Хинолинил включает изохинолинил и другие изомеры, например, структуры, представленные ниже, является незамещенным, как изображено, или имеет заместители, с учетом ограничений, описанных в данном документе.
На заместители в А и В накладываются некоторые ограничения. Однако указанные заместители являются независимыми, что означает, что А и В могут иметь одинаковые или различные заместители; заместители в А могут быть одинаковыми или отличаться друг от друга; и заместители в В могут быть одинаковыми или отличаться друг от друга.
С учетом ограничений, описанных в данном документе (например, ограничения по количеству атомов в заместителе), примеры заместителей включают, но не ограничиваются ими:
гидрокарбил, что означает фрагмент, состоящий только из углерода и водорода, включая, но не ограничиваясь ими:
а) алкил, что означает гидрокарбил, не имеющий никаких двойных или тройных связей, включая, но не ограничиваясь ими:
- линейный алкил, например, метил, этил, н-пропил, н-бутил, н-пентил, н-гексил и т.д.,
- разветвленный алкил, например, изо-пропил, трет-бутил и другие разветвленные изомеры бутила, разветвленные изомеры пентила и т.д.,
- циклоалкил, например, циклопропил, циклобутил, циклопентил, циклогексил и т.д.,
- комбинации линейного, разветвленного и/или цикло-алкила;
б) алкенил, например, гидрокарбил, имеющий 1 или более двойных связей, включая линейный, разветвленный или цикло-алкенил;
в) алкинил, например, гидрокарбил, имеющий 1 или более тройных связей, включая линейный, разветвленный или цикло-алкинил;
г) комбинации алкила, алкенила и/или акинила.
алкил-CN, например, -CH2-CN, -(CH2)2-CN, -(СН2)3-CN и т.п.;
гидроксиалкил, т.е., алкил-ОН, например, гидроксиметил, гидроксиэтил и т.п.;
эфирные заместители, включая -O-алкил, алкил-O-алкил и т.п.;
тиоэфирные заместители, включая -S-алкил, алкил-S-алкил и т.п.;
аминозаместители, включая -NH2, -NH-алкил, -N-алкил1алкил2 (т.е. алкил1 и алкил2 являются одинаковыми или различными, и оба соединяются с N), алкил-NH2, алкил-NH-алкил, алкил-N-алкил1алкил2 и т.п.;
аминоалкил, что означает алкиламин, например, аминометил (-СН2-амин), аминоэтил и т.п.;
сложноэфирные заместители, включая -CO2-алкил, -CO2-фенил и т.д.;
другие карбонилсодержащие заместители, включая альдегиды; кетоны, например,
и т.п.; в частности, рассматриваются ацетильные
пропионильные, и бензоильные заместители;
фенил или замещенный фенил;
фторуглероды или гидрофторуглероды, например, -CF3, -CH2CF3 и т.д.; и
-CN;
также возможны комбинации вышеупомянутых групп, с учетом упомянутых ограничений.
С другой стороны, заместитель может представлять собой -F, -Cl, -Br или -I.
В частности, в качестве заместителя рассматривается алкил, имеющий от 1 до 8 атомов углерода.
С другой стороны, рассматривается алкил, имеющий от 1 до 4 атомов углерода.
Заместители должны быть достаточно устойчивыми для хранения соединений во флаконе при комнатной температуре при нормальном атмосферном давлении в течение по крайней мере 12 часов или достаточно устойчивыми, чтобы быть пригодными для любой цели, описанной в данном документе.
Если заместитель представляет собой соль, например карбоновой кислоты или амина, противоион указанной соли, то ион, который ковалентно не связан с остатком молекулы, не учитывают при подсчете числа тяжелых атомов в заместителе. Так, например, соль -CO2 -Na+ представляет собой устойчивый заместитель, состоящий из 3 тяжелых атомов, т.е. натрий не учитывается. В другом примере, соль -NH(Me)2 +Cl- представляет собой устойчивый заместитель, состоящий из 3 тяжелых атомов, т.е. хлор не учитывается.
В одном примере осуществления изобретения, А представляет собой пиридинил, что означает, что рассматриваются соединения структур таких, как показано ниже.
В этих структурах R1, R2 и R3 представляют собой заместители, как определено в данном документе.
В другом примере осуществления изобретения А представляет собой тиенил, что означает, что рассматриваются соединения структур, таких, как показано ниже.
В этих структурах R1, R2 и R3 представляют собой заместители, как определено в данном документе.
В другом примере осуществления изобретения А представляет собой фурил, что означает, что рассматриваются соединения структур, таких, как показано ниже.
В этих структурах R1, R2 и R3 представляют собой водород или заместители, как определено в данном документе.
В одном примере осуществления изобретения А представляет собой пиридинил, тиенил, фурил или пирролил.
В другом примере осуществления изобретения, каждый заместитель независимо представляет собой -Н, алкил, имеющий от 1 до 8 атомов углерода, -F, -Cl, -Br, -CH2OH, амин, имеющий от 0 до 8 атомов углерода, -CH2CN, -CF3 или ацил, имеющий от 1 до 8 атомов углерода.
В другом примере осуществления изобретения А представляет собой пиридинил.
В другом примере осуществления изобретения В представляет собой хинолинил.
В другом примере осуществления изобретения каждый заместитель в В представляет собой -Н, -F, -Cl, -Br, -СН3, -NHCH3 или -CF3.
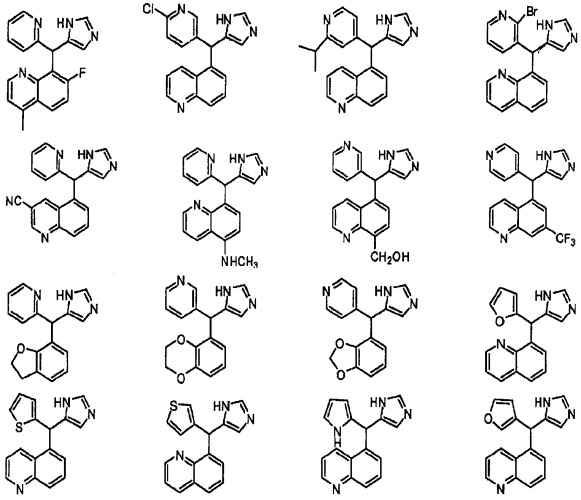
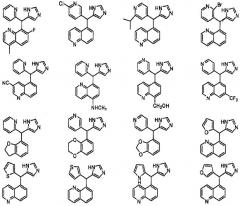
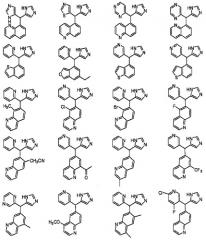
Предположительные примеры полезных соединений включают соединения, приведенные ниже.
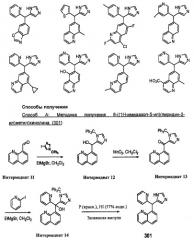
Раствор 4-иод-1-тритилимидазола (коммерчески доступен) (5,2 г, 11,94 ммоль) в дихлорметане (80 мл) при -10°С обрабатывали этилмагнийбромидом (3,98 мл, 11,94 ммоль, 3М в эфире) и оставляли для взаимодействия в течение 45 мин. Раствор хинолин-8-карбальдегида (Интермедиат 11) (1,5 г, 9,55 ммоль) в дихлорметане добавляли из шприца при -10°С и перемешивали в течение 16 ч при комнатной температуре. Смесь разлагали водой (50 мл) и насыщенным раствором хлористого аммония (50 мл) и подвергали водной обработке. Остаток очищали с помощью хроматографии на силикагеле с использованием 3% NH3-MeOH:CH2Cl2 с получением хинолин-8-ил(1-тритил-1Н-имидазол-5-ил)метанола (Интермедиат 12) в виде твердого вещества (3,7 г, 82,7%).
Смесь хинолин-8-ил(1-тритил-1Н-имидазол-5-ил)метанола (Интермедиат 12) (3,7 г, 7,9 ммоль) в CH2Cl2 (50 мл) обрабатывали активированным оксидом марганца (IV) (коммерчески доступен от компании Aldrich): MnO2 (4,1 г, 47,4 ммоль) при комнатной температуре. Смесь нагревали при 60°С в течение 2 ч. Затем смесь охлаждали до комнатной температуры и фильтровали через целит, растворитель удаляли в вакууме с получением хинолин-8-ил(1-тритил-1Н-имидазол-5-ил)метанона (Интермедиат 13) (3,6 г, 97%).
Раствор 2-иод-пиридина (коммерчески доступен) (307 мг, 1,5 ммоль) в дихлорметане (20 мл) обрабатывали при комнатной температуре этилмагнийбромидом (0,50 мл, 1,5 ммоль, 3М в эфире) и оставляли для взаимодействия в течение 45 мин. Раствор хинолин-8-ил(1-тритил-1Н-имидазол-5-ил)метанона (Интермедиат 13) (465 мг, 1,00 ммоль) в дихлорметане добавляли из шприца при комнатной температуре, и затем реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Смесь разлагали водой (20 мл) и насыщенным раствором хлористого аммония (20 мл). Остаток подвергали обычной водной обработке и получали пиридин-2-ил(хинолин-8-ил)(1-тритил-1Н-имидазол-5-ил)метанол (Интермедиат 14) (385 мг, неочищенный).
Раствор пиридин-2-ил(хинолин-8-ил)(1-тритил-1Н-имидазол-5-ил)метанола (Интермедиат 14) (385 мг, 0,70 ммоль) в 57% водном растворе HI (10 мл) и изо-PrOH (2 мл) с добавленным красным фосфором (219 мг, 7,0 ммоль) нагревали при 160°С в запаянной ампуле в течение 16 часов. Затем смесь охлаждали до комнатной температуры и выливали в смесь воды со льдом, которую затем подщелачивали с помощью NaOH и разбавляли CHCl3. Остаток подвергали обычной водной обработке с использованием CHCl3 и очищали с помощью жидкостной хроматографии среднего давления (5-15% MeOH:CH2Cl2) с получением 8-((1Н-имидазол-5-ил)(пиридин-2-ил)метил)хинолина (658) в виде твердого вещества, 236 мг (61% для двух стадий).
1HNMR (CD3OD, 300 МГц) δ 8,82 (dd, J=1,8, 4,5 Гц, 1Н), 8,43 (dd, J=1,8, 5,7 Гц, 1Н), 8,28 (dd, J=1,8, 8,4 Гц, 1Н), 7,83 (dd, J=4,0, 7,8 Гц, 1Н), 7,73-7,70 (m, 2H), 7,68-7,43 (m, 3H), 7,25-7,21 (m, 2H), 7,03 (с, 1Н), 6,52 (с, 1Н).
Данные биологических испытаний
Анализ методом выбора рецептора и усиления (RSAT)
В анализе методом RSAT измеряют опосредованную рецептором потерю контактного ингибирования, что приводит к селективной пролиферации клеток, содержащих рецепторы, в смешанной популяции конфлюэнтных клеток. Увеличение числа клеток оценивают с помощью подходящего трансфектированного маркерного гена, такого как β-галактозидаза, активность которого можно легко измерить в 96-луночном формате. Рецепторы, которые активируют G-белок, Gq, отвечают за этот отклик. Рецепторы альфа2, которые обычно связываются с Gi, активируют ответ RSAT при соэкспрессии с гибридным белком Gq, который имеет домен распознания рецептора Gi, называемый Gq/i5.
Клетки NIH-3T3 помещают в 15-см чашки при плотности 2×106 клеток и выдерживают в среде Игла в модификации Дульбекко с добавкой 10% телячьей сыворотки. Через день клетки подвергают котрансфекции осаждением фосфатом кальция с плазмидами экспрессии млекопитающих, кодирующими p-SV-β-галактозидазу (5-10 мкг), рецептором (1-2 мкг) и G-белком (1-2 мкг). В смесь для трансфекции также можно включить 40 мкг ДНК из молок лососевых. На следующий день и через 1-2 дня добавляют свежую смесь, клетки собирают и замораживают в виде 50 аликвот для анализов. Клетки размораживают и добавляют по 100 мкл к аликвотам различных концентраций лекарственных препаратов по 100 мкл в 96-луночном планшете, операцию повторяют трижды. Инкубирование продолжают 72-96 часов при 37°С. После промывки рассолом с добавкой фосфатного буфера, активность фермента β-галактозидазы определяют путем добавления 200 мкл хромогенного субстрата (состоящего из 3,5 мМ о-нитрофенил-β-D-галактопиранозида и 0,5% Nonidet P-40 в рассоле с добавкой фосфатного буфера), инкубирования в течение ночи при 30°С и измерения оптической плотности при 420 нм. Оптическая плотность представляет собой меру активности фермента, которая зависит от числа клеток и отражает пролиферацию клеток, опосредованную рецептором. Эффективность, или собственную активность, рассчитывают как отношение максимального эффекта лекарственного препарата к максимальному эффекту стандартного полного агониста для каждого подтипа рецепторов. Бримонидин, также именуемый UK14304, химическая структура которого показана ниже, применяют в качестве стандартного агониста для рецепторов альфа2А, альфа2В и альфа2С. ЕС50 представляет собой концентрацию, при которой действие лекарственного препарата равно половине его максимального эффекта.
Бримонидин
Результаты анализа методом RSAT для нескольких типичных соединений по изобретению представлены в Таблице ниже, наряду с химическими формулами этих типичных соединений. Значения EC50 приведены в наномолях. Н/О означает "не определяется" при концентрации менее 10 мкМ. СА означает "собственная активность".
| Данные биологических испытаний: собственная активностьэффективность в нМ (ЕС50) | |||
| Структура | Альфа 2А | Альфа 2В | Альфа 2С |
| H/O (0,15) | 22 (1,00) | 275 (0,60) | |
| 576 (0,50) | 2,15 (1,29) | 123 (1,16) | |
| H/O (0,13) | 348 (0,45) | H/O (0,22) | |
| H/O (0,12) | 231 (0,90) | H/O (0,33) | |
| H/О | 771 (0,65) | H/О (0,18) | |
| Н/О (0,23) | 9,12 (0,87) | 159 (0,86) | |
| 430 (0,46) | 10 (1,13) | 157 (1,12) |
Вышеописанным способом были синтезированы следующие соединения:
8-((1Н-имидазол-5-ил)(пиридин-3-ил)метил)хинолин, 302:
1H ЯМР (300 МГц, CDCl3): δ 8,82 (dd, J=1,8, 4,5 Гц, 1Н), 8,42 (d, J=2,1 Гц, 1Н), 8,33 (dd, J=1,5, 4,8 Гц, 1Н), 8,28 (dd, J=1,8, 8,1 Гц, 1Н), 7,83 (dd, J=1,5, 8,1 Гц, 1Н), 7,69 (d, J=1,2, Гц, 1Н), 7,67-7,63 (m, 1Н), 7,56-7,43 (m, 3Н), 7,30 (dd, J=4,8, 8,1 Гц, 1Н), 6,95 (с, 1Н), 6,57 (с, 1Н).
5-((1Н-имидазол-5-ил)(пиридин-2-ил)метил)хинолин, 116:
1H ЯМР (300 МГц, CDCl3): δ 8,82 (dd, J=1,5, 4,2 Гц, 1Н), 8,56 (d, J=8,7 Гц, 1Н), 8,51-8,49 (m, 1Н), 7,97 (d, J=8,7 Гц, 1Н), 7,77-7,66 (m, 3Н), 7,47 (dd, J=4,5, 8,7 Гц, 1Н), 7,32-7,26 (m, 1Н), 7,20 (t, J=8,1 Гц, 2Н), 6,54 (с, 1Н), 6,39 (с, 1Н).
5-((1Н-имидазол-4-ил)(пиридин-3-ил)метил)хинолин, 319:
1H ЯМР (300 МГц, CDCl3): δ 8,81 (dd, J=4,5, 1,8 Гц, 1Н), 8,43 (d, J=2,1 Гц, 1Н), 8,41 (dd, J=4,8, 1,8 Гц, 1Н), 8,26 (d, J=8,7 Гц, 1Н), 7,96 (d, J=8,7 Гц, 1Н), 7,56 (dd, J=8,7, 7,5 Гц, 1Н), 7,48 (с, 1Н), 7,39 (dt, J=8,1, 1,8 Гц, 1Н), 7,28 (dd, J=8,4, 3,9 Гц, 1Н), 7,16 (dd, J=7,8, 5,1 Гц, 1Н), 7,08 (d, J=6,9 Гц, 1Н), 6,29 (с, 1Н), 6,12 (с, 1Н).
5-((1Н-имидазол-4-ил)(пиридин-4-ил)метил)хинолин, 320:
1H ЯМР (300 МГц, CDCl3): δ 8,82 (dd, J=4,2, 1,5 Гц, 1Н), 8,46-8,44 (m, 2Н), 8,23 (d, J=8,4 Гц, 1Н), 7,98 (d, J=8,4 Гц, 1Н), 7,57 (dd, J=8,4, 7,2 Гц, 1Н), 7,53 (с, 1Н), 7,28 (dd, J=8,7, 4,5 Гц, 1Н), 7,11-7,06 (m, 3Н), 6,34 (с, 1Н), 6,09 (с, 1Н).
Способы разработки рецептур для этих соединений хорошо известны в технике. Например, в патенте США номер 7141597 (в частности, от параграфа 10, строка 27 до параграфа 14, строка 47) содержится информация, которая может применяться для общего руководства. Подобная важная информация также доступна в других многочисленных источниках. Биологическая активность соединений, описанных в данном документе (например, Таблица), может применяться для дополнительного общего руководства по дозировке, в зависимости от специфического применения соединения.
Конкретные детали предшествующего описания и композиции, которые могут применяться для осуществления настоящего изобретения, представляют наилучший рассмотренный способ. Однако для специалиста в данной области очевидно, что аналогично можно получить другие соединения с желаемыми фармакологическими свойствами и что описанные соединения также можно получить из различных исходных соединений через различные химические реакции. Аналогично различные фармацевтические композиции можно получать и применять с практически тем же самым результатом. Таким образом, хотя в предшествующем тексте могут содержаться некоторые детали, это не следует рассматривать как ограничение всех возможностей данного документа; скорее объем настоящего изобретения определяется только правомерным построением формулы изобретения.
1. Соединение формулы где А представляет собой пиридинил; иВ представляет собой конденсированную кольцевую систему, состоящую из:а. фенильного кольца, присоединенного к остатку молекулы,б. второго гетероциклического пяти- или шестичленного кольца, конденсированного с фенильным кольцом и имеющего один атом азота или кислорода,и его таутомерные формы.
2. Соединение по п.1 формулы
3. Соединение по п.1 формулы
4. Соединение по п.1 формулы
5. Соединение по п.1 формулы
6. Соединение по п.1 формулы