5-о-производные авермектина, способ их получения и антипаразитарные средства на их основе
Иллюстрации
Показать всеИзобретение относится к неизвестным ранее 5-O-производным авермектина общей формулы I:
где: А=Ме или Et, R=OH, OAlk или NR1R2, где: R1, R2=H,Alk, X=-(CH2)n-, где: n=2-12,
где: R3, R4, R5, R6=Н, Alk, Ph или Наl; n=1-5; или Х представляет собой гетероциклический фрагмент. Изобретение также относится к способу получения указанных соединений. Технический результат - получение новых соединений, которые проявляют антипаразитарную активность и могут быть использованы в качестве антипразитарных средств в медицине, ветеринарии, а также в сельскохозяйственной, рыбной промышленности и в других областях, связанных с разведением животных, в качестве антипаразитарных средств. 3 н. и 3 з.п. ф-лы, 1 табл., 27 пр.
Реферат
Изобретение относится к области химии макролидов, а именно к неизвестным ранее 5-O-производным авермектина, обладающим антипаразитарной активностью, способу их получения и антипаразитарным средствам на их основе, которые могут найти применение в медицине, ветеринарии, а также в сельскохозяйственной, рыбной промышленности и в других областях, связанных с разведением животных, в качестве антипаразитарных средств.
Актуальной задачей медицины и ветеринарии является обновление ассортимента противопаразитарных средств. Используемые в настоящее время препараты (такие, как «вермокс» [Агольцев В.А., Ноздрачев И.П., Панферов В.И., Мошненко З.Д., Бурлакова В.Г. «Способ лечения аспергиллеза у кроликов», Патент РФ №2073512, опубл. 1997]; «клозантел» (синонимы: клозантин, клозантекс, сантел, фасковерм, роленол) [Веселова Т.П., Архипов И.А., Дорошина М.В. «Эффективность клозантела при фасциолезе овец», Бюллетень Всесоюзного института гельминтологии им. К.И.Скрябина 1986. Т.42. 27-28]; производные авермектина [Алексеев М.А., Рославцева С.А. «Развитие резистентности к авермектинам A1 и A2 на примере комнатной мухи Musca domestica L. (Diptera: Muscidae)», Агрохимия. - 2006. - №1. - С.71-76]; [Гусейнов Н.Г., Мельницкий С.А., Мирзаев М.Н., Манджиев О.Х. «Эффективность препарата Ниацид-К при стронгилятозах желудочно-кишечного тракта и гиподерматозе крупного рогатого скота», Ветеринарная медицина. - 2007. - №2-3. - С.34]) применяются длительное время, вследствие чего наблюдается развитие резистентности к этим препаратам у большинства паразитов, против которых направлено их действие [Echevarria F., M.Borba, A.Pinheiro, P.Waller, J. Hansen "The prevalence of antihelmintic resistance in nematode parasites of sheep in southern Latin America: Brazil.", Vet. Parasitol.- 1996. - №62. - P.199-206]; [Hejmadi M.V., S. Jagannathan N.S., Delany G.C. Coles, Wolstenholme A. J. "L-glutamate binding sites of parasitic nematodes: an association with ivermectin resistance", Parasitology. - 2000. - №120. - P.535-545]; [Wyk J.A., Malan F.S. "Resistance of field strains of Haemon-chus contortus to ivermectin, closantel; rafoxanide and the benzimtda-zoles in South Africa", Veterinany Record. - 1988. - V.123, №9. - P.226-228]; [Wyk J.A, Malan F.S., Gerber H.M., Alva R.M.R. "Two field strains of Haemonchus contortus resistant to rafoxanide", Onderstepoort J.Vet. Res., 1987. - V.54. - P.143-146]; [Fairweather I., Gilleard J.S. "Fasciolicides: efficacy, actions, resistance and its management", Gilleard J.S., Beech R.N. "Population genetics of anthelmintic resistance in parasitic nematodes", Parasitology. - 2007. - №8. - P.40-47]; [Kotze A. C., Robert J., Dobson L. and et al. "High-level ivermectin resistance in a field isolate of Haemonchus contortus associated with a low level of resistance in the larval stage: implications for resistance detection", Veterinary Parasitology. - 2002. - №3. - P.255-263]; [Prichard R.K. "Ivermectin resistance and overview of the Consortium for Anthelmintic Resistance SNPs", Expert Opin Drag Discov. - 2007. - №2. - P.41-52]; [Coles G., Jackson F, Pomroy W.E. and et al. "The detection of anthelmintic resistance in nematodes", Veterinary Parasitology. - 2006. - №8. - P.167-185]; [Tyrell K., Leo F. "Overcoming Macrocyclic lactone resistence in Haemonchus contortus with pulse dosing of Levamisole" Veterinary Parasitology. - 2009. - №11. - P.98-102]; [Varady M., Cobra J., Letkova V., Коvac G. "Comparison of two versions of larval development test to detect anthelmintic resistance in Haemonchus contortus", Veterinary Parasitology. - 2009. - №2-3. - P.267-271].
В связи с этим для достижения лечебного эффекта приходится постоянно увеличивать дозировку известных препаратов, что приводит к неоправданному накоплению этих препаратов в организме человека и животных, а также существенно увеличивает стоимость лечения.
Наиболее близким к заявленным соединениям общей формулы I по структуре и свойствам является авермектин B формулы (II):
где: R=СН3- или CH3CH2-,
которые получают в виде смеси 2-х соединений - метального производного (20%) и этильного производного (80%), имеющих приблизительно одинаковую антипаразитарную активность (в литературе такую смесь называют авермектином B) [Мирзаев М.Н., Савченков С.Н., Жарова Т.П., Девришов Д.А., Воронин Е.С. «Биотехнологические аспекты создания неинъекционных форм противопаразитарных препаратов на основе авермектинов», Проблемы инфекционных и инвазионных болезней в животноводстве на современном этапе. - М., 1999. - С.272-273]. На основе соединения формулы II были созданы антипаразитарные препараты. В результате длительного применения их у паразитов, против которых применяется данный препарат, развилась резистентность. Для достижения лечебного эффекта приходится постоянно увеличивать дозировку известных препаратов, что приводит к неоправданному накоплению этих препаратов в организме человека и животных, а также существенно увеличивает стоимость лечения.
Задачей настоящего изобретения является расширение ассортимента соединений, обладающих антипаразитарной активностью, разработка способа их получения и создание антипаразитарных средств на их основе.
Поставленная задача достигается предлагаемыми новыми соединениями - 5-O-производными авермектина общей формулы I:
где: А=Me или Et
R=ОН, OAlk или NR1R2
где: R1, R2=H, Alk
Х=-(СН2)n-,
где: n=2-12
где: R3, R4, R5, R6=Н, Alk, Ph или Hal;
n=1-5;
или X представляет собой гетероциклический фрагмент,
а также способом их получения, заключающимся в том, что авермектин В подвергают взаимодействию с соответствующим ангидридом в среде органического растворителя в присутствии катализатора аминного типа с последующим выделением целевого продукта в виде соответствующей кислоты либо в виде алкилового эфира, полученного алкилированием кислоты, либо в виде амида, полученного действием амина на алкиловый эфир.
Процесс можно проводить при температуре от 15°C до 60°C, преимущественно при комнатной температуре.
В качестве органического растворителя преимущественно используют пиридин либо смесь диметилформамида (ДМФА) и пиридина.
В качестве катализатора аминного типа используют, например, триэтиламин, диметиламинопиридин.
Предлагаемые вещества - 5-O-производные авермектина формулы I можно использовать в качестве антипаразитарных средств.
До настоящего времени не были известны производные авермектина, содержащие заместители предложенного типа в 5 положении авермектинового цикла. Не было никаких данных о том, что такие вещества можно получить из авкермектина B. Не было также никаких данных, позволяющих предположить, что вещества формулы I может обладать антипаразитарной активностью и его можно использовать в качестве антипаразитарного средства. Таким образом, заявляемое изобретение соответствует критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется примерами, не ограничивающими его объем.
Пример 1. Получение соединения формулы I.
К раствору 0,00035 M вещества авермектина В (300 мг) в пиридине (10 мл) прибавляют 0,0075 M янтарного ангидрида (300 мг) и каталитическое количество 4-диметиламинопиридин (DMAP). Реакционную смесь перемешивают (контроль по ТСХ). Затем реакционную смесь выливают в воду. Выпавший осадок отфильтровывают, промывают водой, сушат в вакууме. Получают 340 мг продукта Ia. Выход (92%). Найдено (%): C 64,32; H 7,67. C52H76O17. Вычислено (%): C 64,20; H 7,82. В масс-спектре имеется пик молекулярного иона 973 [М+Н]+.
Доказательство структуры продукта Ia основано также на данных 1H - ЯМР-спектра (появление дополнительного сигнала в области 2,75 м.д., который соответствует сигналам протонов -СН2-групп сукцинатного фрагмента), ИК-спектроскопии (наличие в спектре в области 3440 см-1 сигнала кислотной OH-группы). В масс-спектрометре, полученном методом электронной эмиссии, имеется пик молекулярного иона 973 [М+Н]+. Элементный анализ соответствует расчетным данным.
Пример 2. Аналогично примеру 1, но процесс проводят в среде смеси ДМФА и пиридина при температуре 15-20°C, получают продукт Ia с выходом 87%.
Пример 3. Аналогично примеру 1, но процесс проводят в присутствии каталитического количества триэтиламина, получают продукт Ia с выходом 75%.
Пример 4. Получение соединения формулы I.
Аналогично примеру 1, но процесс проводят с использованием малеинового ангидрида, получают продукт Ib. Выход (92%). Найдено (%): C 64,72; H 7,67. C52H74O17. Вычислено (%): C 64,33; H 7,62. В масс-спектре имеется пик молекулярного иона 971 [М+Н]+.
Пример 5. Получение соединения формулы I.
Аналогично примеру 1, но процесс проводят с использованием ангидрида 5-фенилбицикло[2.2.1]гептан-2,3-дикарбоновой кислоты, получают продукт Iс. Выход (74%). Найдено (%): C 67,32; H 7,57. C63H86O17. Вычислено (%): C 67,80; H 7,71. В масс-спектре имеется пик молекулярного иона 1116 [М+Н]+.
Пример 6. Получение соединения формулы I.
Аналогично примеру 1, но процесс проводят с использованием, ангидрида циклогексан-1,2-дикарбоновой кислоты, получают продукт Id. Выход (65%). Найдено (%): C 64,97; H 7,64. C56H82O17. Вычислено (%): C 65,43; H 7,98. В масс-спектре имеется пик молекулярного иона 1028 [М+Н]+.
Пример 7. Получение соединения формулы I.
Аналогично примеру 1, но процесс проводят с использованием ангидрида трицикло[3.2.2.02,4]нон-8-ен-6,7-дикарбоновой кислоты, получают продукт Ie. Выход (72%). Найдено (%): C 66,32; H 7,87. C59H82O17. Вычислено (%): C66,48; H 7,71. В масс-спектре имеется пик молекулярного иона 1064 [М+Н]+.
Пример 8. Получение соединения формулы I.
Аналогично примеру 1, но процесс проводят с использованием ангидрида циклогекс-4-ен-1,2-дикарбоновой кислоты, получают продукт If. Выход (59%). Найдено (%): C 65,12; H 7,77. C56H80O17. Вычислено (%): C 65,56; H 7,80. В масс-спектре имеется пик молекулярного иона 1026 [М+Н]+.
Пример 9. Получение соединения формулы I.
Аналогично примеру 1, но процесс проводят с использованием ангидрида бензол-1,2-дикарбоновой кислоты, получают продукт Ig. Выход (63%). Найдено (%): C 65,33; H 7,60. C56H80O17. Вычислено (%): C 65,82; H 7,44. В масс-спектре имеется пик молекулярного иона 1022 [М+Н]+.
Пример 10. Получение соединения формулы I.
Аналогично примеру 1, но процесс проводят с использованием ангидрида бицикло[2.2.1]гепт-5-ен-2,3-дикарбоновой кислоты, получают продукт Ih. Выход (67%). Найдено (%): C 66,30; H 7,67. C57H80O17. Вычислено (%): C 65,96; H 7,71. В масс-спектре имеется пик молекулярного иона 1038 [М+Н]+.
Пример 11. Получение соединения формулы I.
Аналогично примеру 1, но процесс проводят с использованием ангидрида 3,4,5,6-тетрахлорбензол-1,2-дикарбоновой кислоты, получают продукт Ii. Выход (71%). Найдено (%): C 57,32; H 6,67. C56H72Cl4O17. Вычислено (%): C 57,98; H 6,21.
Пример 12. Получение соединения формулы I.
Аналогично примеру 1, но процесс проводят с использованием ангидрида 4,5-дибромбензол-1,2-дикарбоновой кислоты, получают продукт Ij. Выход (57%). Найдено (%): C57,36; H 6,57. C56H74Br2O17. Вычислено (%): C 57,00; H 6,28.
Пример 13. Получение соединения формулы I.
Аналогично примеру 1, но процесс проводят с использованием тетраметил янтарного ангидрида, получают продукт Ih. Выход (72%). Найдено (%): C 65,32; H 8,60. C56H84O17. Вычислено (%): C 65,37; H 8,17. В масс-спектре имеется пик молекулярного иона 1029 [М+Н]+.
Пример 14. Получение соединения формулы I.
Продукт Ia растворили в эфире и добавили раствор диазометана в эфире. Реакционную смесь перемешивают (контроль по ТСХ). Затем растворитель удаляют. Остаток промывают гексаном, затем промывают водой, сушат в вакууме. Получили продукт Ik. Выход (74%). Найдено (%): C 64,22; H 7,87. C53H78O17. Вычислено (%): C 64,50; H 7,91. В масс-спектре имеется пик молекулярного иона 987 [М+Н]+.
Пример 15. Получение соединения формулы I.
Продукт Ik растворили в сухом эфире и добавили диэтиламин при охлаждении, Реакционную смесь перемешивают (контроль по ТСХ). Затем растворитель удаляют. Остаток промывают гексаном, затем промывают водой, сушат в вакууме. Получили продукт Il. Выход (75%). Найдено (%): C 65,98; H 8,66. C56H85NO16. Вычислено (%): C 65,43; H 8,27. В масс-спектре имеется пик молекулярного иона 1028 [М+Н]+.
Пример 16. Получение соединения формулы I.
Процесс ведут аналогично примеру 5, фильтрат после удаления осадка упаривают досуха под вакуумом, экстрагируют хлористым метиленом, промывают водой, сушат над сульфатом магния. Из остатка после удаления растворителя получают продукт Im. Выход (6,4%). Найдено (%): C 67,26; H 7,27. C62H84O17. Вычислено (%): C 67,57; H 7,62. В масс-спектре имеется пик молекулярного иона 1102 [М+Н]+.
Пример 17. Получение соединения формулы I.
Процесс ведут аналогично примеру 8, фильтрат после удаления осадка упаривают досуха под вакуумом, экстрагируют хлористым метиленом, промывают водой, сушат над сульфатом магния. Из остатка после удаления растворителя получают продукт In. Выход (5,7%). Найдено (%): C 65,22; H 7,97. C55H78O17. Вычислено (%): C 65,28; H 7,71. В масс-спектре имеется пик молекулярного иона 1012 [М+Н]+.
Пример 18. Получение соединения формулы Iо.
Аналогично примеру 1, но процесс проводят с использованием ангидрида 2,3-пиридиндикарбоновой кислоты, получают Iо. Выход 46%. Найдено (%): С 64,79; Н 7,21, N 1,46. C55H75NO17. Вычислено (%): С 64,63; Н 7,40, N 1,37. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 1021.
Пример 19. Получение соединения формулы Iр.
Аналогично примеру 1, но процесс проводят с использованием 1,4-диметилгексагидрофуро-[3,4-b]-пиразин-5,7-диона, получают Iр. Выход 56%. Найдено (%): С 63,79; Н 7,81, N 2,43. C56H84N2O17. Вычислено (%): С 63,62; Н 8,01, N 2,65. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 1056.
Пример 20. Получение соединения формулы Iq.
Аналогично примеру 1, но процесс проводят с использованием 1Н, 3Н-фуро[3,4-с]-фуран-1,3-диона, получают Iq. Выход 52%. Найдено (%): С 63,99; Н 7,51. C54H74O18. Вычислено (%): С 64,14; Н 7,38. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 1010.
Пример 21. Получение соединения формулы Ir.
Аналогично примеру 1, но процесс проводят с использованием тетрагидро-4Н,6Н-фуро[3,4-с][1,2,5]-оксадиазол-4,6-диона, получают Ir.
Выход 52%. Найдено (%): С 61,82; Н 7,01, N 2,58. C52H72N2O18.
Вычислено (%): С 61,65; Н 7,16; N 2,76. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 1012.
Пример 22. Получение соединения формулы Is.
Аналогично примеру 1, но процесс проводят с использованием 1Н,3Н-тиено[3,4-с]-фуран-1,3-диона, получают Is. Выход 43%. Найдено (%): С 63,32; Н 7,15, S3,32. C54H74O17S. Вычислено (%): С 63,14; Н 7,26; S 3,12. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 1026.
Пример 23. Получение соединения формулы It.
Аналогично примеру 1, но процесс проводят с использованием 5-метилтетрагидро-1Н-фуро[3,4-с]пиррол-1,3(3aH)-диона, получают It. Выход 51%. Найдено (%): С 64,32; Н 7,77, N 1,51. C55H81NO17. Вычислено (%): С 64,25; Н 7,94; N 1,36. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 1027.
При изучении противопаразитарной активности был использован экспресс-метод оценки биоцидной активности с применением олигохет Tubificidal tubifex в качестве тест-объектов [Дриняев В.А., Чижов В.Н., Ковалев В.Н., Мирзаев М.Н. «Способ определения нематоцидной активности авермектинов», патент РФ №2013053, 1994].
При определении активности исследуемое вещество растворяют в воде при определенной концентрации, затем в полученное средство (препарат) вносят олигохеты по 10-20 особей и выдерживают в течение 1-3 ч, после чего подсчитывают общее количество олигохет А в каждом из растворов исследуемого вещества, количество активно подвижных нематод В, количество нематод с нарушенной подвижностью С и количество неподвижных нематод D, вычисляют процент смертности нематод в каждом разведении по формуле 1-[В+(С 0,5)+(D 0)]/А100, находят концентрацию исследуемого образца, при которой смертность олигохет составляет 50% (СК50), и определяют противопаразитарную активность путем сравнения СК50 исследуемого образца и эталонного образца известной концентрации.
Пример 24. Проводили определение нематоцидной активности с использованием предлагаемого средства при концентрации 2,5 мкг/мл.
Пример 25. Проводили определение нематоцидной активности с использованием предлагаемого средства при концентрации 5 мкг/мл.
Пример 26. Проводили определение нематоцидной активности с использованием предлагаемого средства при концентрации 25 мкг/мл.
Пример 27. Проводили определение нематоцидной активности с использованием предлагаемого средства при концентрации 50 мкг/мл.
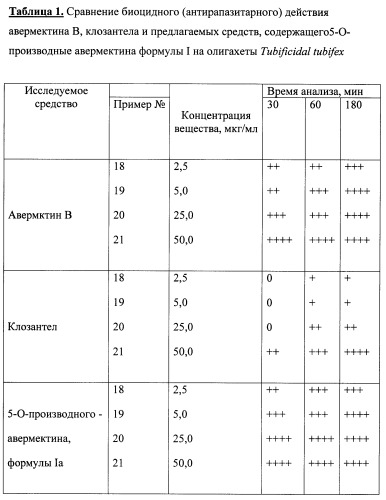
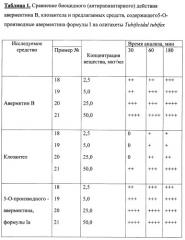
Результаты исследования средств, содержащих соединение общей формулы I приведены в таблице 1.
Анализ данных таблицы свидетельствует, что предлагаемые антипаразитарные средства более активны по сравнению с известными средствами. Так, например, как видно из таблицы 1, известное средство «клозантел» значительно уступает предлагаемому средству. Что же касается авермектина В, то при его использовании для поражения 80-100% олигохет при концентрации 25 мкг/мл необходима экспозиция в течение 180 минут, тогда как при использовании предлагаемых средств для достижения такого же эффекта требуется в шесть раз меньше времени (30 минут).
Таким образом, технический результат предлагаемого изобретения заключается в получении 5-О-производных авермектина формулы I, обладающих антипаразитарной активностью, и создании более эффективных антипаразитарных средств, которые могут быть использованы для борьбы с паразитами в меньших концентрациях по сравнению известными средствами, в том числе и с авермектином В формулы II.
Предлагаемое средство является более эффективным, что позволяет существенно снизить используемую концентрацию средства, его стоимость, а также расширить ассортимент антипаразитарных средств.
1. 5-O-Производные авермектина общей формулы I: где А - Ме или Et,R - OH, OAlk или NR1R2,где R1,R2 - H, Alk,X - -(CH2)n-,где n=2-12 , , , , , , ,где R3, R4, R5, R6 - Н, Alk, Ph или Наl;n=1-5;или Х представляет собой гетероциклический фрагмент.
2. Соединения по п.1, обладающее антипаразитарной активностью.
3. Способ получения соединений по пп.1 и 2, заключающийся в том, что авермектин В обрабатывают соответствущим ангидридом в среде органического растворителя в присутствии катализатора аминного типа с последующим выделением целевого продукта в виде соответствующей кислоты либо в виде алкилового эфира, полученного алкилированием кислоты либо в виде амида, полученного действием амина на алкиловый эфир.
4. Способ по п.3, отличающийся тем, что в качестве органического растворителя используют пиридин либо смесь диметилформамида и пиридина.
5. Способ по п.3, отличающийся тем, что в качестве катализатора аминного типа используют, например, триэтиламин, диметиламинопиридин.
6. Антипаразитарные средства на основе 5-O-производных авермектина общей формулы I по пп.1 и 2.