Антибиотические пептиды
Иллюстрации
Показать всеИзобретение относится к новому антибиотическому пептиду и производным пептидов, в частности, для применения в медицине. Дополнительно, изобретение относится к композициям и к способу скринингового анализа лекарственных средств. Пептиды и производные пептида имеют общую формулу Sub1-X1NX2X3PVYIPX4X5RPPHP-Sub2, где Sub1, X1, X2, X3, X5, Sub2 указаны в формуле изобретения. Пептиды или производные пептидов по изобретению обладают по меньшей мере одним из следующих преимуществ по сравнению с пептидами апидецина, встречающимися в природе: (i) увеличенное время полужизни в сыворотке млекопитающих вследствие более высокой протеазной устойчивости, (ii) повышенная противомикробная активность по отношению к одному или нескольким бактериальным штаммам, в частности к патогенам человека, или грибам, или другим микробным инфекциям, (iii) демонстрируют расширенный спектр противомикробной активности, (iv) вызывают меньшее развитие устойчивости у микроорганизмов и (v) не являются токсичными для клеток человека, включая эритроциты. 5 н. и 16 з.п. ф-лы, 7 табл, 8 ил., 6 пр.
Реферат
Настоящее изобретение относится к новому антибиотическому пептиду и пептидным производным, в частности для применения в медицине.
Дополнительно, изобретение относится к композициям и способам уничтожения микроорганизмов, таких как бактерии или грибы, и способам лечения инфекций, вызванных микроорганизмами. Изобретение дополнительно относится к способу скринингового анализа лекарственных средств.
Несмотря на значительные достижения в лечении антибиотиками увеличивается число случаев тяжелых бактериальных и грибковых инфекций. Каждый год в Соединенных Штатах имеет место более чем 40 миллионов случаев госпитализации, и приблизительно 2 миллиона пациентов заражаются внутрибольничными инфекциями, 50-60% которых вызывают бактерии, устойчивые к действию антибиотиков [1]. Ежегодное количество смертей, связанных с внутрибольничными инфекциями, оценивают как около 60000-70000 в США и вплоть до 10000 в Германии [2]. Тогда как устойчивые грамотрицательные бактерии представляли собой большую проблему в 1970-х, прошедшее десятилетие показало рост числа инцидентов с грамположительными штаммами, устойчивыми к действию многих лекарственных средств [3]. В настоящее время в быстрое возникновение устойчивых штаммов вовлечены как грамположительные, так и грамотрицательные патогенные микроорганизмы [4]. Устойчивость впервые проявилась у видов, которым было достаточно единичных мутаций, чтобы вызвать клинически значимые уровни, таких как Staphylococcus aureus и Pseudomonas aeruginosa, за ними последовали бактерии, которым необходимы множественные мутации, такие как E. coli и Neisseria gonorrhoeae. Это происходило, в основном, в результате широкого применения фторхинолонов [5]. Важные причины устойчивости грамотрицательных штаммов включают расширенный спектр лактамаз в Escherichia coli и Klebsiella pneumoniae [6]. Почти половина клинических штаммов Haemophilus ducreyi, которые обуславливают мягкий шанкр, несут гены для придания устойчивости к амоксициллину, ампициллину и ряду других β-лактамов [7]. Кроме того, у Salmonella enteric, серовара Typhimurium, устойчивость к тетрациклинам увеличилась от нуля в 1948 г. до уровня в 98% в 1998 г. [8].
Это влечет за собой необходимость продолжения поиска новых антибиотиков. Индуцибельные антибактериальные пептиды составляют область исследования, где сходятся вместе современные биохимия, иммунология и разработка лекарственных средств. Пептидные антибиотики, варьирующие по размеру от 13 до более чем сотни аминокислотных остатков, уже получены из растений, животных и микроорганизмов [9]. От одного животного получают приблизительно 6-10 пептидных антибиотиков, где каждый пептид часто демонстрирует разнообразный спектр активности [10]. Точно установлено, что подавляющее большинство бактерицидных пептидов, включая хорошо изученные дефензины, цекропины и магаинины, функционируют посредством «литического/ионофорного» механизма. Общим свойством всех «литических» пептидов является воздействие на проницаемость бактериальных цитоплазматических мембран [11, 12, 13]. Основой для такого действия является катионная, амфипатическая структура, которая способствует образованию каналов для гидрофильных ионов (протонов) в липидном бислое; утечка протонов приводит к исчезновению трансмембранного потенциала, необходимого для многих жизненно важных процессов, и, таким образом, служит причиной гибели клетки. Поскольку нарушение в структуре мембран этими пептидами не зависит от распознавания хиральными молекулами, функционально допустимыми являются аминокислотные замены, которые не изменяют общую амфипатическую структуру или общий суммарный заряд [14, 15]. Пептиды, действующие непосредственно на бактериальную мембрану, в повышенных концентрациях часто также оказывают токсическое действие на клеточные мембраны млекопитающих, что ограничивает их потенциал в качестве перспективных лекарственных средств. Когда в последовательности α-спиралей антибактериальных пептидов вводят пролины, способность пептидов к изменению проницаемости цитоплазматической мембраны E. coli значительно снижается, в зависимости от количества включенных остатков пролина. В связи с этим любопытным является то, что некоторые из наиболее активных природных антибактериальных пептидов, отобранные по меньшей мере против грамотрицательных патогенов, принадлежат к семейству пептидов, обогащенных пролином [16].
Подобные побочные эффекты можно преодолеть посредством других антибактериальных пептидов, мишенью которых являются специфические бактериальные белки или другие внутри- или внеклеточные соединения, без перекрестной активности к аналогам млекопитающих. Этому, видимо, соответствуют антибактериальные пептиды, обогащенные пролином, включающие апидецин, первоначально выделенный из насекомых. При огромной вариации в размере и биохимических свойствах не удивительно, что целью исследований антибактериальных пептидов являются взаимосвязи структура - активность и конформация - активность. Полная доработка природного репертуара антибактериального пептида до его биологических возможностей является важной не только для общей биохимии, но и представляет постоянный интерес для фармацевтической промышленности. Несмотря на проблемы, связанные с in vitro тестированием антибиотиков, основанных на пептидах, некоторое количество природных антибактериальных пептидов уже дошло до стадии клинических испытаний [17]. Тогда как некоторые из них показали эффективность на начальной стадии клинических испытаний как средства для местного действия, другие показывают активность как средства для системной терапии. Например, недавно завершил фазу III клинических испытаний катионный белок rBPI 21 для парентерального применения при менингококкемии [17].
Апидецин, который исходно выделили из медоносной пчелы, относится к семейству антибактериальных пептидов, обогащенных пролином, и демонстрирует последовательность, сходную с последовательностью пиррхокорицина, дрозоцина и формецина (таблица 1) [18]. Апидецины представляют собой пептиды длиной в 18-20 аминокислотных остатков, содержащие только немодифицированные L-аминокислоты с высококонсервативными PRPPHPRI/L C-концами и с относительно высоким содержанием пролина (33%). Их можно легко синтезировать на твердой фазе, используя стандартную стратегию Fmoc/tBu. Пептид в наномолярных дозах ингибирует жизнеспособность многих грамотрицательных бактерий, при этом грамположительные бактерии являются не восприимчивыми к его действию. Летальное действие является почти мгновенным и, как было показано, не зависит от общепринятого «классического» механизма [19]. Кроме того, у мутантов, устойчивых к действию апидецина, чувствительность к «порообразующим» пептидам не уменьшена, и D-энантиомер лишен антибактериальной активности. На сегодняшний день существует модель, связывающая антагонистическое действие апидецина на бактерии со стереоселективным распознаванием хиральных мишеней [19]. Антибактериальные пептиды, обогащенные пролином, включая в качестве члена этого семейства апидецин, не просто убивают бактерии посредством нарушения проницаемости их мембран, но связываются стереоспецифическим образом с белком-мишенью, который не идентифицирован для апидецина, что, в конечном счете, приводит к гибели клетки. Кроме того, в отличие от AMP, таких как меллитин или грамдицидин S, с определенными вторичными структурами, пептиды, обогащенные пролином, по-видимому, нетоксичны для эукариотических клеток in vitro и не являются гемолитическими. В сыворотке млекопитающих апидецин полностью разрушается в течение одного часа из-за расщеплений на N- и C-концах, которые могут быть результатом расщепления амино- и карбоксипептидазами, эндопротеазного расщепления или их всех. Ранее упомянутые метаболиты теряют антибактериальную активность при значениях MIC обычно выше 125 мкг/мл.
| Таблица 1 | ||
| Сравнение последовательностей апидецина 1а или 1b (Apis mellifera) [18], дрозоцина (Drosphila melanogaster) [20], формецина 1 (Myrmecia gulosa) [21] и пиррхокорицина (Pyrrhocoris apterus) [22] | ||
| SEQ ID No | Пептид | Последовательность |
| 1 | Апидецин 1a | GNNRPVYIPQPRPPHPRI |
| 2 | Апидецин 1b | GNNRPVYIPQPRPPHPRL |
| 161 | Дрозоцин | GKPRPYSPRPTSHPRPIRV |
| 162 | Формецин 1 | GRPNPVNNKPTPYPHL |
| 163 | Пиррхокорицин | VDKGSYLPRPTPPRPIYNRN |
Все еще сохраняется потребность в новых антибактериальных и противогрибковых соединениях, новых антибактериальных и фунгицидных фармацевтических композициях, способах их применения и новых соединениях, которые можно использовать в скрининговом анализе лекарственных средств для выявления новых фармацевтических антибиотиков.
Одной целью изобретения является получение новых антибиотических пептидов, предпочтительно с повышенной стабильностью. Другой целью изобретения является обеспечение способа для скринингового анализа лекарственных средств.
Первая цель изобретения достигается пептидом или пептидным производным по изобретению с по меньшей мере 16 аминокислотными остатками и общей формулой
где
X1 представляет собой нейтральный остаток или фрагмент с суммарным положительным зарядом или с положительно заряженной в физиологических условиях боковой цепью, которая все еще несет положительный заряд после модификации с Sub1. Предпочтительные остатки X1 предпочтительно выбраны из группы нейтральных остатков (таких как цис-4-гидроксипролин, транс-4-гидроксипролин, цис-3-гидроксипролин, транс-3-гидроксипролин, цитруллин, N-метилсерин, N-метилглицин, дигидроксифенилаланин, N-этиласпарагин, N-этилглицин, гомосерин, пеницилламин, тетрагидропиранилглицин, алло-треонин, 3,5-динитротирозин) или положительно заряженных остатков, включая аргинин, δ-гидроксилизин, гомоаргинин, β-гомоаргинин, D-аргинин, метиларгинин (предпочтительно альфа-N-метиларгинин), нитроаргинин (предпочтительно N(G)-нитроаргинин), нитрозоаргинин (предпочтительно N(G)-нитрозоаргинин), аргинал (-COOH в аргинине замещена на -CHO), гуанидинопропионовая кислота, 2,4-диаминомасляная кислота, β-гомоаргинин, ε-N-метиллизин, алло-гидроксилизин, 2,3-диаминопропионовую кислоту, 2,2'-диаминопимелиновую кислоту, лизин, орнитин, симметричный диметиларгинин, асимметричный диметиларгинин, 2,6-диаминогексановую кислоту, гистидин, 1-метилгистидин, 3-метилгистидин, п-аминобензойную кислоту и 3-аминотирозин;
X2 представляет собой остаток с полярной боковой цепью (такой как аспарагин, серин, цитруллин или глутамин) или фрагмент с суммарным положительным зарядом или с положительно заряженной в физиологических условиях боковой цепью (такой как лизин или аргинин, орнитин или гомоаргинин). Предпочтительные остатки X2 выбраны из групп, включающих аспарагин, глутамин, серин, треонин, цитруллин, цис-4-гидроксипролин, транс-4-гидроксипролин, цис-3-гидроксипролин, транс-3-гидроксипролин, цитруллин, N-метилсерин, N-метилглицин, дигидроксифенилаланин, N-этиласпарагин, N-этилглицин, гомосерин, пеницилламин, тетрагидропиранилглицин, алло-треонин, 3,5-динитротирозин, а также аргинин, лизин, δ-гидроксилизин, гомоаргинин, 2,4-диаминомасляную кислоту, гомоаргинин, β-гомоаргинин, D-аргинин, метиларгинин (предпочтительно альфа-N-метиларгинин), нитроаргинин (предпочтительно N(G)-нитроаргинин), нитрозоаргинин (предпочтительно N(G)-нитрозоаргинин), аргинал, гуанидинопропионовую кислоту, ε-N-метиллизин, алло-гидроксилизин, 2,3-диаминопропионовую кислоту, 2,2'-диаминопимелиновую кислоту, орнитин, симметричный диметиларгинин, асимметричный диметиларгинин, 2,6-диаминогексановую кислоту, гистидин, 1-метилгистидин, 3-метилгистидин, п-аминобензойную кислоту и 3-аминотирозин;
X3 представляет собой фрагмент с суммарным положительным зарядом или с положительно заряженной в физиологических условиях боковой цепью. Предпочтительные остатки X3 выбраны из группы, включающей аргинин, лизин, δ-гидроксилизин, гомоаргинин, 2,4-диаминомасляную кислоту, гомоаргинин, β-гомоаргинин, D-аргинин, метиларгинин (предпочтительно альфа-N-метиларгинин), нитроаргинин (предпочтительно N(G)-нитроаргинин), нитрозоаргинин (предпочтительно N(G)-нитрозоаргинин), аргинал, гуанидинопропионовую кислоту, ε-N-метиллизин, алло-гидроксилизин, 2,3-диаминопропионовую кислоту, 2,2'-диаминопимелиновую кислоту, орнитин, симметричный диметиларгинин, асимметричный диметиларгинин, 2,6-диаминогексановую кислоту, гистидин, 1-метилгистидин, п-аминобензойную кислоту, 3-метилгистидин и 3-аминотирозин;
X4 представляет собой нейтральный остаток с полярной боковой цепью, такой как аспарагин или цитруллин, или фрагмент с суммарным положительным зарядом или с положительно заряженной в физиологических условиях боковой цепью. Предпочтительные остатки X4 выбраны из групп, включающих аспарагин, гомоглутамин, цис-4-гидроксипролин, транс-4-гидроксипролин, цис-3-гидроксипролин, транс-3-гидроксипролин, цитруллин, N-метилсерин, N-метилглицин, дигидроксифенилаланин, N-этиласпарагин, N-этилглицин, гомосерин, пеницилламин, тетрагидропиранилглицин, алло-треонин и 3,5-динитротирозин, а также аргинин, лизин, δ-гидроксилизин, гомоаргинин, 2,4-диаминомасляную кислоту, β-гомоаргинин, D-аргинин, метиларгинин (предпочтительно альфа-N-метиларгинин), нитроаргинин (предпочтительно N(G)-нитроаргинин), нитрозоаргинин (предпочтительно N(G)-нитрозоаргинин), аргинал, гуанидинопропионовую кислоту, ε-N-метиллизин, алло-гидроксилизин, 2,3-диаминопропионовую кислоту, 2,2'-диаминопимелиновую кислоту, орнитин, симметричный диметиларгинин, асимметричный диметиларгинин, 2,6-диаминогексановую кислоту, гистидин, п-аминобензойную кислоту, 1-метилгистидин, 3-метилгистидин и 3-аминотирозин;
X5 представляет собой пролин или производное пролина, такое как цис-4-гидроксипролин, транс-4-гидроксипролин, цис-3-гидроксипролин, транс-3-гидроксипролин, β-циклогексилаланин, 3,4-цис-метанопролин, 3,4-дегидропролин, гомопролин или псевдопролин;
Нейтральный остаток определяется как аминокислотный остаток, имеющий незаряженную в физиологических условиях боковую цепь. Физиологические условия обозначают pH 7,4, 37°C и осмотическое давление, равное 300 мосмоль/кг. Полярную боковую цепь определяют как боковую цепь, несущую по меньшей мере одну полярную группу (например, гидроксил, амино, амид или сульфгидрильную группу), которые обеспечивают образование водородной связи с другой полярной группой. Производное пролина представляет собой структуру, полученную из пролина, содержащую замещенное или незамещенное кольцо пирролидина. Фрагмент, имеющий суммарный положительный заряд или положительно заряженную в физиологических условиях боковую цепь, является основным аминокислотным остатком. Гидрофобный фрагмент представляет собой нейтральный остаток без полярных групп в боковой цепи алифатической или ароматической аминокислоты, предпочтительно являющийся более гидрофобным, чем аланин.
Sub1 представляет собой свободную N-концевую аминогруппу аминокислоты X1 или модификацию N-концевой аминогруппы (замещение в последовательности N-концевой аминогруппы аминокислоты X1 посредством Sub1) с общей формулой NR1R2. Sub1=NR1R2, где R1 и R2 являются независимыми друг от друга, выбранными предпочтительно из водорода или групп, состоящих из:
(i) неразветвленной цепи, разветвленной, циклической или гетероциклической алкильной группы, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, циклогексил;
(ii) неразветвленной цепи, разветвленной, циклической или гетероциклической алканоильной группы, такой как ацетил или метаноил (формил), пропионил, н-бутирил, изобутирил, пентаноил, гексаноил или циклогексаноил;
(iii) репортерной группы, такой как флуоресцентный краситель (например, флуоросцеин, Alexa488) или биотин;
(iv) линкера, вместе с COR3 (смотрите ниже) связывающего соответствующие N- и C-концы для получения циклического пептида, на основе, например, гуанидина, олигомеров этиленгликоля, 2,4-диаминобутановой кислоты, 2,3-диаминопропионовой кислоты, 2,2'-диаминопимелиновой кислоты, десмозина или изодесмозина.
Sub2 представляет собой свободную C-концевую карбоксильную группу С-концевой аминокислоты или модификацию C-концевой карбоксильной группы, предпочтительно с общей формулой COR3 (R3 замещенная гидроксильная группа последней аминокислоты) Х6-COR3 или X7-COR3 или Х6Х7-COR3.
COR3 предпочтительно выбран из группы, состоящей из:
(i) карбоксила (R3 представляет собой свободный гидроксил), сложного эфира (R3 представляет собой алкокси), амида (R3 представляет собой амин) или имида;
(ii) линкера, вместе с Sub1 связывающего N- и C-концы с получением циклического пептида;
(iii) COR3 с R3 представляет собой дополнительный аминокислотный остаток, выбранный из группы, состоящей из Pro, Ile, Leu, Arg, Val, или R3, является пептидом предпочтительно из 2-3 аминокислот, содержащим, по меньшей мере, одну аминокислоту, выбранную из группы, состоящей из Pro, Ile, Leu, Arg, Val, замещенную членом группы, состоящей из карбоксила (R3 является свободным гидроксилом), сложного эфира (R3 является спиртом, таким как метанол, этанол, пропанол, изопропанол или бутанол), амидом (R3 является амином) или имидом (R3 является алкиламином или диалкиламином, таким как метиламин, этиламин, диметиламин или циклогексиламин).
(iv) COR3 с R3 представляет собой дополнительную разветвленную аминокислоту для образования димерной или олигомерной структуры, такую как лизин, гидроксилизин, орнитин, 2,4-диаминобутановая кислота, 2,3-диаминопропионовая кислота, 2,2'-диаминопимелиновая кислота, десмозин, изодесмозин или комбинации этих разветвленных аминокислот.
Таким образом, на С-конце производные пептидов можно, в частности, создавать в виде сложного эфира (R3 = алкокси), амида (R3 = амид), имида или пептида, удлиненного посредством дополнительных аминокислот, выбранных из группы, состоящей из Pro, Ile, Arg, Val, модифицированных вновь на C-конце в виде сложного эфира, амида или имида. Дополнительно производные пептидов можно создавать посредством модификаций на N-конце или C-конце пептида. Эти изменения могут, например, представлять собой добавление алкила, или алканоильной группы (каждый с прямой цепью, или являющиеся разветвленными, или циклическими, или гетероциклическими), или гуанидиногруппы, или добавление макромолекулы, или репортерной группы как посредством устойчивого соединения, так и соединения, которое можно расщепить в определенных условиях (такого как дисульфидные мостики или кислотонеустойчивые линкеры).
Все природные аминокислоты, неприродные аминокислоты или производные аминокислот (такие как иминокислоты), образующие пептиды или производные пептидов по изобретению, могут быть как в L-, так и в D-конфигурации. Однако, если не указано иначе, аминокислотные строительные блоки в последовательности находятся предпочтительно в L-конфигурации.
X6 и X7 являются необязательными дополнительными остатками. Таким образом, в случае если X6 и X7 отсутствуют, последний пролин (Р) в последовательности, указанной выше, имеет свободную C-концевую карбоксильную группу или соединен с Sub2.
Таким образом, в случае если присутствует по меньшей мере один из X6 и X7, пептид имеет, например, одну из следующих общих формул:
X6 выбран из пролина, или производного пролина, или фрагмента, имеющего суммарный положительный заряд или положительно заряженную в физиологических условиях боковую цепь. Предпочтительные остатки X6 выбраны из групп, включающих пролин, цис-4-гидроксипролин, транс-4-гидроксипролин, цис-3-гидроксипролин, транс-3-гидроксипролин, β-циклогексилаланин, 3,4-цис-метанопролин, 3,4-дегидропролин, гомопролин, псевдопролин, а также аргинин, предпочтительно D-аргинин, δ-гидроксилизин, гомоаргинин, 2,4-диаминомасляную кислоту, β-гомоаргинин, ε-N-метиллизин, алло-гидроксилизин, 2,3-диаминопропионовую кислоту, 2,2'-диаминопимелиновую кислоту, лизин, аргинин, орнитин, метиларгинин (предпочтительно альфа-N-метиларгинин), нитроаргинин (предпочтительно N(G)-нитроаргинин), нитрозоаргинин (предпочтительно N(G)-нитрозоаргинин), аргинал, гуанидинопропионовую кислоту, симметричный диметиларгинин, асимметричный диметиларгинин, 2,6-диаминогексановую кислоту, гистидин, 1-метилгистидин, 3-метилгистидин или 3-аминотирозин.
X7 выбран из пролина или производных пролина, полярного фрагмента (такого как серин) или гидрофобного фрагмента. Предпочтительные остатки X7 выбраны из групп, включающих пролин, цис-4-гидроксипролин, транс-4-гидроксипролин, цис-3-гидроксипролин, транс-3-гидроксипролин, β-циклогексилаланин, 3,4-цис-метанопролин, 3,4-дегидропролин, гомопролин или псевдопролин, серин, треонин, δ-гидроксилизин, цитруллин, гомосерин, или алло-треонин, а также фенилаланин, N-метиллейцин, лейцин, изолейцин, валин, метионин, трет-бутилглицин, циклогексилаланин, аланин, β-аланин, 1-аминоциклогексилкарбоновую кислоту, N-метилизолейцин, норлейцин, норвалин, N-метилвалин, или короткую пептидную последовательность, предпочтительно длиной от одного до 3 остатков, выбранных предпочтительно из пролина, изолейцина или любых фрагментов, упомянутых ранее, или разветвленного линкера, содержащего несколько пептидных единиц, таких как лизин, гидроксилизин, орнитин, 2,4-диаминобутановая кислота, 2,3-диаминопропионовая кислота, 2,2'-диаминопимелиновая кислота, десмозин, изодесмозин.
C-концевая аминокислота представляет собой, например, последний пролин (P) в формуле 1, X6 (в формуле 3) или X7 (в формуле 2 и 4).
Природные последовательности на основе немодифицированного апидецина 1a и 1b с SEQ ID № 1 (GNNRPVYIPQPRPPHPRI-OH) и SEQ ID № 2 (GNNRPVYIPQPRPPHPRL-OH), где OH замещает свободную карбоксильную группу на C-конце (Sub1 = NH2 и Sub2 = RI-OH или RL-OH, R3 = -OH), исключены из объема изобретения.
Пептиды или производные пептидов по изобретению обладают по меньшей мере одним из следующих преимуществ по сравнению с природными пептидами апидецина:
(i) увеличенным временем полужизни в сыворотке млекопитающих вследствие повышенной протеазной устойчивости, и
(ii) увеличенной антибактериальной активностью против одного или нескольких бактериальных штаммов, особенно патогенных для человека, или грибковых или других микробных инфекций, и
(iii) пептиды не являются токсичными для клеток человека, включая эритроциты.
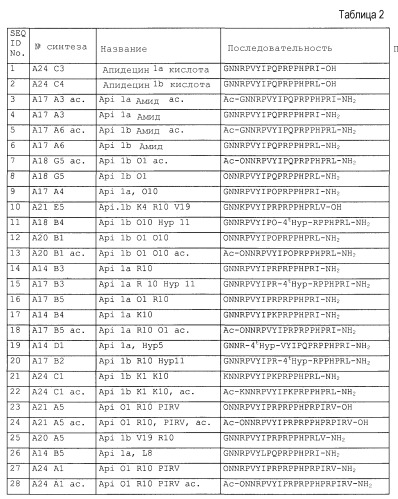
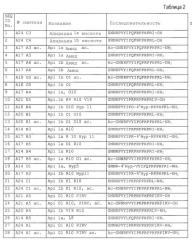
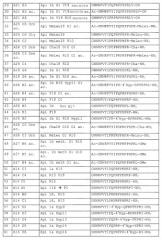
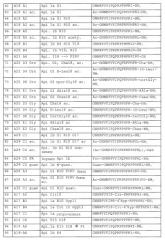
Примеры пептидов и производных пептидов по изобретению имеют последовательности согласно SEQ ID № 3-121, а также 122-159 (смотрите также таблицу 2 в примере 1). Менее предпочтительными являются пептиды и производные пептидов с SEQ ID № 92, 141 и 142 (смотрите также таблицу 2 в примере 1).
Пептиды и/или мультимерные пептидные конструкции по данному изобретению, которые модифицируют для повышения антибактериальной или противогрибковой активности, и для расширения спектра активности по отношению к другим бактериям или грибам, и для повышения устойчивости к протеазам и пептидазам, характеризуются высокой антибактериальной и/или противогрибковой эффективностью и хорошей метаболической стабильностью в сыворотке млекопитающих.
Соответствующие модификации в положениях 3 (X2), 4 (X3) и 10 (X4) повышают антибактериальную активность последовательности апидецина дикого типа по отношению к различным бактериям, как обсуждается ниже и показано в примерах.
Первые положения (Sub1, X1, X2 и X3), как предполагают, ответственны за надлежащий транспорт через мембрану внутрь клетки, тогда как положение 10 (X4) может также вносить вклад в ингибирование внутриклеточной мишени. Кроме того, остаток X2 может дополнительно придавать устойчивость N-концу последовательности пептида против деградации и, таким образом, увеличивать время полужизни в сыворотке.
Предпочтительные примеры по изобретению представляют собой последовательности с положительно заряженными остатками X4 (положение 10), такие как последовательности, выбранные из последовательностей согласно SEQ ID № 9-18, 20-25, 27-31, 34-40, 45-49, 55 и 56, 64-69, 81-83, 86-91, 97-100, 102-104, 112, 113, 117, 119, 122-128, 131, 134, 137, 138, 145-147 и 150-159. Менее предпочтительными являются последовательности с глутамином (Q) в X4 (положение 10).
Предпочтительные примеры по изобретению представляют собой последовательности с положительно заряженными остатками вместо X3 (положение 4), такие как последовательности, выбранные из последовательностей согласно SEQ ID № 10, 68, 95, 97, 100, 122-131, 134, 137 и 155.
Кроме того, свободную N-концевую аминогруппу и свободную C-концевую карбоксильную группу, которые, по-видимому, крайне важны для антибиотической активности пептидов, пептидных производных и их мультимеров, предпочтительно модифицируют, поскольку эти концы подвергаются петидазной и протеазной деградации в сыворотке, в большинстве жидкостей организма, тканях, органах или клетках. Увеличение протеазной устойчивости увеличивает время полужизни пептида в сыворотке. Дополнительно, модификация концов также позволяет пептиду образовывать связи с другими фрагментами, такими как другие аминокислотные последовательности (таким образом, возможно образование мультимерных пептидов или белков), или с другими биомолекулами, которые могут функционировать как носитель или метка. В конкретном варианте осуществления молекула носителя также функционирует в виде нацеливающей молекулы, которая способна локализовать бактериальную инфекцию и может связаться с бактерией для того, чтобы доставить антибиотическое соединение в место нахождения клетки (бактериальной) для воздействия или даже перенести его через бактериальную мембрану в бактериальную клетку. Подобные нацеливающие фрагменты могут представлять собой молекулы, которые, как известно, связываются с молекулами липополисахарида (LPS), которые образуют клеточную стенку грамотрицательных бактерий. Известными соединениями для подобного использования являются, например, якорные пептиды, такие как мотив AcmA Lactobacillus или антитела против липополисахаридов. Последние предпочтительны, так как они также обладают присущим им антибиотическим действием и, таким образом, могут быть использованы для усиления действия пептида по изобретению.
В виде N-концевой аминокислоты, которая представляет собой Sub1-X1, очень важно иметь фрагмент, который несет положительный заряд в физиологических условиях, т.е. в организме (человека). Физиологические условия, таким образом, обозначают pH, равное приблизительно 6-8, и температуру, равную приблизительно 30-40°C. Этот положительный заряд или в Sub1, или в X1 положении пептида или пептидного производного является, по всей вероятности, необходимым для осуществления антибактериальной функции.
Одним примером достижения стабильности N-конца против протеолитического расщепления является ацилирование (Sub1=ацил-NH-), такое как ацетилирование (Sub1=ацетил-NH-) α-аминогруппы положительно заряженной аминокислоты, такой как орнитин или лизин (Sub1-X1=ацил-Orn или ацил-Lys). Это ацилирование (предпочтительно ацетилирование) позволяет сохранить положительный заряд боковой цепи аминокислоты.
Другим примером достижения стабильности N-конца против протеолитического расщепления является гуанидинирование (предпочтительно Sub1=N(СН3)2-(C-N+(CH3)2)-NH-), которое вводит наряду с этим положительно заряженную группу в положение 1.
Более предпочтительными примерами по изобретению являются последовательности с положительно заряженными остатками, такими как X1 и X4 (положение 1 и 10), такие как последовательности, выбранные из последовательностей согласно SEQ ID №12 и 13, 16, 18, 21-24, 27-30, 35-40, 64, 65, 66, 81-83, 86-88, 112, 113, 117, 119, 124-128, 131, 134 и 137.
Дополнительными предпочтительными примерами по изобретению являются последовательности с пролином, производным пролина или положительно заряженным остатком вместо X6 (положение 17), такие как последовательности, выбранные из последовательностей согласно SEQ ID №10, 23, 24, 27, 28, 70, 109-113, 121, 127, 128, 131-134, 136, 138, 139, 145, 146 и 148-155.
Другими предпочтительными примерами по изобретению являются последовательности с пролином, производным пролина, полярным фрагментом или гидрофобным фрагментом вместо X7 (положение 18), такие как последовательности, выбранные из последовательностей согласно SEQ ID №10, 24, 27-37, 42, 44, 46, 47, 68-77, 83, 93, 94, 96, 107-110, 114, 115 и 126, 144.
Более предпочтительными примерами являются пептиды с положительно заряженной аминокислотой в положении 1 (X1) или 10 (X4) (такой как орнитин, аргинин или лизин) и модифицированным С-концом, в особенности пептиды согласно SEQ ID №7-8, 11-13, 20, 21, 22, 25, 38-40, 45, 65-67, 131, 134 и 137.
Наиболее предпочтительные пептиды содержат орнитин в положении 1 (остаток X1), аргинин в положении 10 (остаток X4), пролин или гидроксипролин в положении 11 (остаток X5), аргинин или его производное (такое как орнитин, гомоаргинин) в положении 17 (остаток X6 в Sub2) и ацетилирование или гуанидирование N-конца, такое как с SEQ ID №40, 88, 131, 134 и 137.
Из примеров можно видеть, что уже небольшая модификация С-конца на амид (Sub2=-NH2) значительно повышает ингибиторный эффект, направленный против Е. coli и S. typhi. Предпочтительные последовательности с амидом на С-конце представляют собой SEQ ID № 4, 6, 7, 8, 14, 20, 38, 39 и 134.
Предпочтительными также являются модификации, такие как метил, пропил, амид и пролин в положениях 17 (Х6), и/или 18 (X7), и/или на С-конце (Sub2), выполненные для снижения C-концевого разрушения. Результаты экспериментов позволили выяснить, что аминокислоты в положениях 17 и 18, по-видимому, также являются очень важными для антибиотического действия, так как замена одной аминокислоты в этих положениях на аланин приводит к полной потере эффективности относительно антибиотической активности апидецина дикого типа.
Наиболее предпочтительными примерами по изобретению являются пептиды, которые соответствуют всем преимуществам:
(i) увеличенное время полужизни в сыворотке млекопитающих вследствие повышенной протеазной устойчивости, и
(ii) повышенная противомикробная активность по отношению к одному или нескольким бактериальным штаммам, в частности патогенов человека, или грибам, или другим микробным инфекциям, и
(iii) пептиды не являются токсичными для клеток человека, включая эритроциты.
Действие противомикробных пептидов является чрезвычайно комплексным, так, они должны пройти сквозь мембрану бактериальной клетки и попасть в цитоплазму, чтобы специфически ингибировать внутриклеточную бактериальную мишень, не будучи при этом токсичными для клеток млекопитающих и клеток крови. Другим важным моментом для рассмотрения является стабильность пептидов или пептидных производных к деградации посредством петидаз или протеаз. Таким образом, идеальный пептид имеет высокую антибактериальную активность (низкие значение MIC), не токсичен для клеток, не обладает гемолитическим действием, и время его полужизни в крови составляет несколько часов. По сравнению с природной последовательностью апидецина самые подходящие производные пептидов, описанные в настоящем изобретении, имеют противомикробную активность, увеличенную более чем в десять раз. Этого частично достигали посредством амидирования C-конца и замещением Gln в положении 10 (X4) на основной остаток, наиболее предпочтительны аргинин или орнитин. Так как время полужизни этих пептидов в сыворотке относительно короткое, предпочтительным является модифицированный N-конец (посредством формилирования, ацетилирования или гуанидирования) для снижения деградации аминопептидазами или аминопротеазами. На N-конце предпочтительным является положительный заряд для того, чтобы обеспечить достаточную антибактериальную активность. Глицин в положении 1 (X1) природной последовательности апидецина предпочтительно замещают на основной остаток, такой как аргинин, лизин или орнитин, наиболее предпочтительно на орнитин, так как его C-концевую пептидную связь не расщепляют трипсин и родственные ферменты. По той же причине Arg-17 (X6) природной последовательности апидецина предпочтительно заменяют, чтобы уменьшить расщепление пептидной связи между Arg-17 (X6) и Leu/Ile-18 (X7), эндопротеазами. Существуют примеры замен Arg-17 (Х6) на орнитин или N-метилирования Leu-18 (X7), которые в обоих случаях повышали стабильность в сыворотке более чем в 24 раза, поскольку время полужизни изменилось с 15 мин до более чем 360 мин. Хотя ни один из пептидов не проявляет токсичного действия на клеточные линии COS-7 или эритроциты, замена Pro-11 (X5) на транс-4-Нур создает потенциал для дополнительного снижения возможных побочных эффектов, так как замены на полярные остатки уменьшают тенденцию пептидов или пептидных производных связываться с мембранами клеток млекопитающего, не снижая при этом антибактериальной активности.
Предпочтительно, пептиды или производные пептидов по изобретению не вызывают устойчивость или вызывают меньшую устойчивость, чем пептиды дикого типа.
Предпочтительно, ряд пептидов или пептидных производных по изобретению показывает расширенный спектр противомикробной активности, демонстрируя активность против бактерий, таких как Baccilus subtilis и Mycobacterium vaccae, которую не наблюдают у природных пептидов апидецина дикого типа. Общим свойством этих последовательностей с активностью против B. subtilis является положительно заряженный N-конец. Общим свойством этих последовательностей с активностью против M. vaccae является положительно заряженный N-конец, заряженный остаток (предпочтительно аргинин или орнитин) на X4 (положение 10) и заряженный остаток (предпочтительно орнитин) на X1 (положение 1). Примеры этих предпочтительных последовательностей выбраны из SEQ ID № 65, 83, 131 и 155.
В настоящем документе термин «пептид» обозначает последовательность аминокислот, соединенных посредством пептидной связи, где аминокислоты предпочтительно представляют собой одну из двадцати природных аминокислот, образующих пептиды, и где аминокислоты могут быть в L-конфигурации, или в D- конфигурации, или, для изолейцина и треонина, в D-алло-конфигурации (с инверсией только в одном из хиральных центров).
Термин производное пептида (или пептидомиметики) по изобретению включает не только пептиды, которые модифицируют, например на N- или С-конце посредством указанных выше групп Sub1 и Sub2. Он дополнительно включает пептиды, которые изменяют посредством замен и/или модификаций одного или нескольких аминокислотных остатков на химические группы, отличные от природных аминокислотных остатков, образующих протеины, такие как непротеиногенные α-аминокислоты, β-аминокислоты или пептиды с измененной главной цепью. Измененная главная цепь обозначает, что по меньшей мере одну пептидную связь заменили, например, на нерасщепляемую связь, такую как восстановленная амидная связь, алкилированная амидная связь или тиоамидная связь.
Включены также фрагменты, которые могут образовывать ковалентную связь как с COOH-группой предыдущего аминокислотного остатка, так и с NH2-группой последующего аминокислотного остатка, и которые, таким образом, не являются обязательно необходимыми для поддерживания структуры пептидного остова, такие как дипептидные изостеры на основе сахарной аминокислоты, азапептиды, 6-гомополимеры, y-пептиды, Y-лактамные аналоги, олиго(фениленэтилен)ы, винилогические сульфонопептиды, поли-N-замещенные глицины или олигокарбаматы. Эти модификации являются преимущественными в положениях, подверженных ферментативной деградации, в частности в трех N-концевых остатках (позиции 1-3 - X1-N-X2) и двух C-концевых остатках (после положения 16 - X6-X7). Таким образом, предпочтительно, чтобы по меньшей мере одна из связей между X1-N (например, Gly-Asn), N-X2 (например, Asn-Asn), X2-X3 (например, Asn-Arg), X6-X7 (например Arg-Leu или Arg-Ile) являлась