Способ экстракции ионов меди(ii), никеля(ii) и/или кобальта(ii) из слабокислых и аммиачных водных растворов
Иллюстрации
Показать всеИзобретение относится к способу экстракции ионов меди(II), никеля(II) и/или кобальта(II) из слабокислых и аммиачных водных растворов органическим реагентом с последующей реэкстракцией водным раствором минеральной кислоты. В качестве органического реагента используют N',N'-диметилгидразиды α-разветвленных третичных карбоновых кислот общей формулы (I) , где R1 и R2 - алифатические радикалы с разветвленной цепью, содержащие в сумме от 9 до 18 атомов углерода. Предлагаемый способ обеспечивает совместимость с углеводородными растворителями в любых соотношениях, характеризуется высокой емкостью органической фазы по меди(II), малым влиянием содержания аммиака и солей аммония на степень экстракции ионов металлов и может быть использован в гидрометаллургии цветных металлов. 9 з.п. ф-лы, 1 ил., 8 табл., 10 пр.
Реферат
Изобретение относится к способам экстракции и разделения меди(II), кобальта(II) и никеля(II) из слабокислых (рН>5) и аммиачных растворов и может быть использовано в гидрометаллургии цветных металлов, например, для переработки растворов аммиачного выщелачивания лома цветных металлов, концентратов руд, отходов цветной металлургии.
Известно извлечение меди(II) экстракцией из кислых и аммиачных растворов оксиоксимами [Ритчи Г.М., Эшбрук Л.В. Экстракция: Принципы и применение в металлургии. Пер. с англ. - М.: Металлургия, 1983. - С.117-148]. Недостатками оксиоксимов являются относительно небольшая емкость (по меди(II) в аммиачных средах не более 6-12 г/л), перенос аммиака при экстракции.
По другому способу экстракцию меди(II) из слабокислых и аммиачных сред осуществляют β-дикетонами, например, Ликс-54. Этот реагент незначительно переносит аммиак, имеет высокую емкость органической фазы (до 30-35 г/л по меди) [Mickler W., Uhlemann E. Liquid-liquid Extraction of Copper from Ammoniacal Solution with Cyclohexyl-Substituted β-dikеtonеs // Separation Science and Technology 1993. - V.28. - Issue 17-18. - P.2643-2650]. Однако β-дикeтоны весьма чувствительны к присутствию аммиака и солей аммония, что является их существенным недостатком.
Ближайшим аналогом (принятым за прототип) является способ экстракции меди(II), кобальта(II) и никеля(II) N',N'-диалкилгидразидами 2-этилгексановой кислоты, образующими комплексы с ионами меди(II), кобальта(II) и никеля(II) в слабокислой и аммиачной средах, среди которых наилучшими свойствами обладает N',N'-дигептилгидразид [Батуева Т.Д., Радушев А.В., Гусев В.Ю. Экстракция меди(II) из слабокислых и аммиачных сред N',N'-диалкилгидразидами алифатических карбоновых кислот // Журнал прикладной химии, 2009. - Т.82. - №11. - с.1850-1854].
Недостатком прототипа является относительно невысокая емкость экстрагента (по меди(II) не более 25-30 г/л), чувствительность к повышенным содержаниям аммиака и солей аммония, ограниченная растворимость в керосине.
Задачей изобретения является разработка способа экстракции меди(II), кобальта(II) и никеля(II) из слабокислых и аммиачных растворов с последующей реэкстракцией раствором минеральной кислоты, с использованием экстрагента с более высокой, чем у прототипа, емкостью органической фазы по меди(II), менее чувствительного к солям аммония, обладающего высокой растворимостью в углеводородных растворителях.
Для решения поставленной задачи предлагается следующее.
1. Способ экстракции ионов меди(II), никеля(II) и/или кобальта(II) из слабокислых и аммиачных водных растворов органическим реагентом с последующей реэкстракцией водным раствором минеральной кислоты, отличающийся тем, что в качестве органического реагента используют N',N'-диметилгидразиды α-разветвленных третичных карбоновых кислот общей формулы (I):
,
где R1 и R2 - алифатические радикалы с разветвленной цепью, содержащие в сумме от 9 до 18 атомов углерода
2. Способ по п.1, отличающийся тем, что органический реагент используют в углеводородном растворителе в концентрации 0,05-2 моль/л.
3. Способ no п.1, отличающийся тем, что при извлечении меди(II) экстракцию осуществляют в слабокислых или аммиачных растворах в интервале от рH 6 до содержания NН3 10 моль/л.
4. Способ по п.1, отличающийся тем, что при извлечении никеля(II) экстракцию осуществляют в аммиачных растворах в интервале рН 7-12.
5. Способ но п.1, отличающийся тем, при извлечении кобальта(II) экстракцию осуществляют в аммиачных растворах в интервале рН 8,5-10,3.
6. Способ по п.1, отличающийся тем, что при совместном извлечении никеля(II) и кобальта(II) экстракцию осуществляют в аммиачных растворах в интервале рН 7-12.
7. Способ но п.1, отличающийся тем, что при одновременном присутствии никеля(II) и кобальта(II) выделение никеля(II) осуществляют в аммиачных растворах интервале рH 7,5-9.
8. Способ по п.1, отличающийся тем, что при одновременном присутствии меди(II) и никеля(II) выделение меди(II) осуществляют в слабокислых или аммиачных растворах в интервале pH 6-7,5.
9. Способ по п.1, отличающийся тем, что при одновременном присутствии меди(II) и кобальта(II) выделение меди(II) осуществляют в слабокислых или аммиачных растворах в интервале рН 6-9.
10. Способ по п.1, отличающийся тем, что при одновременном присутствии меди(II), никеля(II) и кобальта(II), выделение меди(II) осуществляют в слабокислых или аммиачных растворах в интервале рН 6-7,5.
Заявляемые соединения можно получить известными способами: алкилированием ацилгидразидов, ацилированием соответствующего диалкилзамещенного гидразина хлорангидридами кислот и другими.
Синтез соединений общей формулы (I) проводили способом ацилирования соответствующего диалкилзамещенного гидразина хлорангидридами кислот.
Синтезированы N',N'-диметилгидразиды (ДМГД) общей формулы (I), где R1 и R2 - смесь алифатических радикалов с разветвленной цепью, содержащие в сумме от 9 до 18 атомов углерода. ДМГД-9 получен на основе узкой фракции кислот с суммой атомов углерода в радикалах R1 и R2, равной 9, а ДМГД-9-18 - на основе широкой фракции кислот с суммой углеродных атомов в радикалах R1 и R2, равной 9-18.
Соединения выделены в виде вязких масел, смешивающихся с органическими растворителями (керосином, нонаном и др.) в любых соотношениях и практически нерастворимых в воде, серной кислоте и аммиаке.
Пример 1
Синтез ДМГД-9
К 1 молю хлорангидрида α-разветвленных третичных карбоновых кислот узкой фракции со средним суммарным числом атомов углерода в молекуле 10 в 30 мл гексана прикапывали при перемешивании и охлаждении до 0°С 2 моля диметилгидразина в 15 мл гексана в течение 2 ч. Затем нагревали до комнатной температуры и отгоняли гексан. Остаток промывали водой, щелочью, снова водой до рН 7. Выход 85%.
Пример 2
Синтез ДМГД-9-18
Синтез проводился по методике, описанной в примере 1, с хлорангидридом α-разветвленных третичных карбоновых кислот широкой фракции с числом атомов углерода в молекуле 10-18. Выход 80%.
Строение соединений обшей формулы (I) подтверждено данными элементного анализа, хромато-масс-спектроскопией (снятыми на хромато-масс-спектрометре Agilent Technologies 6890N/5975B, колонка HP-5ms, 30 м·0,25 мм, 0.25 мкм, газ-носитель - гелий, ионизация электронным ударом (70 эВ)), ИК спектрами (снятыми на Фурье-спектрометре IFS 66/S Bruker), спектрами ЯМР 1H (полученными на спектрометре «MERCURY plus 300») и анализом на содержание основного вещества.
Спектральные характеристики заявляемых соединений ДМГД-9 и ДМГД-9-18 представлены в таблице 1.
Хромато-масс-спектроскопией показано, что время удерживания у группы ДМГД-9 составляет 7,25-7,7 мин. В усредненном спектре группы ДМГД-9 имеется пик молекулярного иона 214, соответствующий формуле С9Н19СОNНN(СН3)2 (С12Н26N2О). Фрагментация соответствует структуре CH3R1R2CONH(CH3)2. При этом хроматограмма по молекулярному иону 214 в общем следует хроматограмме по наиболее интенсивному иону 71.
ДМГД общей формулы (I) в качестве органического реагента используют в виде растворов в углеводородном растворителе в концентрации 0,05-2 моль/л.
При меньшем чем 9 общем числе углеродных атомов в радикалах R1 и R2 увеличиваются потери с водной фазой; при большем чем 18 - возрастает вязкость органической фазы экстрагента.
Применение менее чем 0,05 моль/л растворов ДМГД общей формулы (I) нецелесообразно из-за низкой емкости получаемых растворов экстрагентов. ДМГД смешиваются с углеводородными растворителями в любых соотношениях, однако при содержании ДМГД более 2 моль/л возрастает вязкость экстрактов.
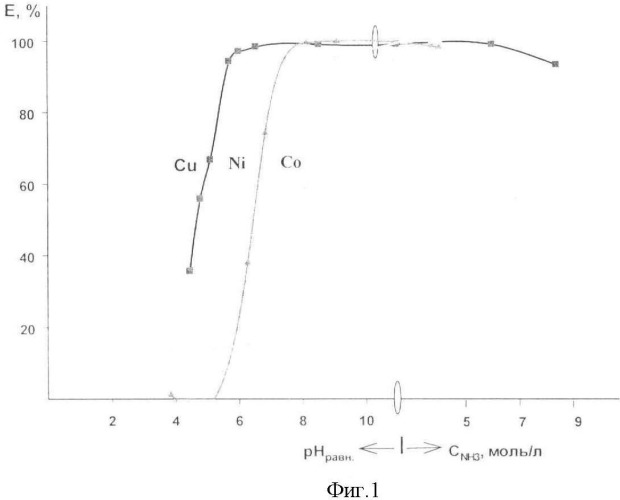
Нa фиг.1 представлено влияние кислотности водной фазы на экстракцию Ni(II), Cu(II) и Co(II) 0,2 моль/л раствором ДМГД-9 в керосине. Vo:Vв=1:2, τ=1 мин.
Механизм экстракции
ДМГД общей формулы (I), (HL) являются амфотерными бидентатными лигандами. В слабокислых (pH>5) или аммиачных средах с цветными металлами (медью(II), никелем(II) и кобальтом(II)) они способны при комплексообразовании депротонироваться, образуя анионы L-, и экстрагировать, например, медь(II) в виде нейтрального внутрикомплексного соединения типа СuL2, согласно уравнениям (1) и (2).
Слабокислые или аммиачные растворы меди(II), или кобальта(II), или никеля(II) или их смесей перемешивают с 0,05-2 моль/л растворами ДМГД общей (формулы(I) в керосине. При этом извлекаемые ионы меди(II) переходят в органическую фазу. Затем медь(II) или кобаль(II) и/или никель(II) из органической фазы переводят в водную, перемешивая с растворами H2SO4, согласно уравнению (3):
Результаты экспериментов но использованию ДМГД общей формулы (I) для экстракции приведены в примерах, таблицах и на фигуре 1.
Пример 3
Экстракция меди(II) ДМГД-9
К 1 мл 0,1 моль/л раствора CuSO4 (в делительных воронках) прибавляли различные количества аммиака или H2SO4 для создания определенного рН раствора и доводили объем до 30 мл водой. После 1 мин встряхивания с 10 мл 0,05 моль/л растворов реагентов в керосине и разделения фаз определяли рНравн водной фазы и измеряли оптическую плотность экстрактов при 660 нм в кювете 1=2 на спектрофотометре СФ-2000. По полученным данным рассчитывали степень извлечения меди(II) в зависимости от рНравн или содержания NH3 по уравнению (4)
,
где Ai и Amax - оптические плотности экстрактов при данном рН.
Коэффициент распределения (D) рассчитывали по уравнению (5)
где Е - степень экстракции металла, %,
Vв и Vo - объемы водной и органической фаз, мл.
Полученные результаты даны в таблице 2 на фигуре 1.
Пример 4
Экстракция меди(II) ДМГД-9-18
К 7,5 мл 9,7·10-3 моль/л раствора CuSO4 (в делительных воронках) прибавляли различные количества аммиака или H2SO4 для создания определенного pH раствора и доводили объем до 15 мл водой. После 1 мин встряхивания с 5 мл 0,1 моль/л растворов ДМГД-9-18 в керосине и разделения фаз (15 мин) определяли рНравн водной слоя. Остаточное содержание меди(II) определяли на атомно-адсорбционном спектрометре. Рассчитывали степень экстракции по уравнению (6), а коэффициенты распределения D - по уравнению (5)
где Сисх - исходная концентрация металла в водном растворе, мг/л;
Сi - концентрация металла при заданной рН, мг/л.
Полученные результаты даны в таблице 3.
Из таблиц 2 и 3 следует, что экстрагенты ДМГД в сравнении с прототипом лучше извлекают медь(II); в аммиачной области извлечение практически количественное до 7-10 моль/л NH3.
Пример 5
Влияние солей аммония на экстракцию меди(II) ДМГД-9-18
К 7,5 мл 9,7·10-3 моль/л раствора CuSO4 (в делительных воронках) прибавляли 0,1 или 1 мл 1 моль/л аммиака для создания определенного рН раствора, разные количества (NH4)2SO4 и доводили объем до 15 мл водой. После 1 мин встряхивания с 5 мл 0,1 моль/л растворов реагентов в керосине и разделения фаз (5 мин) определяли рНравн водной фазы и остаточное содержание ионов меди(II), которое определяли на атомно-адсорбционном спектрометре. Рассчитывали степень экстракции по уравнению (6), а коэффициенты распределения D - по уравнению (5).
Результаты приведены в таблице 4, из которой видно, что присутствие до 1,6 моль/л (NH4)2SO4 (211 г/л) мало влияет на извлечение меди(II).
C прототипом при pH=8,5 и содержании (NH4)2SO4=0,5 моль/л (66 г/л) степень извлечения Сu2+ снижается на 59%, то есть заявляемые экстрагенты менее чувствительны к присутствию солей аммония.
Пример 6
Экстракции никеля(II) ДМГД-9
В делительную воронку помещали 1 мл 0,1 моль/л стандартного раствора никеля(II), расчетное количество раствора аммиака или Н2SO4 и воды до 10 мл, 5 мл 0,2 моль/л реагенга в керосине. Встряхивали воронку 3 мин и выдерживали до полного расслоения фаз 10 мин. Нижний слой отделяли, измеряли рНравн. Остаточное содержание никеля(II) определяли на атомно-адсорбционном спектрометре. Рассчитывали степень экстракции по уравнению (6), а коэффициенты распределения D - по уравнению (5).
Результаты представлены в таблице 5 и на фигуре 1, из которых видно, что никель(II) извлекается в интервале рН 7,5-12 на 94-99%.
Пример 7
Экстракция кобальта(II) ДМГД-9
В делительную воронку помещали 1 мл 0,1 моль/л стандартного раствора кобальта(II), расчетное количество раствора аммиака (или Н2SO4) и воды до 10 мл, 5 мл 0,2 моль/л реагента в керосине. Встряхивали воронку 3 мин и выдерживали для расслоения фаз 10 мин. Далее поступали, как описано в примере 4.
Результаты эксперимента представлены в таблице 6 и на фигуре 1, из которых видно, что кобальт(II) извлекается на 90-94% при pH в интервале 8,5-10,3.
Пример 8
Расчет коэффициентов разделения (β) пар Ni(II) - Co(II), Cu(II) - Ni(II), Cu(II) - Co(II)
Результаты экстракции Cu(II), Ni(II) и Co(II) (примеры 3, 6 и 7) 0,2 моль/л раствором ДМГД-9 в керосине представлены на фигуре 1.
Из фигуры 1 следует, что оптимальные рH экстракции этих ионов существенно отличаются, что подтверждается значениями коэффициентов разделения (β) пар этих элементов, рассчитанными по уравнению (7) при некоторых pH (таблица 7).
где и - коэффициенты разделения иона металлов M1 и M2.
Из таблицы 7 и фигуры 1 следует, что в слабокислой и аммиачной средах возможно разделение пар Ni(II) - Co(II), Cu(II) - Ni(II), Cu(II) - Co(II), Cu(II) - (Ni(II)+Co(II)) экстракцией с ДМГД-9.
Пример 9
Емкость органической фазы экстрагентов ДМГД по меди(II)
Аликвоты по 10 мл стандартного раствора с содержанием 54,6 и 29,9 г/л раствора меди(II) в виде аммиаката помещали в делительную воронку, добавляли по 10 мл 2 моль/л растворов ДМГД-9 в керосине и встряхивали 1 мин. После расслаивания образования 3-й фазы не наблюдали. Водную фазу отделяли и определяли остаточное содержание меди(II) на атомно-адсорбционном спектрометре. По полученным данным рассчитывали степень извлечения по уравнению (6) и емкость органической фазы по меди(II) как разность ее содержания в водной и органической фазах.
Результаты с ДМГД-9 представлены в таблице 8.
Из таблицы 8 видно, что емкость 2 моль/л растворов ДМГД-9 в керосине составляет 54 г/л по меди(II). Емкость 1,5 моль/л раствора ДМГД-9-18 в керосине составляет 45 г/л по меди(II); при повышении концентрации этого экстрагента до 2 моль/л в керосине и содержания меди(II) более 45 г/л наблюдается ухудшение разделения фаз.
Емкость по меди(II) прототипа меньше и составляет 25-30 г/л.
Пример 10
Реэкстракция меди(II) из органической фазы
Аликвоты по 10 мл органической фазы (0,2 моль/л раствор ДМГД-9-18 в керосине), содержащие по 6,3 г/л меди(II), встряхивали с равными объемами 0,1 и 0,2 моль/л H2SO4. После разделения фаз найдено в водной фазе комплексонометрически 6,1 и 6,25 г/л меди. Реэкстракция меди(II) в одну ступень составила соответственно 96,8 и 99,2%.
Таким образом, предлагаемый способ имеет следующие преимущества по сравнению с прототипом:
- совместимость с углеводородными растворителями в любых соотношениях;
- более высокая емкость органической фазы по меди(II);
- значительно меньшее влияние содержания аммиака и солей аммония на степень экстракции ионов металлов.
| Таблица 1 | ||||
| Спектральные характеристики соединений CH3R1R2CCONH(CH3)2 | ||||
| № п/п | ИК-спектры, v/см-1 | ЯМР 1Н, δ м.д., J/Гц | ||
| N-H | Амид I | Амид II | ||
| ДМГД 9 (со средним суммарным числом атомов углерода в молекуле 10) | 3252 | 1658 | 1523 | 0,85-0,9 (м, 4СH3 R1, R2); 1,23-2,0 (м, CH2, CH R1, R2); 1,40 (с, 3Н, СН3); 2,8 (м, 6H, N(СН3)2); 7,3 - NH |
| ДМГД-9-18 (с числом атомов углерода в молекуле 10-18) | 3256 | 1649 | 1536 | 0,9-1,1 (м, 4СН3 R1, R2); 1,25-1,48 (м, СН2, CH R1, R2); 1,88 (м, CH R1, R2), 2,8 (м, 6Н, N(СН3)2); 7,3-NH |
| Таблица 2 | ||
| Степень извлечения Е и коэффициенты распределения (Di) Cu(II) при экстракции с ДМГД-9.Vв:Vo=1:3. - 0,21 г/л, СHL=0,05 моль/л | ||
| рH или NH3, моль/л | Е, % | Di |
| 4,46 | 36 | 1,7 |
| 4,78 | 56 | 3,8 |
| 5,09 | 67 | 6,1 |
| 5,70 | 94 | 47 |
| 5,90 | 96 | 72 |
| 6,28 | 99 | 297 |
| 8,53 | 99,9 | 2297 |
| 9,1 | 99,9 | 2297 |
| 7 моль/л NH3 | 99,9 | 2297 |
| Прототип: pH 5 - 5 моль/л NH3 | 99,9 | 999 |
| Таблица 3 | ||
| Степени извлечения Е и коэффициенты распределения (Di) при экстракции Cu(II) с ДМГД-9-18.Vв:Vо=1:3. , CHL=0,1 моль/л | ||
| pH или NH3, моль/л | E, % | Di |
| 3,3 | 41 | 2,1 |
| 3,5 | 63 | 5,1 |
| 3,9 | 86 | 16,1 |
| 6,6 | 97 | 97 |
| 9,5 | 99 | 237 |
| 10,0 | 99,8 | 1497 |
| 4,0 моль/л NН3 | 99,8 | 1497 |
| 6,5 моль/л NH3 | 99 | 297 |
| 10,0 моль/л NH3 | 97,5 | 117 |
| Прототип: pH 5 - 5 моль/л NH3 | 99,9 | 999 |
| Таблица 4 | ||||
| Влияние солей аммония на экстракцию Cu(II) ДМГД - 9-18.Vв:Vo=1:3. , СHL=0,1 моль/л | ||||
| pHравн | Концентрации, моль/л | Степень извлечения Cu2+ | ||
| NH3 | (NH4)2SO4 | без (NH4)2SO4 | в присутствии (NH4)2SO4 | |
| 8,2 | 0,1 | 0,44 | 99 | 99 |
| 8,2 | 0,1 | 1,46 | 99 | 94 |
| 7,8 | 0,03 | 1,60 | 98 | 96 |
| Таблица 5 | |||
| Степени извлечения Е и коэффициенты распределения (Di) при экстракции никеля(II) с ДМГД-9. Vo:Vв=1:2. , CHL=0,2 моль/л. | |||
| № опыта | pH | E, % | Di |
| 1 | 1,72 | 7,9 | 0,17 |
| 2 | 3,75 | 1,1 | 0,02 |
| 3 | 5,9 | 18,8 | 0,46 |
| 4 | 6,28 | 34,5 | 1,05 |
| 5 | 9,1 | 99,6 | 498 |
| 6 | 10,3 | 99,2 | 248 |
| 7 | 12 | 98,5 | 131 |
| Прототип | 9-10 | 80 | 4 |
| Таблица 6 | |||
| Степени извлечения Е и коэффициенты распределения (Di) кобальта(II) ДМГД-9.Vo:Vв=1:2. , СHL=0,2 моль/л | |||
| № опыта | pН | ЕСо(II), % | DCo(II) |
| 1 | 1,72 | 13,0 | 0,3 |
| 2 | 3,75 | 9,8 | 0,21 |
| 3 | 5,9 | 9,0 | 0,19 |
| 4 | 6,28 | 8,7 | 0,18 |
| 5 | 9,1 | 94,3 | 33,33 |
| 6 | 10,3 | 93,0 | 26,87 |
| Прототип | рН5 | 97 | 32,3 |
| Таблица 7 | |||||||||
| Степени извлечения (Е), коэффициенты распределения (Di) и разделения (β) nap Ni(II) - Co(II), Cu(II) - Ni(II), Cu(II) - Co(II) с реагентом ДМГД-9. СHL=0,2 моль/л в керосине, концентрации ионов металлов: , , . τ=1 мин | |||||||||
| рН | E, % | Di | βNi/Со | βNi/Cu | ВCu/Со | ||||
| Co(II) | Ni(II) | Cu(II) | Co(II) | Ni(II) | Cu(II) | ||||
| 5,9 | 9,0 | 18,8 | 96,0 | 0,19 | 0,46 | 72 | 2,4 | 156 | 378 |
| 6,28 | 8,7 | 34,5 | 99,0 | 0,18 | 1,05 | 297 | 5,8 | 282 | 1650 |
| 9,1 | 94,3 | 99,6 | 99,9 | 33,3 | 498 | 2297 | 15 | 4,6 | 69 |
| 10,3 | 93,1 | 99,2 | 99,9 | 26,7 | 248 | 2297 | 3,3 | 9,2 | 86 |
| Таблица 8 | |||
| Емкость органической фазы по меди(II) 2 моль/л раствора ДМГД-9 в керосине. Vв:Vо=1:1, экстракция 1 мин | |||
| Водная фаза (аммиачный раствор меди(II)) | , г/л | 29,9 | 54,6 |
| , г/л | 0 | 0,42 | |
| Органическая фаза (2 моль/л экстрагент) | CСu(o), (г/л) | 29,6 | 54,19 |
| Степень извлечения меди(II) | % | 100 | 99,2 |
1. Способ экстракции ионов меди(II), никеля(II) и/или кобальта(II) из слабокислых и аммиачных водных растворов органическим реагентом с последующей реэкстракцией водным раствором минеральной кислоты, отличающийся тем, что в качестве органического реагента используют N',N'-диметилгидразиды α-разветвленных третичных карбоновых кислот общей формулы (I): ,где R1 и R2 - алифатические радикалы с разветвленной цепью, содержащие в сумме от 9 до 18 атомов углерода.
2. Способ по п.1, отличающийся тем, что органический реагент используют в углеводородном растворителе в концентрации 0,05-2 моль/л.
3. Способ по п.1, отличающийся тем, что при извлечении меди(II) экстракцию осуществляют в слабокислых или аммиачных растворах в интервале от рН 6 до содержания NH3 10 моль/л.
4. Способ по п.1, отличающийся тем, что при извлечении никеля(II) экстракцию осуществляют в аммиачных растворах в интервале рН 7-12.
5. Способ по п.1, отличающийся тем, что при извлечении кобальта(II) экстракцию осуществляют в аммиачных растворах в интервале рН 8,5-10,3.
6. Способ по п.1, отличающийся тем, что при совместном извлечении никеля(II) и кобальта(II) экстракцию осуществляют в аммиачных растворах в интервале рН 7-12.
7. Способ по п.1, отличающийся, тем, что при одновременном присутствии никеля(II) и кобальта(II) выделение никеля(II) осуществляют в аммиачных растворах в интервале рН 7,5-9.
8. Способ по п.1, отличающийся тем, что при одновременном присутствии меди(II) и никеля(II) выделение меди(II) осуществляют в слабокислых или аммиачных растворах в интервале рН 6-7,5.
9. Способ по п.1, отличающийся тем, что при одновременном присутствии меди(II) и кобальта(II) выделение меди(II) осуществляют в слабокислых или аммиачных растворах в интервале рН 6-9.
10. Способ по п.1, отличающийся тем, что при одновременном присутствии меди(II), никеля(II) и кобальта(II) выделение меди(II) осуществляют в слабокислых или аммиачных растворах в интервале рН 6-7,5.