Меченые пептиды, связывающие фактор роста гепатоцитов (hgf), для визуализации
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии и медицины. Предложен агент визуализации, представляющий собой конъюгат структуры I, как определено в формуле изобретения. Агент визуализации относится к меченым cMet-связывающим пептидам. Эти пептиды включают метку оптической репортерной группой, подходящей для визуализации in vivo, с использованием света в диапазоне длин волн в области спектра 600-1200 нм. Также предложены фармацевтическая композиция для оптической визуализации, содержащая агент визуализации, набор для ее приготовления и способ оптической визуализации организма млекопитающего in vivo. Также предложен способ ведения больных колоректальным раком, включающий стадию оптической визуализации in vivo. Предложенный агент визуализации обладает повышенной cMet-связывающей аффинностью и избирательностью нацеливания in vivo на клетки-мишени. 6 н. и 22 з.п. ф-лы, 2 табл., 7 пр.
Реферат
Область изобретения
Настоящее изобретение относится к меченым cMet-связывающим пептидам, подходящим для оптической визуализации in vivo. Эти пептиды включают метку оптической репортерной группой, подходящей для визуализации в области спектра от красной до ближней инфракрасной. Также раскрыты способы визуализации in vivo, в частности, для применения в диагностике колоректального рака (CRC).
Предшествующий уровень техники
В WO 2005/030266 раскрыто, что существует медицинская необходимость в ранней диагностике колоректального рака (CRC). В WO 2005/030266 раскрыты оптические контрастные агенты визуализации, имеющие аффинность в отношении биологической мишени, аномально экспрессирующейся при CRC. Данная биологическая мишень выбрана из следующих: циклооксигеназа-2 (СОХ-2), бета-катенин, Е-кадгерин, Р-кадгерин, различные киназы, Her-2, матриксные металлопротеиназы (ММР), циклины, Р53, тимидилат-синтаза, рецепторы фактора роста эндотелия сосудов (VEGF), рецепторы эпидермального фактора роста, K-ras, белок аденоматозного полипоза толстой кишки, катепсин В, рецептор активатора плазминогена урокиназного типа (uPAR), рецептор фактора роста гепатоцитов (cMet), муцины и желудочные рецепторы. Сказано, что предпочтительные такие мишени (стр.7, строки 11-12) представляют собой: cMet, MMP-14, СОХ-2, бета-катенин и катепсин В. Вектор из WO 2005/030266 может представлять собой: пептид, пептоидную группировку, олигонуклеотид, олигосахарид, относящееся к липидам соединение или обычную органическую малую молекулу, подобную лекарствам. Репортерная группировка предпочтительно представляет собой краситель, который взаимодействует со светом в диапазоне длин волн от ультрафиолетовой до инфракрасной области электромагнитного спектра.
Фактор роста гепатоцитов (HGF), также известный как рассеивающий фактор (scatter factor, SF), представляет собой фактор роста, который вовлечен в различные физиологические процессы, такие как заживление ран и ангиогенез. Взаимодействие HGF с его высокоаффинным рецептором (cMet) вовлечено в рост, инвазию и метастазы опухолей.
В Knudsen et al. рассмотрена роль HGF и cMet в раке предстательной железы с возможным применением для визуализации и терапии [Adv.Cancer Res., 91, 31-67 (2004)]. Меченые антитела против met для диагностики и терапии описаны в WO 03/057155.
В WO 2004/078778 раскрыты полипептиды или мультимерные пептидные конструкции, которые связываются с cMet или комплексом, содержащим cMet и HGF. Описано приблизительно 10 различных структурных классов пептидов. В WO 2004/078778 раскрыто, что эти пептиды могут быть мечены детектируемой меткой для in vitro и in vivo применений или лекарственным средством для терапевтического применения. Детектируемая метка может представлять собой: фермент, флуоресцентное соединение, оптический краситель, ион парамагнитного металла, ультразвуковой контрастный агент или радионуклид. Сказано, что предпочтительные метки согласно WO 2004/078778 являются радиоактивными или парамагнитными и, наиболее предпочтительно, включают металл, который хелатирован металл-хелатирующим агентом.
Настоящее изобретение
В настоящем изобретении предложены агенты визуализации, подходящие для оптической визуализации in vivo, которые содержат cMet-связывающие циклические пептиды и оптическую репортерную визуализируемую группировку, подходящую для визуализации организма млекопитающего in vivo с использованием света в диапазоне длин волн от зеленой до ближней инфракрасной области спектра 500-1200 нм. cMet-связывающие циклические пептиды относятся к одному из структурных классов пептида из WO 2004/078778 и имеют оптимальную аффинность связывания в отношении cMet. Эти пептиды имеют происхождение из фагового дисплея и отобраны по их аффинности в отношении cMet и отсутствию конкуренции с HGF, как описано в WO 2004/078778. cMet-связывающие пептиды по настоящему изобретению предпочтительно имеют по меньшей мере один из их концов, защищенных группами, ингибирующими метаболизм (MIG). Это является важным фактором для применения in vivo, где эндогенные ферменты и пептидазы в противном случае будут быстро метаболизировать пептид с последующей потерей cMet-связывающей аффинности и тем самым потерей избирательного нацеливания in vivo.
В настоящем изобретении предложен наилучший путь использования cMet-связывающих пептидов in vivo, включающий применение оптического репортера, в противоположность другим способам визуализации (например, ядерной, магнитно-резонансной визуализации (MRI) или ультразвуковой), и кроме того предложены предпочтительные оптические визуализируемые репортеры. Область спектра от зеленой до ближней инфракрасной (свет с длиной волны 500-1200 нм) является предпочтительной, так как эта область имеет минимальное спектральное перекрывание с эндогенными тканями и веществами, такими как гемоглобин, порфирины, меланин и коллаген [Licha, Topics Curr. Chem., 222, 1-29 (2002)]. Другие важные факторы, вносящие вклад в аутофлуоресценцию, представляют собой восстановленный никотинамид-адениндинуклеотид (NADH), флавин-адениндинуклеотид (FAD) и эластин.
Подробное описание изобретения
В первом аспекте настоящего изобретения предложен агент визуализации, включающий конъюгат формулы I:
где:
Z1 присоединен к N-концу сМВР и представляет собой Н или MIG;
Z2 присоединен к С-концу сМВР и представляет собой ОН, OBc или MIG, где Bc представляет собой биосовместимый катион;
сМВР представляет собой cMet-связывающий циклический пептид из 17-30 аминокислот, который включает аминокислотную последовательность (SEQ-1):
Cysa-X1-Cysc-X2-Gly-Pro-Pro-X3-Phe-Glu-Cysd-Trp-Cysb-Tyr-X4-X5-X6; где
X1 представляет собой Asn, His или Tyr;
X2 представляет собой Gly, Ser, Thr или Asn;
X3 представляет собой Thr или Arg;
X4 представляет собой Ala, Asp, Glu, Gly или Ser;
X5 представляет собой Ser или Thr;
X6 представляет собой Asp или Glu;
и каждый из Cysa-d представляет собой остаток цистеина, так что остатки а и b, а также c и d циклизованы с образованием двух отдельных дисульфидных связей;
MIG представляет собой группу, ингибирующую метаболизм, которая представляет собой биосовместимую группу, ингибирующую или подавляющую метаболизм сМВР-пептида in vivo;
L представляет собой синтетическую линкерную группу формулы -(А)m-, где каждый А независимо представляет собой -CR2-, -CR=CR-, -C≡C-, -CR2CO2-, -CO2CR2-, -NRCO-, -CONR-, -NR(C=O)NR-, -NR(C=S)NR-, -SO2NR-, -NRSO2-, -CR2OCR2-, -CR2SCR2-, -CR2NRCR2-, С4-8циклогетероалкиленовую группу, С4-8циклоалкиленовую группу, С5-12ариленовую группу или С3-12гетероариленовую группу, аминокислоту, сахар или монодисперсную полиэтиленгликолевую (PEG) структурную единицу;
каждый R независимо выбран из Н, С1-4алкила, С2-4алкенила, С2-4алкинила, С1-4алкоксиалкила или С1-4гидроксиалкила;
m равен целому числу от 1 до 20;
n равен целому числу 0 или 1;
IM представляет собой оптическую репортерную визуализируемую группировку, подходящую для визуализации организма млекопитающего in vivo с использованием света в диапазоне длин волн в области спектра от зеленой до ближней инфракрасной: 600-1200 нм.
Термин "агент визуализации" означает соединение, подходящее для визуализации организма млекопитающего in vivo. Предпочтительно, млекопитающее представляет собой человека. Визуализация может быть инвазивной (например, интраоперационной или эндоскопической) или неинвазивной. Предпочтительный способ визуализации представляет собой эндоскопию. Хотя конъюгат формулы I подходит для визуализации in vivo, он также может быть использован in vitro (например, для анализов количественного определения cMet в биологических образцах или визуализации cMet в тканевых образцах). Предпочтительно, агент визуализации используют для визуализации in vivo.
Группа Z1 замещает аминогруппу последнего аминокислотного остатка. Таким образом, когда Z1 представляет собой Н, амино-конец сМВР оканчивается свободной группой NH2 последнего аминокислотного остатка. Группа Z2 замещает карбонильную группу последнего аминокислотного остатка. Таким образом, когда Z2 представляет собой ОН, карбокси-конец сМВР оканчивается свободной группой CO2H последнего аминокислотного остатка, и когда Z2 представляет собой OBc, эта концевая карбоксильная группа ионизирована в виде группы CO2Bc.
Термин "группа, ингибирующая метаболизм" (MIG) означает биосовместимую группу, которая ингибирует или подавляет метаболизм сМВР-пептида in vivo либо по амино-концу (Z1), либо по карбокси-концу (Z2). Такие группы хорошо известны специалистам в данной области техники и выбраны подходящим образом, для амино-конца пептидов, из: N-ацилированных групп -NH(C=О)RG, где ацильная группа -(C=O)RG имеет RG, выбранный из C1-6алкила, С3-10арильных групп, или содержит полиэтиленгликолевую (PEG) структурную единицу. Подходящие группы PEG описаны ниже для линкерной группы (L). Предпочтительные такие группы PEG представляют собой биомодификаторы формулы IA или IB. Предпочтительные такие аминоконцевые группы MIG представляют собой ацетил, бензилоксикарбонил или трифторацетил, наиболее предпочтительно ацетил.
Подходящие группы, ингибирующие метаболизм, для пептидного карбоксильного конца включают: карбоксамид, трет-бутиловый эфир, бензиловый эфир, циклогексиловый эфир, аминоспирт или полиэтиленгликолевую (PEG) структурную единицу. Подходящая группа MIG для карбоксильного концевого аминокислотного остатка сМВР-пептида является такой, где концевая аминогруппа аминокислотного остатка N-алкилирована C1-4алкильной группой, предпочтительно метильной группой. Предпочтительные такие группы MIG представляют собой карбоксамид или PEG, наиболее предпочтительные такие группы представляют собой карбоксамид.
Формула I означает, что группировка -(L)n[IM] может быть присоединена по любому положению Z1, Z2 или сМВР. Для Z1 или Z2 группировка -(L)n[IM] может быть либо присоединена к группе MIG, где один из Z1/Z2 представляет собой MIG. Когда Z1 представляет собой Н, или Z2 представляет собой ОН, присоединение группировки -(L)n[IM] по положению Z1 или Z2 дает соединения формул [IM]-(L)n-[cMBP]-Z2 или Z1-[cMBP]-(L)n-[IM], соответственно. Ингибирование метаболизма сМВР по одному из пептидных концов может также быть достигнуто путем присоединения группировки -(L)n[IM] таким образом, но -(L)n[IM] не охватывается определением MIG по настоящему изобретению.
Группировка -(L)n- формулы I может быть присоединена по любому подходящему положению IM. Группировка -(L)n- либо занимает место имеющегося заместителя IM, либо ковалентно присоединена к имеющемуся заместителю IM. Группировка -(L)n- предпочтительно присоединена через карбоксиалкильный заместитель IM.
Термин "cMet-связывающий циклический пептид" (сМВР) означает пептид, который связывается с высокоаффинным рецептором фактора роста гепатоцитов (HGF), также известным как cMet (c-Met или рецептор фактора роста гепатоцитов). Подходящие сМВР-пептиды по настоящему изобретению имеют кажущуюся константу диссоциации (KD) для cMet из комплекса cMet/HGF менее чем приблизительно 20 нМ. Указанные сМВР-пептиды содержат остатки пролина, и известно, что такие остатки могут проявлять цис/транс изомеризацию основной амидной связи. сМВР-пептиды по настоящему изобретению включают любые такие изомеры.
Термин "биосовместимый катион" (Bc) означает положительно заряженный противоион, который образует соль с ионизированной отрицательно заряженной группой, где указанный положительно заряженный противоион является также нетоксичным и поэтому подходящим для введения в организм млекопитающего, особенно организм человека. Примеры подходящих биосовместимых катионов включают: щелочные металлы натрий и калий; щелочноземельные металлы кальций и магний; и ион аммония. Предпочтительные биосовместимые катионы представляют собой натрий и калий, наиболее предпочтительно натрий.
Термин "аминокислота" означает L- или D-аминокислоту, аналог аминокислоты (например, нафтилаланин) или миметик аминокислоты, которые могут быть естественного происхождения или получены тонким синтезом, и могут быть оптически чистыми, то есть в виде индивидуального энантиомера и поэтому хиральными, или в виде смеси энантиомеров. Для обозначения аминокислот в данном описании использованы общепринятые 3-буквенные или однобуквенные сокращения. Предпочтительно, аминокислоты по настоящему изобретению являются оптически чистыми. Термин "миметик аминокислоты" означает синтетические аналоги существующих в природе аминокислот, которые являются изостерами, то есть разработаны так, чтобы имитировать стерическую и электронную структуру природного соединения. Такие изостеры хорошо известны специалистам в данной области техники и включают депсипептиды, ретро-инверсо-пептиды, тиоамиды, циклоалканы или 1,5-дизамещенные тетразолы, но не ограничены ими [см. М. Goodman, Biopolymers, 24, 137, (1985)].
Термин "пептид" означает соединение, содержащее две или более аминокислот, как определено выше, связанных пептидной связью (то есть амидной связью, присоединяющей амин одной аминокислоты к карбоксилу другой аминокислоты). Термин "миметик пептида" или "миметик" относится к биологически активным соединениям, которые имитируют биологическую активность пептида или белка, но более не являются пептидными по химической природе, то есть они более не содержат никаких пептидных связей (то есть амидных связей между аминокислотами). Здесь термин «миметик пептида» используют в более широком смысле для включения молекул, которые более не являются полностью пептидными по природе, таких как псевдопептиды, полупептиды и пептоиды.
Термин "оптическая репортерная визуализируемая группировка" (IM) означает флуоресцентный краситель или хромофор, способный к обнаружению прямо или опосредованно в процедуре оптической визуализации с использованием света в диапазоне длин волн в области спектра от зеленой до ближней инфракрасной (500-1200 нм, предпочтительно 600-1000 нм). Предпочтительно IM имеет флуоресцентные свойства.
Предусмотрено, что одна из ролей линкерной группы -(А)m- формулы I заключается в том, чтобы отдалять IM от активного сайта сМВР-пептида. Это особенно важно, когда визуализируемая группировка является относительно объемной, так чтобы не препятствовать взаимодействию с ферментом. Этого можно достичь комбинацией гибкости (например, простые алкильные цепи), так что эта объемная группа имеет свободу для саморасположения вдали от активного сайта, и/или жесткости, такой как циклоалкильный или арильный спейсер, который ориентирует IM вдали от активного сайта. Природа линкерной группы может также быть использована для модификации биораспределения агента визуализации. Таким образом, например, включение эфирных групп в линкер будет способствовать минимизации связывания с белками плазмы. Когда -(А)m- содержит полиэтиленгликолевую (PEG) структурную единицу или пептидную цепь из 1-10 аминокислотных остатков, линкерная группа может иметь функцию модифицирования фармакокинетических параметров и скорости клиренса из крови агента визуализации in vivo. Такие "биомодифицирующие" линкерные группы могут ускорять клиренс агента визуализации из фоновой ткани, такой как мышечная или печеночная, и/или из крови, тем самым давая лучшее диагностическое изображение вследствие меньших фоновых помех. Биомодифицирующая линкерная группа может также быть использована для того, чтобы способствовать конкретному пути экскреции, например, через почки, в противоположность пути через печень.
Термин "сахар" означает моно-, ди- или трисахарид. Подходящие сахара включают: глюкозу, галактозу, мальтозу, маннозу и лактозу. Возможно, сахар может быть функционализирован, чтобы обеспечить легкое сочетание с аминокислотами. Таким образом, например, глюкозаминное производное аминокислоты может быть конъюгировано с другими аминокислотами через пептидные связи. Глюкозаминное производное аспарагина (имеющееся в продаже от NovaBiochem) представляет собой один из таких примеров:
Предпочтительные признаки
Молекулярная масса агента визуализации составляет подходящим образом вплоть до 8000 Дальтон. Предпочтительно, молекулярная масса находится в диапазоне от 2800 до 6000 Дальтон, наиболее предпочтительно от 3000 до 4500 Дальтон, особенно предпочтительно от 3200 до 4000 Дальтон.
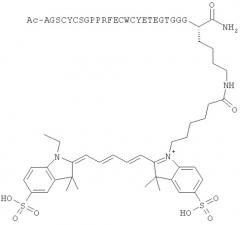
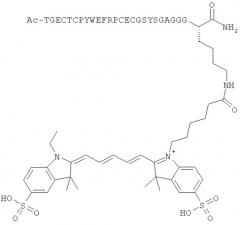
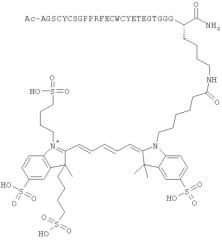
Предпочтительные агенты визуализации по настоящему изобретению имеют оба пептидных конца, защищенных группами MIG, то есть предпочтительно оба Z1 и Z2 представляют собой MIG, которые будут, как правило, разными. Как указано выше, один из Z1/Z2 может возможно представлять собой -(L)n[IM]. Наличие обоих замещенных пептидных концов в данном случае важно для применений визуализации in vivo, так как в противном случае ожидается быстрый метаболизм с последующей потерей аффинности избирательного связывания в отношении cMet. Когда оба Z1 и Z2 представляют собой MIG, предпочтительно Z1 представляет собой ацетил, и Z2 представляет собой первичный амид. Наиболее предпочтительно, Z1 представляет собой ацетил, и Z2 представляет собой первичный амид, и группировка -(L)n[IM] присоединена к ε-аминогруппе боковой цепи остатка лизина в сМВР.
Предпочтительные сМВР-пептиды по настоящему изобретению имеют KD в отношении связывания cMet с комплексом cMet/HGF менее чем приблизительно 10 нМ (на основе анализа измерений поляризации флуоресценции), наиболее предпочтительно в диапазоне от 1 до 5 нМ, в идеальном случае менее чем 3 нМ,
Пептидная последовательность (SEQ-1):
Cysa-X1-Cysc-X2-Gly-Pro-Pro-X3-Phe-Glu-Cysd-Trp-Cysb-Tyr-X4-X5-X6 (SEQ-1)
сМВР формулы I представляет собой последовательность 17-мерного пептида, ответственную главным образом за избирательное связывание с cMet. Когда сМВР-пептид по настоящему изобретению содержит более чем 17 аминокислотных остатков, остальные аминокислоты могут представлять собой любую аминокислоту, за исключением цистеина. Дополнительно, незащищенные остатки цистеина могут вызывать нежелательное скремблирование определенных дисульфидных мостиков Cysa-Cysb и Cysc-Cysd. Дополнительные пептиды предпочтительно содержат по меньшей мере один аминокислотный остаток с боковой цепью, подходящей для легкой конъюгации группировки -(L)n[IM]. Подходящие такие остатки включают остатки Asp или Glu для конъюгации с группами -(L)n[IM], функционализированными аминогруппами, или остаток Lys для конъюгации с группой -(L)n[IM], функционализированной карбоксигруппами или активным сложным эфиром. Аминокислотные остатки для конъюгации -(L)n[IM] подходящим образом локализованы вдали от 17-мерного связывающего участка сМВР-пептида (SEQ-1) и предпочтительно локализованы на С- или N-конце. Предпочтительно, аминокислотный остаток для конъюгации представляет собой остаток Lys.
Замещение остатка триптофана SEQ-1 оценивали с известными аминокислотными заместителями фенилаланином и нафтилаланином. Однако была обнаружена потеря аффинности в отношении cMet, подтверждая тот факт, что остаток триптофана важен для активности.
Предпочтительно, когда сМВР-пептид дополнительно содержит N-концевой остаток серина с получением 18-мера (SEQ-2):
Ser-Cysa-X1-Cysc-X2-Gly-Pro-Pro-X3-Phe-Glu-Cysd-Trp-Cysb-Tyr-X4-X5-X6 (SEQ-2)
В дополнение к SEQ-1 или предпочтительно SEQ-2, сМВР наиболее предпочтительно дополнительно включает одно из следующего:
(1) остаток Asp или Glu в пределах 4 аминокислотных остатков пептидного С- или N-конца сМВР-пептида, и -(L)nIM функционализирована аминогруппой, которая конъюгирована с карбоксилом боковой цепи указанного остатка Asp или Glu с получением амидной связи;
(2) остаток Lys в пределах 4 аминокислотных остатков пептидного С- или N-конца сМВР-пептида, и -(L)nIM функционализирована карбоксильной группой, которая конъюгирована с ε-аминогруппой боковой цепи указанного остатка Lys с получением амидной связи.
Предпочтительные сМВР-пептиды содержат 22-мерную аминокислотную последовательность (SEQ-3):
Ala-Gly-Ser-Cysa-X1-Cysc-X2-Gly-Pro-Pro-X3-Phe-Glu-Cysd-Trp-Cysb-Tyr-X4-X5-X6-Gly-Thr (SEQ-3)
сМВР-пептиды по настоящему изобретению предпочтительно имеют X3, представляющий собой Arg.
сМВР-пептид предпочтительно дополнительно содержит, в дополнение к SEQ-1, SEQ-2 или SEQ-3, по любому из N- или С-концов линкерный пептид, выбранный из:
-Gly-Gly-Gly-Lys- (SEQ-4), -Gly-Ser-Gly-Lys- (SEQ-5) или
-Gly-Ser-Gly-Ser-Lys- (SEQ-6).
Остаток Lys линкерного пептида является наиболее предпочтительной точкой локализации для конъюгации группировки -(L)n[IM]. Особенно предпочтительные сМВР-пептиды содержат SEQ-3 вместе с линкерным пептидом SEQ-4, давая 26-мерную аминокислотную последовательность (SEQ-7):
Ala-Gly-Ser-Cysa-Tyr-Cysc-Ser-Gly-Pro-Pro-Arg-Phe-Glu-Cysd-Trp-Cysb-Tyr-Glu-Thr-Glu-Gly-Thr-Gly-Gly-Gly-Lys (SEQ-7)
сМВР-пептиды с SEQ-1, SEQ-2, SEQ-3 и SEQ-7 предпочтительно имеют Z1 и Z2, оба представляющих собой MIG, и, наиболее предпочтительно, имеют Z1, представляющий собой ацетил, и Z2, представляющий собой первичный амид.
Группировка -(L)n[IM] подходящим образом присоединена к одной из групп Z1 или Z2 или аминоксилотному остатку сМВР-пептида, который отличается от cMet-связывающей последовательности SEQ-1. Предпочтительные аминокислотные остатки и сайты конъюгации являются такими, как описано выше. Когда группировка -(L)n[IM] присоединена к Z1 или Z2, она может занимать место Z1 или Z2 при конъюгации по N- или С-концу и блокировать метаболизм in vivo таким образом.
Предпочтительные группы IM имеют распространенную делокализованную систему электронов, например, цианины, мероцианины, индоцианины, фталоцианины, нафталоцианины, трифенилметины, порфирины, пирилиевые красители, тиапирилиевые красители, скварилиевые красители, крокониевые красители, азулениевые красители, индоанилины, бензофеноксазиниевые красители, бензотиафенотиазиниевые красители, антрахиноны, нафтохиноны, индатрены, фталоилакридоны, трисфенохиноны, азокрасители, красители с внутримолекулярным и межмолекулярным переносом заряда и комплексы красителей, тропоны, тетразины, бис(дитиолен)овые комплексы, бис(бензол-дитиолат)ные комплексы, иоданилиновые красители, бис(S,O-дитиолен)овые комплексы. Флуоресцентные белки, такие как зеленый флуоресцентный белок (GFP) и модификации GFP, которые имеют различные свойства поглощения/испускания, также являются полезными. Комплексы некоторых редкоземельных металлов (например европия, самария, тербия или диспрозия) используют в некоторых контекстах, так как они являются флуоресцентными нанокристаллами (квантовые точки).
Конкретные примеры хромофоров, которые могут быть использованы, включают флуоресцеин, сульфородамин 101 (техасский красный), родамин В, родамин 6G, родамин 19, индоцианиновый зеленый, Су2, Су3В, Су3.5, Су5, Су5.5, Су7, Су7.5, Marina Blue, Pacific Blue, Oregon Green 488, Oregon Green 514, тетраметилродамин, Alexa Fluor 350, Alexa Fluor 430, Alexa Fluor 532, Alexa Fluor 546, Alexa Fluor 555, Alexa Fluor 568, Alexa Fluor 594, Alexa Fluor 633, Alexa Fluor 647, Alexa Fluor 660, Alexa Fluor 680, Alexa Fluor 700 и Alexa Fluor 750. Цианиновые красители являются особенно предпочтительными. Licha et al. приводят обзор по красителям и конъюгатам с красителями для оптической визуализации in vivo [Topics Curr. Chem., 222, 1-29 (2002); Adv.Drug Deliv.Rev., 57, 1087-1108 (2005)].
Предпочтительные цианиновые красители, которые являются флуорофорами, представлены формулой II:
где каждый X' независимо выбран из: -С(СН3)2, -S-, -О- или -С[(СН2)аСН3][(СН2)bM]-, где а равен целому числу от 0 до 5, b равен целому числу от 1 до 5, и М представляет собой группу G или выбран из SO3M1 или Н;
каждый Y' независимо представляет собой 1-4 группы, выбранные из группы, состоящей из:
H, -CH2NH2, -SO3M1, -СН2СООМ1, -NCS и F, и где указанные группы Y' находятся по любому положению ароматического кольца;
Q' независимо выбран из группы, состоящей из: H, SO3M1, NH2, COOM1, аммония, сложноэфирных групп, бензила и группы G;
М1 представляет собой Н или Bc;
I равен целому числу от 1 до 3;
и m равен целому числу от 1 до 5;
где по меньшей мере один из X', Y' и Q' включает группу G;
G представляет собой реакционноспособную или функциональную группу, подходящую для присоединения к сМВР-пептиду.
Группа G взаимодействует с комплементарной группой сМВР-пептида, образуя ковалентную связь между флуорофором цианинового красителя и сМВР-пептидом. G может представлять собой реакционноспособную группу, которая может взаимодействовать с комплементарной функциональной группой пептида или, альтернативно, может включать функциональную группу, которая может взаимодействовать с реакционноспособной группой сМВР-пептида. Примеры реакционноспособных и функциональных групп включают: активные сложные эфиры; изотиоцианаты; малеимид; галогеноацетамид; галогенангидрид; гидразид; винилсульфон; дихлортриазин; фосфорамидит; гидроксил; амино; сульфгидрил; карбонил; карбоновую кислоту и тиофосфат. Предпочтительно G представляет собой активный сложный эфир.
Термин "активированный сложный эфир" или "активный сложный эфир" означает сложноэфирное производное ассоциированной карбоновой кислоты, которое является лучшей уходящей группой и поэтому обеспечивает более легкое взаимодействие с нуклеофилом, таким как амины. Примеры подходящих активных сложных эфиров представляют собой: N-гидроксисукцинимид (NHS), сульфо-сукцинимидиловый эфир, пентафторфенол, пентафтортиофенол, пара-нитрофенол, гидроксибензотриазол и РуВОР (то есть гексафторфосфат бензотриазол-1-ил-окситрипирролидинофосфония). Предпочтительные активные сложные эфиры представляют собой N-гидроксисукцинимидные или пентафторфенольные сложные эфиры, особенно N-гидроксисукцинимидные сложные эфиры.
В предпочтительном воплощении формулы II:
каждый X' выбран из группы -С(СН3)2- и -С(СН3)[(СН2)4М]-,
где М представляет собой группу G или -SO3M1;
каждый Y' представляет собой SO3M1, Н или 1-4 атома F;
каждый Q' выбран из группы G и SO3M1;
I предпочтительно равен 2, и m предпочтительно равен 3, 4 или 5;
где, когда один из X' или Q' представляет собой группу G, она наиболее предпочтительно представляет собой сукцинимидиловый сложный эфир.
Особенно предпочтительные цианиновые красители представлены формулой III:
где R1 и R2 независимо представляют собой Н или SO3M1, и по меньшей мере один из R1 и R2 представляет собой SO3M1, где М1 представляет собой Н или Bc;
R3 и R4 независимо представляют собой С1-4алкил или C1-6карбоксиалкил;
R5, R6, R7 и R8 независимо представляют собой группы Ra;
где Ra представляет собой С1-4алкил, C1-6карбоксиалкил или -(CH2)kSO3M1, где k равен целому числу 3 или 4;
при условии, что цианиновый краситель имеет суммарно 1-4 заместителя SO3M1 в группах R1, R2 и Ra.
Предпочтительные красители формулы III выбраны таким образом, чтобы присутствовала по меньшей мере одна С1-6карбоксиалкильная группа, для того чтобы облегчить конъюгацию с сМВР.
Предпочтительные индивидуальные красители формулы III перечислены в Таблице 1.
| Таблица 1 | ||||
| Химические структуры индивидуальных цианиновых красителей | ||||
| Таблица 1 | Название красителя | |||
| Су5(1) | Су5(2) | Су5** | Alexa647 | |
| R1 | Н | SO3H | SO3H | SO3H |
| R2 | SO3H | SO3H | SO3H | SO3H |
| R3 | СН3 | СН3 | СН3 | Rf |
| R4 | СН3 | СН3 | СН3 | СН3 |
| R5 | СН3 | СН3 | СН3 | СН3 |
| R6 | СН3 | СН3 | -(СН2)4SO3H | СН3 |
| R7 | Rf | Rf | Rf | -(СН2)3SO3H |
| R8 | СН3 | Et | -(СН2)4SO3H | -(СН2)3SO3H |
где Rf представляет собой -(СН2)5СООН.
Особенно предпочтительные красители формулы II представляют собой Су5** и Alexa647, причем Су5** является наиболее предпочтительным.
Когда присутствует синтетическая линкерная группа (L), она предпочтительно содержит концевые функциональные группы, которые облегчают конъюгацию с [IM] и Z1-[cMBP]-Z2. Когда L содержит пептидную цепь из 1-10 аминокислотных остатков, эти аминокислотные остатки предпочтительно выбраны из глицина, лизина, аргинина, аспарагиновой кислоты, глутаминовой кислоты или серина. Когда L содержит группировку PEG, она предпочтительно содержит структурные единицы, полученные при олигомеризации монодисперсных PEG-подобных структур формул IA или IB:
17-амино-5-оксо-6-аза-3,9,12,15-тетраоксагептадекановая кислота формулы IA, где p равен целому числу от 1 до 10. Альтернативно, может быть использована PEG-подобная структура на основе производного пропионовой кислоты формулы IB:
где p является таким, как определено для формулы IA, и q равен целому числу от 3 до 15.
В формуле IB, p предпочтительно равен 1 или 2, и q предпочтительно равен числу от 5 до 12.
Когда линкерная группа не содержит PEG или пептидную цепь, предпочтительные группы L имеют основную цепь соединенных атомов, образующих группировку -(А)m- из 2-10 атомов, наиболее предпочтительно из 2-5 атомов, особенно предпочтительно из 2 или 3 атомов. Минимальная линкерная группа с основной цепью из 2 атомов дает преимущество в том, что визуализируемая группировка хорошо отделена, так что какое-либо нежелательное взаимодействие минимизировано.
В формуле I, n предпочтительно равен 0 или 1, наиболее предпочтительно 0, то есть не присутствует никаких линкерных групп.
Предпочтительные агенты визуализации по настоящему изобретению представлены формулой IV:
где группа (L)n[IM] присоединена к ε-аминогруппе остатка Lys. Предпочтительные агенты визуализации формулы IV имеют MIG (N-концевой Ala), представляющую собой ацетил, и MIG (С-концевой Lys), представляющую собой первичный амид. В формуле IV, n предпочтительно равен нулю, и IM предпочтительно представляет собой цианиновый краситель, наиболее предпочтительно цианиновый краситель формулы II, Особенно предпочтительные агенты визуализации формулы IV имеют IM, представляющую собой Су5** или Alexa647, наиболее предпочтительно Су5**.
Пептиды формулы Z1-[cMBP]-Z2 по настоящему изобретению могут быть получены способом получения, включающим:
(1) твердофазный пептидный синтез линейного пептида, который имеет такую же пептидную последовательность, как и желаемый сМВР-пептид, и в котором Cysa и Cysb не защищены, а остатки Cysc и Cysd имеют защитные группы для тиола;
(2) обработку пептида со стадии (1) водным основанием в растворе с получением моноциклического пептида с первой дисульфидной связью, соединяющей Cysa и Cysb;
(3) удаление с Cysc и Cysd защитных групп для тиола и циклизацию с получением второй дисульфидной связи, соединяющей Cysc и Cysd, с получением желаемого бициклического пептидного продукта Z1-[cMBP]-Z2.
Термин "защитная группа" означает группу, которая ингибирует или подавляет нежелательные химические реакции, но которая предназначена быть достаточно реакционноспособной, так чтобы ее можно было удалить с интересующей функциональной группы в достаточно мягких условиях, которые не изменяют остальную часть молекулы. После удаления защиты получают желаемый продукт. Защитные группы для амино хорошо известны специалистам в данной области техники, и они подходящим образом выбраны из: Boc (где Boc представляет собой трет-бутоксикарбонил), Fmoc (где Fmoc представляет собой флуоренилметоксикарбонил), трифторацетила, аллилоксикарбонила, Dde [то есть 1-(4,4-диметил-2,6-диоксоциклогексилиден)-этил] или Npys (то есть 3-нитро-2-пиридинсульфенил). Подходящие защитные группы для тиола представляют собой Trt (тритил), Асm (ацетамидометил), t-Bu (трет-бутил), трет-бутилтио, метоксибензил, метилбензил или Npys (3-нитро-2-пиридинсульфенил). Использование других защитных групп описано в "Protective Groups in Organic Synthesis", Theorodora W. Greene и Peter G.M.Wuts, (John Wiley & Sons, 1991). Предпочтительные защитные группы для амино представляют собой Воc и Fmoc, наиболее предпочтительно Boc. Предпочтительные защитные группы для амино представляют собой Trt и Acm.
В Примерах 1 и 2 предложено дополнительное конкретное описание. Дополнительные подробности твердофазного пептидного синтеза описаны в Р. Lloyd-Williams, F. Albericio and E. Girald; Chemical Approaches to the Synthesis of Peptides and Proteins, CRC Press, 1997. сМВР-пептиды лучше всего хранить в атмосфере инертного газа и выдерживать в морозильной камере. При использовании в растворе лучше избегать значений рН выше 7, так как это повышает риск скремблирования дисульфидных мостиков.
Агенты визуализации могут быть получены как описано в третьем аспекте (ниже).
Во втором аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая агент визуализации по первому аспекту вместе с биосовместимым носителем, в форме, подходящей для введения млекопитающему.
"Биосовместимый носитель" представляет собой жидкость, в частности жидкость, в которой агент визуализации может быть суспендирован или растворен, так чтобы композиция была физиологически переносимой, то есть могла быть введена в организм млекопитающего без проявления токсичности или чрезмерного дискомфорта. Биосовместимый носитель представляет собой подходящим образом инъецируемый жидкий носитель, такой как стерильная апирогенная вода для инъекций; водный раствор, такой как физиологический раствор (который может быть преимущественно отрегулирован так, чтобы конечный продукт для инъекции был изотоническим); водный раствор одного или более чем одного вещества, регулирующего тоничность (например, соли катионов плазмы с биосовместимыми противоионами), сахара (например глюкоза или сахароза), сахарные спирты (например сорбит или маннит), гликоли (например глицерин) или другие неионные полиолы (например полиэтиленгликоли, пропиленгликоли и тому подобное). Предпочтительно, биосовместимый носитель представляет собой апирогенную воду для инъекций или изотонический физиологический раствор.
Агенты визуализации и биосовместимый носитель каждый предложены в подходящих флаконах или сосудах, включающих герметичный контейнер, который обеспечивает поддержание стерильной целостности и/или радиоактивной безопасности, а также, возможно, инертный газ в свободном пространстве над продуктом (например, азот или аргон), в то же время обеспечивая возможность добавления и извлечения растворов шприцем или канюлей. Предпочтительный такой контейнер представляет собой закрытый герметичной мембраной флакон, где газонепроницаемая крышка прижата дополнительным укупорочным средством (как правило, алюминиевым). Указанная крышка является подходящей для прокалывания шприцем или многократного прокалывания иглой для подкожных инъекций (например, герметичная крышка с прижатой мембраной), в то же время сохраняя стерильную целостность. Такие контейнеры имеют дополнительное преимущество в том, что крышка может выдерживать вакуум при необходимости (например, для смены газа в свободном пространстве над продуктом или дегазации растворов) и выдерживать изменения давления, такие как падения давления, не давая возможности при этом проникновения внешних атмосферных газов, таких как кисло