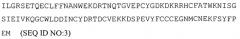Антагонисты активина-actriia-fc и их применение для лечения или профилактики рака молочной железы
Иллюстрации
Показать всеГруппа изобретений относится к онкологии, а именно раскрывает слитый белок ActRIIa-Fc, его применение и способ лечения связанного с раком молочной железы разрежения кости у человека введением эффективного количества данного белка. Группа изобретений позволяет предотвратить или подавить развитие разрежения кости у пациента. 3 н. и 29 з.п. ф-лы, 3 ил., 6 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет на основании предварительной заявки США № 60/899070, поданной 1 февраля 2007 г., и предварительной заявки США № 61/000540, поданной 25 октября 2007 г. Все содержание вышеуказанных заявок включено в данное описание в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Рак молочной железы является наиболее распространенным типом рака среди женского населения Западных стран, в США он поражает более 180000 женщин каждый год. Заболевание возникает в молочной железе, которая имеет разветвленную систему протоков. Каждая молочная железа, или грудная железа, содержит от 15 до 20 сегментов, называемых долями, причем каждая доля содержит ряд разветвленных потоков, выходящих в сосок. Эпителиальные клетки, выстилающие каждый проток, отвечают за продукцию молока. Полагают, что инвазивный рак молочной железы возникает в нормальном эпителии конечного элемента протока/доли в результате ряда увеличивающихся аномальных пролиферативных повреждений. Когда опухоль приобретает способность к метастазированию, клетки рака молочной железы распространяются в другие органы, что значительно затрудняет лечение. Чаще всего участками метастазов рака молочной железы являются легкие, печень и кости. Метастазы в костях обычно связаны с сильной болью, разрежением костей и повышением риска переломов. Многие антиэстрогенные терапии, используемые для лечения рака молочной железы, также связаны с разрежением костей.
У пациентов с диагнозом рак молочной железы первичную опухоль обычно удаляют с помощью хирургической операции и/или лучевой терапии, после чего проводят вспомогательную терапию, чтобы воздействовать на все раковые клетки, которые могли распространиться в отдаленные участки. К вспомогательной терапии относится цитотоксическая химиотерапия и/или эндокринная терапия. Хотя химиотерапия эффективна при лечении разных типов злокачественных заболеваний, многие противоопухолевые соединения вызывают нежелательные побочные эффекты. Кроме того, многие опухоли не отвечают на химиотерапию и эндокринную терапию или приобретают устойчивость к ним. Хотя вспомогательная терапия снижает процент смертности среди пациентов с раком молочной железы, коэффициент 10-летней выживаемости среди пациентов с наиболее распространенными гистопатологическими типами инвазивного рака молочной железы составляет пока только 35-50% (Weigelt et al. 2005 Nat. Rev. Cancer 5: 591-602). Кроме того, многие женщины, которые могли бы подвергаться только локальному лечению, в случае плохого прогноза необязательно получают вспомогательную терапию.
Следовательно, для лечения рака молочной железы требуются более действенные и эффективные молекулярные мишени. Альтернативные способы лечения, которые являются менее токсичными и/или более эффективными, чем химиотерапия и эндокринная терапия, улучшают режимы лечения и повышают выживание. Кроме того, в клинике можно использовать средства, пригодные для профилактического лечения пациентов с риском развития инвазивного или метастатического рака молочной железы. Следовательно, целью настоящего изобретения является предоставление альтернативных композиций и способов лечения рака молочной железы, или подавления или предотвращения развития рака молочной железы у пациентов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Отчасти настоящее изобретение относится к применению антагонистов активина, а также антагонистов ActRIIa для лечения или профилактики рака молочной железы, или разрежения костей, связанного с раком молочной железы. В частности, данное описание предлагает способы лечения или профилактики рака молочной железы с использованием растворимой формы ActRIIa, которая действует как ингибитор активина. Хотя растворимый ActRIIa может воздействовать на рост или выживание раковых клеток посредством механизма, отличного от антагонизма по отношению к активину, целевые терапевтические средства можно выбирать на основе антагонизма по отношению к активину, или антагонизма по отношению ActRIIa, или и того, и другого. Такие средства имеют общее название антагонисты активина-ActRIIa. Следовательно, в некоторых воплощениях описание предлагает способы применения антагонистов активина-ActRIIa, включающих в себя, например, активин-связывающие полипептиды ActRIIa, антитела против активина, антитела против ActRIIa, активин- или ActRIIa-направленные малые молекулы и аптамеры, и нуклеиновые кислоты, которые уменьшают экспрессию активина и ActRIIa, для лечения или профилактики рака молочной железы у пациентов, нуждающихся в этом. Как описано в патентной заявке США № 11/603485, включенной в данное описание в качестве ссылки, антагонисты активина-ActRIIa можно использовать для стимулирования роста костей и увеличения плотности костей. Как описано в данном документе, такие антагонисты также можно использовать для лечения или профилактики рака молочной железы, метастазов рака молочной железы в костях и разрежения костей, связанного с раком молочной железы.
В некоторых аспектах изобретение предлагает способы лечения или профилактики рака молочной железы с помощью полипептидов, в том числе растворимого активин-связывающего полипептида ActRIIa, который связывается с активином. На основе полипептидов ActRIIa можно получить фармацевтическую композицию, содержащую активин-связывающий полипептид ActRIIa и фармацевтически приемлемый носитель. Активин-связывающий полипептид ActRIIa может связываться с активином с KD, составляющей менее 1 микромоля, или менее 100, 10 или 1 наномоля. Активин-связывающий полипептид ActRIIa может селективно связываться с активином по сравнению с GDF11 и/или GDF8, причем KD при связывании с активином может быть, по меньшей мере, в 10, 20 или 50 раз ниже, чем при связывании с GDF11 и/или GDF8. Без связи с каким-либо конкретным механизмом действия полагают, что данная степень селективности в отношении ингибирования активина по сравнению с ингибированием GDF11/GDF8 объясняет влияние на кости, или выживание, или рост опухолевых клеток при отсутствии сопутствующего детектируемого воздействия на мышцы. Во многих воплощениях выбирают полипептид ActRIIa, влияние которого на мышцы составляет менее 15%, менее 10% или менее 5% при использовании доз, обеспечивающих желательное воздействие на раковые клетки. Чистота композиции, определяемая методом эксклюзионной хроматографии, может составлять, по меньшей мере, 95% по отношению к другим полипептидным компонентам, и необязательно чистота композиции может составлять, по меньшей мере, 98%. Для получения такой композиции можно использовать любой описанный в данном документе активин-связывающий полипептид ActRIIa, такой как полипептид, имеющий аминокислотную последовательность, выбранную из SEQ ID NO:2, 3, 7 или 12, или имеющий аминокислотную последовательность, которая, по меньшей мере, на 80%, 85%, 90%, 95%, 97% или 99% идентична аминокислотной последовательности, выбранной из SEQ ID NO:2, 3, 7, 12 или 13. Активин-связывающий полипептид ActRIIa может включать в себя функциональный фрагмент природного полипептида ActRIIa, такой как фрагмент, содержащий, по меньшей мере, 10, 20, 30, 50, 90 или более аминокислот последовательности, выбранной из SEQ ID NO:1-3, или последовательности SEQ ID NO:2, утратившей от 10 до 15 C-концевых аминокислот ("хвост").
Растворимый активин-связывающий полипептид ActRIIa может содержать одно или более изменений в аминокислотной последовательности (например, в лиганд-связывающем домене) по сравнению с природным полипептидом ActRIIa. Примеры изменений полипептида ActRIIa приведены в WO 2006/012627, стр. 59-60, который включен в данное описание в качестве ссылки. Изменение аминокислотной последовательности может приводить, например, к изменению гликозилирования полипептида, продуцирующегося в клетке млекопитающего, насекомого или в другой эукариотической клетке, или к изменению протеолитического расщепления полипептида по сравнению с природным полипептидом ActRIIa.
Активин-связывающий полипептид ActRIIa может представлять собой слитый белок, один домен которого представляет собой полипептид ActRIIa (например, лиганд-связывающий фрагмент ActRIIa), а один или более других доменов представляют собой фрагменты, придающие желательные свойства, например, улучшающие фармакокинетику, упрощающие очистку, повышающие способность достигать конкретные ткани и др. Например, домен слитого белка может улучшать один или более факторов, включающих в себя стабильность in vivo, период полужизни in vivo, поглощение/введение, тканевую локализацию или тканевое распределение, образование белковых комплексов, мультимеризацию слитого белка и/или очистку. Активин-связывающий слитый белок ActRIIa может содержать домен Fc иммуноглобулина (дикого типа или мутантный), или сывороточный альбумин, или фрагмент другого полипептида, который обеспечивает желательные свойства, такие как улучшенная фармакокинетика, повышенная растворимость или повышенная стабильность. В предпочтительном воплощении гибрид ActRIIa-Fc содержит относительно неструктурированный линкер, расположенный между доменом Fc и внеклеточным доменом ActRIIa. Данный неструктурированный линкер может соответствовать неструктурированному участку С-конца внеклеточного домена ActRIIa, содержащему примерно 15 аминокислот ("хвост"), или он может представлять собой искусственную последовательность, содержащую 1, 2, 3, 4 или 5 аминокислот, или составляющую в длину от 5 до 15, 20, 30, 50 или более аминокислот, которая соответственно не имеет вторичной структуры, или он может представлять собой смесь указанных фрагментов. Линкер может быть обогащен остатками глицина и пролина и может содержать, например, одинарную последовательность остатка треонина/серина и остатков глицина, или повторяющиеся последовательности остатка треонина/серина и остатков глицина (например, синглеты или повторы TG4 или SG4). Слитый белок может содержать последовательность, облегчающую очистку, такую как эпитопный маркер, маркер FLAG, полигистидиновая последовательность и слияние GST. Растворимый полипептид ActRIIa необязательно содержит один или несколько остатков модифицированных аминокислот, выбранных из: гликозилированной аминокислоты, пэгилированной аминокислоты, фарнезилированной аминокислоты, ацетилированной аминокислоты, биотинилированной аминокислоты, аминокислоты, конъюгированной с липидным фрагментом, и аминокислоты, конъюгированной с органическим дериватизирующим средством. Фармацевтический препарат также может содержать одно или несколько дополнительных соединений, таких как соединение, используемое для лечения костного нарушения. Предпочтительно фармацевтический препарат практически не содержит пирогенов. Как правило, белок ActRIIa предпочтительно экспрессируют в клеточной линии млекопитающих, которая обеспечивает соответствующее природное гликозилирование белка, позволяющее уменьшить вероятность нежелательного иммунного ответа у пациента. Успешно применяются человеческие клеточные линии и клеточные линии CHO, предположительно можно использовать другие традиционные экспрессионные системы млекопитающих. Кроме того, дрожжевые клетки, а также клетки других типов можно подвергнуть генетическим изменениям, обеспечивающим способность клеток экспрессировать ферменты млекопитающих, которые катализируют гликозилирование, в результате чего гликозилирование белков, экспресируемых в данных клетках, отличных от клеток млекопитающих, проходит в строго контролируемом режиме гликозилирования млекопитающих. Указанные рекомбинантные клеточные линии также можно использовать для экспрессии белков, описанных в данном документе.
Как описано в данном документе, белки ActRIIa, обозначаемые ActRIIa-Fc (форма с минимальным линкером между фрагментом ActRIIa и фрагментом Fc), обладают желательными свойствами, включающими в себя селективное связывание с активином по сравнению с GDF8 и/или GDF11, высокое сродство связывания лиганда и период полужизни у животных моделей, превышающий две недели. В некоторых воплощениях изобретение предлагает способы лечения или профилактики рака молочной железы с помощью полипептидов ActRIIa-Fc и фармацевтических препаратов, содержащих такие полипептиды и фармацевтически приемлемый наполнитель.
В некоторых аспектах изобретение предлагает способы лечения или профилактики рака молочной железы с помощью нуклеиновых кислот, кодирующих растворимый активин-связывающий полипептид ActRIIa. Выделенный полинуклеотид может содержать последовательность, кодирующую растворимый активин-связывающий полипептид ActRIIa, такой как описано выше. Например, выделенная нуклеиновая кислота может содержать последовательность, кодирующую внеклеточный домен (например, лиганд-связывающий домен) ActRIIa, и последовательность, кодирующую частично или полностью трансмембранный домен и/или цитоплазматический домен ActRIIa, кроме стоп-кодона, располагающегося в трансмембранном домене или цитоплазматическом домене, или между внеклеточным доменом и трансмембранным или цитоплазматическим доменом. Например, выделенный полинуклеотид может содержать полноразмерную последовательность полинуклеотида ActRIIa, такую как SEQ ID NO:4 или 5, или ее частично укороченную версию, причем указанный выделенный полинуклеотид может дополнительно содержать кодон терминации транскрипции, располагающийся на расстоянии, по меньшей мере, шестисот нуклеотидов от 3'-конца, или таким образом, чтобы после трансляции полинуклеотида внеклеточный домен был необязательно сопряжен с укороченным фрагментом полноразмерного ActRIIa. Предпочтительной нуклеотидной последовательностью является SEQ ID NO:14. Нуклеиновые кислоты, используемые в соответствии с описанными в данном документе способами, могут быть функционально связаны с промотором, обеспечивающим экспрессию, и изобретение также предлагает клетки, трансформированные такими рекомбинантными полинуклеотидами. Предпочтительно клетка представляет собой клетку млекопитающего, такую как клетка яичника китайского хомячка (CHO).
Изобретение также предлагает способы получения растворимого активин-связывающего полипептида ActRIIa, который можно использовать для лечения или профилактики рака молочной железы. Такой способ может включать в себя экспрессию любой из нуклеиновых кислот (например, SEQ ID NO:4, 5 или 14), раскрытых в данном описании, в подходящей клетке, такой как клетка CHO. Такой способ может включать в себя: a) культивирование клетки в условиях, подходящих для экспрессии растворимого полипептида ActRIIa, где указанная клетка трансформирована конструкцией, обеспечивающей экспрессию растворимого ActRIIa; и b) выделение экспрессированного растворимого полипептида ActRIIa. Растворимый полипептид ActRIIa можно выделить в виде частично очищенных фракций, или фракций с высокой степенью очистки. Очистку можно проводить в несколько стадий, включающих в себя, например, одну, две, три или более из перечисленных ниже стадий, используемых в любом порядке: хроматография на белке A, анионообменная хроматография (например, на сефарозе Q), хроматография с использованием гидрофобных взаимодействий (например, на фенилсефарозе), гель-хроматография и катионообменная хроматография.
В некоторых аспектах описанный в данном документе антагонист активина-ActRIIa, такой как растворимый активин-связывающий полипептид ActRIIa, можно использовать в способе лечения, профилактики или ингибирования рака молочной железы у субъекта, в том чиисле, например, в способах замедления появления рака молочной железы, подавления развития рака молочной железы, уменьшения размера опухоли, предотвращения роста опухоли, замедления появления метастазов или профилактики метастазов, в том числе в кости. В некоторых воплощениях изобретение предлагает способы уменьшения или подавления роста или выживания клеток рака молочной железы у пациентов, нуждающихся в этом. Способ может включать в себя введение субъекту, нуждающемуся в этом, эффективного количества антагониста активина-ActRIIa. В некоторых аспектах изобретение предлагает применение антагонистов активина-ActRIIa для получения лекарственного средства для лечения или профилактики рака молочной железы, как описано в данном документе. Изобретение также относится к комбинированным терапиям, включающим в себя применение антагониста активина-ActRIIa вместе с лучевой терапией, химиотерапией (например, с использованием цитотоксического средства) и/или эндокринной терапией. Антагонист может представлять собой слитый белок ActRIIa-Fc, где слитый белок ActRIIa-Fc содержит аминокислотную последовательность, которая, по меньшей мере, на 90% идентична аминокислотной последовательности SEQ ID NO:3.
В других воплощениях настоящее изобретение относится к способам профилактики или замедления появления рака молочной железы у пациентов, имеющих один или несколько факторов риска рака молочной железы. В некоторых воплощениях изобретение относится к способам профилактики или замедления появления метастатического заболевания у пациентов с диагнозом первичная опухоль молочной железы или пролиферативное поражение молочной железы. Способ профилактики или замедления появления рака молочной железы у пациента-человека может включать в себя введение пациенту-человеку, нуждающемуся в этом, эффективного количества полипептида, выбранного из группы, состоящей из: a) полипептида, содержащего аминокислотную последовательность, по меньшей мере, на 90% идентичную SEQ ID NO:2; b) полипептида, содержащего аминокислотную последовательность, по меньшей мере, на 90% идентичную SEQ ID NO:3; и c) полипептида, содержащего, по меньшей мере, 50 последовательных аминокислот, выбранных из SEQ ID NO:2.
Другие воплощения данного изобретения относятся к способу ингибирования активин-опосредованного сигнального пути у пациента-человека, страдающего от рака молочной железы. В некоторых воплощениях данный способ включает в себя введение пациенту-человеку эффективного количества антагониста активина-ActRIIa. В других воплощениях антагонист представляет собой полипептид, выбранный из группы, состоящей из: a) полипептида, содержащего аминокислотную последовательность, по меньшей мере, на 90% идентичную SEQ ID NO:2; b) полипептида, содержащего аминокислотную последовательность, по меньшей мере, на 90% идентичную SEQ ID NO:3; и c) полипептид, содержащий, по меньшей мере, 50 последовательных аминокислот, выбранных из SEQ ID NO:2.
В некоторых аспектах изобретение предлагает способ идентификации средства, которое подавляет рост или выживание раковых клеток (например, клеток рака молочной железы). Данный способ включает в себя: a) идентификацию тестируемого средства, которое связывается с активином или лиганд-связывающим доменом полипептида ActRIIa; и b) определение влияния средства на пролиферацию, выживание или апоптоз раковых клеток.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1 показана очистка ActRIIa-hFc, экспрессированного в клетках CHO. Очищенный белок имеет один, четко определенный пик, визуализированный с помощью колонки для определения размера (левая панель) и SDS-PAGE с окрашиванием Кумасси (правая панель) (левая линия: стандарты с определенной молекулярной массой; правая линия: ActRIIa-hFc).
На фигуре 2 показаны результаты анализа связывания ActRIIa-hFc с активином и GDF-11 методом BiaCoreTM.
На фигуре 3 показано, что обработка ActRIIa-mFc значительно уменьшает образование метастатических повреждений у мышиной модели метастатического рака молочной железы. Визуализацию мышей проводят неинвазивным способом (флуоресцентная визуализация под анестезией) через пять недель после внутрисердечного введения клеток рака молочной железы MDA-MB-231, экспрессирующих люциферазу. Видимые метастатические повреждения наблюдаются у 12 из 14 мышей, обработанных средой, и только у 4 из 12 мышей, обработанных ActRIIa-mFc.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1. Обзор
Суперсемейство трансформирующих факторов роста-бета (TGF-beta) включает в себя ряд факторов роста, которые содержат элементы и структурные мотивы с одинаковыми последовательностями. Известно, что данные белки оказывают биологическое действие на широкий ряд клеток как позвоночных, так и беспозвоночных. Члены данного суперсемейства выполняют важные функции в процессе эмбрионального развития, участвуя в формировании структуры и тканевой специализации, и могут влиять на ряд процессов дифференциации, включающих в себя адипогенез, миогенез, хондрогенез, кардиогенез, гемопоэз, нейрогенез и дифференциацию эпителиальных клеток. Это семейство подразделяется на две основные ветви: BMP/GDF и TGF-бета/активин, члены которых оказывают разное, зачастую взаимодополняющее действие. Изменение активности члена семейства TGF-бета зачастую приводит к значительным физиологическим изменениям в организме. Например, породы крупного рогатого скота Piedmontese и Belgian Blue несут мутацию с потерей функции в гене GDF8 (также называемом миостатин), которая вызывает значительное увеличение мышечной массы. Grobet et al., Nat Genet. 1997, 17(l):71-4. Кроме того, у людей неактивные аллели GDF8 связаны с повышенной мышечной массой и, по имеющимся данным, с исключительной силой. Schuelke et al., N Engl J Med 2004, 350:2682-8.
Активины представляют собой димерные полипептидные факторы роста, принадлежащие к суперсемейству TGF-бета. Существуют три основные формы активина (A, B и AB), которые представляют собой гомо/гетеродимеры двух близкородственных субъединиц β (βAβA, βBβB и βAβB соответственно). Человеческий геном также кодирует активин C и активин E, которые, в основном, экспрессируются в печени, кроме того, известны гетеродимерные формы, содержащие βc или βE. Активины, входящие в состав суперсемейства TGF-β, представляют собой уникальные и полифункциональные факторы, которые могут стимулировать продукцию гормонов в клетках яичников и плаценты, поддерживать жизнеспособность нервных клеток, положительно или отрицательно, в зависимости от типа клеток, влиять на развитие клеточного цикла и индуцировать мезодермальную дифференциацию, по меньшей мере, у эмбрионов амфибий (DePaolo et al., 1991, Proc Soc Ep Biol Med. 198:500-512; Dyson et al., 1997, Curr Biol. 7:81-84; Woodruff, 1998, Biochem Pharmacol. 55:953-963). Кроме того, показано, что активин B участвует в регуляции дифференциации эпителиальных клеток молочной железы у мышей (Robinson and Hennighausen, 1997 Development 124: 2701-2708). В некоторых тканях сигнальный путь активина подавляется под действием родственного гетеродимера, ингибина. Например, в процессе высвобождения фолликулстимулирующего гормона (FSH) из гипофиза активин стимулирует секрецию и синтез FSH, а ингибин препятствует секреции и синтезу FSH. Другие белки, способные регулировать биоактивность активина и/или связываться с активином, включают в себя фоллистатин (FS), фоллистатин-родственный (FSRP) и α2-макроглобулин.
Сигналы TGF-β опосредуются гетеродимерными комплексами серин/треонинкиназных рецепторов типа I и типа II, которые после стимуляции лигандом фосфорилируют и активируют нижестоящие белки Smad (Massague, 2000, Nat. Rev. Mol. Cell Biol. 1:169-178). Указанные рецепторы типа I и типа II представляют собой трансмембранные белки, состоящие из лиганд-связывающего внеклеточного домена, содержащего участок, обогащенный цистеином, трансмембранного домена и цитоплазматического домена, обладающего ожидаемой специфичностью к серин/треонину. Рецепторы типа I участвуют в передаче сигнала; а рецепторы типа II нужны для связывания лигандов и для экспрессии рецепторов типа I. Рецепторы активина типов I и II образуют стабильные комплексы после связывания с лигандом с последующим фосфорилированием рецепторов типа I под действием рецепторов типа II.
Два родственных рецептора типа II, ActRIIa и ActRIIb, были идентифицированы как рецепторы активинов типа II (Mathews and Vale, 1991, Cell 65:973-982; Attisano et al., 1992, Cell 68: 97-108). Помимо активинов, ActRIIa и ActRIIb могут биохимически взаимодействовать с некоторыми другими белками семейства TGF-β, включающими в себя BMP7, Nodal, GDF8 и GDF11 (Yamashita et al., 1995, J. Cell Biol. 130:217-226; Lee and McPherron, 2001, Proc. Natl. Acad. Sci. 98:9306-9311; Yeo and Whitman, 2001, Mol. Cell 7: 949-957; Oh et al., 2002, Genes Dev. 16:2749-54). ALK4 является основным рецептором типа I активинов, в особенности, активина A, а ALK-7 также может служить рецептором активинов, в особенности, активина B.
Как описано в данном документе, растворимый полипептид ActRIIa (sActRIIa), который более предпочтительно связывается с активином A, чем с другими членами семейства TGF-β, такими как GDF8 или GDF11, можно использовать для лечения или профилактики рака, в особенности, рака молочной железы. Без связи с каким-либо конкретным механизмом, полагают, что эффект sActRIIa обусловлен, в первую очередь, антагонистическим действием по отношению к активину, причем очень сильное связывание активина (константа диссоциации на пикомолярном уровне) обеспечивается конкретной конструкцией sActRIIa, используемой в данных исследованиях. Антагонисты активина-ActRIIa включают в себя, например, активин-связывающие растворимые полипептиды ActRIIa, антитела, способные связываться с активином (в особенности, с субъединицами активина A или B, также называемыми βA или βB) и нарушать связывание с ActRIIa, антитела, способные связываться с ActRIIa и нарушать связывание с активином, отличные от антител белки, выбранные по способности связываться с активином или ActRIIa (примеры таких белков, а также способов их получения и отбора можно найти, например, в WO/2002/088171, WO/2006/055689 и WO/2002/032925), рандомизированные пептиды, выбранные по способности связываться с активином или ActRIIa, зачастую гибридизованные с доменом Fc. Два разных белка (или других фрагмента), обладающие способностью связывать активин или ActRIIa, в особенности, активин-связывающие средства, которые блокируют участки связывания типа I (например, растворимый рецептор активина типа I) и типа II (например, растворимый рецептор активина типа II) соответственно, можно соединить с получением бифункциональной связывающей молекулы. Также можно использовать аптамеры нуклеиновых кислот, малые молекулы и другие средства, ингибирующие сигнальный путь активин-ActRIIa. Разные белки обладают антагонистической активностью по отношению к активину-ActRIIa, в том числе ингибин (т.е. альфа-субъединица ингибина), хотя ингибин необратимо подавляет активность активина не во всех тканях, фоллистатин (например, фоллистатин-288 и фоллистатин-315), FSRP, активин C, альфа(2)-макроглобулин и мутантная форма активина A M108A (замена метионина на аланин в положении 108). Как правило, альтернативные формы активина, особенно с изменениями в связывающем домене рецептора типа I, могут связываться с рецепторами типа II и не могут образовывать активный трехкомпонентный комплекс, действуя, таким образом, как антагонисты. Кроме того, в качестве антагонистов активина-ActRIIa можно использовать нуклеиновые кислоты, такие как антисмысловые молекулы, siРНК или рибозимы, которые ингибируют активин A, B, C или E, или, предпочтительно, экспрессию ActRIIa. Используемый антагонист активина-ActRIIa может обладать селективностью в отношении ингибирования активин-опосредуемого сигнального пути по сравнению с другими членами семейства TGF-бета, в особенности, такими как GDF8 и GDF11. Растворимые белки ActRIIb связываются с активином, однако белок дикого типа не обладает значительной селектичностью связывания с активином по сравнению с GDF8/11. Тем не менее, такие полипептиды ActRIIb, а также измененные формы ActRIIb с разными связывающими свойствами (см., например, WO 2006/012627, pp. 55-59, включенный в данное описание в качестве ссылки) могут оказывать желательное действие на раковые клетки. Природному или измененному ActRIIb можно придать дополнительную специфичность к активину путем присоединения второго, активин-селективного связывающего средства.
Термины, упоминающиеся в данном описании в контексте настоящего изобретения и в конкретном контексте, в котором применяется каждый термин, имеют значения, традиционно используемые в данной области. Некоторые термины обсуждаются ниже и на протяжении описания, чтобы дополнительно разъяснить практикующему специалисту описание композиций и способов данного изобретения, а также получения и применения композиций. Объем или значение какого-либо термина зависят от контекста, в котором используется данный термин.
Термины "примерно" или "приблизительно", как правило, относятся к приемлемой степени ошибки количественных измерений, связанной с природой или точностью измерений. Обычно величина ошибки находится в пределах, например, 20 процентов (%), предпочтительно, 10% и более предпочтительно, 5% от заданного значения или интервала значений.
Альтернативно, в особенности в применении к биологическим системам, термины "примерно" и "приблизительно" могут относиться к значениям, находящимся, предпочтительно, в 5-кратном диапазоне, более предпочтительно, в 2-кратном диапазоне относительно заданного значения. Если не указано иначе, многочисленные количественные значения, приведенные в данном описании, являются приблизительными, то есть термины "примерно" и "приблизительно" могут подразумеваться, даже если они специально не указаны.
Способы данного изобретения могут включать в себя стадии сравнения последовательностей, например, последовательности дикого типа с одной или несколькими мутантными последовательностями (вариантами последовательности). Такое сравнение обычно включает в себя выравнивание полимерных последовательностей, например, с помощью программ и/или алгоритмов для выравнивания последовательностей, хорошо известных в данной области (например, BLAST, FASTA и MEGALIGN, а также многие другие). Опытным специалистам хорошо известно, что, если мутация включает в себя вставку или делецию остатка, при таком выравнивании последовательностей вводится "пробел" (обычно обозначаемый прочерком или "A") в полимерной последовательности, не содержащей вставленного или удаленного остатка.
Термин "гомологичный", во всех грамматических формах и вариантах написания, относится к взаимосвязи двух белков, имеющих "единое эволюционное происхождение", включающих в себя белки из суперсемейств организмов одного вида, а также гомологичные белки из организмов разных видов. Такие белки (и кодирующие их нуклеиновые кислоты) обладают гомологией последовательностей, что отражается в подобии их последовательностей, которое выражается либо в виде процента идентичности, либо в виде присутствия конкретных остатков или мотивов и консервативных положений.
Термин "подобие последовательностей" во всех его грамматических формах относится к степени идентичности или соответствия нуклеотидных или аминокислотных последовательностей, которые могут иметь или не иметь единое эволюционное происхождение.
Однако при традиционном использовании и в настоящей заявке термин "гомологичный" в сочетании с таким наречием, как "высоко", может относиться к подобию последовательностей и может быть связан или не связан с единым эволюционным происхождением.
Термин "рак молочной железы" относится к любому пролиферативному поражению или пролиферативной аномалии молочной железы, которые включают в себя, например, доброкачественные поражения, предраковые и раковые поражения, солидные опухоли и метастатические заболевания (как с локальным метастазированием, например, на стадии III, так и с более широким метастазированием, например, на стадии IV). Рак молочной железы включает в себя, без ограничения, такие заболевания, как аденокарцинома, дольковую (мелкоклеточную) карциному, внутрипротоковую карциному, медуллярный рак молочной железы, слизеобразующий рак молочной железы, канальцевый рак молочной железы, папиллярный рак молочной железы, болезнь Педжета и воспалительный рак молочной железы. Рак молочной железы также связан с заболеваниями других органов, таких как легкие, печень и кости, которые возникают вследствие метастатического поражения молочной железы. Рак молочной железы также охватывает гормонозависимые и гормононезависимые опухоли. Обычно гормононезависимый рак молочной железы характеризуется отсутствием или пониженными уровнями рецепторов эстрогена и/или прогестерона, такой рак, как правило, является устойчивым к антигормональной (в особенности, антиэстрогенной) терапии. Рак молочной железы также классифицируют на основе экспрессии Her2, причем опухоли Her2+ имеют более плохой прогноз, чем опухоли Her2-.
2. Полипептиды ActRIIa
В некоторых аспектах настоящее изобретение относится к способам лечения или профилактики рака молочной железы с помощью полипептидов ActRIIa. В данном описании термин "ActRIIa" относится к семейству белков-рецепторов активина типа IIa (ActRIIa) любых видов, а также к вариантам, полученным из таких белков ActRIIa в результате мутагенеза или другой модификации. Упоминание ActRIIa в данном описании следует понимать как упоминание любой из идентифицированных в настоящее время форм. Члены семейства ActRIIa обычно представляют собой трансмембранные белки, состоящие из лиганд-связывающего внеклеточного домена, содержащего обогащенный цистеином участок, трансмембранного домена и цитоплазматического домена с ожидаемой серин/треонинкиназной активностью.
Термин "полипептид ActRIIa" охватывает полипептиды, включающие в себя любые природные полипептиды из семейства ActRIIa, а также любые их варианты (в том числе мутанты, фрагменты, слияния и пептидомиметики), сохраняющие полезную активность. См., например, WO/2006/012627. Например, полипептид ActRIIa включает в себя полипептид, полученный из последовательности любого известного ActRIIa и имеющий последовательность, по меньшей мере, примерно на 80% идентичную последовательности полипептида ActRIIa, и, необязательно, идентичную, по меньшей мере, на 85%, 90%, 95%, 97%, 99% или больше. Например, полипептид ActRIIa данного изобретения может связываться и ингибировать функцию белка ActRIIa и/или активина. Полипептид ActRIIa можно выбрать по способности ингибировать пролиферацию или выживание раковых клеток in vivo. Примеры полипептида ActRIIa включают в себя предшественник человеческого полипептида ActRIIa (SEQ ID NO:1) и растворимый человеческий полипептид ActRIIa (например, SEQ ID NO:2, 3, 7 и 12).
Предшественник человеческого ActRIIa имеет следующую белковую последовательность:
Сигнальный пептид подчеркнут одной чертой; внеклеточный домен выделен жирным шрифтом, а потенциальные участки N-связанного гликозилирования подчеркнуты двойной чертой.
Растворимая (внеклеточная), процессированная полипептидная последовательность человеческого ActRIIa:
Следует отметить, что N-концевая последовательность, начинающаяся с "ILG...", была определена экспериментально и отличается от N-концевой последовательности "AIL...", которая обычно приводится в литературе. C-концевой "хвост" внеклеточного домена подчеркнут. Последовательность с делецией "хвоста" (последовательность Δ15):
Нуклеотидная последовательность, кодирующая человеческий белок-предшественник ActRIIa (нуклеотиды 164-1705 последовательности из Genbank № NM_001616):
Нуклеотидная последовательность, кодирующая человеческий растворимый (внеклеточный) полипептид ActRIIa:
В конкретном воплощении изобретение относится к способам лечения или профилактики рака молочной железы с помощью растворимого полипептида ActRIIa. Как описано в данном документе, термин "растворимый полипептид ActRIIa" обычно относится к полипептидам, содержащим внеклеточный домен белка ActRIIa. Термин "растворимый полипептид ActRIIa" в данном описании включает в себя любой природный внеклеточный домен белка ActRIIa, а также все его варианты (в том числе мутанты, фрагменты и пептидомиметические формы). Активин-связывающий полипептид ActRIIa представляет собой полипептид, сохраняющий способность связываться с активином, в том числе, например, с активином AA, AB, BB, или с формами, содержащими субъединицу C или E. Необязательно активин-связывающий полипептид ActRIIa связывается с активином AA с константой диссоциации 1 нМ или менее. Внеклеточный домен белка ActRIIa связывается с активином и, как правило, является растворимым, следовательно, его можно назвать растворимый, активин-связывающий полипептид ActRIIa. Примеры растворимого, активин-связывающего полипептида ActRIIa включают в себя растворимый полипептид, описанный как SEQ ID NO:2, 3, 7, 12 и 13. SEQ ID NO:7, называемый ActRIIa-hFc, подробно описан в разд