Пептид аземиопсин, избирательно взаимодействующий с никотиновыми холинорецепторами мышечного типа и пригодный для использования в качестве мышечного релаксанта в медицине и косметологии
Иллюстрации
Показать всеИзобретение относится к блокирующим никотиновые холинорецепторы биологически активным пептидам, которые могут найти применение в области биохимии, биотехнологии и медицины. Пептид аземиопсин имеет аминокислотную последовательность: H2N-Asp1-Asn2-Trp3-Trp4-Pro5-Lys6-Pro7-Pro8-His9-Gln10-Gly11-Prol2-Arg13-Prol4-Prol5-Argl6-Prol7-Argl8-Prol9-Lys20-Pro21-COX, где X является группой OH или NH2 и обладает способностью избирательно взаимодействовать с никотиновыми холинорецепторами мышечного типа. Пептид может быть использован в качестве основы для создания миорелаксантов, селективно блокирующих холинорецепторы мышечного типа. Изобретение представляет собой новый тип природных токсинов, взаимодействующих с никотиновыми холинорецепторами и не содержащих дисульфидных связей. 2 н.п. ф-лы, 5 ил., 1 табл., 4 пр.
Реферат
Изобретение относится к биохимии, конкретно к биологически активным полипептидам, которые обладают способностью селективно взаимодействовать с никотиновыми холинорецепторами мышечного типа и могут найти применение в научных исследованиях или медицине.
Никотиновые холинорецепторы (нХР) составляют большое семейство лиганд-управляемых ионных каналов. нХР участвуют в процессах быстрой синаптической передачи в нервно-мышечных сочленениях или между нейронами. [Wells GB. Structural answers and persistent questions about how nicotinic receptors work. // Front Biosci - 2008. - vol.13 - p.5479-5510]. Кроме того, известно, что нейронные нХР присутствуют также в ненейронных клетках, где играют существенную функциональную роль [Grando SA. Basic and clinical aspects of non-neuronal acetylcholine: biological and clinical significance of non-canonical ligands of epithelial nicotinic acetylcholine receptors. // J Pharmacol Sci. - 2008. - vol.106. - p.174-179]. Например, в иммунной системе не-нейронные нХР выполняют важную функцию регуляции процессов воспаления. Существует две больших группы нХР: рецепторы мышечного типа и нейронные рецепторы [Dani JA, Bertrand D. Nicotinic acetylcholine receptors and nicotinic cholinergic mechanisms of the central nervous system. // Annu Rev Pharmacol Toxicol. - 2007 - vol.47 - p.699-729]. нХР мышечного типа состоят из пяти субъединиц (две альфа1, одна бета1, одна гамма (или эпсилон) и одна дельта), которые псевдосимметрично расположены вокруг центральной оси, совпадающей с ионным каналом рецептора. Два участка связывания агонистов или конкурентных антагонистов расположены в местах контакта двух альфа-субъединиц с соседними гамма и дельта-субъединицами. Нейронные нХР состоят из субъединиц двух разных типов: альфа (альфа2-альфа10) и бета (бета2-бета4). Эти рецепторы существуют в виде гетероолигомерных (образованных различной комбинацией альфа и бета-субъединиц) или гомоолигомерных (образованных альфа-субъединицами альфа7-альфа10 подтипов) белков. Все перечисленные выше подтипы нХР различаются не только структурно, но и фармакологически. Детальное изучение функционирования различных подтипов нХР требует применения точных и избирательных биохимических инструментов. Такими инструментами являются в частности нейротоксины ядов змей, которые могут избирательно взаимодействовать с некоторыми подтипами нХР. Так называемые альфа-нейротоксины короткого типа (59-63 аминокислотных остатка, четыре дисульфидных связи) блокируют нХР только мышечного типа, в то время как нейротоксины длинного типа (66-74 аминокислотных остатка, пять дисульфидных связей) блокируют также нейронные гомопентамерные нХР альфа7-альфа9 подтипов. [Tsetlin V, Utkin Y, Kasheverov I. Polypeptide and peptide toxins, magnifying lenses for binding sites in nicotinic acetylcholine receptors. // Biochem Pharmacol. - 2009 - vol.78 - p.720-731]. У нейротоксинов длинного типа пятая дисульфидная связь является совершенно необходимой для взаимодействия с нейронными холинорецепторами. Ни эти, ни нейротоксины короткого типа не взаимодействуют с нейронными гетеропентамерными нХР. Существует другая группа токсинов, так называемые каппа-бунгаротоксины, которые избирательно и эффективно блокируют нейронные нХР альфа3бета2 подтипа и в меньшей степени альфа4бета2 и альфа7 подтипа. Структурно каппа-бунгаротоксины близки альфа-нейротоксинам длинного типа, но существуют в виде нековалентных димеров [Dewan JC, Grant GA, Sacchettim JC. Crystal structure of kappa-bungarotoxin at 2.3-A resolution. // Biochemistry. - 1994. - vol.33. - p.13147-13154].
В начале восьмидесятых годов прошлого столетия в морских моллюсках рода Conus были открыты пептидные токсины, вызывавшие постсинаптический блок и названные альфа-конотоксинами [Kasheverov IE, Utkin YN, Tsetlin VI. Naturally occurring and synthetic peptides acting on nicotinic acetylcholine receptors. // Curr Pharm Des. 2009. - vol.15. - p.2430-2452]. К настоящему времени выделено и охарактеризовано около 50 таких токсинов. Функционально все они являются конкурентными антагонистами нХР, однако различаются по селективности взаимодействия с определенными подтипами рецепторов. Можно выделить две основные группы альфа-конотоксинов, к одной принадлежат токсины, взаимодействующие с мышечными нХР - мышечные конотоксины, к другой - взаимодействующие с нейронными нХР - нейронные конотоксины. Последние обычно взаимодействуют с двумя или более подтипами нХР. Характерной особенностью мышечных конотоксинов является их способность различать два участка связывания на нХР Torpedo или мышечного типа. По структуре альфа-конотоксины представляют собой пептиды длиной 12-20 аминокислотных остатков и содержат 2 дисульфидных связи. Благодаря небольшому размеру конотоксины и их аналоги могут быть получены методом пептидного синтеза, однако наличие нескольких дисульфидных связей существенно снижает выход целевого продукта вследствие образования побочных продуктов с неправильным замыканием дисульфидных связей. Эти пептиды имеют перспективы для применения в фармакологии. Так, конотоксин Vc1.1 (известный также как ACV1) проходит испытания как средство борьбы с болью. Этот токсин действует на нейронный нХР. Изучено его действие in vivo на нескольких животных моделях, воспроизводящих человеческие нейропатические боли [Livett B.G., Sandall D.W., Keays D., Down J., Gayler K.R., Satkunanathan N., Khalil Z. Therapeutic applications of conotoxins that target the neuronal nicotinic acetylcholine receptor. // Toxicon. - 2006. - vol.48. - p.810-829].
Наиболее близкими к заявляемому пептиду по свойствам являются пептиды ваглерины из яда Южно-Азиатской куфии Tropidolaemus wagleri. Они состоят из 22-24 аминокислотных остатков и содержат одну дисульфидную связь [Weinstein SA, Schmidt JJ, Bernheimer AW, Smith LA. Characterization and amino acid sequences of two lethal peptides isolated from venom of Wagler's pit viper, Trimeresurus wagleri. // Toxicon. - 1991. - vol.29. - p.227-236]. Эти токсины взаимодействуют с нХР мышечного типа, при этом они эффективно взаимодействуют со «зрелыми» рецепторами, содержащими эпсилон-субъединицу, но не с эмбриональными нХР, содержащими гамма-субъединицу [McArdle JJ, Lentz TL, Witzemann V, Schwarz H, Weinstein SA, Schmidt JJ. Waglerin-1 selectively blocks the epsilon form of the muscle nicotinic acetylcholine receptor. // J Pharmacol Exp Ther. - 1999. - vol.289. - p.543-550].
Описанные выше пептиды, взаимодействуя с нХР мышечного типа, блокируют сокращение мускулатуры. Это свойство может быть использовано для приготовления миорелаксантов [Olivera BM, Layer RT, Watkins M, Hillyard DR, McIntosh JM, Schoenfeld R, Jones RM, Nielsen J. Alpha-conotoxin peptides. WO/2002/007750]. В последнее время появились данные о возможности использования пептидов, взаимодействующих с мышечными нХР, в косметических целях. Включение таких соединений в косметические препараты (кремы) приводит к разглаживанию морщин [Garcia Sanz N, van den Nest W, Carreno Serraima C, Ferrer Montiel A, Cebrian Puche J, Alminana Domenech N, Fernandez Ballester G. Compounds which inhibit muscle contraction. WO/2011/009626].
Все описанные выше нейротоксины содержат дисульфидные связи. Нейротоксины змей, содержащие более 60 аминокислотных остатков и 4-5 дисульфидных связи, достаточно сложны для химического синтеза. Конотоксины и ваглерины могут быть синтезированы методом пептидного синтеза, однако наличие дисульфидных связей и необходимость их правильного замыкания существенно снижает выход целевого продукта.
Изобретение решает задачу расширения ассортимента пептидов, избирательно взаимодействующих с никотиновыми холинорецепторами мышечного типа.
Поставленная задача решается за счет пептида аземиопсина, имеющего следующую аминокислотную последовательность:
H2N-Asp1-Asn2-Trp3-Trp4-Pro5-Lys6-Pro7-Pro8-His9-Glnl0-Gly11-Prol2-Argl3-Prol4-Prol5-Argl6-Pro17-Arg18-Pro19-Lys20-Pro21-COX, где X является группой ОН (аземиопсин, AF-3) или NH2 (аземиопсин-амид, AF-3а).
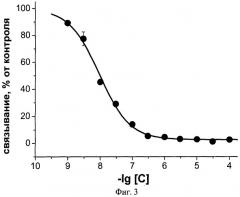
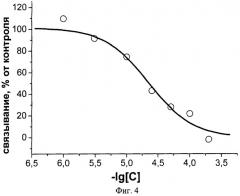
Заявляемый пептид с высокой эффективностью взаимодействует с нХР мышечного типа, как было показано в тестах по ингибированию связывания радиоактивного альфа-бунгаротоксина с мембранными препаратами электрического органа ската Torpedo californica, содержащими нХР мышечного типа. Половинный эффект уменьшения связывания радиоактивного токсина IC50 составляет 9,3±0,6 нМ. В то же время в случае нейронного нХР альфа7 типа эта величина составляет 22±2 µМ. Дополнительно, заявляемый пептид полностью блокирует проведение нервного импульса в классическом опыте на нервно-мышечном препарате лягушки. Кроме того, заявляемый пептид в прямом токсикологическом эксперименте на мышах в 10 раз менее токсичен, чем обладающий паралитической активностью д-тубокурарин, который используют в качестве мышечного релаксанта в медицине. Так, доза, вызывающая гибель половины животных, ЛД50 для аземиопсина составляет 2,57 мг/кг, в то время как для д-тубокурарина эта величина равняется 0,2 мг/кг.
Заявляемый пептид аземиопсин содержит 21 аминокислотный остаток, т.е. является сравнительно небольшой молекулой, что упрощает его получение методом пептидного синтеза. Кроме того, пептид является линейным и не содержит остатков цистеина, что также упрощает его получение химическим синтезом или биотехнологически, поскольку исключается риск образования неактивных продуктов за счет неверного замыкания дисульфидных связей.
Пептид аземиопсин AF-3 получают из природного источника - яда бирманской гадюки Azemiops feae, которая относится к семейству Viperidae, классу Reptilia, отряду Sqamata, типу Chordata.
Пептид аземиопсин-амид AF-3а получают химическим синтезом, он отличается от природного пептида наличием амидной группы на C-концевом остатке пролина и проявляет сходные биологические свойства.
Заявляемый пептид представляет собой новое соединение и не является близким аналогом каких-либо пептидов или белков. Изобретение иллюстрируют фиг.1-5.
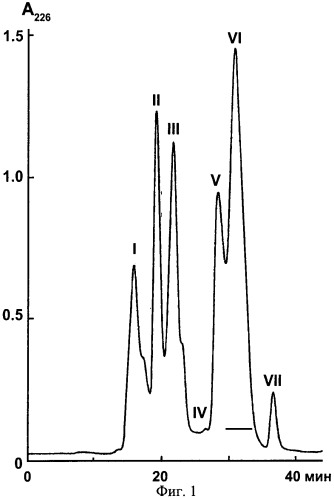
Фиг.1. Разделение яда гадюки Azemiops feae методом гель-фильтрации. Для разделения используют колонку Superdex 75 (1×30 см), скорость элюирования 30 мл/час и 0,1 М аммоний-ацетатный буфер (pH 6,2).
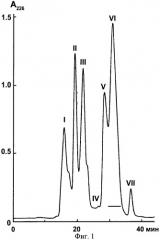
Фиг.2. Выделение пептида аземиопсина (AF-3) методом обращенно-фазной хроматографии. Для разделения используют обращенно-фазную колонку Jupiter С 18 (4,6×250 мм) и скорость элюции 1 мл/мин. Разделение проводят в линейном градиенте концентрации ацетонитрила в присутствии 0,1% трифторуксусной кислоты. Детекция при длине волны 226 нм.
Фиг.3. Ингибирование аземиопсином связывания радиоактивного альфа-бунгаротоксина с мембранами электрического органа Torpedo californica, содержащими никотиновые холинорецепторы мышечного типа. С - концентрация аземиопсина, моль/л.
Фиг.4. Ингибирование аземиопсином связывания радиоактивного альфа-бунгаротоксина с клетками GH4C1, гетерологически экспрессирующими никотиновые холинорецепторы альфа7 типа. С - концентрация аземиопсина, моль/л.
Фиг.5. Зависимость количества погибших животных от дозы введенного аземиопсина.
Изобретение иллюстрируют примеры.
Пример 1. Выделение аземиопсина из яда бирманской гадюки Azemiops feae.
На первом этапе цельный яд гадюки Azemiops feae подвергают разделению по методу гель-фильтрации на колонке Superdex 75 (Фиг.1). Собранные фракции лиофильно высушивают и фракцию VI, отмеченную линией (Фиг.1), подвергают дальнейшему разделению методом обращено-фазной хроматографии на колонке Jupiter С18 (4,6×250 мм). Фракционирование проводят в линейном градиенте концентрации ацетонитрила от 2 до 62% (v/v) в 0,1%-ной трифторуксусной кислоте в течение 60 минут со скоростью 1 мл/мин. Детекцию осуществляют по оптическому поглощению при 226 нм. Фракция AF-3 (Фиг.2) содержит пептид аземиопсин, который используют для дальнейших исследований.
Пример 2. Установление аминокислотной последовательности аземиопсина.
Определение N-концевой аминокислотной последовательности пептида проводят методом ступенчатой деградации по Эдману на автоматическом секвенаторе Procise 492 (Applied Biosystems, США). В результате устанавливают аминокислотную последовательность 10 N-концевых аминокислотных остатков:
NH2-Aspl-Asn2-Trp3-Trp4-Pro5-Lys6-Pro7-Pro8-His9-Glnl0.
Полную аминокислотную последовательность устанавливают методом MALDI масс-спектрометрии с использованием времяпролетного масс-спектрометра Ultrafex II TOF/TOF (Bruker Daltonik GmbH, Германия). Спектры фрагментных ионов генерировали индуцированной лазером диссоциацией, ускоренной низкоэнергетической ударной диссоциацией с использованием гелия в качестве вспомогательного газа. В результате анализа фрагментных ионов устанавливают полную аминокислотную последовательность пептида аземиопсина AF-3:
NH2-Asp1-Asn2-Trp3-Trp4-Pro5-Lys6-Pro7-Pro8-His9-Glnl0-Glyll-Prol2-Argl3-Prol4-Prol5-Arg16-Pro17-Arg18-Pro19-Lys20-Pro21-OH.
Пример 3. Химический синтез аземиопсин-амида AF-3а.
Присоединение первой аминокислоты. Получение Fmoc-Pro-P (Fmoc=9-флуоренилметилоксикарбонил).
200 мг 2-хлоротритилхлоридного полимера с содержанием гидроксильных групп 1,0 ммоль/г промывают безводным хлористым метиленом. В 5 мл хлористого метилена растворяют 374 мг (1,1 ммоль) Fmoc-Pro-OH и 374 мкл (2,2 ммоль) диизопропилэтиламина, раствор перемешивают 5 мин и затем приливают к полимеру. Реакцию проводят 1 час при комнатной температуре и перемешивании. По окончании реакции полимер отфильтровывают и трижды промывают последовательно хлористым метиленом, этиловым спиртом, диметилформамидом.
Описание одного синтетического цикла наращивания полипептидной цепи.
Получение Fmoc-Lys(Boc)-Pro-P:
а) Полученный на предыдущем этапе пептидил-полимер в течение 20 мин обрабатывают 20%-ным раствором пиперидина в диметилформамиде. Полимер промывают последовательно 5 мл следующих растворителей: диметилформамидом - 3 раза по 2 мин, смесью диоксан-вода (2:1) - 2 раза по 5 мин, диметилформамидом - 5 раз по 2 мин.
б) В 5 мл диметилформамида растворяют 505 мг (1,1 ммоль) Fmoc-Lys(Boc)-OH, 150 мг (1,1 ммоль) 1-гидроксибензотриазола, и 172 мкл (1,1 ммоль) N,N'-диизопропилкарбодиимида, раствор перемешивают 10 мин при 0°C и затем приливают к суспендированному полимеру. Реакцию проводят 4 часа при периодическом перемешивании. По окончании реакции полимер отфильтровывают, промывают диметилформамидом и обрабатывают 5 мл смеси Ac2O-пиридин-диметилформамид (20:20:60) в течение 1 ч, после чего полимер последовательно промывают диметилформамидом, изопропанолом, диметилформамидом.
Синтез полипептидной цепи проводят вручную в стеклянном проточном реакторе (2×20 см) по следующему протоколу для каждого синтетического цикла (из расчета 8-10 мл растворителя на 400 мг исходного полимера), при проведении реакции конденсации (операция 6) используют объем реакционной смеси 5-7 мл:
1. ДМФА (диметилформамид) (5×2 мин);
2. 20% пиперидин в ДМФА (20 мин);
3. ДМФА (3×2 мин);
4. диоксан-вода, 2:1, (2×5 мин);
5. ДМФА (5×2 мин);
6. Реакция конденсации: 5 молярных эквивалентов активированной Fmoc-аминокислоты (4 ч);
7. ДМФА (3×2 мин);
8. ацилирование: Ac2O-пиридин-диметилформамид, 20:20:60, (1 ч);
9. ДМФА (3×2 мин);
10. изопропанол (3×2 мин.);
Для активации Fmoc-производных аминокислот с использованием смеси DIPCDI/HOBT (N,N'-диизопропилкарбодиимид/1-гидроксибензотриазол) к раствору 1,1 ммоль (5 эквивалентов) Fmoc-защищенной аминокислоты и 150 мг (1,1 ммоль, 5 эквивалентов) HOBt в 4 мл ДМФА добавляют 170 мкл (1,1 ммоль, 5 эквивалентов) DIPCDI, раствор перемешивают 10 мин.
Полноту протекания реакции конденсации контролируют с помощью нингидринового или, в случае N-концевого пролина, изатинового тестов после операции 6 синтетического протокола.
Для синтеза используют следующие производные аминокислот: Fmoc-Gly-ОН, Fmoc-Lys(Boc)-OH, Fmoc-His(Trt)-OH, Fmoc-Pro-OH, Fmoc-Gln(Trt)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Asp(tBu)-OH, Fmoc-Trp(Boc)-OH, Fmoc-Arg(Pbf)-OH.
Отщепление пептида от полимера.
Для реакции отщепления пептида от полимера и одновременного деблокирования защитных групп боковых цепей аминокислот отбирают 800 мг пептидил-полимера. К пептидил-полимеру приливают 15 мл смеси ТФУ (трифторуксусная кислота) - H2O в объемном соотношении 97.5:2.5, суспензию перемешивают в течение 2 ч, затем полученный раствор пептида отфильтровывают от полимера, промывают 5 мл ТФУ и избыток ТФУ упаривают при пониженном давлении. Пептид осаждают 100 мл этилового эфира, отфильтровывают и промывают эфиром (5×20 мл). Осадок растворяют в 5 мл 10% уксусной кислоты 20 мин, отфильтровывают и промывают 5 мл 10% уксусной кислоты. Полученный раствор пептида лиофилизируют и обессоливают на колонке (2,5×60 см) с Сефадексом G-10 в 0.1М уксусной кислоте. Очистку пептида проводят с помощью обращенно-фазной ВЭЖХ в градиенте ацетонитрила (от 10% до 35% за 75 мин.) в 0.1% ТФУ при расходе элюента 3 мл/мин, поглощение элюата регистрируют при длине волны 226 нм. Фракции, соответствующие основному пику на хроматограмме, собирают и лиофилизируют. Молекулярная масса пептида, установленная методом масс-спектрометрии, составила 2539,1 Да, теоретическая расчетная молекулярная масса - 2539,4 Да.
Пример 4. Биологическая активность аземиопсина.
Биологическую активность аземиопсина определяют в экспериментах по конкуренции с радиоактивным альфа-бунгаротоксином за связывание с никотиновыми холинорецепторами мышечного или альфа7 типа. В качестве источника холинорецепторов мышечного и альфа7 типа используют мембраны электрического органа ската Torpedo californica и клетки GH4C1, гетерологически экспрессирующие альфа7 рецептор человека. Для экспериментов по конкурентному связыванию суспензию мембран электрического органа (1,2 нМ альфа-бунгаротоксин-связывающих участков) или клетки GH4C1 (0,4 нМ альфа-бунгаротоксин-связывающих участков) в 20 мМ Tris-HCl буфере, pH 8.0, содержащем бычий сывороточный альбумин в концентрации 1 мг/мл, инкубируют 90 мин с различными концентрациями аземиопсина. Затем добавляют радиоактивный [125I]-меченый альфа-бунгаротоксин в концентрации 0.2-0.4 нМ и инкубирют еще 5 мин. Для определения неспецифического связывания препараты перед добавлением радиоактивного бунгаротоксина инкубируют с альфа-кобратоксином в концентрации 1 мкМ. После инкубации с радиоактивным бунгаротоксином суспензию мембран или клеток фильтруют через фильтры из стекловолокна GF/F (Whatman, Англия), предварительно выдержанные в растворе 0.25% полиэтиленимина. Затем промывают фильтры три раза по 3 мл 20 мМ Tris-HCl буфера, рН 8.0, содержащего бычий сывороточный альбумин в концентрации 0.1 мг/мл. Количество связавшейся радиоактивности определяют на приборе 1470 Automatic Gamma Counter (Perkin Elmer).
Пример 5. Определение острой токсичности аземиопсина
Полулетальную дозу ЛД50, т.е. среднюю дозу аземиопсина, вызывающую гибель половины членов испытуемой группы животных, определяли в прямом токсикологическом эксперименте. Мыши-самцы штамма BALB/c весом 18-22 г были произвольно разбиты на 6 групп, по 5 особей в каждой. После предварительного взвешивания мышей, раствор пептида в стерильной воде вводили внутрибрюшинно в концентрации от 2 до 10 мг/кг. Гибель мышей наступала через 10-30 мин. Общий объем введенного раствора составил 230 мкл. В качестве контроля использовали внутрибрюшинную инъекцию 230 мкл стерильной воды. Полученные результаты приведены в табл.1.
| табл.1 | |||
| Определение ЛД50 аземиопсина. | |||
| № группы | Доза аземиопсина (мг/кг) | Количество погибших мышей | |
| число | % | ||
| 1 | 10 | 5 | 100 |
| 2 | 8 | 5 | 100 |
| 3 | 4 | 4 | 80 |
| 4 | 2,7 | 3 | 60 |
| 5 | 2 | 1 | 20 |
| 6 | 0 | 0 | 0 |
Для расчета полулетальной дозы был построен график зависимости количества погибших животных от количества введенного препарата и на его основании определена величина ЛД50, составившая 2,57±0,27 мг/кг.
Пример 6. Исследование действия аземиопсина на нервно-мышечный препарат лягушки. Пептид аземиопсин растворяют в физиологическом растворе Рингера: NaCl - 0.65%, KCl - 0.014%, CaCL2 - 0.012%, NaHCO3 - 0.020%. Готовят нервно-мышечный препарат лягушки. Затем наносят раствор пептида (1 мг/мл) в течение 20 минут в место сочленения седалищного нерва и икроножной мышцы. При дальнейшем электрическом раздражении седалищного нерва не происходит сокращения икроножной мышцы, то есть наблюдают полную блокаду проведения нервного импульса. В качестве контроля использовали аналогичный нервно-мышечный препарат, инкубированный в течение 20 мин в растворе Рингера, для которого наблюдали сокращение мышцы при электрическом раздражении седалищного нерва.
1. Пептид аземиопсин, избирательно взаимодействующий с никотиновыми холинорецепторами мышечного типа и имеющий следующую аминокислотную последовательность:NH2-Aspl-Asn2-Trp3-Trp4-Pro5-Lys6-Pro7-Pro8-His9-Gln10-Gly11-Prol2-Arg13-Prol4-Prol5-Argl6-Prol7-Argl8-Prol9-Lys20-Pro21-COX,где X является группой OH или NH2.
2. Применение пептида по п.1 в качестве мышечного релаксанта периферического действия в хирургии, дерматологии и косметологии.