Установка для наработки плазмидосодержащих углеводородокисляющих микроорганизмов
Иллюстрации
Показать всеИзобретение относится к области микробиологии и биотехнологии, в частности к установкам для культивирования биомассы углеводородокисляющих микроорганизмов, и может использоваться для наработки микроорганизмов, обладающих катаболическими генами, содержащимися на плазмидах биодеградации углеводородов. Установка содержит емкость для культивирования микроорганизмов с блоком поддержания температуры, устройства для введения питательной среды и инокулята в емкость и отвода из нее готового продукта, блок электронного управления, соединенный с блоком поддержания температуры емкости для культивирования микроорганизмов и систему концентрирования суспензии клеток, соединенную с выходом емкости для культивирования микроорганизмов. Емкость оборудована воздушным пробоотборником, соединенным с датчиком углекислого газа, и жидкостным пробоотборником, соединенным соответственно с датчиками оптической плотности и счета клеток суспензии, при этом выходы всех датчиков и блока поддержания температуры подключены через контроллер к компьютеру. Изобретение позволяет обеспечить повышение точности контроля получения биомассы углеводородокисляющих микроорганизмов в требуемой фазе роста в виде концентрированной суспензии клеток. 1 з.п. ф-лы, 2 ил.
Реферат
Изобретение относится к области микробиологии и биотехнологии, а именно к установкам для культивирования биомассы углеводородокисляющих микроорганизмов, и может использоваться для наработки микроорганизмов, обладающих катаболическими генами, содержащимися на плазмидах биодеградации углеводородов.
Миллионы тонн жидких и твердых отходов ежегодно образуются в результате деятельности нефтяной и нефтеперерабатывающей промышленности. Способность микроорганизмов к трансформации или деградации углеводородов нефти хорошо известна и позволяет использовать их для биоремедиации загрязненных территорий. В большинстве случаев в основе биотехнологий очистки окружающей среды от нефти и нефтепродуктов используются биопрепараты, которые содержат жизнеспособные клетки как отдельных штаммов углеводородокисляющих микроорганизмов («Путидойл», «Олеворин»), так и бактериальный консорциум («Деворойл»).
Известно, что плазмиды играют важную роль в адаптации микроорганизмов к изменяющимся условиям окружающей среды. Эти генетические детерминанты позволяют содержащим их микроорганизмам катаболизировать устойчивые в окружающей среде соединения, например ароматические углеводороды, которые не способны разлагать большинство известных микроорганизмов. Известно, что интродукция микроорганизмов - потенциальных доноров плазмид биодеградации ароматических углеводородов, может интенсифицировать процессы очистки и, кроме того, повышать биодеградативный потенциал микробных популяций в местах, загрязненных полициклическими ароматическими соединениями, путем передачи плазмид и генов биодеградации в эндогенные микроорганизмы.
Как известно, микроорганизмы, обладающие катаболическими генами, содержащимися на плазмидах биодеградации углеводородов, имеют очевидное преимущество перед остальными микроорганизмами, поскольку способность расщеплять поллютант играет роль защитного механизма и обеспечивает микроорганизм дополнительным источником углерода и энергии.
Также известно, что любой процесс выращивания микроорганизмов в ограниченном объеме питательной среды следует относить к периодическому культивированию, при котором рост культуры условно разделяют на несколько фаз: лаг-фаза; фаза ускорения роста; экспоненциальная фаза; фаза замедления роста; стационарная фаза и фаза лизиса. В фазе ускорения роста клетки начинают размножаться, и число делящихся клеток постепенно увеличивается. Далее следует экспоненциальная фаза, наиболее важная для наработки плазмидосодержащих углеводородокисляющих микроорганизмов. Известно, что в этой фазе концентрация компонентов питательной среды и продукты метаболизма не ограничивают скорость роста, и размножение идет с максимально возможной скоростью, генетически заложенной в клетке. Быстро растущие клетки потребляют из среды питательные вещества, среда обедняется, постепенно накапливаются продукты метаболизма и культура переходит в стадию замедления роста. Эта фаза представляет для экспериментаторов максимальный интерес, так как в ней достигается наибольший суммарный прирост биомассы, в культуральной среде накапливаются значительные количества продуктов метаболизма, увеличивается активность ряда ферментов. Размножение клеток в этой фазе существенно замедляется, но и к концу фазы замедления в популяции обнаруживается всего 10% размножающихся клеток. В случае плазмидосодержащих штаммов, этот период роста (фаза замедления роста) является наиболее важной, так как для получения культуры, обогащенной именно плазмидосодержащими клетками, необходимо следить за моментом наступления следующей фазы роста (стационарной фазы). В стационарной фазе скорость роста популяции уравнивается со скоростью отмирания и некоторое время популяция поддерживается в состоянии подвижного равновесия. Длительность стационарной фазы роста зависит от наличия источников энергии. Также в стационарной фазе увеличивается вероятность элиминации плазмид из клетки, что влияет на качество культуры плазмидосодержащих микроорганизмов.
Кроме того, выявлено, что присутствие катаболических плазмид в штаммах-деструкторах увеличивает степень деградации нефти. Поэтому при наработке биомассы плазмидосодержащих углеводородокисляющих микроорганизмов необходимо создать условия, которые бы способствовали культивированию микроорганизмов стабильно содержащих в своем составе плазмиды деградации углеводородов нефти.
В связи с этим установка для наработки плазмидосодержащих углеводородокисляющих микроорганизмов должна отвечать ряду необходимых требований.
Во-первых, она должна обеспечивать специфические условия культивирования плазмидосодержащих микроорганизмов.
Во-вторых, установка в процессе технологического цикла должна строго контролировать: количество СО2, оптическую плотность клеток; количество клеток в заданном объеме, что определяет количество и качество полученных плазмидосодержащих микроорганизмов.
В-третьих, установка в процессе технологического цикла должна предусматривать проведение мониторинга переходов одной фазы роста в другую, что важно для определения времени и количества вносимого углеводородного субстрата для активизации ферментных систем микроорганизмов, что положительно влияет на поддержание плазмид в клетках.
Известны различные аппараты и установки для получения биомассы микроорганизмов. Например, установка для выращивания микроорганизмов (см. патент РФ на полезную модель №5183, кл. С12М 1/00, 1997 г.) включает емкость с крышкой, снабженную мешалкой, средства для введения инокулята и отвода готового продукта, а также средства для поддержания заданной температуры в емкости. Установка снабжена устройством для подачи газа в емкость и устройством стерильного розлива готового продукта. Причем средство поддержания заданной температуры в емкости содержит расположенную на последней пароводяную рубашку с электронагревателями и гидросистему для подвода и отвода воды в рубашку, а также средство ввода инокулята, состоящее из герметично установленного на крышке емкости патрубка, снабженного в верхней его части съемной крышкой с уплотнением.
Основным недостатком известной установки является то, что она не позволяет использовать ее для получения биомассы углеводородокисляющих микроорганизмов из-за отсутствия в ней средств контроля за фазами роста микроорганизмов.
Кроме того, в известной установке отсутствуют средства для получения концентрированной суспензии клеток.
Также известен аппарат для выращивания микроорганизмов (см. патент РФ на изобретение №2352626, кл. С12М 1/02, 2007 г.) для производства биомассы аэробных микроорганизмов для кормовых и других целей. Аппарат содержит емкость, заполняемую культуральной жидкостью до определенного уровня и снабженную патрубками для подвода жидкой минеральной питательной среды, воздуха и отвода накопленной биомассы, а также, как минимум, одну дополнительную емкость, являющуюся абсорбером газообразного субстрата. Эти емкости имеют обечайки, установленные по оси емкости для разделения наполняемой жидкостью части емкости на подъемный и опускной каналы, а также барботеры для подвода воздуха, расположенные в подъемных каналах емкостей, которые соединены между собой и с побудителем циркуляции жидкости.
Основным недостатком известного аппарата является то, что он предполагает использовать в качестве органического сырья газообразный субстрат, например природный или сжиженный газ, а не жидкие углеводороды.
Кроме того, в известном аппарате отсутствуют средства для получения концентрированной суспензии клеток.
Известна ферментационная установка для культивирования микроорганизмов, (см. патент на полезную модель №86184, кл. С12М 1/02, 2009 г.), содержащая реактор с культуральным сосудом и термостатирующей рубашкой и крышкой, который оснащен технологическими патрубками. Установка снабжена также магнитным приводом с турбинной мешалкой, барбатером и электронными средствами управления процессом получения биомассы микроорганизмов. Весь процесс работы установки контролируется и регулируется пультом контроля и управления.
Основным недостатком известной установки является то, что она предназначена для глубинного культивирования микроорганизмов при изготовлении вакцин и других биологических препаратов, а следовательно, снабжена для повышения надежности и безопасности избыточными элементами, значительно усложняющими конструкцию реактора (перемешивающее устройство, цилиндрическая магнитная муфта с разделительной мембраной, крыльчатка пеногашения, турбинная мешалка и т.п.).
Другим недостатком известной установки является то, что ее нельзя использовать для получения биомассы углеводородокисляющих микроорганизмов из-за отсутствия в ней средств контроля за фазами роста микроорганизмов.
Кроме того, в известной установке отсутствуют средства для получения концентрированной суспензии клеток.
Наиболее близкой по технической сути к заявляемому техническому решению (прототипом) является установка для получения биомассы углеводородокисляющих микроорганизмов (патент РФ на полезную модель №94225, С12М 1/00, 2010 г.), включающая термостатированную емкость для культивирования микроорганизмов с блоком поддержания температуры, устройства для введения питательной среды и инокулята в емкость и отвода из нее готового продукта, а также блок электронного управления, соединенный с блоком поддержания температуры.
Основными недостатками известной установки, являются, во-первых, невозможность контроля за фазами роста микроорганизмов, а во-вторых, отсутствие средств для получения концентрированной суспензии клеток.
Задачей, решаемой заявляемым техническим решением, является устранение обозначенных недостатков, а именно доработка установки, после которой она будет пригодна для получения биомассы углеводородокисляющих микроорганизмов в требуемой фазе роста, причем в виде концентрированной суспензии клеток.
Поставленная задача в установке для наработки плазмидосодержащих углеводородокисляющих микроорганизмов, включающей емкость для культивирования микроорганизмов с блоком поддержания температуры, устройства для введения питательной среды и инокулята в емкость и отвода из нее готового продукта, а также блок электронного управления, соединенный с блоком поддержания температуры в емкости для культивирования микроорганизмов, решена тем, что установка дополнительно содержит систему концентрирования суспензии клеток, соединенную с выходом емкости для культивирования микроорганизмов, а сама емкость оборудована воздушным пробоотборником, соединенным с датчиком углекислого газа, и жидкостным пробоотборником, соединенным соответственно с датчиками оптической плотности и счета клеток суспензии, при этом выходы всех датчиков и блока поддержания температуры подключены через контроллер к компьютеру.
Наличие в установке воздушного и жидкостного пробоотборников и соединенных с ними датчиков углекислого газа, оптической плотности и счета клеток суспензии позволяют достаточно точно определять фазы роста культуры микроорганизмов, а следовательно, получать именно плазмидосодержащие клетки. Благодаря присутствию в установке системы концентрирования суспензии клеток, установка позволяет сепарировать из суспензии плазмидосодержащие углеводородокисляющие микроорганизмы. Для уменьшения времени сепарации микроорганизмов из суспензии, система концентрирования суспензии клеток выполнена в виде последовательно включенных жидкостного насоса и роторной центрифуги, при этом вход насоса соединен с емкостью для культивирования микроорганизмов посредством магистрали с электромагнитным клапаном.
Таким образом, заявляемое устройство позволяет создать установку для наработки углеводородокисляющих микроорганизмов, способную так организовать процесс роста биомассы, чтобы постоянно контролировать все протекающие фазы роста микроорганизмов, т.е. в результате получить биомассу с максимально насыщенным количеством плазмидосодержащих штаммов, что не имеет аналогов среди известных установок для наработки углеводородокисляющих микроорганизмов, а значит, удовлетворяет критерию «изобретательский уровень».
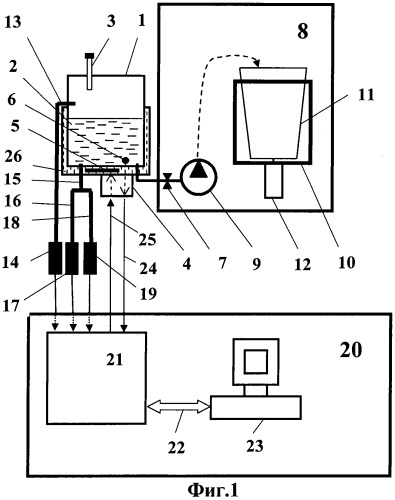
На фиг.1 приведена блок-схема одного из вариантов реализации заявляемого технического решения, где: 1 - емкость для культивирования микроорганизмов (ферментер с наружной водяной «рубашкой»), заполненная на 60-70% питательной средой 2; 3 - горловина для введения культуральной жидкости (питательной среды и инокулята); 4 - блок поддержания температуры культуральной жидкости, включающий нагреватель 5 и термодатчик 6; 7 - запорный вентиль в магистрали, соединяющей емкость для культивирования микроорганизмов с системой концентрирования суспензии клеток 8, включающей жидкостный насос 9 и роторную центрифугу 10 с ротором 11, установленным на валу электродвигателя 12; 13 - воздушный пробоотборник, соединенный с датчиком углекислого газа 14; 15 - жидкостный пробоотборник, соединенный через магистраль 16 с датчиком оптической плотности 17 и через магистраль 18 с датчиком счета клеток суспензии 19; 20 - блок электронного управления, включающий контроллер 21, соединенный сигнальной шиной 22 с компьютером 23; 24 - сигнальный провод датчика температуры 6 культуральной жидкости 2; 25 - провод включения нагревателя 5 водяной «рубашки» 26.
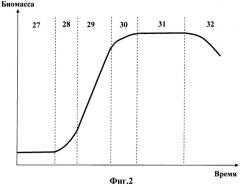
На фиг.2 приведен график роста культуры углеводородокисляющих микроорганизмов, условно разделенный на несколько фаз: 27 - лаг-фаза; 28 - фаза ускорения роста; 29 - экспоненциальная фаза; 30 - фаза замедления роста; 31 - стационарная фаза и 32 - фаза лизиса.
Установка работает следующим образом. В емкость для культивирования 1 (ферментер) через горловину 3 заливают стерильную питательную среду и инокулят плазмидосодержащих углеводородокисляющих микроорганизмов с температурой около 28°С, которую далее поддерживает на этом уровне блок электронного управления 20, используя измерения датчика температуры 6 культуральной жидкости 2 и нагреватель 5 водяной «рубашки» 26. Далее начинается культивирование. Через каждые 2 часа по сигналу с блока электронного управления 20 производится пробоотбор культуральной жидкости в объеме 5 мл через жидкостный пробоотборник 15, оборудованный электромагнитным клапаном (электромагнитный клапан и канал его управления на рисунке условно не показаны). Часть отобранной культуральной жидкости анализируется посредством датчика определения оптической плотности 17, а другая часть - датчиком 19, который производит подсчет клеток суспензии. Одновременно производится отбор воздушной пробы с использованием воздушного пробоотборника 13, соединенного с датчиком углекислого газа 14, который фиксирует концентрацию образующегося углекислого газа. Полученные сигналы с датчиков 14, 17 и 19 через контроллер 21 и сигнальную шину 22 поступают в компьютер 23, который обрабатывает текущие результаты замеров и на их основе строит кривую роста культуры (фиг.2) выращиваемых плазмидосодержащих микроорганизмов. Режим постоянного мониторинга процесса позволяет контролировать переход из одной фазы в другую с целью определения конечной точки фазы замедления роста 30. При фиксировании окончания фазы замедления роста 30 вносится 1% углеводородного субстрата для активизации ферментных систем микроорганизмов, а затем через 20-30 минут культивирование завершают. Полученная суспензия клеток поступает в роторную центрифугу 10, в которой происходит концентрирование биомассы микроорганизмов. Полученная концентрированная суспензия извлекается из ротора 11 центрифуги 10.
В действующем макете заявляемой установки были использованы:
- ферментер марки - BioFlo 5000 (производитель New Brunswick Scientific - США) в качестве емкости для культивирования микроорганизмов;
- оптический датчик СО2 ИГМ-0171 (производитель ПРОМПРИБОР - Россия) в качестве датчика углекислого газа;
- фотоэлектроколориметр АР-700 (производитель АНАЛИТ-НЕВА - Россия) в качестве датчика оптической плотности;
- счетчик колоний микроорганизмов СКМ-1 (производитель БИОЛАЙТ - Россия) в качестве датчика счета клеток суспензии;
- электронасос центробежный серии ОНЦ1-С (производитель Пищмашсервис - Россия) в качестве жидкостного насоса;
- центрифуга лабораторная медицинская РС-6 (производитель Новосиббиоприбор - Россия) в качестве роторной центрифуги.
1. Установка для наработки плазмидосодержащих углеводородокисляющих микроорганизмов, включающая емкость для культивирования микроорганизмов с блоком поддержания температуры, устройства для введения питательной среды и инокулята в емкость и отвода из нее готового продукта, а также блок электронного управления, соединенный с блоком поддержания температуры емкости для культивирования микроорганизмов, отличающаяся тем, что установка дополнительно содержит систему концентрирования суспензии клеток, соединенную с выходом емкости для культивирования микроорганизмов, а сама емкость оборудована воздушным пробоотборником, соединенным с датчиком углекислого газа, и жидкостным пробоотборником, соединенным соответственно с датчиками оптической плотности и счета клеток суспензии, при этом выходы всех датчиков и блока поддержания температуры подключены через контроллер к компьютеру.
2. Установка по п.1, отличающаяся тем, что система концентрирования суспензии клеток выполнена в виде последовательно включенных жидкостного насоса и роторной центрифуги, при этом вход насоса соединен с емкостью для культивирования микроорганизмов посредством магистрали с электромагнитным клапаном.