Дифференцировка человеческих эмбриональных стволовых клеток
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и клеточной инженерии. Предложен способ получения инсулинпродуцирующих клеток, полученных из полипотентных стволовых клеток и способных секретировать инсулин без использования слоя питающих клеток. Изобретение может быть использовано в фармакологической промышленности для получения инсулина. 71 з.п. ф-лы, 23 ил., 17 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении предлагаются способы, способствующие осуществлению дифференцировки полипотентных стволовых клеток, и продукты, относящиеся к этим способам или возникающие в результате их использования. В частности, в настоящем изобретении предлагается усовершенствованный способ создания клеток, экспрессирующих гормоны поджелудочной железы, и клеток, секретирующих гормоны поджелудочной железы. Кроме того, в настоящем изобретении также предлагаются способы стимулирования дифференцировки полипотентных стволовых клеток без использования слоя питающих клеток, а также продукты, относящиеся к этим способам или возникающие в результате их использования. В настоящем изобретении также предлагаются способы, способствующие осуществлению стимулируемой глюкозой секреции инсулина в инсулинпродуцирующих клетках, полученных из полипотентных стволовых клеток.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Достижения в области клеточной заместительной терапии сахарного диабета 1 типа и нехватка трансплантируемых островков Лангерганса заставили обратить внимание на разработку источников инсулинпродуцирующих клеток, или β-клеток, подходящих для трансплантации. Одним из подходов является формирование функциональных β-клеток из полипотентных стволовых клеток, таких как, например, эмбриональные стволовые клетки.
При эмбриональном развитии позвоночных, полипотентные стволовые клетки дают начало группе клеток, формирующих три зародышевых листка (эктодерму, мезодерму и эндодерму) в ходе процесса, именуемого гаструляцией. Ткани, из которых состоят, например, щитовидная железа, тимус, поджелудочная железа, кишечник и печень, будут развиваться из эндодермы, через промежуточную стадию. Промежуточной стадией данного процесса является образование сформировавшейся эндодермы. Клетки сформировавшейся эндодермы экспрессируют ряд маркеров, таких как HNF-3beta, GATA4, Mixl1, CXCR4 и Sox-17.
Полипотентные стволовые клетки могут экспрессировать один или несколько стадийно-специфичных эмбриональных антигенов (stage-specific embryonic antigen, SSEA) 3 и 4, а также маркеры, определяемые антителами, обозначенными как Tra-1-60 и Tra-1-81 (Thomson et al., Science 282:1145, 1998). Дифференцировка полипотентных стволовых клеток in vitro приводит к утрате экспрессирования SSEA-4, Tra-1-60 и Tra-1-81 (если имеются) и к увеличению экспрессии SSEA-1. В недифференцированных полипотентных стволовых клетках, как правило, активна щелочная фосфатаза, которая может быть обнаружена путем фиксации клеток с помощью 4% параформальдегида, с последующим обнаружением с помощью Vector Red, применяемого в качестве субстрата, в соответствии с инструкциями производителя (Vector Laboratories, Burlingame Calif.). Недифференцированные полипотентные стволовые клетки также, как правило, экспрессируют Oct-4 и TERT, обнаруживаемые методом ОТ-ПЦР.
Полипотентные стволовые клетки, как правило, культивируются на слое питающих клеток, которые оказывают разностороннюю поддержку полипотентным клеткам. Как вариант, полипотентные стволовые клетки культивируются в культуральной системе, по существу не содержащей питающих клеток, но, тем не менее, поддерживающей пролиферацию полипотентных стволовых клеток и не допускающей существенной дифференцировки. Выращивание полипотентных стволовых клеток в культуре, не содержащей питающих клеток, без дифференцировки, осуществляется при помощи среды, кондиционированной путем предварительного культивирования в ней клеток другого типа. Как вариант, выращивание полипотентных стволовых клеток в культуре, не содержащей питающих клеток, без дифференцировки, осуществляется при помощи среды с определенным химическим составом.
Например, в публикациях Reubinoff et al. (Nature Biotechnology 18: 399-404 (2000)) и Thompson et al. (Science, 6 ноября 1998 года: Vol. 282, № 5391, pp. 1145-1147) описано культивирование линий полипотентных стволовых клеток из человеческих бластоцист с применением слоя питающих клеток из мышиных эмбриональных фибробластов.
В публикации Richards et al. (Stem Cells 21: 546-556, 2003) анализировался набор из 11 различных слоев питающих клеток, полученных от взрослых, новорожденных и эмбрионов людей, по их способности осуществлять поддержку культуры человеческих полипотентных стволовых клеток. Richards et al. сообщают: «линии человеческих эмбриональных стволовых клеток, культивируемые на питающих слоях из фибробластов кожи взрослых людей, сохраняют морфологию, характерную для эмбриональных стволовых клеток, и остаются полипотентными».
В заявке на патент US20020072117 описываются линии клеток, продуцирующие среду, осуществляющую поддержку полипотентных стволовых клеток приматов в культуре, не содержащей питающих клеток. Использованные клеточные линии представляют собой мезенхимо- и фибробластоподобные линии, полученные из эмбриональной ткани или дифференцированные из эмбриональных стволовых клеток. В заявке на патент US20020072117 также описывается использование этих клеточных линий в качестве первичного слоя питающих клеток.
В другом примере, Wang et al. (Stem Cells 23: 1221-1227, 2005) описывают способы длительного выращивания человеческих полипотентных стволовых клеток на слоях питающих клеток, полученных из человеческих эмбриональных стволовых клеток.
В другом примере, Stojkovic et al. (Stem Cells 23: 306-314, 2005) описывают систему питающих клеток, получаемую в результате спонтанной дифференцировки человеческих эмбриональных стволовых клеток.
В еще одном примере, Miyamoto et al. (Stem Cells 22: 433-440, 2004) описывают источник питающих клеток, получаемых из человеческой плаценты.
Amit et al. (Biol. Reprod. 68: 2150-2156, 2003) описывают слой питающих клеток, полученных из человеческой крайней плоти.
В другом примере, Inzunza et al. (Stem Cells 23: 544-549, 2005) описывают слой питающих клеток, полученных из человеческих постнатальных фибробластов крайней плоти.
В патенте US6642048 описывается среда, поддерживающая рост полипотентных стволовых клеток приматов (пПС) в среде, не содержащей питающих клеток, и клеточные линии, которые могут использоваться для производства такой среды. В патенте US6642048 говорится: «Данное изобретение включает мезенхимо- и фибробластоподобные клеточные линии, полученные из эмбриональной ткани или дифференцированные из эмбриональных стволовых клеток. В документе описываются и иллюстрируются способ получения таких клеточных линий, обработки среды и выращивания стволовых клеток с применением кондиционированной среды».
В другом примере, в заявке на патент WO2005014799, описывается кондиционированная среда для поддержания, пролиферации и дифференцировки клеток млекопитающих. В заявке на патент WO2005014799 говорится: «Культуральная среда, произведенная в соответствии с настоящим изобретением, кондиционируется при помощи секреторной активности клеток мыши, в частности, активности дифференцированных и иммортализованных трансгенных гепатоцитов, именуемых MMH (Met Murine Hepatocyte)».
В другом примере, Xu et al. (Stem Cells 22: 972-980, 2004) описывают кондиционированную среду, полученную из производных человеческих эмбриональных стволовых клеток, генетически модифицированных для увеличения экспрессии обратной транскриптазы человеческой теломеразы.
В другом примере, заявке на патент US20070010011, описывается культуральная среда определенного химического состава для поддержания полипотентных стволовых клеток.
В альтернативной культуральной системе используется не содержащая сыворотки среда, обогащенная факторами роста, способными стимулировать пролиферацию эмбриональных стволовых клеток. Например, Cheon et al. (BioReprod DOI:10.1095/biolreprod.105.046870, 19 октября 2005 года) описывают не содержащую питающих клеток и сыворотки культуральную систему, в которой эмбриональные стволовые клетки поддерживаются в некондиционированной, заменяющей сыворотку среде (SR), обогащенной различными факторами роста, способными запустить самообновление эмбриональных стволовых клеток.
В другом примере, Levenstein et al. (Stem Cells 24: 568-574, 2006) описывают способы длительного культивирования человеческих эмбриональных стволовых клеток в отсутствие фибробластов или кондиционированной среды, с применением среды, обогащенной основным фактором роста фибробластов (bFGF).
В другом примере, заявке на патент US20050148070, описывается способ культивирования человеческих эмбриональных стволовых клеток в среде с определенным составом без сыворотки и без питающих клеток-фибробластов, где данный способ включает: культивирование стволовых клеток в культуральной среде, содержащей альбумин, аминокислоты, витамины, минеральные вещества, по меньшей мере один трансферрин или заменитель трансферрина, по меньшей мере один инсулин или заместитель инсулина, культуральную среду, в основном не включающую эмбриональную сыворотку млекопитающих и содержащую по меньшей мере приблизительно 100 нг/мл фактора роста фибробластов, способного активировать сигнальный рецептор фактора роста фибробластов, причем фактор роста фибробластов происходит из источника, иного, чем просто слой питающих клеток-фибробластов, среду, поддерживающую пролиферацию стволовых клеток в недифференцированном состоянии без слоя питающих клеток или кондиционированной среды.
В другом примере, заявке на патент US20050233446, описывается среда с определенным составом, которая может использоваться при культивировании стволовых клеток, включая недифференцированные зародышевые стволовые клетки приматов. В растворе, среда, по существу, является изотонической относительно культивируемых стволовых клеток. В данной культуре указанная среда содержит основную среду и количество bFGF, инсулина и аскорбиновой кислоты, достаточное для поддержки роста зародышевых стволовых клеток без существенной дифференцировки.
В другом примере, патенте US6800480, говорится: «В одном варианте осуществления предлагается культуральная среда для выращивания клеток зародышевых стволовых клеток приматов, в значительной степени в недифференцированном состоянии, включающая основную среду с низким содержанием эндотоксина и низким осмотическим давлением, которая эффективно поддерживает рост зародышевых стволовых клеток приматов. Основная среда объединяется с питательной сывороткой, способной поддерживать рост зародышевых стволовых клеток приматов, и субстратом, выбранным из группы, состоящей из питающей клетки и экстраклеточного матрикса, полученного из питающих клеток. Среда также содержит аминокислоты, не относящиеся к незаменимым, антиоксидант и первый фактор роста, выбираемый из группы, состоящей из нуклеозидов и соль-пирувата».
В другом примере, заявке на патент US20050244962, говорится: «В одном аспекте, в изобретении предлагается способ культивирования эмбриональных стволовых клеток приматов. Стволовые клетки культивируются в культуре, в основном, не содержащей эмбриональной сыворотки млекопитающих (предпочтительно, также, в основном, не содержащей эмбриональной сыворотки любых животных) и в присутствии фактора роста фибробластов, полученного из источника, иного, чем просто питающие клетки-фибробласты. В предпочтительной форме, слой питающих фибробластов, ранее необходимый для поддержания культуры стволовых клеток, становится необязательным вследствие добавления достаточного количества фактора роста фибробластов».
В другом примере, заявке на патент WO2005065354, описывается изотоническая культуральная среда определенного состава, в основном не содержащая питающих клеток и сыворотки, включающая: a) базовую среду; b) количество bFGF, достаточное для поддержания роста, в основном недифференцированных стволовых клеток млекопитающих; c) количество инсулина, достаточное для поддержания роста, в основном недифференцированных стволовых клеток млекопитающих; и d) количество аскорбиновой кислоты, достаточное для поддержки роста, в основном недифференцированных стволовых клеток млекопитающих.
В другом примере, WO2005086845, описывается способ поддержания недифференцированных стволовых клеток, где упомянутый способ включает воздействие на стволовые клетки одним членом семейства белков трансформирующего ростового фактора-бета (TGFβ), одним членом семейства белков фактора роста фибробластов (FGF) или никотинамидом (NIC) в количестве, достаточном для поддержания клеток в недифференцированном состоянии в течение периода времени, достаточного для получения желаемого результата.
Полипотентные стволовые клетки могут культивироваться и дифференцироваться на субстрате тканевой культуры, покрытом экстраклеточным матриксом. Экстраклеточный матрикс может быть растворен перед покрытием им субстрата тканевой культуры. Примеры подходящих способов растворения экстраклеточного матрикса и покрытия субстрата тканевой культуры можно найти в публикации Kleinman, H.K., et al., Biochemistry 25: 312 (1986), и Hadley, M.A., et al., J. Cell. Biol. 101: 1511 (1985).
Формирование поджелудочной железы происходит при дифференцировке сформировавшейся эндодермы в панкреатическую эндодерму. Клетки панкреатической эндодермы экспрессируют ген панкреатическо-дуоденального гомеобокса, Pdx1. При отсутствии Pdx1 развитие поджелудочной железы не идет дальше формирования вентрального и дорзального зачатков. Следовательно, экспрессия Pdx1 является важным этапом онтогенеза поджелудочной железы. Зрелая поджелудочная железа содержит, среди других типов клеток, экзокринную ткань и эндокринную ткань. Экзокринная и эндокринная ткани образуются при дифференцировке панкреатической эндодермы.
Клетки, обладающие свойствами островковых клеток, как сообщалось, были получены из эмбриональных клеток мыши. Например, в публикации Lumelsky et al. (Science 292: 1389, 2001) сообщается о дифференцировке мышиных эмбриональных стволовых клеток в инсулинсекретирующие структуры, сходные с островками поджелудочной железы. Soria et al. (Diabetes 49: 157, 2000) сообщают, что инсулинсекретирующие клетки, полученные из мышиных эмбриональных стволовых клеток, нормализовали гликемию у мышей с диабетом, вызванным стрептозотоцином.
В одном примере, в публикации Hori et al. (PNAS 99: 16105, 2002) описывается, что обработка мышиных эмбриональных стволовых клеток ингибиторами фосфоинозитид 3-киназы (LY294002) приводила к получению клеток, сходных с β-клетками.
В другом примере, Blyszczuk et al. (PNAS 100: 998, 2003) сообщается о получении инсулинпродуцирующих клеток из мышиных эмбриональных стволовых клеток с конститутивной экспрессией Pax4.
Micallef et al. сообщают, что ретиноевая кислота может регулировать способность эмбриональных стволовых клеток формировать Pdx1-положительную панкреатическую эндодерму. Ретиноевая кислота с наибольшей эффективностью индуцирует экспрессию Pdx1 при добавлении в культуру на 4 день дифференцировки эмбриональных стволовых клеток в течение периода, соответствующего концу гаструляции эмбриона (Diabetes 54: 301, 2005).
В публикации Miyazaki et al. сообщается о линии мышиных эмбриональных стволовых клеток со сверхэкспрессией Pdx1. Эти результаты показывают, что экспрессия экзогенного Pdx1 очевидно повышает экспрессию генов инсулина, соматостатина, глюкокиназы, нейрогенина 3, P48, Pax6 и HNF6 в образующихся дифференцированных клетках (Diabetes 53: 1030, 2004).
В публикации Skoudy et al. сообщается, что активин A (входящий в суперсемейство TGF-β) повышает экспрессию экзокринных панкреатических генов (p48 и амилаза) и эндокринных генов (Pdx1, инсулин и глюкагон) в эмбриональных стволовых клетках мыши. Максимальный эффект наблюдался при использовании активина A в концентрации 1 нМ. Также эти авторы наблюдали, что на уровень экспрессии мРНК инсулина и Pdx1 не влияла ретиноевая кислота; однако обработка раствором FGF7 с концентрацией 3 нМ приводила к повышению уровня транскрипта Pdx1 (Biochem. J. 379: 749, 2004).
В работе Shiraki et al. изучались эффекты факторов роста, специфически увеличивающих дифференцировку эмбриональных стволовых клеток в Pdx1-положительные клетки. Эти авторы наблюдали, что TGF-β2 приводил к воспроизводимому увеличению доли Pdx1-положительных клеток (Genes Cells, июнь 2005 г.; 10(6): 503-16).
В публикации Gordon et al. продемонстрирована индукция образования эндодермальных клеток brachyury+/HNF-3beta+ из эмбриональных стволовых клеток мыши в отсутствие сыворотки и в присутствии активина в сочетании с ингибитором сигнального пути Wnt (US 2006/0003446A1).
В публикации Gordon et al. (PNAS, Vol. 103, страница 16806, 2006) говорится: «Для образования передней первичной полоски требовались, одновременно, сигнальные пути Wnt и TGF-бета/Nodal/активин».
Однако модель развития эмбриональных стволовых клеток на мышах может не имитировать в точности программу развития у высших млекопитающих, как, например, у человека.
Thomson et al. выделяли эмбриональные стволовые клетки из человеческих бластоцист (Science 282: 114, 1998). Параллельно, Gearhart и соавторы получили клеточные линии человеческих эмбриональных зародышевых клеток (чЭЗ) из ткани половых желез эмбриона (Shamblott et al., Proc. Natl. Acad. Sci. USA 95: 13726, 1998). В отличие от эмбриональных стволовых клеток мыши, воспрепятствовать дифференцировке которых можно путем простого культивирования с фактором торможения лейкемиии (Leukemia Inhibitory Factor, LIF), человеческие эмбриональные стволовые клетки должны культивироваться в очень специфических условиях (США, патенты №№ 6200806; WO 99/20741; WO 01/51616).
D'Amour et al. описывают получение обогащенных культур сформировавшейся эндодермы, производной от человеческих эмбриональных стволовых клеток, в присутствии высокой концентрации активина и низкой концентрации сыворотки (Nature Biotechnology 2005). Трансплантация этих клеток под почечную капсулу мышей приводит к их дифференцировке в более зрелые клетки, обладающие характерными особенностями некоторых эндодермальных органов. Клетки сформировавшейся эндодермы, производные от человеческих эмбриональных стволовых клеток, могут подвергаться дальнейшей дифференцировке в Pdx1-положительные клетки после добавления FGF-10 (US 2005/0266554A1).
В публикации D'Amour et al. (Nature Biotechnology - 24, 1392-1401 (2006)) говорится: «Мы разработали процесс дифференцировки, преобразующий человеческие эмбриональные стволовые клетки (чЭС) в эндокринные клетки, способные синтезировать гормоны поджелудочной железы, инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Данный процесс имитирует органогенез поджелудочной железы in vivo, проводя клетки через фазы, напоминающие образование сформировавшейся эндодермы, эндодермы кишечной трубки, панкреатической эндодермы и превращение предшественников эндокринных клеток в клетки, экспрессирующие эндокринные гормоны».
В другом примере, Fisk et al. сообщают о системе для получения островковых клеток поджелудочной железы из человеческих эмбриональных стволовых клеток (заявка на патент US2006/0040387A1). В данном случае процесс дифференцировки был разделен на три стадии. Сначала человеческие эмбриональные стволовые клетки были дифференцированы до эндодермы с помощью сочетания бутирата натрия и активина А. Далее клетки культивировались с антагонистами TGF-β, такими как Noggin, в сочетании с EGF или бета-целлюлином с получением Pdx1-положительных клеток. Окончательная дифференцировка запускалась никотинамидом.
В одном примере, Benvenistry et al. сообщают: «Мы делаем вывод, что сверхэкспрессия Pdx1 увеличивала экспрессию панкреатических обогащенных генов, а для индукции экспрессии инсулина могут требоваться дополнительные сигналы, присутствующие только in vivo» (Benvenistry et al., Stem Cells 2006; 24: 1923-1930).
В другом примере, Odorico et al. сообщается о способах прямой дифференцировки in vitro полипотентных стволовых клеток млекопитающих в клетки панкреатической линии дифференцировки. Данные способы включают культивацию стволовых клеток в присутствии эффективного количества костного морфогенетического белка с индукцией дифференцировки в направлении мезэндодермы. Эти мезэндодермальные клетки далее культивируются до образования эмбриоидных телец (ЭТ), обогащенных клетками, коммитированными в сторону сформировавшейся эндодермы, которые при определенных условиях, в итоге, дифференцируются в клетки панкреатической линии дифференцировки (US20070259423).
В другом примере, Tulachan et al. (Developmental Biology, 305, 2007, страницы 508-521) утверждают: «Ингибирование сигнального пути TGF-B в эмбриональный период может, таким образом, позволить клеткам эпителия поджелудочной железы развиться до эндокринной линии дифференцировки».
Следовательно, острой потребностью по-прежнему остается разработка условий для создания стабильных линий полипотентных стволовых клеток, способных быть размноженными для решения текущих клинических задач и сохраняющих потенциал дифференцировки в эндокринные клетки поджелудочной железы, в клетки, экспрессирующие гормоны поджелудочной железы, или в клетки, секретирующие гормоны поджелудочной железы и обладающие способностью секретировать инсулин в ответ на изменение концентрации глюкозы. Мы использовали альтернативный подход к повышению эффективности дифференцировки человеческих эмбриональных стволовых клеток в сторону эндокринных клеток поджелудочной железы, способных секретировать инсулин в ответ на изменение концентрации глюкозы.
КРАТКОЕ ОПИСАНИЕ
В одном варианте осуществления настоящего изобретения предлагается способ получения клеток, способных секретировать инсулин в ответ на стимуляцию глюкозой, из полипотентных стволовых клеток, включающий следующие стадии:
культивирование полипотентных стволовых клеток,
дифференцировку полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформировавшейся эндодермы,
дифференцировку клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы, в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, и
дифференцировку клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в клетки, экспрессирующие маркеры, характерные для линии эндокринных клеток поджелудочной железы.
В одном варианте осуществления настоящего изобретения предлагается способ активизации стимулируемой глюкозой секреции инсулина в клетках, экспрессирующих маркеры, характерные для линии эндокринных клеток поджелудочной железы, полученных из полипотентных стволовых клеток, включающий следующие стадии:
культивирование полипотентных стволовых клеток,
дифференцировку полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформировавшейся эндодермы,
дифференцировку клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы, в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, и
дифференцировку клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в клетки, экспрессирующие маркеры, характерные для линии эндокринных клеток поджелудочной железы.
В одном из вариантов осуществления экспрессирующие маркеры, характерные для линии панкреатической эндодермы, дифференцируются из клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы, любым из следующих способов:
обработка клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы, фактором роста фибробластов и ингибитором сигнального пути Hedgehog; затем удаление среды, содержащей фактор роста фибробластов и ингибитор сигнального пути Hedgehog с последующей культивацией клеток в среде, содержащей ретиноевую кислоту, фактор роста фибробластов и ингибитор сигнального пути Hedgehog, или
обработка клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы, ретиноевой кислотой и по меньшей мере одним из факторов роста фибробластов, или
обработка клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы, ретиноевой кислотой, ингибитором фактора «Sonic Hedgehog», по меньшей мере одним фактором роста фибробластов и по меньшей мере одним фактором, способным ингибировать костный морфогенетический белок (bone morphogenetic protein, BMP), или
обработка клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы, ретиноевой кислотой, ингибитором фактора «Sonic Hedgehog», по меньшей мере одним фактором роста фибробластов и нетрином, или
обработка клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы, ретиноевой кислотой, ингибитором фактора «Sonic Hedgehog», по меньшей мере одним фактором роста фибробластов, по меньшей мере одним фактором, способным ингибировать BMP и нетрином, или
обработка клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы по меньшей мере одним фактором роста фибробластов и ингибитором фактора «Sonic Hedgehog», затем удаление среды, содержащей по меньшей мере один фактор роста фибробластов и ингибитор фактора «Sonic Hedgehog», с последующей обработкой клеток ингибитором фактора «Sonic Hedgehog», по меньшей мере одним фактором роста фибробластов и ретиноевой кислотой, или
обработка клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы по меньшей мере одним фактором роста фибробластов и ингибитором фактора «Sonic Hedgehog», затем удаление среды, содержащей по меньшей мере один фактор роста фибробластов и ингибитор фактора «Sonic Hedgehog», с последующей обработкой клеток ингибитором фактора «Sonic Hedgehog», по меньшей мере одним фактором роста фибробластов, ретиноевой кислотой и по меньшей мере одним фактором, способным ингибировать BMP, или
обработка клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы по меньшей мере одним фактором роста фибробластов и ингибитором фактора «Sonic Hedgehog», затем удаление среды, содержащей по меньшей мере один фактор роста фибробластов и ингибитор фактора «Sonic Hedgehog», с последующей обработкой клеток ингибитором фактора «Sonic Hedgehog», по меньшей мере одним фактором роста фибробластов, ретиноевой кислотой и нетрином, или
обработка клеток, экспрессирующих маркеры, характерные для линии сформировавшейся эндодермы по меньшей мере одним фактором роста фибробластов и ингибитором фактора «Sonic Hedgehog», затем удаление среды, содержащей по меньшей мере один фактор роста фибробластов и ингибитор фактора «Sonic Hedgehog», с последующей обработкой клеток ингибитором фактора «Sonic Hedgehog», по меньшей мере одним фактором роста фибробластов, ретиноевой кислотой, по меньшей мере одним фактором, способным ингибировать BMP, и нетрином.
В одном варианте осуществления настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии эндокринных клеток поджелудочной железы, дифференцируются из клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, любым из следующих способов:
культивирование клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей ингибитор γ-секретазы и агонист GLP-1, затем удаление среды, содержащей ингибитор γ-секретазы и агонист GLP-1, с последующей культивацией клеток в среде, содержащей агонист GLP-1, IGF-1 и HGF, или
культивирование клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей агонист GLP-1, затем удаление среды, содержащей агонист GLP-1, с последующей культивацией клеток в среде, содержащей агонист GLP-1, IGF-1 и HGF, или
культивирование клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей ингибитор γ-секретазы и агонист GLP-1, или
культивирование клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей агонист GLP-1, или
обработка клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, фактором, ингибирующим сигнальный путь Notch, или
обработка клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, фактором, ингибирующим сигнальный путь TGF-βR-1, или
обработка клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, фактором, ингибирующим сигнальный путь Notch, и фактором, ингибирующим сигнальный путь TGF-βR-1, или
культивирование клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей от приблизительно 10 мМ до приблизительно 20 мМ глюкозы и агонист GLP-1.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
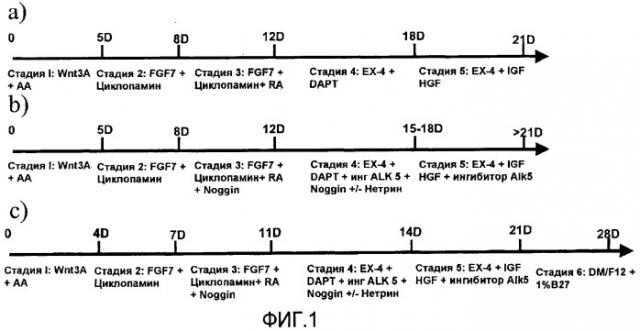
На фиг.1 показана схема протокола дифференцировки, используемого в настоящем изобретении. Панель a) относится к способу, описанному в заявке на патент США № 11/736908, панели b) и c) представляют способы, являющиеся предметом настоящего изобретения.
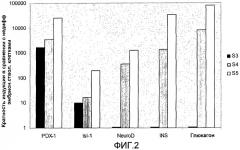
На фиг.2 показан анализ методом ПЦР в реальном времени линии человеческих эмбриональных стволовых клеток H1, дифференцируемых в соответствии со способами, описываемыми в примере 2. Экспрессия маркеров панкреатической эндодермы (PDX-1, ISL-1) и эндокринных маркеров (NeuroD, инсулин и глюкагон) показана на стадиях с 3 по 5 (S3-S5). На стадиях с 4 по 5 наблюдалось достоверное увеличение экспрессии инсулина и глюкагона.
На фиг.3 показан анализ методом ПЦР в реальном времени линии человеческих эмбриональных стволовых клеток H1, дифференцируемых в соответствии со способами, описываемыми в примере 3. Панкреатические эндокринные маркеры a) инсулин, b) NKX2, c) глюкагон, d) NeuroD и маркер панкреатической эндодермы e) PDX-1 на стадиях с 3 по 5. Влияние ингибиторов различных киназ оценивалось на стадии 3 или 4, либо на стадиях 3 и 4 (+/+ обозначает присутствие данного соединения как на стадии 3, так и на стадии 4, +/- обозначает присутствие данного соединения на стадии 3 и его отсутствие на стадии 4, -/+ обозначает присутствие данного соединения на стадии 4 и его отсутствие на стадии 3).
На фиг.4 показан анализ методом ПЦР в реальном времени линии человеческих эмбриональных стволовых клеток H1, дифференцируемых в соответствии со способами, описываемыми в примере 4. Панкреатические маркеры a) глюкагон и инсулин, b) HAND1 и NeuroD, c) HNF4a и PDX-1, d) NKX2.2 и Sox17 показаны для стадий с 3 по 5. Эффект ингибитора ALK5 II оценивался на стадии 4 или 5, либо на стадиях 4 и 5 (+/+ обозначает присутствие ингибитора на обеих стадиях 4 и 5, +/- обозначает присутствие ингибитора на стадии 4 и его отсутствие на стадии 5, -/+ обозначает присутствие ингибитора на стадии 5 и его отсутствие на стадии 4).
На фиг.5 показан анализ методом ПЦР в реальном времени линии человеческих эмбриональных стволовых клеток H1, дифференцируемых в соответствии со способами, описываемыми в примере 5. Эффект 1-10 мкМ ингибиторов I и II ALK5 на экспрессию: a) глюкагона, b) инсулина, c) PDX-1, d) NeuroD, показан для стадий с 4 по 5. При контрольной обработке ни один из ингибиторов ALK5 в ходе процесса дифференцировки не использовался.
На фиг.6 показан анализ методом ПЦР в реальном времени линии человеческих эмбриональных стволовых клеток H1, дифференцируемых в соответствии со способами, описываемыми в примере 6. Эффект сочетания 1 мкМ ингибитора ALK5 и 0-500 нг/мл рекомбинантного человеческого фактора Noggin на экспрессию a) альбумина, b) CDX2, c) инсулина, d) глюкагона, e) PDX-1, f) NeuroD и g) NKX2.2, показан для стадий с 3 по 5. Ингибитор ALK5 добавлялся на стадиях 4 и 5, а белок Noggin добавлялся на стадии 3.
На фиг.7 показан анализ методом ПЦР в реальном времени линии человеческих эмбриональных стволовых клеток H1, дифференцируемых в соответствии со способами, описываемыми в примере 7. Эффект сочетания 1 мкМ ингибитора ALK5 и 100 нг/мл рекомбинантного человеческого белка Noggin на экспрессию a) инсулина, b) глюкагона, c) ngn3, d) NeuroD, e) CDX-2, f) PDX-1, показан для стадий 4 и 5. Ингибитор ALK5 добавлялся на стадиях 4 и 5, а белок Noggin добавлялся на стадиях 3, 4 или 3 и 4.
На фиг.8 показана морфология клеток, дифференцированных в соответствии со способами, описанными в примере 7: a) 4-кратное фазово-контрастное изображение клеток стадии 5 на 6 день, b) 10-кратное фазово-контрастное изображение клеток стадии 5 на 6 день, c) 4-кратное фазово-контрастное изображение клеток стадии 5 на 12 день, d) 10-кратное фазово-контрастное изображение клеток стадии 5 на 12 день.
На фиг.9 показаны иммунофлуоресцентные изображения клеток, дифференцированных в соответствии со способами, описанными в примере 7. Клетки находятся на стадии 5, день 12. a) Инсулиновое окрашивание единичного кластера, а также в сочетании с b) ядерным красителем DAPI.
На фиг.10 показан анализ методом ПЦР в реальном времени линии человеческих эмбриональных стволовых клеток H1, дифференцируемых в соответствии со способами, описываемыми в примере 7.
На фиг.11 показан анализ методом ПЦР в реальном времени линии человеческих эмбриональных стволовых клеток H1, дифференцируемых в соответствии со способами, описываемыми в примере 8. Демонстрируется эффект сочетания белка Noggin, добавляемого на стадиях 3 и 4, с белком нетрин-4 и/или ингибитором ALK 5, добавляемым на стадии 4, на экспрессию a) ngn3, b) PDX-1, c) NeuroD, d) Pax4, e) инсулина и f) глюкагона.
На фиг.12 показан анализ методом ПЦР в реальном времени линии человеческих эмбриональных стволовых клеток H1, дифференцируемых в соответствии со способами, описываемыми в примере 8. Панель a) инсулин, b) глюкагон, c) ngn3, d) NKX2.2, e) NeuroD и f) PDX-1.
На фиг.13 показана стимулированная глюкозой секреция инсулина (Glucose Stimulated Insulin Secretion, GSIS) in vitro в длительно культивируемых культурах стадии 5. Клетки стадии 5, подготовленные в соответствии со способами, описанными в примере 9, стимулировались глюкозой в день a) 6, b) 12 и c) 8-20 дней в культуре стадии 5.
На фиг.14 показан эффект белка нетрин-1 или нетрин-2 на экспрессию эндокринных маркеров. Анализ методом ПЦР в реальном времени линии человеческих эмбриональных стволовых клеток H1, дифференцируемых в соответствии со способами, описываемыми в примере 10.
На фиг.15 показана индукция появления эндокринных маркеров с использованием альтернативного метода индукции образования сформировавшейся эндодермы. Анализ методом ПЦР в реальном времени линии человеческих эмбриональных стволовых клеток H1, дифференцируемых в соответствии со способами, описываемыми в примере 11. Панель a) инсулин, b) глюкагон, c) NKX2.2, d) Pax4, e) PDX-1 и f) NeuroD.
На фиг.16 показана экспрессия различных маркеров на разных стадиях протокола дифференцировки, приведенного на фиг.1, с. Панель a) показана экспрессия CXCR4, определенная методом FACS (сортировкой флуоресцентно-активированных клеток) в клетках H1 на третий день стадии 1. Панель b) Показана экспрессия маркеров, характерных для линии сформировавшейся эндодермы и внеэмбриональной линии, в клетках на третий день стадии 1, измеренная методом ПЦР в реальном времени. Панели c)-n) демонстрируют экспрессию различных генов в клетках, собранных в конце стадий 2-6, измеренную методом ПЦР в реальном времени.
На фиг.17 показано количество клеток на разных стадиях протокола дифференцировки, приведенного на фиг.1, с.
На фиг.18 показана секреция C-пептида клетками в конце стадии 6 протокола дифференцировки, приведенного на фиг.1, c, в ответ на различные стимулы.
На фиг.19 показано содержание в клетках C-пептида и проинсулина в конце стадии 6 протокола дифференцировки, приведенного на фиг.1, c, в сравнении с панкреатическими островками взрослых людей.
На фиг.20 показана экспрессия инсулина (панель a), синаптофизина (панель b) и ко-экспрессия синаптофизина (ось X) и инсулина (ось Y) (панель c) в клетках в конце стадии 6 протокола дифференцировки, приведенного на фиг.1, c.
На фиг.21 показана экспрессия синаптофизина (панели a и c) и инсулина (панели b и d) в конце стадии 6 протокола дифференцировки, приведенного на фиг.1, c, в клетках, обработанных 100 нг/мл белка Chordin вместо белка Noggin на стадиях 3-4.
На фиг.22 показана экспрессия различных маркеров в клетках линии человеческих эмбриональных стволовых клеток H9, обработанных в соответствии с протоколом дифференцировки, приведенным на фиг.1, c. Приведенные данные представляют собой экспрессию a) HNF4a, b) HNF6, c) CDX2, d) PDX-1, e) NKX6.1, f) Pax4, g) NKX2.2, h) NeuroD, i) NGN3, j) PECAM, k) глюкагона и l) инсулина, измеренную методом ПЦР в реальном времени в клетках, собранных в конце стадий 3-6.
На фиг.23 показана экспрессия различных маркеров в клетках линии человеческих эмбриональных стволовых клеток H1, обработанных в соответствии с протоколом дифференцировки, приведенным на фиг.1, c, где клетки были обработаны с помощью B27 или N2. Приведенные данные представляют собой экспрессию a) CDX2, b) глюкагона, c) инсулина и d) PDX-1, измеренную методом ПЦР в реальном времени в клетках, собранных в конце стадий 3-6.
ПОДРОБ