Дифференцировка человеческих эмбриональных стволовых клеток
Иллюстрации
Показать всеИзобретение относится к областям клеточной технологии и молекулярной биологии. Предложен способ стимуляции дифференцировки плюрипотентных стволовых клеток без использования фидерного клеточного слоя, в частности, в панкреатическую эндодерму. Изобретение может быть применено для целей медицины, а именно, транспланталогии. 3 н. и 10 з.п. ф-лы, 53 ил., 36 пр.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к способам стимуляции дифференцировки плюрипотентных стволовых клеток. В частности, настоящее изобретение относится к улучшенному способу создания панкреатической эндодермы, панкреатических гормон-экспрессирующих клеток и панкреатических гормон-секретирующих клеток. Настоящее изобретение также относится к способам стимуляции дифференцировки плюрипотентных стволовых клеток без использования фидерного клеточного подслоя.
Предшествующий уровень техники
Успехи в области клеточно-заместительной терапии сахарного диабета типа I и дефицит островков Лангерганса, необходимых для трансплантации, вызывают все возрастающий интерес к поиску источников инсулин-продуцирующих клеток или β-клеток, подходящих для трансплантации. Одним из подходов к решению этой задачи является генерирование функциональных β-клеток из плюрипотентных стволовых клеток, таких как, например, эмбриональные стволовые клетки.
При эмбриональном развитии позвоночных плюрипотентные клетки преобразуются в группу клеток, содержащих три зародышевых слоя (экдодерма, мезодерма и эндодерма), в процессе, известном как гаструляция. Такие ткани как, например, ткани щитовидной железы, тимуса, поджелудочной железы, кишечника и печени, развиваются из эндодермы через промежуточную стадию. Промежуточной стадией в этом процессе является образование дефинитивной эндодермы. Клетки дефинитивной эндодермы экспрессируют ряд маркеров, таких как HNF-3-бета, GATA4, Mixl1, CXCR4 и Sox-17.
Образование поджелудочной железы происходит в результате дифференцировки дефинитивной эндодермы в панкреатическую эндодерму. Клетки панкреатической эндодермы имеют ген, содержащий панкреатодуоденальный гомеобокс Pdx1. В отсутствие Pdx1 поджелудочная железа не развивается после образования вентральных и дорсальных «почек». Таким образом, экспрессия Pdx1 указывает на критическую стадию органогенеза поджелудочной железы. Помимо клеток других типов, зрелая поджелудочная железа содержит экзокринную ткань и эндокринную ткань. Экзокринные и эндокринные ткани образуются после дифференцировки панкреатической эндодермы.
Сообщалось, что из эмбриональных клеток мышей были получены клетки, несущие характерные признаки островковых клеток. Так, например, в публикации Lumelsky et al. (Science 292:1389, 2001) описана дифференцировка мышиных эмбриональных стволовых клеток в инсулин-секретирующие структуры, аналогичные структурам панкреатических островков. В публикации Soria et al. (Diabetes 49:157, 2000) сообщалось, что инсулин-секретирующие клетки, происходящие от мышиных эмбриональных стволовых клеток, нормализуют уровень сахара в крови у мышей с диабетом, индуцированным стрептозотоцином.
Так, например, в работе Hori et al. (PNAS 99: 16105, 2002) указывается, что обработка мышиных эмбриональных стволовых клеток ингибиторами фосфоинозитид-3-киназы (LY294002) приводит к продуцированию клеток, напоминающих β-клетки.
Другой пример можно найти в публикации Blyszczuk et al. (PNAS 100:998, 2003), где описано генерирование инсулин-продуцирующих клеток из мышиных эмбриональных стволовых клеток, конститутивно экспрессирующих Pax4.
Micallef и сотрудники сообщают, что ретиноевая кислота может регулировать коммитирование эмбриональных стволовых клеток с образованием Pdx1-позитивной панкреатической эндодермы. Ретиноевая кислота является наиболее эффективной в индуцировании экспрессии Pdx1 при ее добавлении к культурам на 4-й день после дифференцировки эмбриональных стволовых клеток, то есть в период времени, соответствующий концу стадии гаструляции в эмбрионе (Diabetes 54:301, 2005).
В работе Miyazaki et al. описана линия мышиных эмбриональных стволовых клеток, сверхэкспрессирующая Pdx1. Результаты, полученные этими исследователями, показали, что экспрессия экзогенного Pdx1 приводит к заметному увеличению уровня экспрессии генов инсулина, соматостатина, глюкокиназы, нейрогенина 3, P48, Pax6 и HNF6 в полученных дифференцированных клетках (Diabetes 53: 1030, 2004).
Skoudy и сотрудниками сообщалось, что активин A (член суперсемейства TGF-β) стимулирует экспрессию экзокринных панкреатических генов (p48 и амилазы) и эндокринных генов (Pdx1, инсулина и глюкагона) в мышиных эмбриональных стволовых клетках. Максимальный эффект наблюдался с использованием 1 нМ активина A. Исследователи также обнаружили, что ретиноевая кислота не оказывает влияния на уровень экспрессии мРНК инсулина и Pdx1, однако обработка 3 нМ FGF7 приводит к повышению уровня транскрипта для Pdx1 (Biochem. J. 379: 749, 2004).
Shiraki и сотрудниками было проведено исследование действия факторов роста, которые специфически стимулируют дифференцировку эмбриональных стволовых клеток в Pdx1-позитивные клетки. Наблюдения этих исследователей показали, что TGF-β2 вызывает воспроизводимое увеличение числа Pdx1-позитивных клеток (Genes Cells. June 2005; 10(6):503-16.).
Gordon и сотрудниками было продемонстрировано индуцирование клеток эндодермы, содержащих brachyury+/HNF-3-beta+, из мышиных эмбриональных стволовых клеток в отсутствие сыворотки и в присутствии активина вместе с ингибитором передачи Wnt-сигнала (US 2006/0003446A1).
В работе Gordon и др. (PNAS, Vol 103, page 16806, 2006) указывается, что: «для генерирования первичной полоски передней доли эмбриона требуется одновременная передача сигнала Wnt и TGF-бета/nodal/активина».
Однако мышиная модель развития эмбриональных стволовых клеток не может точно имитировать программу их развития у высших млекопитающих, таких как, например, человек.
Thomson и сотрудниками были выделены эмбриональные стволовые клетки из человеческих бластоцистов (Science 282:114, 1998). Одновременно, Gearhart и сотрудниками были получены клеточные линии человеческих эмбриональных зародышевых клеток (hEG) из ткани гонады плода (Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998). В отличие от мышиных эмбриональных стволовых клеток, дифференцировка которых может быть предотвращена путем простого культивирования с фактором ингибирования лейкоза (LIF), человеческие эмбриональные стволовые клетки должны поддерживаться только в особых условиях (патент США № 6200806; WO 99/20741; WO 01/51616).
D'Amour и сотрудниками было описано получение обогащенных культур дефинитивной эндодермы, происходящей от человеческих эмбриональных стволовых клеток, в присутствии высокой концентрации активина и низкой концентрации сыворотки (Nature Biotechnology 2005). Трансплантация этих клеток под почечную капсулу мыши приводит к их дифференцировке в более зрелые клетки, имеющие свойства, характерные для некоторых органов эндодермы. Клетки дефинитивной эндодермы, происходящие от человеческих эмбриональных стволовых клеток, могут также дифференцироваться в Pdx1-позитивные стволовые клетки после добавления FGF-10 (US 2005/0266554A1).
D'Amour и сотрудники (Nature Biotechnology-24, 1392-1401 (2006)) сообщают: «Мы разработали способ дифференцировки, который позволяет превращать человеческие эмбриональные стволовые клетки (hES) в эндокринные клетки, способные синтезировать гормоны поджелудочной железы, такие как инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Такой способ имитирует in vivo панкреатический органогенез посредством направления клеток на путь экспрессии эндокринных гормонов посредством прохождения ими фаз, напоминающих фазы образования дефинитивной эндодермы, эндодермы трубки кишечника, эндодермы поджелудочной железы и эндокринного предшественника».
Другой пример можно найти в работе Fisk et al., в которой описана система получения панкреатических островковых клеток из человеческих эмбриональных стволовых клеток (US2006/0040387A1). В этом случае путь дифференцировки подразделяется на три стадии. Человеческие эмбриональные стволовые клетки сначала подвергают дифференцировке в эндодерму с использованием комбинации бутирата натрия и активина А. Затем клетки культивируют с антагонистами TGFβ, такими как Noggin, в комбинации с EGF или бета-целлюлином, в результате чего образуются Pdx1-позитивные клетки. Терминальная стадия дифференцировки была индуцирована никотинамидом.
Еще один пример можно найти в работе Benvenistry и др., где сообщается: «Мы пришли к выводу, что сверхэкспрессия Pdx1 приводит к усилению экспрессии большого числа генов поджелудочной железы, а для индуцирования экспрессии инсулина могут потребоваться дополнительные сигналы, которые присутствуют только in vivo» (Benvenistry et al, Stem Cells 2006; 24:1923-1930).
Поэтому в настоящее время является особенно актуальной разработка условий для получения плюрипотентных стволовых клеточных линий, которые могли бы отвечать всем современным клиническим требованиям, но при этом сохраняли бы свою способность дифференцироваться в панкреатические эндокринные клетки, панкреатические гормон-экспрессирующие клетки или панкреатические гормон-секретирующие клетки. Авторами настоящего изобретения был применен альтернативный подход для повышения эффективности дифференцировки человеческих эмбриональных стволовых клеток в панкреатические эндокринные клетки.
Описание сущности изобретения
В одном из своих вариантов настоящее изобретение относится к способу дифференцировки плюрипотентных стволовых клеток, где указанный способ включает стадии:
a. культивирования плюрипотентных стволовых клеток,
b. дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы,
c. дифференцировки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, и
d. дифференцировки клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки клеток панкреатической эндокринной системы.
В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, подвергают дифференцировке из плюрипотентных стволовых клеток путем обработки плюрипотентных стволовых клеток любым одним из нижеследующих способов, таких как:
a. культивирование плюрипотентных стволовых клеток в среде, содержащей активин А и не содержащей сыворотки, с последующим культивированием указанных клеток с активином А и с сывороткой, а затем с активином А и с сывороткой в другой концентрации, или
b. культивирование плюрипотентных стволовых клеток в среде, содержащей активин А и не содержащей сыворотки, с последующим культивированием указанных клеток с активином А и с сывороткой в другой концентрации, или
c. культивирование плюрипотентных стволовых клеток в среде, содержащей активин А и лиганд Wnt и не содержащей сыворотки, с последующим удалением лиганда Wnt и культивированием указанных клеток с активином А и с сывороткой, или
d. культивирование плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, и культивирование плюрипотентных стволовых клеток с активином А и лигандом Wnt, или
e. культивирование плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом; последующее культивирование плюрипотентных стволовых клеток с активином А и лигандом Wnt в первой культуральной среде, содержащей сыворотку; и культивирование плюрипотентных стволовых клеток с активином А во второй культуральной среде, содержащей сыворотку, или
f. культивирование плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, последующее культивирование плюрипотентных стволовых клеток с активином А и лигандом Wnt в первой культуральной среде, содержащей сыворотку, и культивирование плюрипотентных стволовых клеток с активином А и лигандом Wnt во второй культуральной среде, содержащей сыворотку в другой концентрации.
В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, подвергают дифференцировке из клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, путем обработки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы любым одним из нижеследующих способов, таких как:
a. обработка клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, фактором роста фибробластов и ингибитором пути передачи сигнала хеджехот («hedgehog»), с последующим удалением среды, содержащей фактор роста фибробластов и ингибитор пути передачи сигнала «хеджехот»; и культивирование клеток в среде, содержащей ретиноевую кислоту, фактор роста фибробластов и ингибитор пути передачи сигнала хеджехот, или
b. обработка клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов, или
c. обработка клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой, с последующим удалением ретиноевой кислоты, а затем обработкой клеток по меньшей мере одним фактором роста фибробластов.
В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки клеток панкреатической эндокринной системы, подвергают дифференцировке из клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы любым одним из нижеследующих способов, таких как:
a. культивирование клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы в среде, содержащей DAPT и эксендин 4, с последующим удалением среды, содержащей DAPT и эксендин 4; и культивирование клеток в среде, содержащей эксендин 1, IGF-1 и HGF, или
b. культивирование клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы в среде, содержащей эксендин 4, с последующим удалением среды, содержащей эксендин 4, и культивирование клеток в среде, содержащей эксендин 1, IGF-1 и HGF, или
c. культивирование клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы в среде, содержащей DAPT и эксендин 4, или
d. культивирование клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы в среде, содержащей эксендин 4, или
e. обработка клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы, фактором, ингибирующим путь передачи сигнала Notch, или
f. культивирование клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы в среде, содержащей примерно 10 мМ - 20 мМ глюкозы и эксендин 4.
В одном из своих вариантов настоящее изобретение относится к способу лечения пациента, страдающего диабетом, где указанный способ включает стадии:
a. культивирования плюрипотентных стволовых клеток,
b. дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы,
c. дифференцировки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы,
d. дифференцировки клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, в клетки линии β-клеточной дифференцировки, и
e. имплантации клеток линии β-клеточной дифференцировки указанному пациенту.
Краткое описание графического материала
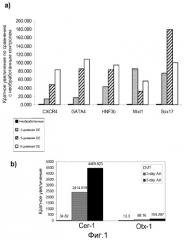
На фигуре 1, панели a, проиллюстрирована экспрессия маркеров дефинитивной эндодермы CXCR4, GATA4, HNF-3-бета, Mix11, Sox-17 в клеточной линии человеческих эмбриональных стволовых клеток H9 после обработки 100 нг/мл активина A в течение двух, пяти и восьми дней. Экспрессию маркеров дефинитивной эндодермы оценивали на мРНК-уровне и нормализовали по уровням экспрессии в необработанных человеческих эмбриональных стволовых клетках. На панели b проиллюстрирована экспрессия маркеров эндодермы передней доли, а именно генов Cerberus, Otx-1 и Hex клеточной линии человеческих эмбриональных стволовых клеток H9 после обработки 100 нг/мл активина A в течение трех и пяти дней.
На фигуре 2 проиллюстрирована экспрессия маркеров дефинитивной эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 после обработки 100 нг/мл активина A в течение пяти дней. Экспрессию маркеров дефинитивной эндодермы оценивали с помощью иммуногистохимического анализа. На панели (a) проиллюстрирована экспрессия Sox-17. На панели (b) проиллюстрирована экспрессия HNF-3-бета. На панели (c) проиллюстрирована экспрессия Oct3/4.
На фигуре 3 проиллюстрирована экспрессия маркеров дефинитивной эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 после проведения постадийной дифференцировки в соответствии с протоколом. Экспрессию маркеров дефинитивной эндодермы оценивали на мРНК-уровне и нормализовали по уровням экспрессии в необработанных человеческих эмбриональных стволовых клетках. На панели (a) проиллюстрирована экспрессия GATA4. На панели (b) проиллюстрирована экспрессия Sox-17. На панели (c) проиллюстрирована экспрессия HNF-3-бета. На панели (d) проиллюстрирована экспрессия Mix11. На графике обозначение “AA” означает обработку активином A в течение одного дня (1d), трех дней (3d), пяти дней (5d) или семи дней (7d). На графике обозначение “UT” означает необработанный контроль, культивированный в течение одного дня (1d), трех дней (3d), пяти дней (5d) или семи дней (7d).
На фигуре 4 проиллюстрирована экспрессия маркеров внеэмбриональной эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 после проведения постадийной дифференцировки в соответствии с протоколом. Экспрессию маркеров внеэмбриональной эндодермы оценивали на мРНК-уровне и нормализовали по уровням экспрессии в необработанных человеческих эмбриональных стволовых клетках. На панели (a) проиллюстрировано влияние 100 нг/мл активина А на экспрессию AFP. На панели (b) проиллюстрировано влияние 100 нг/мл активина А на экспрессию Sox-7. На графике обозначение “AA” означает обработку активином A в течение одного дня (1d), трех дней (3d), пяти дней (5d) или семи дней (7d). На графике обозначение “UT” означает необработанный контроль, культивированный в течение одного дня (1d), трех дней (3d), пяти дней (5d) или семи дней (7d).
На фигуре 5 проиллюстрирована экспрессия маркеров мезодермы и эктодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 после проведения постадийной дифференцировки в соответствии с протоколом. Экспрессию маркеров мезодермы и эктодермы оценивали на мРНК-уровне и нормализовали по уровням экспрессии в необработанных человеческих эмбриональных стволовых клетках. На панели (a) проиллюстрировано влияние 100 нг/мл активина А на экспрессию Brachyury. На панели (b) проиллюстрировано влияние 100 нг/мл активина А на экспрессию Zic1. На графике обозначение “AA” означает обработку активином A в течение одного дня (1d), трех дней (3d), пяти дней (5d) или семи дней (7d). На графике обозначение “UT” означает необработанный контроль, культивированный в течение одного дня (1d), трех дней (3d), пяти дней (5d) или семи дней (7d).
На фигуре 6 проиллюстрирована экспрессия маркеров дефинитивной эндодермы Brachyury (панель а), CXCR4 (панель b), Mix11 (панель c), Sox17 (панель d), HNF-3-бета (панель e), Oct4 (панель f) в клеточной линии человеческих эмбриональных стволовых клеток H7 после обработки 100 нг/мл активина A в течение одного, трех, пяти и семи дней. Экспрессию маркеров дефинитивной эндодермы оценивали на мРНК-уровне и нормализовали по уровням экспрессии в необработанных человеческих эмбриональных стволовых клетках.
На фигуре 7 проиллюстрирована экспрессия маркеров дефинитивной эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 в соответствии с протоколом дифференцировки. Экспрессию маркеров дефинитивной эндодермы оценивали с помощью иммуногистохимического анализа. На панелях (a) и (b) проиллюстрирована экспрессия Sox-17. На панелях (c) и (d) проиллюстрирована экспрессия HNF-3-бета. На панелях (e) и (f) проиллюстрирована экспрессия GATA4. На панелях (b), (d) и (f) проиллюстрировано контрастное окрашивание ядер реагентом DAPI. Столбцы под заголовком «обработанные» относятся к обработке активином А (100 нг/мл) в течение пяти дней. Столбцы под заголовком «необработанные» относятся к необработанному контролю.
На фигуре 8 проиллюстрирована экспрессия маркеров панкреатической эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 в соответствии со вторым протоколом дифференцировки. Экспрессию маркеров панкреатической эндодермы оценивали с помощью ПЦР и нормализовали по уровням экспрессии в человеческих эмбриональных стволовых клетках, обработанных активином A. На панели (a) проиллюстрирована экспрессия Pdx1. На панели (b) проиллюстрирована экспрессия GLUT-2. На панели (c) проиллюстрирована экспрессия PTF1a.
На фигуре 9 проиллюстрирована экспрессия маркеров панкреатической эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 в соответствии со вторым протоколом дифференцировки. Экспрессию маркеров панкреатической эндодермы детектировали с помощью иммуногистохимического анализа. На панели (a) проиллюстрирована экспрессия Pdx1 в необработанном контроле, а на панели (b) проиллюстрирована экспрессия Pdx1 в культуре, обработанной в соответствии с протоколом постадийной дифференцировки.
На фигуре 10 проиллюстрирована экспрессия маркеров панкреатической эндокринной системы в клеточной линии человеческих эмбриональных стволовых клеток H9 в соответствии с третьим протоколом дифференцировки. Экспрессию маркеров панкреатической эндокринной системы оценивали с помощью ПЦР и нормализовали по уровням экспрессии в человеческих эмбриональных стволовых клетках, обработанных активином A. На панели (a) проиллюстрирована экспрессия NeuroD1. На панели (b) проиллюстрирована экспрессия Ngn3. На панели (c) проиллюстрирована экспрессия инсулина. На панели (d) проиллюстрирована экспрессия Hes-1, где уровень экспрессии нормализован по уровню экспрессии в клетках панкреатической эндодермы.
На фигуре 11 проиллюстрирована экспрессия маркеров панкреатической эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 в соответствии с протоколом дифференцировки. Экспрессию маркеров панкреатической эндодермы анализировали с помощью ПЦР и нормализовали по уровням экспрессии в человеческих эмбриональных стволовых клетках, обработанных активином A. На панели (a) проиллюстрирована экспрессия Nkx2.2. На панели (b) проиллюстрирована экспрессия Pdx1.
На фигуре 12 проиллюстрирована экспрессия Pdx 1 в клетках для каждого пассажа (P0, P1 и P2) в культуре. Экспрессию Pdx 1 анализировали с помощью ПЦР и нормализовали по уровням экспрессии в человеческих эмбриональных стволовых клетках Н9, обработанных активином A.
На фигуре 13 проиллюстрирована экспрессия маркеров гепатоцитов в клеточной линии человеческих эмбриональных стволовых клеток H9 в соответствии с третьим протоколом дифференцировки. Экспрессию маркеров гепатоцитов оценивали с помощью ПЦР и нормализовали по уровням экспрессии в человеческих эмбриональных стволовых клетках, обработанных активином A. На панели (a) проиллюстрирована экспрессия AFP. На панели (b) проиллюстрирована экспрессия альбумина.
На фигуре 14 проиллюстрирована экспрессия маркеров плюрипотентности в клеточной линии человеческих эмбриональных стволовых клеток Н9. Экспрессию маркеров плюрипотентности анализировали с помощью иммуногистохимического анализа. На панели (a) проиллюстрирована экспрессия Oct-4. На панели (b) проиллюстрирована экспрессия щелочной фосфатазы.
На фигуре 15 проиллюстрирован кариотип клеточной линии человеческих эмбриональных клеток H9. Кариотип определяли на клетках при пассаже # P36, которые культивировали на фидерных клетках-фибробластах мышиного эмбриона.
На фигуре 16 проиллюстрирована схема протокола дифференцировки согласно изобретению, где человеческие эмбриональные стволовые клетки подвергают дифференцировке в дефинитивную эндодерму в системе, не содержащей фидерного слоя.
На фигуре 17 проиллюстрирован FACS-анализ клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже # 44, культивированных при различных концентрациях матригеля и обработанных небольшим количеством (0,5-2%) сыворотки и большим количеством активина A (100 нг/мл) в течение 5 дней. Экспрессия маркера дефинитивной эндодермы CXCR4 (CD184) представлена на оси Y, а экспрессия маркера ES CD9 представлена на оси X.
На фигуре 18 проиллюстрированы данные ПЦР в реальном времени, полученные для маркеров дефинитивной эндодермы от культур клеточной линии человеческих эмбриональных стволовых клеток Н9 при пассаже 44, культивированных при разведении матригеля (■) 1:10, при разведении матригеля 1:20 или при разведении матригеля (□) 1:30 и обработанных в соответствии с протоколом дифференцировки, описанным в примере 14. Кратность индуцирования приводится по отношению к недифференцированным клеткам клеточной линии человеческих эмбриональных стволовых клеток Н9 при пассаже #44, культивированных в среде, кондиционированной с использованием фибробластов мышиного эмбриона.
На фигуре 19 представлены графики рассеяния для общей экспрессии генов в недифференцированных плюрипотентных стволовых клетках и в клетках дефинитивной эндодермы, полученных в результате дифференцировки плюрипотентных стволовых клеток. Представлены данные для культур клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже # 44, культивированных на фибробластах мышиного эмбриона (правая панель), и при пассаже # 83, культивированных на матригеле (левая панель).
На фигуре 20 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS, на день 5, для клеточной линии человеческих эмбриональных стволовых клеток H1 (панель a), клеточной линии человеческих эмбриональных стволовых клеток H7 (панель b) и клеточной линии человеческих эмбриональных стволовых клеток H9 (панель c), культивированных на фидерных клетках-фибробластах мышиного эмбриона, обработанных в соответствии с протоколом дифференцировки дефинитивной эндодермы, описанным в примере 4.
На фигуре 21 представлены результаты ПЦР в реальном времени для экспрессии указанных маркеров дефинитивной эндодермы в культурах клеточной линии человеческих эмбриональных стволовых клеток H7 (панель a) и клеточной линии человеческих эмбриональных стволовых клеток H9 (панель b), культивированных на фидерных клетках-фибробластах мышиного эмбриона. Результаты выражены как кратное увеличение по сравнению с недифференцированными клетками.
На фигуре 22 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS, на день 5, для клеточной линии человеческих эмбриональных стволовых клеток H1 (панель a), клеточной линии человеческих эмбриональных стволовых клеток H7 (панель b) и клеточной линии человеческих эмбриональных стволовых клеток H9 (панель c), культивированных на матригеле (при разведении 1:30) и обработанных в соответствии с протоколом дифференцировки дефинитивной эндодермы, описанным в примере 4.
На фигуре 23 представлены результаты ПЦР в реальном времени для экспрессии указанных маркеров дефинитивной эндодермы в культурах клеточной линии человеческих эмбриональных стволовых клеток H7 (панель a), клеточной линии человеческих эмбриональных стволовых клеток H9 (панель b) и клеточной линии человеческих эмбриональных стволовых клеток Н1 (панель с). Результаты выражены как кратное увеличение по сравнению с недифференцированными клетками. Клетки обрабатывали методами, описанными в примере 4.
На фигуре 24 проиллюстрирована картина фазово-контрастного окрашивания культур клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже 46 в присутствии 100 нг/мл активина A (панель a) или 100 нг/мл активина A + 20 нг/мл Wnt-3a (панель b). Клетки обрабатывали в течение пяти дней.
На фигуре 25 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS в культурах клеточной линии человеческих эмбриональных стволовых клеток H7 при пассаже 44 (панели a и b) и H9 при пассаже 46 (панели c и d), после обработки методами, описанными в примере 4. На панелях b и d проиллюстрировано влияние 20 нг/мл Wnt-3a на экспрессию CXCR4. На панелях a и c проиллюстрирована экспрессия CXCR4 в отсутствие Wnt-3a. Результаты получены через 5 дней после обработки.
На фигуре 26 приводятся данные ПЦР в реальном времени для экспрессии указанных генов в культурах клеточной линии человеческих эмбриональных стволовых клеток H7 (панель a) и H9 (панель b). Культуры обрабатывали в соответствии с протоколом дифференцировки, описанным в примере 4. Было также протестировано влияние агонистов Wnt, а именно, Wnt-3a (20 нг/мл), Wnt-5a (20 нг/мл) и Wnt-7a (20 нг/мл), как указано на этих панелях. Клетки обрабатывали в течение 5 дней. Результаты выражены как кратность увеличения по сравнению с недифференцированными клетками.
На фигуре 27 проиллюстрирована экспрессия CXCR4 в культурах клеточной линии человеческих эмбриональных стволовых клеток Н9 при пассаже 46, оцениваемая с помощью FACS через пять дней после обработки. На панели (a) проиллюстрирована экспрессия CXCR4 в отсутствие Wnt-3a. На панели (b) проиллюстрирована экспрессия CXCR4 после обработки 10 нг/мл Wnt-3a. На панели (c) проиллюстрирована экспрессия CXCR4 после обработки 20 нг/мл Wnt-3a, а на панели (d) проиллюстрирована экспрессия CXCR4 после обработки 50 нг/мл Wnt-3a.
На фигуре 28 проиллюстрирована экспрессия указанных дефинитивных маркеров в культурах клеточной линии человеческих эмбриональных стволовых клеток H9 после обработки в течение 5 дней. Результаты выражены как кратное увеличение уровня экспрессии по сравнению с уровнем экспрессии в необработанных клетках, как было определено с помощью ПЦР в реальном времени. На панели (a) проиллюстрировано влияние 10, 20 и 50 нг/мл Wnt-3a на экспрессию указанных генов маркеров дефинитивной эндодермы. На панели (b) проиллюстрировано влияние 1, 5 или 10 нг/мл Wnt-3a (цифры по оси x:10, 5, 1) на экспрессию «goosecoid» (■) и CXCR4 (□) на 2-й день (2 d) и 5-й день (5 d) после обработки. На панели (c) проиллюстрировано влияние 1, 5 или 10 нг/мл Wnt-3a на число клеток на 2-й день (■) или 5-й день (□).
На фигуре 29 проиллюстрирована экспрессия CXCR4 в культурах клеточной линии человеческих эмбриональных стволовых клеток H9, оцениваемая с помощью FACS, после 5-дневной обработки в соответствии с протоколом дифференцировки, описанным в примере 4. Клетки культивировали в отсутствие Wnt-3a или ингибитора GSK-3B (панель a), 20 нг/мл Wnt-3a в течение всего 5-дневного периода (панель b), и в присутствии 1000 нМ ингибитора IX GSK-3B в течение всего 5-дневного периода (панель c), 500 нМ ингибитора IX GSK-3B в течение всего 5-дневного периода (панель d), 100 нМ ингибитора IX GSK-3B в течение всего 5-дневного периода (панель e), 10 нМ ингибитора IX GSK-3B в течение всего 5-дневного периода (панель f), 100 нМ ингибитора IX GSK-3B в течение 1-2 дней (панель g), 10 нМ ингибитора IX GSK-3B в течение 1-2 дней (панель h).
На фигуре 30 проиллюстрирована экспрессия гена маркеров дефинитивной эндодермы, оцениваемая с помощью ПЦР в реальном времени. Результаты выражали как кратность увеличения по сравнению с необработанными клетками. На панели (a) представлены данные, полученные для клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже # 48, обработанных в соответствии с протоколом дифференцировки дефинитивной эндодермы, как описано в примере 4, и содержащих Wnt-3a или ингибитор GSK-3B в указанных концентрациях и через указанные промежутки времени. На панели (b) представлены данные, полученные для клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже # 46, обработанных в соответствии с протоколом дифференцировки дефинитивной эндодермы, как описано в примере 4, и содержащих Wnt-3a или ингибитор GSK-3B в указанных концентрациях и через указанные промежутки времени.
На фигуре 31 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS для клеточных линий эмбриональных стволовых клеток, используемых в настоящем изобретении. На панелях (a-d) представлены данные, полученные для клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже #49. На панелях (e-f) представлены данные, полученные для клеточной линии человеческих эмбриональных стволовых клеток H1 при пассаже #46. Данные были получены через 5 дней после обработки. Клетки обрабатывали в следующих условиях: панель (a): 10 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; панель (b): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; панель (c): 100 нг/мл активина A в течение всех пяти дней плюс 100 нМ ингибитора IX GSK-3B в течение первых двух дней; панель (d): 10 нг/мл активина A в течение всех пяти дней плюс 100 нМ ингибитора IX GSK-3B в течение первых двух дней; панель (e): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; и панель (f): 10 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней.
На фигуре 32 проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы, оцениваемая с помощью ПЦР в реальном времени для культур клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже 49, обработанных 10, 50 или 100 нг/мл активина A плюс 20 нг/мл Wnt-3a: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B и POU5F (Oct-4) и панель (b): SOX-17 и GATA4. Результаты выражали как кратность увеличения по сравнению с необработанными клетками.
На фигуре 33 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS для клеточных линий эмбриональных стволовых клеток Н9 при пассаже 53. Данные были получены через 5 дней после обработки. Клетки обрабатывали в следующих условиях: панель (a): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней и 25 нг/мл BMP-4 в течение 3-5 дней; панель (b): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; панель (c): 100 нг/мл активина A в течение всех пяти дней плюс 100 нМ ингибитора IX GSK-3B в течение первых двух дней; панель (d): 20 нг/мл Wnt-3a + 25 нг/мл BMP-4 в течение всех пяти дней; панель (e): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a + 100 нМ ингибитора IX GSK-3B в течение первых двух дней; и панель (f): 100 нг/мл активина A + 25 нг/мл BMP-4 в течение всех пяти дней. Для всех панелей на оси X представлена экспрессия CD9, а на оси Y представлена экспрессия CXCR4 (CD184).
На фигуре 34 проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы, оцениваемая с помощью ПЦР в реальном времени для культур клеточной линии человеческих эмбриональных стволовых клеток H1 при пассаже 46, обработанных 10 или 100 нг/мл активина A плюс 20 нг/мл Wnt-3a или 100 нМ ингибитора IX GSK-3B: панель (a): экспрессия AFP, Bry, CXCR4, GSC и POU5F (Oct-4) и панель (b): SOX-17, HNF-3B и GATA4. Результаты выражали как кратность увеличения по сравнению с необработанными клетками.
На фигуре 35 проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы, оцениваемая с помощью ПЦР в реальном времени для культур клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже 49, обработанных 50 или 100 нг/мл активина A плюс 10 или 100 нМ ингибитора GSK-3B: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B и POU5F (Oct-4) и панель (b): SOX-17 и GATA4. Результаты выражали как кратность увеличения по сравнению с необработанными клетками.
На фигуре 36 проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы, оцениваемая с помощью ПЦР в реальном времени для культур клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже 53, обработанных комбинациями активина A, Wnt-3a, ингибитора GSK-3B и BMP-4 в течение пяти дней: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B и SOX7 и панель (b): SOX-17, HNF-3B и GATA4.
На фигуре 37 указаны проценты уровней экспрессии CXCR4, определенные с помощью FACS, в культурах клеточной линии человеческих эмбриональных стволовых клеток H9, обработанных в условиях, описанных в примере 22.
На фигуре 38 проиллюстрирована экспрессия маркеров дефинитивной эндодермы, оцененная с помощью FACS, в культурах клеточной линии человеческих эмбриональных стволовых клеток H9, культивированных на фибронектине (панель a) или на матригеле MATRIGELTM (панель b).
На фигуре 39 проиллюстрирована экспрессия маркеров дефинитивной эндодермы, оцененная с помощью ПЦР в реальном времени, в культурах клеточной линии человеческих эмбриональных стволовых клеток H9, культивированны