Выделенные популяции миелоподобных клеток и способы лечения с использованием таких популяций
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению миелоподобных клеток, и может быть использовано в медицине. Популяцию клеток выделяют из периферической крови или из крови пуповины способом, включающим положительную селекцию клеток из периферической крови или из крови пуповины, которые способны к иммунному взаимодействию с антителом, выбранным из группы, состоящей из анти-CD44, анти-CD11b и их сочетания. Выделенная популяция миелоподобных клеток содержит клетки, экспрессирующие антиген CD44, антиген CD11b и индуцируемый гипоксией фактор 1α (HIF-1α). Полученную популяцию используют для восстановления и стабилизации функциональной сосудистой сети, стимуляции образования микроглиальных клеток и для стимуляции физиологической внутрисетчаточной васкуляризации гипоксической ткани сетчатки при одновременном подавлении формирования аномальных преретинальных сосудов. Изобретение позволяет получить клетки с сосудисто-трофической и нейротрофической активностью, которые обладают значительным терапевтическим потенциалом при внутриглазном введении млекопитающему, страдающему от дегенеративного заболевания глаза. 4 н. и 3 з.п. ф-лы, 63 ил., 3 табл., 21 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка является частичным продолжением международной заявки на патент № PCT/US2006/06411, поданной 24 февраля 2006 г., по которой испрашивается приоритет по предварительной патентной заявке США №60/656037, поданной 24 февраля 2005 г. и включенной в данное описание в качестве ссылки.
СПРАВКА О ГОСУДАРСТВЕННЫХ ВЛОЖЕНИЯХ
Часть описанной в данном документе работы была проведена при поддержке грантов EY11254, EY12598, EY13916 и EY14174, выданных Национальным институтом глаза, относящимся к Национальным институтам здравоохранения. Правительство Соединенных Штатов имеет определенные права на данное изобретение.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к выделенным клеткам млекопитающих. Более конкретно, данное изобретение относится к популяциям выделенных клеток, которые имеют характерные особенности миелоидных клеток и могут внедряться в сосудистую сеть сетчатки после введения в стекловидное тело глаза. Данное изобретение также относится к способам лечения дегенеративных заболеваний глаза путем введения миелоподобных клеток в глаз млекопитающего.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Возрастная дегенерация желтого пятна (ARMD) и диабетическая ретинопатия (DR), приводящие к аномальному образованию новых сосудов в сетчатке, являются основными причинами потери зрения у населения стран с развитой промышленностью. Поскольку сетчатка состоит из четко определенных слоев нейронных, глиальных и сосудистых элементов, относительно небольшие нарушения, такие как наблюдающиеся при пролиферации сосудов или отеке, могут приводить к значительной потере зрительной функции. Наследственные дегенеративные заболевания сетчатки, такие как пигментная дегенерация сетчатки (RP), также связаны с сосудистыми аномалиями, такими как сужение артериол и атрофия сосудов. Большинство наследственных дегенеративных заболеваний сетчатки человека специфически поражают палочковидные фоторецепторы, но также сопровождаются утратой колбочек, основным клеточным компонентом пятнышка, участка сетчатки у людей, который отвечает за центральную, тонкую остроту зрения. Недавно описаны колбочко-специфичные факторы выживания (Mohand-Said et al., 1998, Proc. Natl. Acad. Sci USA, 95: 8357-8362), которые могут облегчить выживание колбочек у мышиных моделей дегенерации сетчатки.
Наследственные дегенеративные заболевания сетчатки поражают до 1 субъекта из 3500 и характеризуются прогрессирующей ночной слепотой, уменьшением поля зрения, атрофией оптического нерва, утоньшением артериол, изменением проницаемости сосудов и утратой центрального зрения, часто прогрессирующей до полной слепоты (Heckenlively, J. R., editor, 1988; Retinitis Pigmentosa, Philadelphia: JB Lippincott Co.). Молекулярный генетический анализ данных заболеваний, проведенный для относительно небольшого числа известных пораженных субъектов, позволил идентифицировать мутации более чем в 110 различных генах (Humphries et al., 1992, Science 256:804-808; Farrar et al., 2002, EMBO J. 21:857-864). Многие из этих мутаций связаны с ферментными и структурными компонентами механизма фотопреобразования, включающими родопсин, фосфодиэстеразу цГМФ, периферин rds и RPE65. Несмотря на указанные наблюдения еще не существуют эффективные способы лечения, позволяющие замедлить или прекратить развитие этих дегенеративных заболеваний сетчатки. Последние достижения в генной терапии привели к успешному устранению фенотипов rds (Ali et al 2000, Nat. Genet. 25:306-310) и rd (Takahashi et al., 1999, J. Virol. 73:7812-7816) у мышей и фенотипа RPE65 у собак (Acland et al., 2001, Nat. Genet. 28:92-95), после доставки трансгена дикого типа к фоторецепторам или пигментированному эпителию сетчатки (RPE) животных, несущих специфическую мутацию.
Давно известно, что популяция стволовых клеток существует в кровотоке и костном мозге нормальных взрослых субъектов. Разные субпопуляции этих клеток могут дифференцироваться по гематопоэтической положительной (Lin+) или отрицательной (Lin-) линиям дифференцировки. Кроме того, недавно было показано, что популяция гематопоэтических стволовых клеток отрицательной линии дифференцировки (HSC) содержит предшественники эндотелиальных клеток (EPC), способные формировать кровеносные сосуды in vitro и in vivo (See Asahara et al. 1997, Science 275: 964-7). Данные клетки могут участвовать в нормальном и патологическом постнатальном ангиогенезе (см. Lyden et al., 2001 Nat. Med. 7, 1194-201; Kalka et al., 2000, Proc. Natl. Acad. Sci U.S.A. 97:3422-7; и Kocher et al., 2001, Nat. Med. 7: 430-6), а также дифференцироваться в ряд неэндотелиальных клеточных типов, включающих гепатоциты (см. Lagasse et al., 2000, Nat. Med. 6:1229-34), микроглию (см. Priller et al. 2002 Nat. Med. 7:1356-61), кардиомиоциты (см. Orlic et al., 2001, Proc. Natl. Acad. ScL U.S.A. 98: 10344-9) и эпителиальные клетки (см. Lyden et al., 2001, Nat. Med. 7: 1194-1201). Хотя такие клетки используют в нескольких экспериментальных моделях ангиогенеза, механизм направления EPC к участку образования новых сосудов неизвестен, и не разработана стратегия, позволяющая эффективно увеличивать число клеток, которые вносят вклад в конкретную сосудистую сеть.
Гематопоэтические стволовые клетки костного мозга в настоящее время являются единственным типом стволовых клеток, широко используемым для терапевтического применения. HSC костного мозга используют для трансплантации в течение 40 лет. В настоящее время исследуется возможность применения усовершенствованных методов сбора очищенных стволовых клеток для разработки способов лечения лейкоза, лимфомы и наследственных заболеваний крови. На ограниченном числе пациентов-людей исследуется возможность клинического применения стволовых клеток для лечения диабета и запущенного рака почки у человека.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает популяцию миелоподобных клеток, полученную путем положительной селекции клеток, экспрессирующих CD44, CD11b и индуцируемый гипоксией фактор 1α (HIF-1α), выделенную из костного мозга млекопитающих. Такие клетки обладают полезной сосудисто-трофической и нейротрофической активностью при внутриглазном введении млекопитающему, в частности млекопитающему, страдающему дегенеративным заболеванием глаза. Популяцию миелоподобных клеток по данному изобретению можно выделить путем обработки клеток костного мозга (например, клеток костного мозга человека) антителом против CD44 (рецептор гиалуроновой кислоты), антителом против CD11b, антителом против CD33, CD14, или сочетанием антител против указанных антигенов, причем положительно отбираются клетки, которые способны к иммунному взаимодействию с антителом или антителами, в зависимости от обстоятельств (для разделения клеток используют, например, проточную цитометрию или гранулы, покрытые антителами, или связанные с антителами). Такие клетки, полученные из костного мозга, в данном описании называют миелоподобные клетки костного мозга (MLBM). Альтернативно, популяции миелоподобных клеток по данному изобретению можно выделить из периферической крови (например, из периферической крови человека) или из крови пуповины (например, из крови пуповины человека). Большая часть клеток из популяции миелоподобных клеток по данному изобретению экспрессирует антиген CD44, антиген CD11b и индуцируемый гипоксией фактор 1α (HIF-1α).
Настоящее изобретение также предлагает способ лечения сосудисто-трофических и нейротрофических заболеваний сетчатки у млекопитающего. Способ включает введение выделенных клеток из популяции миелоподобных клеток в больной глаз млекопитающего, предпочтительно, путем внутриглазной инъекции. Предпочтительно, популяция миелоподобных клеток является аутологичной по отношению к млекопитающему, подлежащему лечению (т.е., популяцию миелоподобных клеток выделяют из костного мозга, периферической крови или крови пуповины млекопитающего, подлежащего лечению). Способ лечения по настоящему изобретению уменьшает дегенерацию сосудов и фоторецепторных нейронов в сетчатке млекопитающего, страдающего заболеванием глаза. Клетки вводят в количестве, достаточном для замедления сосудистой и невральной дегенерации сетчатки. Благоприятный эффект оказывает внедрение клеток из популяции миелоподобных клеток в сосудистую сеть сетчатки, хотя в то же время они внедряются в нейронную сеть, уменьшая дегенерацию колбочек в сетчатке. Выделенная популяция миелоподобных клеток млекопитающих содержит клетки, которые селективно воздействуют на активированные астроциты сетчатки при введении в стекловидное тело глаза и остаются стабильно внедренными в сеть новообразованных сосудов и нейронную сеть глаза. Предпочтительно, млекопитающее представляет собой человека.
В предпочтительном воплощении, по меньшей мере, приблизительно 75 процентов клеток выделенной популяции миелоподобных клеток экспрессирует CD44, более предпочтительно, по меньшей мере, приблизительно 90 процентов.
В одном предпочтительном воплощении клетки из популяции миелоподобных клеток трансфицируют терапевтически полезным геном. Например, в способе клеточной генотерапии клетки можно трансфицировать полинуклеотидами, функционально кодирующими нейротрофические средства или антиангиогенные средства, которые селективно воздействуют на новообразованную сосудистую сеть и ингибируют образование новых сосудов, не влияя на уже существующие сосуды. В одном воплощении выделенная популяция миелоподобных клеток по данному изобретению включает ген, который кодирует пептид, ингибирующий ангиогенез. Ангиогенез-ингибирующие клетки из популяции миелоподобных клеток можно использовать для модуляции аномального роста кровеносных сосудов при таких заболеваниях, как ARMD, DR и некоторые дегенеративные заболевания сетчатки, связанные с аномальной сосудистой сетью. В другом предпочтительном воплощении выделенные клетки из популяции миелоподобных клеток по настоящему изобретению трансфицируют геном, кодирующим нейротрофический пептид. Нейротрофические трансфицированные миелоподобные клетки можно использовать для спасения нейронов при глазных заболеваниях, включающих нейронную дегенерацию сетчатки, таких как глаукома, пигментная дегенерация сетчатки и т.п.
Конкретным преимуществом способов лечения глазных заболеваний выделенной популяцией миелоподобных клеток по настоящему изобретению является эффект сосудисто-трофического и нейротрофического спасения, наблюдающийся в глазах, обработанных через стекловидное тело клетками из популяции миелоподобных клеток. Нейроны и фоторецепторы сетчатки, в особенности колбочки, сохраняются, и в глазах, обработанных клетками из популяции миелоподобных клеток по данному изобретению, в некоторой степени сохраняется зрительная функция.
Настоящее изобретение также предлагает способ выделения популяции миелоподобных клеток из костного мозга путем негативной селекции по клеточному маркеру. Данный способ включает контактирование совокупности клеток костного мозга с антителами, специфичными к Ter119, CD45RB220 и CD3e, удаление из совокупности клеток костного мозга клеток, способных к иммунному взаимодействию с антителами против Ter119, CD45RB220 и CD3e, и выделение миелоподобных клеток костного мозга, которые не содержат клеток, экспрессирующих Ter119, CD45RB220 и CD3e. С помощью данного способа можно выделить популяцию клеток, в которой более 90 процентов клеток экспрессируют CD44.
Предпочтительно, если больная сетчатка, подлежащая лечению с помощью популяции миелоподобных клеток и способов по данному изобретению, содержит активированные астроциты. Этого можно достичь путем ранней обработки глаза, когда присутствует ассоциированный глиоз, или путем стимуляции локальной пролиферации активированных астроцитов с помощью лазера.
Помимо терапевтического применения выделенные популяции миелоподобных клеток костного мозга по данному изобретению можно использовать в качестве инструментов исследования физиологии развития сосудов глаза, а также для доставки конкретных генов к конкретным участкам (например, к астроцитам) глаза. Такое применение является ценным инструментом для исследования функции гена и потенциальных терапевтических механизмов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
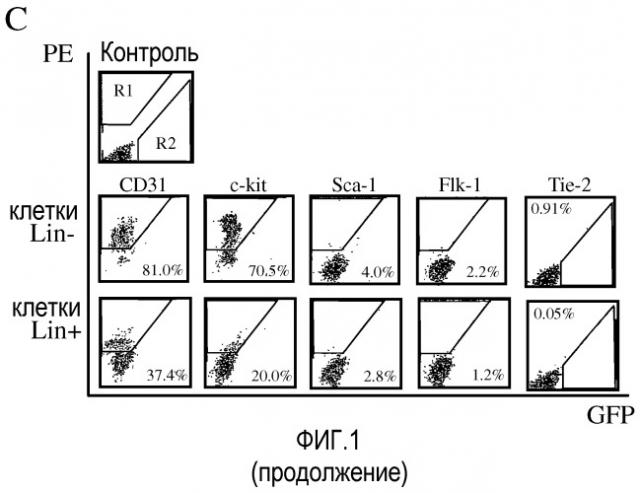
На фиг.1 изображены схематические диаграммы развития сетчатки мыши. (a) Развитие первичного сплетения. (b) Вторая фаза образования сосудов сетчатки. GCL - слой ганглионарных клеток; IPL - внутренний плексиформный (сплетениевидный) слой; INL - внутренний нуклеарный слой; OPL - наружный плексиформный слой; ONL - наружный нуклеарный (зернистый) слой; RPE - пигментный эпителий сетчатки; ON - зрительный нерв; P - периферия. В разделе (c) приведены результаты анализа методом проточной цитометрии разделенных клеток костного мозга Lin+HSC и Lin-HSC. Верхний ряд: гистограмма распределения немеченных антителом клеток, где R1 обозначает область измеримого селектируемого положительного PE-окрашивания; R2 обозначает GFP-положительную область. Средний ряд: клетки Lin-HSC (C57B/6); и нижний ряд: клетки Lin+HSC (C57B/6), где все клеточные линии помечены PE-конъюгированными антителами против Sca-1, c-kit, Flk-1/KDR, CD31. Данные Tie-2 получают с использованием мышей Tie-2-GFP. Проценты указывают долю меченных клеток во всей популяции Lin-HSC или Lin+HSC.
Фиг.2 иллюстрирует приживление Lin-HSC на развивающейся сетчатке мыши. (a) Через четыре дня после введения (P6) в стекловидное тело клетки eGFP+ Lin-HSC присоединяются к сетчатке и дифференцируются. (b) Lin-HSC (мыши B6.129S7-Gtrosa26, окрашенные антителом против β-gal) размещаются впереди сосудистой сети, окрашенной антителом против коллагена IV (звездочка указывает на оконечность сосудистой сети). (c) Большая часть клеток Lin+HSC (eGFP+) через четыре дня после инъекции (P6) не способна дифференцироваться. (d) Мезентериальные мышиные eGFP+ EC через четыре дня после инъекции (P6). (e) Lin-HSC (eGFP+), введенные в глаза взрослых мышей. (f) Небольшое накопление eGFP+ Lin-HSC (стрелки), перемещающихся к существующей астроцитарной матрице трансгенной мыши GFAP-GFP и дифференцирующихся по данному пути. (g) Повышенное накопление ассоциации клеток Lin- (eGFP) и исходных астроцитов (стрелки). (h) Трансгенный контроль, не получающий GFAP-GFP. (I) Через четыре дня после инъекции (P6) eGFP+ Lin-HSC мигрируют к области будущего глубокого сплетения и подвергаются дифференциации. В левой части показана активность Lin-HSC в целой закрепленной сетчатке; в правой части показано расположение клеток Lin- (стрелки) в сетчатке (вверху сторона, обращенная к стекловидному телу, внизу сторона, обращенная к склере), (j) Двойное мечение антителами против α-CD31-PE и α-GFP-alexa 488. Через семь дней после введения клетки Lin-HSC (eGFP, красный) внедряют в сосудистую сеть (CD31). Стрелки указывают участки внедрения. (k) Клетки eGFP+ Lin-HSC образуют сосуды через четырнадцать дней после введения (P17). (l и m) Введение родамин-декстрана в сердце показывает, что сосуды являются интактными и функциональными как в первичном (l), так и в глубоком сплетении (m).
На фиг.3 показано, что клетки eGFP+ Lin-HSC перемещаются к участку глиоза (определяемому по GFAP-экспрессирующим астроцитам, крайнее левое изображение), индуцированного либо лазерным (a), либо механическим (b) повреждением взрослой сетчатки (звездочка указывает поврежденный участок). На крайних правых изображениях видно повышенное скопление, демонстрирующее тесную связь Lin-HSC с астроцитами. Калибровочная шкала=20 мкМ.
На фиг.4 показано, что клетки that Lin-HSC восстанавливают сосудистую сеть мыши с дегенерацией сетчатки. (a-d) Сетчатки на 27 день после инъекции (P33) с окрашиванием коллагеном IV; (a) и (b) сетчатки, обработанные клетками Lin-HSC (Balb/c): отсутствует отличие от сосудистых сетей нормальных мышей FVB; (c) и (d) сетчатки, обработанные клетками Lin-HSC (Balb/c): густая сосудистая сеть, аналогичная сосудистой сети мышей дикого типа; (a) и (c) замороженные срезы целой сетчатки (вверху сторона, обращенная к стекловидному телу, внизу сторона, обращенная к склере) с окрашиванием DAPI; (b) и (d) глубокое сплетение в тотальном препарате сетчатки; (e) столбчатая диаграмма, иллюстрирующая увеличение васкуляризации глубокого сосудистого сплетения, образованного в сетчатках, обработанных клетками Lin-HSC (n=6). Степень глубокой васкуляризации определяют путем вычисления общей длины сосудов в каждом изображении. Сравнивают общую длину сосудов/область высокой мощности (в микронах) для Lin-HSC, Lin+HSC или контрольных сетчаток. (f) Сравнение длины глубокого сосудистого сплетения после введения клеток Lin-HSC (R - правый глаз) или Lin+HSC (L - левый глаз) мыши rd/rd. Показаны результаты, полученные от шести независимых мышей (каждый цвет обозначает независимую мышь), (g) и (h) Клетки Lin-HSC (Balb/c) также восстанавливают сосудистую сеть rd/rd после введения в глаза P15. Показано промежуточное и глубокое сосудистое сплетение в сетчатках, обработанных клетками Lin-HSC (G) или Lin+HSC (H) (через месяц после введения).
На фиг.5 приведены микрофотографии ткани сетчатки мыши: (a) тотальный препарат глубокого слоя сетчатки (мышь rd/rd), пятый день после инъекции (P11) с визуализацией eGFP+ Lin-HSC (серый), (b) и (c) сосудистая сеть сетчатки P60 мышей Tie-2-GFP (rd/rd), получающих клетки Lin- Balb/c (b) или инъекцию клеток Lin+HSC (c) на P6. В левых секциях (b) и (c) видны только эндогенные эндотелиальные клетки (окрашенные GFP). В средних секциях (b) и (c) показаны клетки, окрашенные антителом против CD31; стрелки указывают сосуды, окрашенные CD31, но не GFP, в правых секциях (b) и (c) показаны клетки, окрашенные и GFP и CD31. (d) Окрашивание α-SMA сетчатки, обработанной клетками Lin-HSC (левая секция), и контрольной сетчатки (правая секция).
На фиг.6 показано, что T2-TrpRS-трансфицированные Lin-HSC ингибируют развитие сосудистой сети мышиной сетчатки. (a) Схематическое изображение человеческих TrpRS, T2-TrpRS и T2-TrpRS, содержащих на амино-концах сигнальную последовательность Igk. (b) Сетчатки, обработанные клетками Lin-HSC, трансфицированными T2-TrpRS, экспрессируют белок T2-TrpRS in vivo. (1) Рекомбинантный T2-TrpRS, полученный в E. coli; (2) Рекомбинантный T2-TrpRS, полученный в E. coli; (3) Рекомбинантный T2-TrpRS, полученный в E. coli; (4) контрольная сетчатка; (5) сетчатка, обработанная Lin-HSC+pSecTag2A (только вектор); (6) сетчатка, обработанная Lin-HSC+pKLe135 (Igk-T2-TrpRS в pSecTag). (a) Эндогенный TrpRS. (b) Рекомбинантный T2-TrpRS. (c) T2-TrpRS сетчатки, обработанные клетками Lin-HSC. (c-f) Типичные первичные (поверхностные) и вторичные (глубокие) сплетения сетчаток через семь дней после инъекции. (c) и (d) Глаза, обработанные клетками Lin-HSC, трансфицированными пустой плазмидой, развиваются нормально. (e) и (f) В большинстве глаз, обработанных клетками Lin-HSC, трансфицированными T2-TrpRS, наблюдается ингибирование образования глубокого сплетения. (c) и (e) Первичное (поверхностное) сплетение. (d) и (f) вторичное (глубокое) сплетение). Слабое очертание сосудов, наблюдающееся в секции (f), обусловлено "проступающими" изображениями первичной сети сосудов, показанными в секции (e).
На фиг.7 показана последовательность ДНК, кодирующая His6-меченный T2-TrpRS, SEQ ID NO: 1.
На фиг.8 показана аминокислотная последовательность His6-меченного T2-TrpRS, SEQ ID NO: 2.
На фиг.9 показаны микрофотографии и электроретинограммы (ERG) сетчаток мышей, глаза которых были обработаны Lin-HSC и Lin+HSC (контроли).
На фиг.10 изображены статистические графики, отражающие взаимозависимость восстановления нейронов (ось y) и восстановления сосудов (ось x) для промежуточных (Int.) и глубоких сосудистых слоев глаз мышей rd/rd, обработанных Lin-HSC.
На фиг.11 изображены статистические графики, отражающие отсутствие корреляции между восстановлением нейронов (ось y) и восстановлением сосудов (ось x) для глаз мышей rd/rd, обработанных Lin+HSC.
На фиг.12 изображена столбчатая диаграмма, отражающая длину сосудов (ось y), выраженную в произвольных относительных единицах, для глаз мышей rd/rd, обработанных Lin-HSC (темные столбики), и для необработанных глаз мышей rd/rd (светлые столбики) через 1 месяц (1M), 2 месяца (2M) и 6 месяцев (6M) после введения.
Фиг.13 включает три столбчатых диаграммы, отражающих число ядер во внешнем нейронном слое (ONR) мышей rd/rd через 1 месяц (1M), 2 месяца (2M) и 6 месяцев (6M) после введения, и демонстрирует значительное увеличение числа ядер в глазах, обработанных Lin-HSC (темные столбики), по сравнению с контрольными глазами, обработанными Lin+HSC (светлые столбики).
На фиг.14 изображены графики, отражающие число ядер во внешнем нейронном слое отдельных мышей rd/rd и сравнивающие правый глаз (R, обработанный Lin-HSC) с левым глазом (L, контрольный глаз, обработанный Lin+HSC) в моменты времени (после инъекции) 1 месяц (1M), 2 месяца (2M) и 6 месяцев (6M); каждая линия в конкретном графике сравнивает глаза отдельной мыши.
На фиг.15 изображены изменения в сосудистой сети и нервных клетках сетчатки мышей rd1/rd1 (C3H/HeJ, левые секции) или мышей дикого типа (C57BL/6, правые секции). Показана сосудистая сеть промежуточных (верхние панели) или глубоких (средние панели) плексиформных слоев в тотальных препаратах сетчатки (красный: коллаген IV, зеленый: CD31) и срезах (красный: DAPI, зеленый: CD31, нижние секции) тех же препаратов сетчатки (P: день после родов). (GCL: слой ганглионарных клеток, INL: внутренний нуклеарный слой, ONL: внешний нуклеарный слой).
На фиг.16 показано, что введение Lin-HSC останавливает дегенерацию нервных клеток у мышей rd1/rd1. (A, B и C) сосудистая сеть сетчатки в промежуточных (Int.) или глубоких плексиформных слоях и срезах глаза, обработанного Lin-HSC (правые секции), и противоположного глаза, обработанного контрольными клетками (CD31-) (левые секции), в моменты P30 (A), P60 (B) и P180 (C). (D) Средняя общая длина сосудистой сети (+ или - стандартная ошибка среднего значения) в сетчатках, обработанных Lin-HSC или контрольными клетками (CD31"), в моменты P30 (слева, n=10), P60 (посередине, n=10) и P180 (справа, n=6). Данные, полученные для промежуточного (Int.) и глубокого плексиформного слоев, показаны раздельно (ось Y: относительная длина сосудистой сети). (E) Среднее число клеточных ядер в ONL сетчаток, обработанных контрольными клетками (CD31-) или Lin-HSC, в моменты P30 (слева, n=10), P60 (посередине, n=10) или P180 (справа, n=6) (ось Y: относительное число клеточных ядер в ONL). (F) Линейная корреляция между длиной сосудистой сети (ось X) и числом клеточных ядер в ONL (ось Y) сетчаток, обработанных Lin-HSC или контрольными клетками, в моменты P30 (слева), P60 (посередине) и P180 (справа).
На фиг.17 показано, что функция сетчатки восстанавливается под воздействием Lin-HSC. Электроретинографические (ERG) кривые используют для измерения функции сетчаток, обработанных Lin-HSC или контрольными клетками (CD31"). (A и B) Типичные случаи восстановленных и не восстановленных сетчаток через 2 месяца после введения. Показаны срезы сетчатки правого глаза, обработанного Lin-HSC (A), и левого глаза того же животного, обработанного контрольными клетками CD31- (B) (зеленый: сосудистая сеть, окрашенная CD31, красный: ядра, окрашенные DAPI). (C) Результаты ERG животного, используемого для получения данных, представленных в секциях (A) и (B).
На фиг.18 показано, что популяция человеческих клеток костного мозга может восстановить дегенерирующую сетчатку у мыши rd1 (A-C). Восстановление также наблюдается у другой модели дегенерации сетчатки, rd10 (D-K). (A) Человеческие Lin-HSC (hLin-HSC), меченные зеленым красителем, могут дифференцироваться в клетки сосудов сетчатки после введения в стекловидное тело мышей C3SnSmn.CB17-Prkdc SCID. (B и C) Сосудистая сеть сетчатки (левые секции; вверху: промежуточный плексиформный слой, внизу: глубокий плексиформный слой) и нервные клетки (правая секция) в глазу, обработанном hLin-HSC (B), или в противоположном контрольном глазу (C) через 1,5 месяца после инъекции. (D-K) Восстановление мышей rd10 под воздействием Lin-HSC (введенных на P6). Типичные сетчатки показаны в моменты P21 (D: Lin-HSC, H: контрольные клетки), P30 (E: Lin-HSC, I: контрольные клетки), P60 (F: Lin-HSC, J: контрольные клетки) и P105 (G: Lin-HSC, K: контрольные клетки) (для каждого момента времени обработанные и контрольные глаза принадлежат одному животному). Сосудистую сеть сетчатки (на верхнем изображении в каждой секции представлен промежуточный плексиформный слой; на среднем изображении в каждой секции представлен глубокий плексиформный слой) окрашивают CD31 (зеленый) и коллагеном IV (красный). На нижнем изображении в каждой секции показан поперечный срез, полученный из той же сетчатки (красный: DAPI, зеленый: CD31).
На фиг.19 показано, что кристаллин αA подвергается повышающей регуляции в восстановленных клетках внешнего нуклеарного слоя после обработки Lin-HSC, но не в противоположных глазах, обработанных контрольными клетками. Левая панель: IgG контроль в восстановленной сетчатке, средняя панель: кристаллин αA в восстановленной сетчатке, правая панель: кристаллин αA в невосстановленной сетчатке.
На фиг.20 приведены таблицы генов, которые подвергаются повышающей регуляции в сетчатках мыши, обработанных Lin-HSC по настоящему изобретению. (A) Гены, экспрессия которых в сетчатках мыши повышается в 3 раза после обработки мышиными Lin-HSC. (B) Гены кристаллина, которые подвергаются повышающей регуляции в сетчатках мыши, обработанных мышиными Lin-HSC. (C) Гены, экспрессия которых в сетчатках мыши повышается в 2 раза после обработки человеческими Lin-HSC. (D) Гены нейротрофических факторов или факторов роста, экспрессия которых подвергается повышающей регуляции в сетчатках мыши, обработанных человеческими Lin-HSC.
Фиг.21 иллюстрирует распределение поверхностных антигенов CD31 и интегрина α6 на CD133-положительных (DC133+) и CD133-отрицательных (CD133-) человеческих популяциях Lin-HSC. В левых секциях приведены диаграммы рассеяния, полученные методом проточной цитометрии. В центральных и правых секциях приведены гистограммы, демонстрирующие уровень экспрессии специфического антитела на клеточной популяции. Ось Y соответствует числу событий, а ось X соответствует интенсивности сигнала. Если закрашенная гистограмма сдвинута вправо от незакрашенной (контрольной) гистограммы, это означает, что флуоресцентный сигнал имеет повышенную интенсивность, а уровень экспрессии антитела выше фонового.
Фиг.22 иллюстрирует постнатальное развитие сетчатки у мышей дикого типа C57/B16, выращиваемых в атмосфере с нормальным содержанием кислорода (нормоксия) в период P0-P30 после родов.
Фиг.23 иллюстрирует индуцированную кислородом модель ретинопатии у мышей C57/B16, выращиваемых в атмосфере с высоким содержанием кислорода (гипероксия; 75% кислорода) в период P7-P12 с последующим периодом нормоксии в течение P12-P17.
Фиг.24 демонстрирует восстановление сосудов после обработки популяциями Lin-HSC у модели индуцированной кислородом ретинопатии (OIR).
На фиг.25 показаны восстановленные фоторецепторы внешнего нуклеарного слоя (ONL) мышей rd1 после введения Lin-HSC в стекловидное тело, которые преимущественно представляют собой колбочки. Небольшой процент фоторецепторов сетчатки мышей дикого типа (верхняя секция) представляет собой колбочки, что подтверждается экспрессией красного/зеленого опсина колбочек (A), тогда как большая часть клеток ONL является положительной по специфичному для палочек родопсину (B). После обработки неиммунной сывороткой наблюдается аутофлуоресценция сосудистой сети сетчатки (C), однако нуклеарные слои совсем не окрашиваются опсинами, специфичными для палочек или колбочек. Сетчатки мышей rd/rd (нижние секции) имеют уменьшенный внутренний нуклеарный слой и почти полностью атрофированный ONL, причем оба указанных слоя являются отрицательными по опсину колбочек (D) или палочек (секция G). Контрольные глаза, обработанные CD31-HSC, идентичны необработанным сетчаткам rd/rd и не окрашиваются опсином колбочек (E) или палочек (H). Противоположные глаза, обработанные Lin-HSC, имеют значительно уменьшенный, но явно присутствующий ONL, который преимущественно состоит из колбочек, что доказывается положительной иммунореактивностью по отношению к красному/зеленому опсину колбочек (F). Также присутствует небольшое число палочек (I).
На фиг.26 показаны диаграммы рассеяния, полученные методом проточной цитометрии для популяций стволовых клеток с положительной или отрицательной линией дифференцировки (верхняя левая и нижняя левая диаграммы, соответственно), которые демонстрируют процент клеток, экспрессирующих антиген CD44 (окрашены красным); а также диаграммы, полученные для CD31-отрицательных и CD31-положительных клеточных популяций (верхняя правая и нижняя правая диаграммы, соответственно), которые демонстрируют процент клеток, экспрессирующих антиген CD44 (окрашены красным).
На фиг.27 показаны диаграммы рассеяния, полученные методом проточной цитометрии для клеточных популяций отрицательной линии дифференцировки, которые экспрессируют антиген CD44 на значительном уровне (левый ряд диаграмм), а также для субпопуляций клеток костного мозга, которые не экспрессируют значительных количеств антигена CD44 (правый ряд диаграмм), на этих диаграммах показано относительное процентное содержание клеток, экспрессирующих другие поверхностные антигены.
На фиг.28 показаны микрофотографические изображения сетчатки мыши, обработанной путем введения в стекловидное тело клетками из популяции MLBM данного изобретения (левая секция), по сравнению с сетчаткой мыши, обработанной путем введения в стекловидное тело клетками CD44L0.
На фиг.29 показаны микрофотографические изображения сетчаток глаз, обработанных клетками из популяции MLBM (CD44HI) и клетками CD44LD.
На фиг.30 приведены столбчатые диаграммы, демонстрирующие благоприятные эффекты клеточной популяции MLBM, заключающиеся в уменьшении патогенного ангиогенеза и стимуляции полезной физиологической реваскуляризации мышиных сетчаток в индуцированной кислородом модели ретинопатии или ретинопатии недоношенных. На верхнем графике сравнивается преретинальный участок пучка новых сосудов в контрольной сетчатке (первый столбик), сетчатке, обработанной клетками CD44LD (средний столбик), и в сетчатках, обработанных клетками из популяции MLBM (правый столбик). На нижнем графике сравнивается участок разрушения сосудов в контрольной сетчатке (первый столбик), сетчатке, обработанной клетками CD44LD (средний столбик), и в сетчатках, обработанных клетками из популяции MLBM (правый столбик).
На фиг.31 приведено микрофотографическое изображение, демонстрирующее, что только клетки из популяции MLBM внедряются в сосудистую сеть сетчатки, причем данные клетки экспрессируют эндотелиальный фактор роста сосудов (VEGF), что подтверждает зеленое окрашивание клеток в нижней части изображения.
На фиг.32 приведены микрофотографические изображения, демонстрирующие, что клетки из популяции CD11b+ MLBM данного изобретения селективно направлены на сосудистую сеть сетчатки.
На фиг.33 приведены микрофотографические изображения, демонстрирующие, что клетки костного мозга CD44- CD11b- не обладают избирательностью в отношении сосудистой сети сетчатки.
На фиг.34 показана аминокислотная последовательность фрагмента T2 TrpRS (SEQ ID NO: 3) и его варианта T2-TrpRS-GD (SEQ ID NO: 4).
На фиг.35 показана аминокислотная последовательность мини-TrpRS (SEQ ID NO: 5).
На фиг.36 показана аминокислотная последовательность T1-TrpRS (SEQ ID NO: 6).
На фиг.37 показано нормальное развитие сосудов сетчатки мыши, модель индуцированной кислородом ретинопатии (OIR), и эффект восстановления после трансплантации внутрь стекловидного тела клеток костного мозга Lin-. Мышь рождается с сетчаткой, в значительной степени лишенной сосудов, как показано на 2 день после родов (P2) (секция a, тотальный препарат сетчатки), причем сосуды находятся в поверхностном слое сетчатки, занимая одну плоскость, как показано в секции b. В секциях b,d и f приведены изображения, полученные в результате 3-мерного воспроизведения конфокальных z-серий наборов данных анфас, повернутых на 90 градусов. В течение первой недели после рождения поверхностные сосуды сетчатки растут в радиальном направлении от диска зрительного нерва, почти достигая периферии на день P10 (c). Затем развивается глубокая сосудистая сеть сетчатки в результате ветвления поверхностного слоя, которое происходит в течение второй недели (d). Наконец, образуется третье сплетение сосудов между первыми двумя и примерно к P30 формируется зрелая сосудистая сеть сетчатки (e,f). В секции g приведены результаты, полученные на P10, которые показывают, что гипоксия вызывает у модели OIR разрушение центральных сосудов. В секции h показано, что после возвращения к среде с нормальным содержанием кислорода на P12, в центральной сетчатке начинается реваскуляризация и на границе между васкуляризированным (периферическим) и лишенным сосудов (центральным) слоями сетчатки формируются характерные преретинальные пучки новых сосудов. Данные пучки интенсивно окрашиваются изолектином. В секциях I-n показано, что гематопоэтические клетки-предшественники Lin- стимулируют восстановление сосудов у модели OIR. Клетки Lin-, введенные в стекловидное тело перед воздействием атмосферы с высоким содержанием кислорода, значительно ускоряют реваскуляризацию в центральной сетчатке по сравнению с противоположным глазом, обработанным средой на P17. В то время как в сетчатках, обработанных средой, наблюдается уменьшение поверхностной сосудистой сети (I) и полное отсутствие глубокой сосудистой сети (k, m), в противоположном глазу, обработанном клетками Lin-, наблюдается относительно нормальная сосудистая сеть сетчатки (J) с тремя сплетениями (k, m). В секции o показано, что на P17, в глазах OER, обработанных клетками Lin-, реваскуляризация полностью завершается гораздо чаще, чем в необработанных глазах, или в глазах, обработанных средой. Сосуды визуализируют путем перфузии сердца флуоресцеином-декстраном, секции a-f,i,j, и лектином GS, секции g,h,k-n. Ядра в секциях k-n метят DAPI.
На фиг.38 показано, что клетки Lin- ускоряют реваскуляризацию сетчатки и уменьшают формирование преретинального пучка новых сосудов в OIR. В секциях a-d показан метод компьютерного анализа изображения, используемый для вычисления площади разрушения сосудов сетчатки, а также формирование преретинального пучка новых сосудов (красный) в тотальных препаратах сетчатки глаз OIR на 17 день после родов. В секции e показаны сетчатки, обработанные клетками Lin- перед воздействием среды с высоким содержанием кислорода, в которых наблюдается почти 6-кратное уменьшение области разрушения по сравнению с необработанными контролями, и приблизительно 5-кратное уменьшение по сравнению с глазами, обработанными только средой. В секции f показано, что обработка клетками Lin- значительно уменьшает двухмерную площадь пучков новых сосудов по сравнению с необработанными глазами и глазами, обработанными средой. В секции g показано, что трансплантация клеток Lin- эффективно уменьшает площадь разрушения не только при введении перед воздействием среды с высоким содержанием кислорода, но и при введении в период P9-P12 в процессе воздействия среды с высоким содержанием кислорода и сразу после возвращения к нормальному содержанию кислорода. (На графиках представлены средние значения ± SEM; *p < 0,001).
На фиг.39 показано, что при обработке клетками костного мозга долговременные токсические эффекты являются небольшими или отсутствуют. Сетчатки, анализируемые на 5 или 6 месяцы после обработки клетками Lin-, имеют нормальную сосудистую сеть, а нейронный слой сетчатки выглядит гистологически неизмененным на поперечных срезах (a-f, необработанные сетчатки по сравнению с сетчатками, обработанными клетками Lin-, через 6 месяцев после трансплантации). Опухоли отсутствуют и единственными аномалиями являются "розетки", встречающиеся иногда в нейронном слое сетчатки, которые также можно видеть в контрольных необработанных глазах (g,h).
На фиг.40 показано, что клетки CD44HI преобладают в популяции Lin- и эффективно стимулируют восстановление сосудов в модели OIR. В секции a показано, что костный мозг содержит фракции CD44HI и CD44LD, причем популяция Lin- обогащена клетками CD44HI по сравнению с контрольными CD-клетками. На вкладках показаны светорассеивающие свойства клеток CD44HI, типичные для моноцитов и гранулоцитов, в то время как светорассеивающие свойства клеток CD44LD характерны для лимфоцитов. В секции b показаны типичные сетчатки глаз, обработанных клетками костного мозга CD44LD и CD44HI, на