Культивирование отдельных эмбриональных стволовых клеток
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и медицины. Раскрыт способ дифференцировки эмбриональных стволовых клеток человека в качестве единичных клеток в клетки, экспрессирующие маркеры, характерные для линии панкреотической эндодермы. Способ предусматривает культивирование эмбриональных стволовых клеток в виде кластеров и высвобождение эмбриональных стволовых клеток в виде отдельных клеток. Далее проводят посев отдельных эмбриональных стволовых клеток на субстрате культуры ткани и дифференцировку отдельных эмбриональных стволовых клеток. Также описаны способ поддержания эмбриональных стволовых клеток и способ пассирования эмбриональных стволовых клеток. Предложенная группа изобретений позволяет улучшить способы дифференцировки, поддержания и культивирования эмбриональных стволовых клеток. 3 н. и 46 з.п. ф-лы, 14 ил., 16 пр.
Реферат
Настоящее изобретение относится к области культивирования плюрипотентных стволовых клеток и улучшенным способам культивирования плюрипотентных стволовых клеток на промышленном уровне.
Уровень техники
Плюрипотентные стволовые клетки, такие как, например, эмбриональные стволовые клетки, способны дифференцироваться во все типы дифференцированных (зрелых) клеток. Как таковые, эмбриональные стволовые клетки могут быть источником пополнения клеток и ткани для органов, которые были повреждены в результате заболевания, инфекции или врожденных патологий. Возможности использовать эмбриональные стволовые клетки в качестве источника пополнения клеток препятствует трудность размножения этих клеток in vitro с сохранением их плюрипотентности.
Существующие способы культивирования недифференцированных эмбриональных стволовых клеток требуют сложных условий культивирования, таких как, например, культивирование эмбриональных стволовых клеток в присутствии слоя питающих клеток. Альтернативно, среды, полученные посредством воздействия на них культур питающих клеток, могут быть использованы для культивирования эмбриональных стволовых клеток. Системы культур, в которых используют эти способы, часто используют клетки, полученные из видов, отличных от вида, из которого получают культивируемые стволовые клетки (ксеногенные клетки). Кроме того, в эти системы культур может добавляться сыворотка животного.
Например, в статье Reubinoff et al. (Nature Biotechnology 18:399-404 (2000)) и Thompson et al. (Science 6 November 1998: Vol. 282. no. 5391, pp. 1145-1147) описана культура линий эмбриональных стволовых клеток из бластоцист человека, в которой используются эмбриональные фибробласты мыши в качестве слоя питающих клеток.
В другом примере, в документе WO2005014799, описывается кондиционированная среда для поддержания, пролиферации и дифференцировки клеток млекопитающих. В документе WO2005014799 указано: "Культуральная среда, полученная в соответствии с изобретением, обусловлена активностью секреции клеток мышиных клеток, в частности, клеток дифференцированных и иммортализованных трансгенных гепатоцитов, названных ММН (Met Murine Hepatocyte)".
Однако использование ксеногенных клеток или продуктов ксеногенных клеток повышает риск загрязнения полученных такими способами популяций эмбриональных стволовых клеток вирусными белками и/или ксенопротеинами иммуногенного характера.
В статье Richards et al. (Stem Cells 21: 546-556, 2003) оценивали набор из 11 различных слоев питающих клеток, состоящих из клеток взрослого человека, фетальных и неонатальных клеток, на их способность поддерживать культуру эмбриональных стволовых клеток человека. В статье Richards et al. указано: "Линии эмбриональных стволовых клеток человека, культивируемые на питающих фибробластах кожи взрослого человека, сохраняют морфологию эмбриональных стволовых клеток человека и остаются плюрипотентными".
В документе US6642048 описаны среды, которые поддерживают рост плюрипотентных стволовых (pPS) клеток в культуре без питающих клеток, и клеточные линии, подходящие для получения таких сред. В документе US6642048 указано: "Изобретение относится к мезенхимным и фибробластподобным клеточным линиям, полученным из эмбриональной ткани или дифференцированным из эмбриональных стволовых клеток. Способы получения клеточных линий, приготовления сред и выращивания стволовых клеток с использованием таких кондиционированных сред описаны и проиллюстрированы в предлагаемом описании".
В документе US20020072117 описаны клеточные линии, которые продуцируют среды, поддерживающие рост плюрипотентных стволовых клеток в культуре без питающих клеток. Такие используемые клеточные линии являются мезенхимными и фибробластподобными клеточными линиями, полученными из эмбриональной ткани или дифференцированными из эмбриональных стволовых клеток. В документе US20020072117 также описано применение этих клеточных линий в качестве первичного слоя питающих клеток.
В другом примере, в документе Wang et al. (Stem Cells 23: 1221-1227, 2005), описаны способы длительного выращивания эмбриональных стволовых клеток человека на слоях питающих клеток, полученных из эмбриональных стволовых клеток человека.
В другом примере, в документе Xu et al. (Stem Cells 22: 972-980, 2004) описана кондиционированная среда, полученная из производных эмбриональных стволовых клеток человека, которые были генетически модифицированы для сверхэкспрессии теломеразы, обратной транскриптазы человека.
В другом примере, в статье Stojkovic et al. (Stem Cells 23: 306-314, 2005), описана система питающих клеток, полученная путем спонтанной дифференцировки эмбриональных стволовых клеток человека.
В следующем примере, в статье Miyamoto et al. (Stem Cells 22: 433-440, 2004), описан источник питающих клеток, полученный из плаценты человека.
В статье Amit et al. (Biol. Reprod 68: 2150-2156, 2003) описан слой питающих клеток, полученный из крайней плоти человека.
В другом примере, в статье Inzunza et al. (Stem Cells 23: 544-549, 2005), описан слой питающих клеток из фибробластов постнатальной крайней плоти человека.
В альтернативной культуральной системе используется бессывороточная среда, дополненная факторами роста, способными стимулировать пролиферацию эмбриональных стволовых клеток. Например, в статье Cheon et al. (BioReprod DOI:10.1095/biolreprod.105.046870, October 19, 2005) описана не содержащая питающих клеток бессывороточная культуральная система, в которой эмбриональные стволовые клетки поддерживаются в некондиционированной среде с заменой сыворотки (SR), дополненной различными факторами роста, способная запускать самообновление эмбриональных стволовых клеток.
В другом примере, в статье Levenstein et al. (Stem Cells 24: 568-574, 2006), описаны способы длительного культивирования эмбриональных стволовых клеток человека в отсутствие фибробластов или кондиционированной среды, с использованием сред, дополненных bFGF.
В другом примере, в документе US20050148070, описан способ культивирования эмбриональных стволовых клеток человека в средах определенного состава без сыворотки и без фибробластных питающих клеток, причем этот способ включает культивирование стволовых клеток в культуральной среде, содержащей альбумин, аминокислоты, витамины, минеральные соединения, по меньшей мере трансферрин или заменитель трансферрина, по меньшей мере инсулин или заменитель инсулина, причем эта культуральная среда по существу не содержит фетальной сыворотки млекопитающего и содержит по меньшей мере приблизительно 100 нг/мл фактора роста фибробластов, способного активировать рецептор передачи сигнала фактора роста фибробластов, где фактор роста получают из источника, отличного от слоя питательных фибробластов, причем эта среда поддерживает пролиферацию стволовых клеток в недифференцированном состоянии без питающих клеток или кондиционированной среды.
В другом примере, в документе US20050233446, описаны среды определенного состава, которые можно использовать для культивирования стволовых клеток, в том числе недифференцированных примордиальных стволовых клеток приматов. В растворе эта среда является по существу изотоничной по сравнению с культивируемыми стволовыми клетками. В конкретной культуре эта конкретная среда содержит базальную среду и некоторое количество каждого bFGF, инсулина и аскорбиновой кислоты, необходимых для поддержания по существу недифференцированного роста примордиальных стволовых клеток.
В другом примере, в документе US6800480, указано: "В одном из вариантов осуществления описывается среда для культивирования клеток для выращивания полученных из приматов примордиальных стволовых клеток по существу в недифференцированном состоянии, которая включает базальную среду с низким осмотическим давлением, низким содержанием эндотоксина и которая эффективна для поддержания роста полученных из приматов примордиальных стволовых клеток. Эту базальную среду объединяют с питательной сывороткой, эффективной для поддержания роста полученных из приматов примордиальных стволовых клеток, и субстратом, выбранным из группы, состоящей из питающих клеток и компонента внеклеточного матрикса, происходящего из питающих клеток. Эта среда включает дополнительно аминокислоты, не являющиеся незаменимыми, антиоксидант и первый фактор роста, выбранный из группы, состоящей из нуклеозидов и соли пировиноградной кислоты”.
В другом примере, в документе US20050244962, указано: "В одном из аспектов изобретение относится к способу культивирования эмбриональных стволовых клеток приматов. Эти стволовые клетки культивируют в культуре, по существу не содержащей фетальной сыворотки млекопитающего (предпочтительно, по существу не содержащей любой сыворотки животного) и в присутствии фактора роста фибробластов, который получают из источника, отличного от слоя питательных фибробластов. В предпочтительном варианте этот слой питательных фибробластов, ранее необходимый для поддержания культуры стволовых клеток, снимает необходимость добавления достаточного количества фактора роста фибробластов".
В следующем примере, в документе WO2005065354, описана изотоническая культуральная среда определенного состава, которая является по существу не содержащей слоя питающих клеток и сыворотки, содержащая: a) базальную среду; b) количество bFGF, достаточное для поддержания роста по существу недифференцированных стволовых клеток млекопитающих; c) количество инсулина, достаточное для поддержания роста по существу недифференцированных стволовых клеток млекопитающих; и d) количество аскорбиновой кислоты, достаточное для поддержания по существу недифференцированных стволовых клеток млекопитающих.
В другом примере, в документе WO2005086845, описан способ поддержания недифференцированной стволовой клетки, причем указанный способ предусматривает обработку стволовой клетки представителем семейства белков трансформирующего фактора роста бета (TGFβ), представителем семейства белков фактора роста фибробластов (FGF) или никотинамида (NIC) в количестве, достаточном для поддержания этой клетки в недифференцированном состоянии в течение достаточного периода времени для достижения желаемого результата.
Эмбриональные стволовые клетки являются возможным источником исследования и скрининга лекарственных средств. В настоящее время промышленное культивирование линий ES-клеток человека затруднено и имеет значительные препятствия. Возможным решением этих задач является пассирование и культивирование эмбриональных стволовых клеток человека в виде отдельных клеток. Отдельные клетки являются более доступными для стандартных способов культивирования ткани, таких как, например, подсчет клеток, трансфекция и т.п.
Например, в статье Nicolas et al. описан способ получения и увеличения количества клеточных линий hES из отдельных клеток, которые были выделены сортингом клеток с возбуждением флуоресценции (FACS) после генетической модификации лентивирусными векторами. Stem Cells and Development (2007), 16(1), 109-118.
В другом примере, в заявке на патент США US2005158852, описан способ "улучшения роста и выживания отдельных эмбриональных стволовых клеток человека. Этот способ включает стадию получения отдельной недифференцированной клетки HES; смешивание этой единственной недифференцированной клетки с внеклеточным матриксом (ECM) для включения этой клетки; и инокуляцию этой смеси на питающие клетки с питательной средой в среде роста".
В другом примере, в статье Sidhu, KS et al. (Stem Cells Dev. 2006 Feb; 15(1):61-9), описано первое сообщение о трех клонах эмбриональных стволовых клеток человека (hESC), hES 3.1, 3.2 и 3.3, которые получены из родительской линии hES3 сортингом препаратов отдельных клеток проточной цитометрией. Значение жизнеспособности препаратов отдельных клеток до и после сортинга клеток сохранялось >98%.
При этом пассирование и культивирование эмбриональных стволовых клеток человека в виде отдельных клеток приводит к генетическим патологиям и потере плюрипотентности. Условия культивирования являются важными для поддержания плюрипотентности и генетической стабильности. Обычно пассирование клеточных линий hES проводят вручную или с ферментативными агентами, такими как коллагеназа, либераза или диспаза.
Например, в статье Draper JS et al. указано на наличие "кариотипических изменений, включающих конверсию хромосомы 17q в три независимые линии эмбриональных стволовых клеток человека в пяти независимых случаях" (Nat Biotechnol. 2004 Jan; 22(l):53-4. Epub 2003 Dec 7).
В другом примере, в статье Buzzard et al., указано: "Авторы всегда обнаруживали одно изменение кариотипа… используемые способы культивирования могли иметь отношение к таким результатам, при условии, что способы значительно отличаются от способов, используемых большинством других групп. Обычно авторы пассировали ES-клетки человека через 7 дней после начала иссечением колонии краем разбитой пипетки … В этот способ не включены никакие ферментативные или химические способы диссоциации клеток. Авторы предполагают, что это может объяснять относительную генетическую способность восстановления клеток ES в опытах". (Nat Biotechnol. 2004 Apr;22(4):381-2; author reply 382).
В другом примере, в статье Mitalipova MM et al., указано: "Способы пассирования основной массы материала... могут делать популяции анэуплоидных клеток бессмертными после продолжительного пассирования в культуре, но могут быть использованы в течение более коротких периодов (по меньшей мере, до 15 пассажей) без нарушения кариотипов... можно поддерживать нормальный кариотип в клетках hES при длительном размножении вручную с последующим пассированием основной массы в экспериментах, требующих более высоких количеств клеток hES, чем могут обеспечивать только способы ручного пассажа". (Nat Biotechnol. 2005 Jan;23(l):19-20).
В другом примере, в статье Heng BC et al., указано: "Эти результаты продемонстрировали, что второй протокол (трипсинизация с осторожным пипетированием) является гораздо менее вредным для клеточной жизнеспособности, чем первый протокол (обработка коллагеназой с экскориацией). Это, в свою очередь, способствует более высоким степеням выживания при замораживании-оттаивании" (Biotechnology and Applied Biochemistry (2007), 47(1), 33-37).
В другом примере, в статье Hasegawa K. et al., указано: "Авторы получили сублинии hESC, устойчивые к полной диссоциации. Эти клетки проявляют высокую эффективность реинокуляции, а также высокую эффективность клонирования, и они могут сохранять свою способность к дифференцировке в три зародышевых слоя" (Stem Cells. 2006 Dec;24(12):2649-60. Epub 2006 Aug 24).
Сущность изобретения
Настоящее изобретение относится к способам поддержания, пассажа и дифференцировки плюрипотентных стволовых клеток, которые были выделены как отдельные клетки с использованием ферментов. В частности, настоящее изобретение относится к способам поддержания, пассажа и дифференцировки плюрипотентных стволовых клеток, которые были выделены как отдельные клетки, без последующей потери плюрипотентности и без приобретения хромосомных аномалий.
В одном из вариантов осуществления настоящее изобретение относится к способу дифференцировки плюрипотентных стволовых клеток, включающему стадии:
a) культивирования плюрипотентных стволовых клеток в виде кластеров,
b) высвобождения плюрипотентных стволовых клеток в виде отдельных клеток,
c) посева отдельных плюрипотентных стволовых клеток на субстрате культуры ткани и
d) дифференцировки этих клеток.
В одном из вариантов осуществления настоящее изобретение относится к способу поддержания плюрипотентных стволовых клеток, включающему стадии:
a) получения плюрипотентных стволовых клеток,
b) высвобождения плюрипотентных стволовых клеток в виде отдельных клеток, и
c) посева отдельных плюрипотентных стволовых клеток на субстрате культуры ткани.
В одном из вариантов осуществления настоящее изобретение относится к способу пассирования плюрипотентных стволовых клеток, включающему стадии:
a) получения кластеров плюрипотентных стволовых клеток,
b) высвобождения плюрипотентных стволовых клеток в виде отдельных клеток,
c) посева отдельных плюрипотентных стволовых клеток на субстрате культуры ткани,
d) обеспечения возможности деления отдельных плюрипотентных клеткок,
e) высвобождения отдельных плюрипотентных стволовых клеток и
f) посева отдельных плюрипотентных стволовых клеток на новом субстрате культуры ткани.
Краткое описание фигур
Фигура 1: Изображение при 4-кратном увеличении клеток ES человека H9ccp33, выращенных на разведенном 1:30 фактором роста MATRIGEL™ в MEF-кондиционированной среде.
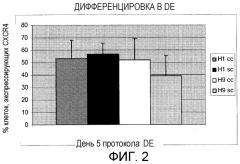
Фигура 2: Процент клеток, экспрессирующих CXCR4 после обработки, вызывающей дифференцировку для получения дефинитивной (развитой) эндодермы. Темно-серый столбец: среднее шести экспериментов по дифференцировке DE с кластерами клеток Н1 (H1 cc) между пассажами 45 и 55. Черный столбец: среднее двух экспериментов по дифференцировке DE с отдельными клетками Н1 (H1 sc) при пассаже 47 и 54. Белый столбец: среднее пяти экспериментов по дифференцировке DE с кластерами клеток Н9 (Н9 сс) между пассажами 37 и 55. Светло-серый столбец: среднее пяти экспериментов по дифференцировке DE с кластерами клеток Н9 (Н9 sc) между пассажами 36 и 48. Стержни ошибок представляют стандартное отклонение повторяемых экспериментов.
Фигура 3: Анализ экспрессии генов при помощи ПЦР реального времени после подвергания 14 или 17 дням протокола панкреатической эндокринной дифференцировки. A. Анализировали отдельные клетки Н9 и кластеры клеток при пассаже 37. B. Продолжение кластеров клеток и отдельных клеток H1 p47 и H9 p37 до стадии панкреатической эндодермы. Экспрессия Pdx1 после дней 14 и 17. Экспрессию генов для указанных маркеров для необработанных клеток принимали как величину 1 для каждого набора данных.
Фигура 4: Изображение, показанное при 4-кратном увеличении, отдельных клеток ES человека H9scp22, выращенных на разведенном 1:30 фактором роста MATRIGEL™ в MEF-кондиционированной среде.
Фигура 5: Оценивание при помощи FACS на экспрессию маркеров плюрипотентности клеток hES. Процент клеток, положительных в отношении указанных маркеров, показан на Х-оси.
Фигура 6: Хромосомный препарат отдельных клеток H9 hES при пассажах 38 раз в виде кластеров с последующими 20 пассажами в виде отдельных клеток.
Фигура 7: Сравнение отдельных клеток Н9 и кластеров клеток во время дифференцировки дефинитивной (развитой) эндодермы. Процент клеток, положительных в отношении CXCR4, показан после подвергания этих клеток протоколу дифференцировки дефинитивной эндодермы. N=2 для H9sc-p и N=5 для H9cc. Стержни ошибок представляют стандартное отклонение повторяемых экспериментов.
Фигура 8: Увеличение маркеров панкреатической эндодермы после дифференцировки отдельных клеток Н9 (пассаж 22). Анализ экспрессии генов при помощи ПЦР реального времени показан после 11, 14 или 17 дней панкреатической эндокринной дифференцировки. Величины для дней 14 и 17 являются средними величинами двух лунок из 6-луночной чашки.
Фигура 9: Отдельные клетки hES могут дифференцироваться на MEF. Результаты FACS из клеток H1scp4, выращенных на питательных MEF-клетках и дифференцированных на дефинитивной (развитой) эндодерме. Маркер дефинитивной эндодермы CXCR4 (CD184) экспрессируется в 89% этих клеток по сравнению с 0% в недифференцированных клетках (см. фигуру 5).
Фигура 10: Отдельные клетки hES (H9scpl8) могут дифференцироваться в 96-луночном формате в дефинитивную эндодерму. Показаны данные иммунофлуоресценции для Sox17-положительного детектирования. Восемь лунок обрабатывали MEF-кондиционированной средой на протяжении эксперимента: MEF-среда. Восемь лунок обрабатывали базальной средой для дифференцировки без компонентов: без соединений. Наборы повторяемых данных восьми лунок усредняли для каждой диаграммы данных. В целом, каждую из 40 лунок обрабатывали ингибитором Wnt3a или Gsk3b и определяли среднее для каждого набора данных. Стержни ошибок представляют стандартное отклонение для каждого повторяемого набора данных.
Фигура 11: Скрининг активных компонентов лекарственных средств с отдельными клетками hES (H9scp19). Всего 13 экспериментальных соединений с малыми молекулами испытывали на их способность заменять Wnt3a в протоколе дифференцировки дефинитивной эндодермы. Показаны три эффективных соединения. Эти наборы данных представляют среднее Sox 17-положительных клеток в двух или более лунках. Клетки, обработанные MEF-кондиционированной средой или базальной средой, использовали в качестве отрицательных контролей.
Фигура 12: Оценивание эффективности трансфекции между кластерами клеток и отдельными клетками H9p33 hES. CMV-GFP трансфицировали в клетки с использованием 8 мкл липофектамина 2000 (Invitrogen, Carlesbad, CA) и 4 или 8 мкг ДНК, черный и серый столбцы, соответственно.
Фигура 13: Фазово-контрастные микрофотографии клеток H1 hES, выращенных на MEF и затем пассированных на MATRIGEL™, в виде кластеров или отдельных клеток. Клетки H1 hES пассажа 37, пассированные из MEF на MATRIGEL™ с коллагеназой, образуют дискретные, плотно упакованные колонии с некоторым количеством рыхлых дифференцированных клеток. Клетки H1 hES, пассированные один раз с Accutase™ или TrypLE™, образуют монослойную культуру с очагами плотно упакованных дифференцированных клеток.
Фигура 14: Клетки H1 hES, пассированные непосредственно на MATRIGEL™ из MEF в виде отдельных клеток, дифференцируются спонтанно. Панель A: процент клеток, остающихся в этой популяции после двух пассажей с Accutase™ из MEF на MATRIGEL™. Панель В: экспрессия маркеров плюрипотентности и дифференцировки в клетках hES после двух пассажей с Accutase™ из MEF на MATRIGEL™. Панель С: фазовые микрофотографии клеток H1 hES после двух пассажей с Accutase™ из MEF на MATRIGEL™.
Сведения, подтверждающие возможность
осуществления изобретения
Для большей ясности, но при этом не ограничивая объем притязаний, подробное описание этого изобретения разделено на следующие подразделы, которые описывают или иллюстрируют определенные признаки, варианты осуществления или варианты применения изобретения.
Определения
Стволовые клетки являются недифференцированными клетками, определяемыми по их способности на уровне этих отдельных клеток как к самообновлению, так и к дифференцировке с образованием клеток-предшественников, в том числе самообновляющихся предшественников, несамообновляющихся предшественников и терминально дифференцированных клеток. Стволовые клетки отличаются также их способностью дифференцироваться in vitro в функциональные клетки различных линий (направлений) дифференцировки из множественных слоев зародышевых клеток (эндодермы, мезодермы и эктодермы), а также давать начало тканям множественных зародышевых слоев после трансплантации и вносить вклад по существу в большинство, если не все, ткани после инъекции в бластоцисты.
Стволовые клетки классифицируют по возможности их развития как: (1) тотипотентные, т.е. способные давать начало всем зародышевым и внезародышевым типам клеток; (2) плюрипотентные, т.е. способные давать начало всем зародышевым типам клеток; (3) мультипотентные, т.е. способные давать начало субпополяции линий (направлений) дифференцировки, но все в пределах конкретных ткани, органа или физиологической системы (например, гемопоэтические стволовые клетки (HSC могут продуцировать потомство, которое включает HSC (самообновляющиеся), ограниченные клетками крови олигопотентные предшественники и все типы клеток и элементы (например, тромбоциты), которые являются нормальными компонентами крови); (4) олигопотентные, т.е. способные давать начало более ограниченной субпопуляции линий (направлений) дифференцировки, т.е. способные давать начало более ограниченной субпопуляции линий (направлений) дифференцировки, чем мультипотентные стволовые клетки; и (5) унипотентные, т.е. способные давать начало линии (направлению) дифференцировки отдельных клеток (например, сперматогенные стволовые клетки).
Дифференцировка является процессом, при котором неспециализированная ("некоммитированная") или менее специализированная клетка приобретает признаки специализированной клетки, такой как, например, нервная клетка или мышечная клетка. Дифференцированной или индуцированной к дифференцировке клеткой является клетка, которая взята на более специализированном ("коммитированном") положении линии дифференцировки клетки. Термин "коммитированная", при применении к процессу дифференцировки, относится к клетке, которая перешла в пути дифференцировки к точке, в которой, при нормальных обстоятельствах, она будет продолжать дифференцироваться в конкретный тип клеток или субпопуляцию типов клеток и не может, при нормальных обстоятельствах, дифференцироваться в другой тип клеток или вернуться к менее дифференцированному типу клеток. Дедифференцировкой называют процесс, при помощи которого клетка возвращается в менее специализированное (или коммитированное) положение в пределах линии дифференцировки клетки. В контексте настоящего изобретения линия (направление) дифференцировки клетки определяет наследственность этой клетки, т.е. из каких клеток она происходит и каким клеткам она может дать начало. Эта линия дифференцировки клетки помещает эту клетку в схему наследственности развития и дифференцировки. Специфическим для линии дифференцировки маркером называют признак, специфически ассоциированный с фенотипом клеток представляющей интерес линии дифференцировки, и он может быть использован для оценки дифференцировки некоммитированной клетки в представляющую интерес линию дифференцировки.
Для описания клеток в культуре могут быть использованы различные термины. "Поддержание" относится обычно к клеткам, помещенным в среду для выращивания при условиях, которые облегчают рост и/или деление клеток, которые могут приводить или могут не приводить к большей популяции этих клеток. "Пассирование" относится к процессу удаления клеток из одного культурального сосуда и помещения их во второй культуральный сосуд при условиях, которые облегчают рост и/или деление клеток.
Конкретную популяцию клеток, или линию клеток, называют или характеризуют иногда количеством проведенных пассажей. Например, популяция культивируемых клеток, которую пассировали десять раз, может называться культурой Р10. Первичную культуру, т.е. первую культуру после выделения клеток из ткани, обозначают Р0. После первой субкультуры клетки описывают как вторичную культуру (Р1 или пассаж 1). После второй субкультуры эти клетки становятся третичной культурой (Р2 или пассаж 2) и т.д. Квалифицированному в данной области специалисту будет понятно, что во время периода пассирования могут быть многочисленные удвоения популяции; таким образом, количество удвоений популяции культуры является большим, чем количество пассажей. Размножение клеток (т.е. количество удвоений популяции) во время периода между пассажами зависит от многих факторов, включающих в себя, но не ограничивающихся ими, плотность посева, субстрат, среду, условия роста и время между проведением пассажей.
"AFP", или "белок альфа-фетопротеин", относится в контексте настоящего изобретения к антигену, продуцируемому в начале развития печени. AFP может также экспрессироваться во внезародышевых клетках.
"β-клеточная линия дифференцировки" относится к клеткам с положительной экспрессией гена для фактора транскрипции PDX-1 и по меньшей мере одного из следующих факторов транскрипции: NGN-3, Nkx2.2, Nkx6.1, NeuroD, Is1-1, HNF-3 бета, MAFA, Pax4 и Pax6. Клетки, экспрессирующие маркеры, характерные для β-клеточной линии дифференцировки, включают β-клетки.
"Brachyury", в контексте настоящего изобретения, является членом семейства T-бокс-генов. Он является маркером клеток первичной полоски и мезодермы.
"Клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной (развитой) эндодермы", обозначают в контексте настоящего изобретения клетки, экспрессирующие по меньшей мере один из следующих маркеров: SOX-17, GATA-4, HNF-3 бета, GSC, Cer1, Nodal, FGF8, Brachyury, Mix-подобный белок гомеобокса, FGF4, CD48, эомезодермин (EOMES), DKK4, FGF 17, GATA-6, CXCR4, C-Kit, CD99 или OTX2. Клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, включают клетки-предшественники первичной полоски, клетки первичной полоски, клетки мезодермы и клетки дефинитивной (развитой) эндодермы.
"CD99" относится в контексте настоящего изобретения к белку, кодируемому геном с номером доступа NM_002414.
"Клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы", обозначают в контексте настоящего изобретения клетки, экспрессирующие по меньшей мере один из следующих маркеров: PDX-1, HNF-1 бета, PTF-1 альфа, HNF-6 или HB9. Клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, включают клетки панкреатической эндодермы.
“Клетки, экспрессирующие маркеры, характерные для линии панкреатической эндокринной дифференцировки", обозначают в контексте настоящего изобретения клетки, экспрессирующие по меньшей мере один из следующих маркеров: NGN-3, NeuroD, Islet-1, PDX-1, NKX6.1, Pax-4, Ngn-3 или PTF-1 альфа. Клетки, экспрессирующие маркеры, характерные для линии панкреатической эндокринной дифференцировки, включают панкреатические эндокринные клетки, панкреатические экспрессирующие гормоны клетки и панкреатические секретирующие гормоны клетки и клетки β-клеточной линии дифференцировки.
"CXCR4" относится в контексте настоящего изобретения к рецептору происходящего из стромальных клеток фактора 1 (SDF-1), также известному как "LESTR" или "фузин". В гаструлирующем зародыше мыши CXCR4 экспрессируется в дефинитивной эндодерме и мезодерме, но не во внезародышевой эндодерме.
"Дефинитивная (развитая) эндодерма" относится в контексте настоящего изобретения к клеткам, которые имеют характеристики клеток, возникающих из эпибласта во время гаструляции и которые образуют желудочно-кишечный тракт и его производные. Клетки дефинитивной эндодермы экспрессируют следующие маркеры: CXCR4, HNF-3 бета, GATA-4, SOX-17, Cerberus, OTX2, goosecoid, c-Kit, CD99 и Mix11.
"Внезародышевой эндодермой" называют в контексте настоящего изобретения популяцию клеток, экспрессирующих по меньшей мере один из следующих маркеров: SOX-7, AFP и SPARC.
"GATA-4" и "GATA-6" являются членами семейства факторов транскрипции GATA. Это семейство факторов транскрипции индуцируется лигандом передачи сигнала TGF-β и способствует сохранению ранних маркеров эндодермы.
"GLUT-2" в контексте настоящего изобретения относится к молекуле-транспортеру глюкозы, которая экспрессируется в многочисленных фетальных и дифференцированных (зрелых) тканях, включающих поджелудочную железу, печень, кишечник, головной мозг и почки.
"Goosecoid", или "GSC", относится в контексте настоящего изобретения к имеющему гомеодомен фактору транскрипции, экспрессируемому в дорсальной губе бластопора.
"Islet-1" или "Isl-1" является в контексте настоящего изобретения членом LIM/гомеодоменного семейства факторов транскрипции и экспрессируется в развивающихся поджелудочных железах.
"MafA" является в контексте настоящего изобретения фактором транскрипции, экспрессируемым в поджелудочной железе, и регулирует экспрессию генов, участвующих в биосинтезе и секреции инсулина.
"Маркеры" являются в контексте настоящего изобретения молекулами нуклеиновых кислот или полипептидов, которые дифференциально экспрессируются в представляющей интерес клетке. В контексте настоящего изобретения дифференциальная экспрессия означает увеличенный уровень в отношении положительного маркера и уменьшенный уровень в отношении отрицательного маркера. Детектируемый уровень маркерной нуклеиновой кислоты или полипептида является достаточно более высоким или более низким в представляющих интерес клетках по сравнению с другими клетками, так что представляющие интерес клетки могут быть идентифицированы и отличены от других клеток с использованием любого из различных способов, известных в данной области.
"Клетка мезоэндодермы" относится в контексте настоящего изобретения к клетке, экспрессирующей по меньшей мере один из следующих маркеров: CD48, эомезодермин (EOMES), SOX-17, DKK4, HNF-3 бета, GSC, FGF 17, GATA-6.
"Nodal" является в контексте настоящего изобретения членом суперсемейства белков TGF бета.
"Oct-4" является членом фактора транскрипции с POU-доменом и является широко признаваемым отличительным признаком плюрипотентных стволовых клеток. Взаимосвязь Oct-4 с плюрипотентными стволовыми клетками демонстрируется по его прочно ограниченной экспрессии в недифференцированных плюрипотентных стволовых клетках. После дифференцировки в соматические линии дифференцировки экспрессия Oct-4 быстро исчезает.
"Панкреатическая эндокринная клетка" или "панкреатическая экспрессирующая гормоны клетка" относится в контексте настоящего изобретения к клетке, способной экспрессировать по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид.
"Панкреатическая секретирующая гормоны клетка" относится в контексте настоящего изобретения к клетке, способной секретировать по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид.
"Pax-4" и "Pax-6" являются в контексте настоящего изобретения факторами транскрипции, специфическими в отношении панкреатических β-клеток, которые участвуют в развитии островков.
"PDX-1" относится в контексте настоящего изобретения к имеющему гомеодомен фактору транскрипции, участвующему в развитии поджелудочной железы.
"Клетка-предшественник клеток первичной полоски" относится в контексте настоящего изобретения к клетке, экспрессирующей по меньшей мере один из следующих маркеров: Nodal или FGF8.
"Клетка первичной полоски" относится в контексте настоящего изобретения к клетке, экспрессирующей один из следующих маркеров: Brachyury, Mix-подобный белок гомеобокса или FGF4.
"PTF-1 альфа" относится в контексте настоящего изобретения к основному белку спираль-петля-спираль 48 кД, который является последовательность-специфической ДНК-связывающей субъединицей тримерного фактора транскрипции 1 поджелудочной железы (PTF1).
"SPARC" в контексте настоящего изобретения известен также как "секретируемый кислый белок, богатый цистеином".
"SSEA-1" (стадиеспецифический зародышевый антиген-1) является гликолипидным поверхностным антигеном на поверхности стволовых клеток (ES) тератокарциномы человека, зародышевых клеток (половых клеток) (EG) мышиных и человека и мышиных эмбриональных стволовых клеток (ES).
"SSEA-3" (стадиеспецифический зародышевый антиген-3) является гликолипидным поверхностным антигеном на поверхности стволовых клеток (ES) тератокарциномы человека, зародышевых клеток (половых клеток) (EG) человека и эмбриональных стволовых клеток (ES) человека.
"SSEA-4" (стадиеспецифический зародышевый антиген-4) является гликолипидным поверхностным антигеном на поверхности стволовых клеток (ES) тератокарциномы человека, зародышевых клеток (половых клеток) (EG) человека и эмбриональных стволовых клеток (ES) человека.
"TRA1-60" является родственным кератинсульфату антигеном, который экспрессируется на поверхности стволовых клеток (ES) тератокарциномы человека и зародышевых клеток (половых клеток) (EG) человека и эмбриональных стволовых клеток (ES) человека.
"TRA1-81" является родственным кератинсульфату антигеном, который экспрессируется на поверхности стволовых клеток (ES) тератокарциномы человека и зародышевых клеток (половых клеток) (EG) человека и эмбриональных стволовых клеток (ES) человека.
"TRA2-49" является изоферментом щелочной фосфатазы, экспрессируемым на поверхности стволовых клеток (ES) тератокарциномы человека и зародышевых клеток (половых клеток) (EG) человека.
Настоящее изобретение относится к способам поддержания, пассирования и дифференцировки плюрипотентных стволовых клеток, которые были выделены в виде отдельных клеток с использованием ферментов. В частности, изобретение относится к способам поддержания, пассирования и дифференцировки плюрипотентных стволовых клеток, которые были выделены в виде отдельных клеток, без последующей потери плюрипотентности и без приобретения хромосомных аномалий.
В одном из вариантов осуществления настоящее изобретение относится к способу дифференцировки плюрипотентных стволовых клеток, включающему стадии:
a) культивирования плюрипотентных стволовых клеток в виде кластеров,
b) высвобождения плюрипотентных ств