Способ дифференциации штаммов vibrio cholerae 0139 серогруппы по алкилсульфатозной активности
Иллюстрации
Показать всеПредлагаемое изобретение относится к области медицинской микробиологии и касается дифференциации токсигенных и нетоксигенных штаммов холерных вибрионов 0139 серогруппы. Описанный способ включает получение синтетической среды для приготовления 100 мл которой готовят навески: 0,5 г хлористого натрия, 2 г агара, 0,002 г индикатора бромтимолового синего, затем компоненты навесок растворяют в 100 мл 0,01 М трис НСl буфере с рН 7,8 и кипятят в течение 30 минут, добавление к полученной среде субстрата в виде 1% водного раствора додецилсульфата натрия (SDS) до конечной концентрации 0,1% его в среде, посев исследуемых культур петлей на полученную синтетическую среду с последующим инкубированием в течение 24-48 часов и проведение учета результатов по наличию на секторах агара мутно-белых зон вокруг посевов размером 2-10 мм, при наличии таких зон штамм относят к токсигенным (ctx+ tcp+), а при отсутствии - к нетоксигенным (ctx- tcp-). Представленный способ является простым и наглядным и может быть использован для определения эпидемической значимости штаммов Vibrio cholerae 0139 серогруппы. 3 табл., 3 пр.
Реферат
Предлагаемое изобретение относится к медицинской микробиологии, а именно к дифференциации токсигенных и нетоксигенных штаммов холерных вибрионов 0139 серогруппы, используя способность холерных вибрионов подвергать гидролизу поверхностно-активные вещества, в число которых входит анионное поверхностно-активное вещество додецилсульфат натрия (SDS).
Известен способ дифференциации ctx+tcp+и ctx-tcp- холерных вибрионов 0139 серогруппы в ПЦР (см. Лабораторная диагностика опасных инфекционных болезней. Практическое руководство/Под редакцией Г.Г.Онищенко и В.В.Кутырева. Издательство «Медицина», издательство «Шико», 2009. - С.77-79.), заключающийся в амплификации участка генома, ограниченного парой специфических праймеров, путем многократного копирования при помощи фермента - термостабильной ДНК-полимеразы. Недостатком известного способа является использование дорогостоящего оборудования, реактивов, сертифицированной лаборатории и специалистов, что усложняет способ дифференцирования.
Наиболее близким по технической сущности является способ изучения алкилсульфатазной активности холерных вибрионов и некоторых других микроорганизмов (статья Г.М.Грижебовский Т.А.Аболина и др. «Изучение алкилсульфатазной активности холерных вибрионов и некоторых других микроорганизмов» // Холера. Материалы Российской научной конференции. - г.Ростов-на-Дону, 1992 г. стр.127-129), заключающийся в том, что используют в качестве питательной среды плотную агаризованную минеральную основу, содержащую 0.01% однозамещенного фосфорнокислого калия, 0.05% хлористого натрия, 0.1% азотнокислого аммония, следы сернокислого железа, 1% пептона, 2% агара и 0.1% додецилсульфата натрия, рН среды 7.6, затем после 20 мин стерилизации на агаровой пластине просекали лунки диаметром 5-10 мм, в которые вносили суспензии микроорганизмов в концентрации 108-109 м.к./мл, после проводят инкубирование при 37°С в течение 48 часов и учет результатов осуществляют при просмотре чашек в проходящем свете, при наличии алкилсульфатазной активности вокруг лунок просматривались зоны помутнения.
Однако известный способ опробирован на холерных вибрионах 01 серогруппы, имеет многокомпонентную питательную среду и трудоемкость в приготовлении. Кроме того, присутствуют сложности в постановке реакции, а именно требуется формирование лунок диаметром 5-10 мм на агаровой пластине методом просечки, приготовление клеток нужной концентрации. Фенотипическое проявление алкилсульфатазной активности у штаммов V. cholerae 0139 серогруппы не изучено. Эти обстоятельства подтверждают, что к настоящему времени отсутствует простой, наглядный способ дифференциации холерных вибрионов 0139 серогруппы клинического (ctx+ tcp+) и водного происхождения (ctx- tcp-) по алкилсульфатазной активности.
Техническая задача предлагаемого изобретения состояла в разработке простого и наглядного способа дифференциации штаммов V. cholerae 0139 серогруппы по алкилсульфатазной активности.
Поставленная задача достигается тем, что в известном способе дифференциации штаммов Vibrio cholerae 0139 серогруппы по алкилсульфатазной активности, включающем нанесение исследуемой культуры на среду субстратом - додецилсульфатом натрия, инкубирование посевов при 37°С и дифференциацию по зонам помутнения, создают синтетическую среду, для приготовления 100 мл которой необходимо: 0,5 г хлористого натрия, 2 г агара, 0,002 г индикатора бромтимолового синего, затем компоненты навесок растворяют в 100 мл 0,01 М трис HCl буфере с рН 7,8 и кипятят в течение 30 минут, после этого к полученной среде добавляют субстрат в виде 1% водного раствора додецилсульфата натрия (SDS) до конечной концентрации 0,01% его в среде, потом проводят посев исследуемых культур петлей на полученную синтетическую среду с последующим инкубированием в течение 24-48 часов, учет результатов проводят по наличию на секторах агара мутно-белых зон вокруг посевов размером (2-10) мм и делают вывод, что исследуемый штамм гидролизует субстрат SDS, проявляя алкилсульфатозную активность, поэтому его дифференцируют как токсигенный (ctx+ tcp+) - эпидемически значимый, а отсутствие таких зон подтверждает, что нет гидролиза и соответственно алкилсульфатозной активности, поэтому штамм является нетоксигенным (ctx- tcp-) - эпидемически незначимым.
Способ осуществляется следующим образом.
Первоначально проводят подготовку исследуемых культур, для этого на чашки агара Мартена с рН 7.8, петлей высевают исследуемые штаммы холерных вибрионов 0139 серогруппы и инкубируют в течение 18 часов при 37°С в термостате.
Затем создают новую синтетическую среду, для приготовления на 100 мл которой необходимо сделать навески: 0.5 г хлористого натрия, 2 г агара, 0,002 г бромтимолового синего в качестве индикатора. Приготовленные навески растворяют в 100 мл 0,01 М трис HCl буфере, имеющего рН 7,8, и кипятят в течение 30 минут до их полного растворения.
Одновременно готовят субстрат, для этого отвешивают навеску 1 г кристаллического додецилсульфат натрия (SDS) и растворяют в 100 мл дистиллированной воды, получая 1% водный раствор, который кипятят один раз на водяной бане. После этого к 90 мл приготовленной среды добавляют 10 мл водного раствора субстрата додецилсульфата натрия до получения конечной концентрации его в среде в количестве 0,1%.
Полученную синтетическую среду разливают в чашки Петри. Посев исследуемой культуры на среду осуществляют петлей «пяточками» и инкубируют при 37°С в течение 24-48 часов.
В результате додецилсульфат натрия, который добавляют в полученную синтетическую среду, подвергается гидролизу штаммами холерных вибрионов 0139 серогруппы, выделенными из клинического материала, и не гидролизуется штаммами холерных вибрионов 0139 серогруппы, выделенными из воды. Деструкцию додуцилсульфата натрия (первичного алкилсульфата) осуществляет фермент - алкилсульфатаза с образованием не растворимого в воде додеканола-1.
Таким образом, алкилсульфатазную активность холерных вибрионов 0139 серогруппы рассматривают как дифференциальный признак для клинических (ctx+ tcp+) и водных штаммов (ctx- tcp-) по алкилсульфатазной активности.
Учет результатов осуществляют через 24-48 часов. Если на секторах агара вокруг посевов четко просматриваются мутно-белые зоны (2-10 мм), то делают вывод о том, что исследуемый штамм токсигенный - эпидемически значимый и проявляет алкилсульфатазную активность, т.е. способен гидролизовать субстрат SDS. Если на секторах агара вокруг посевов исследуемых штаммов зоны не образуются, то исследуемые штаммы холерного вибриона 0139 серогруппы являются нетоксигенными - эпидемически незначимыми, т.е. не проявляет алкилсульфатазную активность и не гидролизует предложенный субстрат.
Пример 1
В качестве исследуемых штаммов используют культуры V. cholerae 0139 «Бенгал» Р-16064, Р-16077 (ctx+tcp+) и Р-17918, Р-17673 (ctx-tcp-). В качестве положительного контроля - штаммы V. cholerae eltor №5879 ctx+tcp+), V.cholerae classica 569 В (ctx+tcp+). Отрицательным контролем служил штамм V.cholerae eltor №14312 (ctx-tcp-). В качестве субстрата используют додецилсульфат натрия в концентрации 1-2%. Учет результатов осуществляют через 24-48 часов культивирования (см. таблица1).
Из таблицы 1 видно, что при концентрации в среде 1-2% додецилсульфата натрия выявить алкилсульфатазную активность микроорганизмов и провести дифференциацию токсигенных от нетоксигенных вариантов невозможно, т.к. концентрация субстрата в среде превышает оптимальную для проявления искомой активности и ингибирует рост некоторых культур, а также делает невозможным проявление алкилсульфатазной активности. Об этом свидетельствует плохой рост культур и отсутствие вокруг посевов непрозрачных мутно-белых зон, а соответственно отсутствие гидролиза SDS.
Пример 2
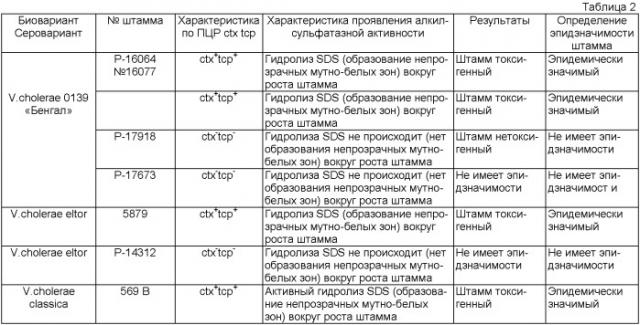
В качестве исследуемых штаммов используют культуры V. cholerae 0139 «Бенгал» Р-16064, Р-16077 (ctx+tcp+) и Р-17918, Р-17673 (ctx-tcp-). В качестве положительного контроля использовали штаммы V. cholerae eltor №5879 (ctx+tcp+), V.cholerae classica 569 В (ctx+tcp+). Как отрицательный контроль: штамм V.cholerae eltor №14312 (ctx-tcp-). В качестве субстрата используют додецилсульфат натрия в концентрации 0.1%. Учет результатов через 24-48 часов культивирования (см. таблица 2).
Из таблицы 2 видно, что при концентрации в среде 0.1% SDS наблюдают дифференциацию токсигенных (ctx+tcp+) и нетоксигенных (ctx-tcp-) вариантов холерных вибрионов 0139 серогруппы по алкилсульфатазной активности. При этом токсигенные штаммы вокруг посева образуют непрозрачные мутно-белые зоны за счет деструкции додецилсульфата натрия с образованием нерастворимого в воде додеканола-1. Следует отметить, что после 24 часов инкубации у некоторых культур на фоне непрозрачных мутно-белых зон появляются образования в виде «годичных колец» с просветлениями, что связано с поэтапным гидролизом субстрата. Нетоксигенные штаммы не обладают способностью гидролизовать SDS и не образуют вокруг посевов в предложенные сроки наблюдения непрозрачных мутно-белых зон. Таким образом, по способности гидролизовать 0.1% SDS холерными вибрионами на синтетической среде можно сделать предварительное заключение о токсигенности штаммов, что определяет их эпидзначимость, следовательно, дифференциация токсигенных ctx+tcp+ штаммов холерных вибрионов 0139 серогруппы возможна на этапе культивирования штаммов в течение 24-48 часов.
Пример 3
В качестве исследуемых штаммов используют культуры V.cholerae 0139 «Бенгал» Р-16064, №16077 (ctx+tcp+) и Р-17918, Р-17673 (ctx-tcp-). В качестве положительного контроля использовали штаммы V. cholerae eltor №5879 (ctx+tcp+), V.cholerae classica 569 В (ctx+tcp+). Как отрицательный контроль: штамм V.cholerae eltor №14312 (ctx-tcp-). В качестве субстрата используют додецилсульфат натрия в концентрации 0.1% (см. таблица 3). Учет результатов реакции производили через 6, 24, 48 и 72 часов культивирования на среде.
Из данных таблицы 3 видно, что при культивировании в течение 6 часов штаммы V.cholerae 0139 «Бенгал» Р-16064, №16077 и Р-17918, Р-17673 не гидролизуют SDS (нет образования непрозрачных мутновато-белых зон). Нельзя определить эпидзначимость исследуемых штаммов и провести дифференциацию по изучаемому признаку.
При культивировании штаммов в течение 24 часов токсигенные штаммы V. cholerae 0139 серогруппы (Р-16064, №16077) вокруг посева образуют непрозрачные мутно-белые зоны за счет деструкции додуцилсульфата натрия с образованием не растворимого в воде додеканола-1.
Таким образом, нетоксигенные штаммы V. cholerae 0139 (Р-17918, Р-17673) не обладают способностью гидролизовать SDS и не образуют вокруг посевов непрозрачные мутно-белые зоны. Из этих данных можно заключить, что дифференциация токсигенных (ctx+tcp+) и нетоксигенных (ctx-tcp-) штаммов холерных вибрионов возможна на этапе культивирования штаммов на питательной среде с SDS в течение 24 часов, однако при культивировании штаммов в течение 48 часов наблюдается более активный гидролиз SDS (с образованием непрозрачных мутно-белых зон) вокруг роста токсигенных штаммов. У некоторых культур на фоне непрозрачных мутновато-белых зон появляются образования в виде «годичных колец» с просветлениями, что связано с поэтапным гидролизом субстрата, в то же время гидролиз SDS у нетоксигенных штаммов 0139 серогруппы не происходит (нет образования непрозрачных мутновато-белых зон) вокруг роста штаммов. Через 72 часа с момента культивирования все контрольные токсигенные штаммы V.cholerae 01№5879 (ctx+tcp+), V.cholerae classica 569 В (ctx+tcp+) и V.cholerae 0139 «Бенгал» Р-16064, №16077 (ctx+tcp+) проявляют алкилсульфатазную активность. Гидролиз SDS штаммами Р-17918, Р-17673 не происходит (нет образования непрозрачных мутно-белых зон). Дифференциацию на этом этапе осуществлять можно, однако с учетом активного гидролиза SDS непрозрачные мутно-белые зоны в результате активного гидролиза резко увеличиваются в диаметре, что в ряде случаев может затруднять учет результатов.
Использование предлагаемого изобретения позволяет за счет новой синтетической среды с добавлением додецилсульфата натрия в качестве стандартного субстрата в оптимальной концентрации 0.1% /100 мл среды осуществлять простым, наглядным способом дифференциацию по алкилсульфатазной активности токсигенных (ctx+tcp+) и нетоксигенных(ctx-tcp-) штаммов холерных вибрионов 0139 серогруппы.
Кроме того, приготовление синтетической среды экономически выгодно, так как не требует специального оборудования и дорогостоящих реактивов, продолжительность хранения составляет до 1 года при 4°С без добавления SDS.
| Таблица 1 | ||||
| Биовариант | № штамма | Характеристика по ПЦР | Характеристика проявления алкилсульфатазной активности | Определение эпидзначимости штамма |
| Серовариант | ctx tcp | |||
| P-16064 | ctx+tcp+ | Гидролиз SDS (образование непрозрачных мутно-белых зон) вокруг роста штаммов) отсутствует. Проявляется ингибирование роста некоторых культур. | ||
| V.cholerae 0139 «Бенгал» | №16077 | |||
| P-17918 | ctx-tcp- | |||
| P-17673 | ||||
| V.cholerae eltor | 5879 | ctx+tcp+ | Гидролиз SDS(образование непрозрачных мутно-белых зон) вокруг роста штаммов) отсутствует. Проявляется ингибирование роста некоторых культур. | Алкилсульфатазная активность не выявлена, все штамммы сработали одинаково, дифференциация невозможна, эпидзначимость не установлена |
| P-14312 | ctx-tcp- | |||
| V.cholerae classica | 569 В | ctx+tcp+ | Гидролиз SDS (образование непрозрачных мутно-белых зон) вокруг роста штаммов) отсутствует. Проявляется ингибирование роста некоторых культур. |
Способ дифференциации штаммов Vibrio cholerae 0139 серогруппы по алкилсульфатазной активности на токсигенные (ctx+ tcp+) и нетоксигенные (ctx- tcp-), включающий нанесение исследуемой культуры на среду с субстратом - додецилсульфатом натрия, инкубирование посевов при 37°С и дифференциацию по зонам помутнения, отличающийся тем, что создают синтетическую среду, для приготовления 100 мл которой готовят навески: 0,5 г хлористого натрия, 2 г агара, 0,002 г индикатора бромтимолового синего, затем компоненты навесок растворяют 100 мл 0,01 М трис НСl буфере с рН 7,8 и кипятят в течение 30 мин, после этого к полученной среде добавляют субстрат в виде 1%-ного водного раствора додецилсульфата натрия (SDS) до конечной концентрации 0,1% его в среде, потом проводят посев исследуемых культур петлей на полученную синтетическую среду с последующим инкубированием в течение 24-48 ч, учет результатов проводят по наличию на секторах агара мутно-белых зон вокруг посевов размером 2-10 мм и делают вывод, что исследуемый штамм гидролизует субстрат SDS, проявляя алкилсульфатазную активность, и является токсигенным (ctx+ tcp+), а отсутствие таких зон подтверждает, что нет гидролиза и соответственно алкилсульфатазной активности, и штамм является нетоксигенным (ctx- tcp-).