Применение тризамещенных соединений глицерина для лечения гематологических злокачественных опухолей
Иллюстрации
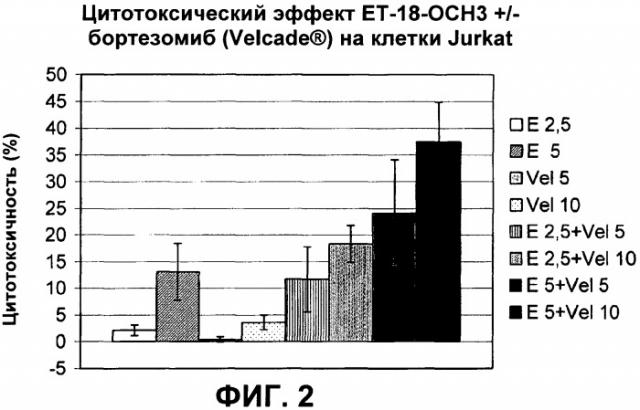
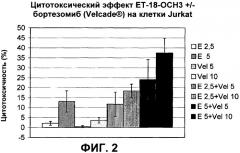
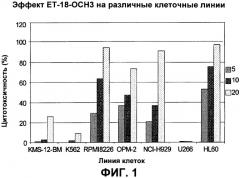
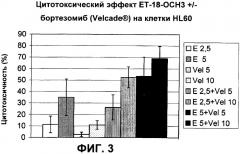
Показать всеПредложены: применение тризамещенных соединений глицерина формулы (I) в производстве лекарственного средства, при этом указанное лекарственное средство применяется с, по меньшей мере, одним другим лекарственным средством, содержащим один или более дополнительных активных игредиентов, которые выбираются из группы, состоящей из антиметаболитов, растительных алкалоидов, ингибиторов топоизомеразы II, ингибиторов протеосом; соответствующая комбинация и in vitro способ определения чувствительности гематологических злокачественных клеток к комбинации лекарственных средств, как определено в настоящем изобретении. Показан синергетический цитотоксический эффект соединения формулы (I) эдельфозина в комбинации с ингибитором протеосом бортезомибом, с антиметаболитом флутарабином, с цитарабином, с ингибитором топоизомеразы II этопозидом. 3 н. и 8 з.п. ф-лы, 10 ил., 4 табл.
Реферат
Настоящее изобретение относится к применению тризамещенных соединений глицерина в производстве лекарственных средств для лечения гематологических злокачественных опухолей. Изобретение также относится к набору из частей, содержащему такое лекарственное средство. Наконец, изобретение также относится и к соответствующему способу лечения таких состояний, и к in vitro способам определения чувствительности таких опухолевых клеток к лекарственному средству, как определено в изобретении.
Гематологические злокачественные опухоли, такие как лейкоз и лимфома, относятся к разновидностям рака, которые затрагивают кровь, костный мозг и лимфоузлы. На хромосомные транслокации сильно влияет этиология этих заболеваний, тогда как для солидных опухолей это нехарактерно. Это приводит к различным подходам в диагностике и лечении гематологических злокачественных заболеваний (см., например, Dewald G.W. et al (1995) Semin. Oncol. 22, 341-354; Grimwade, D. et al (1998) Blood 92, 2322-2333; Jaffe, E.S. et al (2001) Tumors of hematopoietic and lymphoid tissue. International Agency for Research on Cancer, IARC Press, Lyon, France; Grimwade, D et al (2004) Ann. Hematol. 83, Suppl. 1, S45-S48).
Лечение многих пациентов с диссеминированными гематологическими злокачественными опухолями проводили посредством химиотерапии (возможно в сочетании с облучением) в некоторый момент в течение заболевания. Хотя степень ответных реакций при лечении некоторых злокачественных опухолей, таких как лимфоидные злокачественные опухоли, обычно высока, курс лечения будет приводить к выздоравливанию только подгруппы пациентов. Даже среди лимфоидных злокачественных опухолей некоторые заболевания (например, хронический лимфолейкоз (ХЛЛ); фолликулярная лимфома III/IV стадии, представленная малыми расщепленными клетками; лимфома маргинальной зоны III/IV стадии; лимфома из клеток мантийной зоны III/IV стадии и множественная миелома) в настоящее время не поддаются лечению химиотерапией со стандартными дозировками.
Однако доступные в настоящее время нехирургические терапевтические альтернативы лечения связаны с побочными эффектами препаратов, некоторые из которых довольно тяжелые, которые представляют собой ограничительный фактор для химиотерапевтических подходов для сильно постаревшей части населения с множественными патологиями.
Одной проблемой, связанной с лечением таких злокачественных новообразований, является то, что ремиссия этих опухолей неизбежна даже при или несмотря на применение агрессивного лечебного режима. Длительная терапия химиопрепаратами невозможна, так как степень ответа затем приближается к нулю. Предел дозы облучения также достигается относительно быстро, если планируется эффективно лечить даже первичные опухоли. Таким образом, ситуация в настоящее время такова, что после завершения первого лечебного режима необходимо «ждать» до тех пор, пока не произойдет рецидива.
В настоящее время химиотерапевтические протоколы лечения гематологических злокачественных опухолей включают в себя назначение одного или более антинеопластических агентов (то есть цитостатических и/или цитотоксических химиопрепаратов), таких как алкилирующие агенты, растительные алкалоиды, антиметаболиты, антибиотики, ингибиторы топои-зомераз I и/или II, ингибиторы тирозинкиназ, ингибиторы протеосом и стероиды (см., например, Alexanian, R. et al (1969) JAMA 208, 1680-1685; Rai, K.R. et al. (1981) Blood 58, 1203-1212; Alexanian, R. et al. (1990) Am. J. Hematol. 33, 86-89; Bassan, R. et al., 1992, Leukemia 6 (suppl.2), 186-190; Keating, M.J. et al (1993) Chemotherapy of chronic lymphocytic leukemia, in: Cheson, B.D. (ed.) Chronic Lymphocytic Leukemia. Scientific Advances and Clinical Developments. Marcel Dekker, New York, NY, p.297 ff.; Boulard, F. et al (1993) Cancer Invest. 11, 534-553; Smith, M. et al (1996) J. Clin. Oncol. 14, 18-24; Noordijk, E. et al (1997) Int. J. Radiat. Oncol. Biol. Phys. 39, 173; Miller, T.P. et al (1998) N. Eng. J. Med. 339, 21-26; Drucker, B.J. (2001) N. Engl. J. Med. 344, 1031-1037; Richardson, P.O. et al (2002) ASCO Annual Meeting Proceedings, 11а). Все обычные антинеопластические агенты должны вводиться систематически, так как они представляют собой молекулы, оказывающие также неселективные эффекты на их физиологические мишени. Однако это подразумевает, что такие антинеопластические (цитостатические) агенты, особенно при применении в течение длительного периода времени, будут оказывать пагубный эффект на здоровые клетки организма, то есть их применение связано с серьезными побочными эффектами, в основном проявляющимися на быстро делящихся клетках организма. Обычные побочные эффекты включают в себя, среди прочих, генетические нарушения, тошноту, рвоту, диарею, запоры, выпадение волос, нарушение функций иммунной системы, подавление пролиферации миелоцитов, анемию, геморрагию, цитотоксичность, появление вторичных неоплазий и так далее.
Таким образом, по-прежнему существует необходимость или в альтернативных химиопрепаратах, вызывающих побочные эффекты в меньшей степени при сохранении их фармакологической эффективности, или в любых соединениях, которые необходимо вводить в сочетании с вышеуказанными антинеопластическими агентами, где их комбинация приводит к синергетическим цитостатическим и/или цитотоксическим эффектам на опухолевую клетку по сравнению с индивидуальным применением каждого препарата. Такое комбинирование позволило бы заново назначить уменьшенные дозы антинеопластических препаратов с достижением такой же терапевтической эффективности, но при менее серьезных побочных эффектах.
Тризамещенные соединения глицерина, принадлежащие к классу синтетических алкиллизофосфолипидов с простоэфирной связью, могли бы быть объектами для такого комбинаторного подхода.
Такие синтетические алкиллизофосфолипиды с простоэфирной связью, как известно, проявляют антиканцерогенную активность (описано, например, у Arthur, G. and Bittman, R. (1998) Biochim. Biophys. Acta 1390, 85-102; Jendrossek, V., and Handrick, R. (2003) Curr. Med. Chem. Anti-Canc. Agents 3, 343-353; Mollinedo, F. et al (2004) Curr. Med. Chem. 11, 3163-3184). 1-O-октадецил-2-О-метилглицеро-3-фосфохолин (на который также ссылаются как на ЕТ-18-OCHS, АР-121 или эдельфозин) считается прототипом таких липидов. 1-О-октадецил-2-О-метилглицеро-3-фосфохолин представляет собой синтетический аналог тромбоцит-активирующего фактор (PAF; 1-O-алкил-2-ацетил-sn-глицеро-3-фосфохолин), потенциальный активатор фосфолипидного ряда и посредник во многих функциях лейкоцитов, включая агрегацию тромбоцитов, воспаление и анафилаксию. В отличие от наиболее распространенных химиопрепаратов, эти синтетические липиды с простой эфирной связью не действуют непосредственно на клеточную ДНК, а скорее оказывают эффект на липидный состав плазматической мембраны и/или действуют на различные сигнальные пути. Таким образом, их тип действия не зависит от присутствия определенных клеточных рецепторов или же он зависит от клеточного цикла.
Химиотерапия рака главным образом направлена на замедление роста или на разрушение опухолевых клеток, в то же время избегая коллатеральных повреждений у окружающих клеток и тканей. Следовательно, наиболее эффективными противоопухолевыми агентами являются те, которые могут селективно действовать на раковые клетки, оставляя здоровые клетки незатронутыми. Было показано, что синтетические липиды с простой эфирной связью вызывают подобный эффект (см., например, Magistrelli, A. et al (1995) Drug. Metab. Dispos. 23, 113-118). Некоторые механизмы действия были объяснены токсичным действием липидов с простой эфирной связью на раковые клетки, включая также недостаток у клеток ферментов алкильного расщепления. Итоговая неспособность к гидролизу липидов с простой эфирной связью ведет к их внутриклеточному накоплению и к последующему нарушению организации липидов в клеточной мембране. Другие потенциальные механизмы действия липидов с простой эфирной связью включают в себя эффекты на уровне внутриклеточного фосфорилирования белков и нарушения клеточного метаболизма липидов. Здоровые клетки, в отличие от раковых, обычно обладают способностью избежать или преодолеть потенциальный токсический эффект липидов с простой эфирной связью.
Таким образом, синтетические липиды с простой эфирной связью применялись для лечения солидных опухолей различного типа, таких как опухоли мозга или молочной железы (см., например, German Patent DE 2619686 и Международные Патентные Заявки WO 99/59599 и WO 00/01392 соответственно). Однако, хотя противоопухолевая активность этих липидов с простой эфирной связью была экспериментально показана на отдельных животных опухолевых моделях, их клиническому применению обычно препятствуют системные цитотоксические эффекты, включающие в себя гемолиз, особенно в желудочно-кишечном тракте, и также, среди прочих, в легких, печени и почках.
В настоящее время в большинстве клинических испытаний синтетических липидов с простой эфирной связью соединения вводят пациентам перорально или внутривенно. В этом случае было показано, что внутривенное введение липосомального препарата и липофильной эмульсии «масло-в-воде», соответственно, более благоприятно по сравнению со свободным соединением для улучшения терапевтической эффективности наряду с уменьшением токсического эффекта (см., например, Ahmad, I. et al (1997) Cancer Res.57, 1915-1921 и Международная Патентная Заявка WO 91/09590).
Однако из уровня техники также известно, что определенный фосфолипид с простой эфирной связью и карбамоильные соли наряду с терапевтическим действием у пациентов как конкурентный ингибитор PAF или опухолевого роста при однократной или повторной инъекции вызывают пагубные эффекты в области инъекции. Очевидно, что эти побочные эффекты включают в себя лизис красных кровяных телец, сильный отек, воспаление и некроз в месте инъекции. Эти побочные эффекты часто называют "детергентными" эффектами. В том случае, если требуются повторные инъекции, эти вредные эффекты являются особенно неблагоприятными, так как они делают места введения неприемлемыми и требуются новые места для инъекций. Так как число подходящих мест у пациента ограничено, было бы очень желательно избежать вышеупомянутых побочных эффектов, связанных с внутривенным введением 1-О-октадецил-2-O-метилглицеро-3-фосфохолина.
Довольно недавно было показано, что для того чтобы снизить системные побочные эффекты, возможно также вводить липиды с простой эфирной связью перорально вместе с жидкостью-носителем, годной для питья. В Международной Патентной Заявке WO 99/59599 было описано, что 1-O-октадецил-2-О-метилглицеро-3-фосфохолин может вводиться вместе с носителем на водной или молочной основе, содержащей, по меньшей мере, 3% (масса/масса) жира и/или белка. Заманчивым является предположение, что эффективное связывание 1-O-октадецил-2-O-метилглицеро-3-фосфохолина с белками и/или другими липидами «маскирует» липид с простой эфирной связью, что приводит к уменьшению побочных эффектов.
Тем не менее в 10-20% случаев у пациентов, лечение которых проводилось таким носителем на водной или молочной основе, наблюдалась желудочно-кишечная несовместимость, с которой были связаны потеря аппетита, тошнота и/или рвота, запоры и прочее (см., например, Drings, P. et al (1992) Onkologie 15, 375-382).
Таким образом, остается необходимость в лекарственном средстве для лечения гематологических злокачественных опухолей, которое преодолевает вышеуказанные ограничения. В частности, необходимо лекарственное средство, которое подходит для легкого и удобного введения и обеспечит требуемую фармацевтическую эффективность без серьезных побочных эффектов.
Соответственно, целью настоящего изобретения является поиск такого препарата для лечения гематологических злокачественных опухолей.
Эта цель достигается путем применения тризамещенного соединения глицерина, имеющего признаки независимой формулы 1 для производства соответствующего лекарственного средства, которое может применяться индивидуально или в сочетании с одним или более другими фармацевтическими средствами. Некоторые из предпочтительных вариантов выполнения настоящего изобретения определяются объектами зависимых формул.
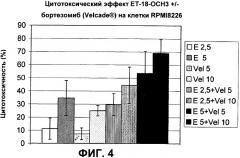
По настоящему изобретению было обнаружено, что тризамещенные соединения глицерина, такие как 1-O-октадецил-1-O-метил-глицеро-3-фосфохолин, подходят не только в качестве препарата для селективного лечения гематологических злокачественных опухолей, но также усиливают цитостатический и/или цитотоксический эффекты некоторых известных химиопрепаратов на опухолевые клетки в синергетической манере. Таким образом, эти синергетические эффекты позволяют вводить уменьшенные дозы препаратов для того, чтобы достичь такой же фармацевтической эффективности по сравнению с индивидуальным назначением, что снова будет уменьшать риск появления системных побочных эффектов.
В контексте настоящего изобретения любое определенное числовое значение обычно связано с интервалом точности, который, как будет понятно специалисту в данной области техники, гарантирует технический эффект рассматриваемого признака. Как применяется здесь, отклонение от определенного числового значения лежит в интервале ±10%, и предпочтительно ±5%.
В первом объекте настоящее изобретение относится к применению тризамещенного соединения глицерина по формуле (I) или его энантиомера, диастереомера или фармацевтически приемлемой соли, для производителя лекарственного средства для лечения гематологических злокачественных опухолей
Х выбирается из группы, состоящей из фосфата и сульфата;
R1 выбирается из группы, состоящей из алкилов с 16-20 атомами углерода;
R2 выбирается из группы, состоящей из алкилов с 1-3 атомами углерода и гидроксиалкилов с 1-3 атомами углерода;
R3 выбирается из группы, состоящей из водорода и алкилов с 1-3 атомами углерода;
R4 выбирается из группы, состоящей из алкилов с 1-3 атомами углерода и циклоалкилов с 3-6 атомами углерода;
R5 выбирается из группы, состоящей водорода и метила.
Тризамещенное соединение глицерина по изобретению может применяться в аморфной или кристаллической форме. Использующийся здесь термин «аморфный» обозначает твердое тело, в котором нет расположения атомов дальнего порядка, то есть некристаллический материал. В предпочтительном варианте выполнения изобретения тризамещенное соединение глицерина находится в кристаллической форме.
Термины "Cn алкил","Cn гидроксиалкил" и "Cn циклоалкил", применяемые здесь, обозначают алкильную группу, гидроксиалкильную группу или циклоалкильную группу, имеющую n атомов углерода, соответственно. Например, термин "C18 алкил" относится к алкильной группе, имеющей 18 атомов углерода. Алкильные или гидроксиалкильные группы по изобретению могут быть прямыми или разветвленными.
У тризамещенных соединений глицерина формулы (I) есть один или более асимметрических центров и таким образом они могут существовать в виде энантиомеров или диастереомеров. Соответственно, лекарственное средство, применяемое в настоящем изобретении, может содержать либо один или более отдельных индивидуальных изомеров (таких как L-форма и D-форма), либо смесь изомеров, предпочтительно рацемические смеси.
Тризамещенные соединения глицерина формулы (I) могут содержаться в лекарственном средстве в виде фармацевтически приемлемых солей. Такие соли могут содержать любой фармацевтически приемлемый анион, "нейтрализующий" положительный заряд азота (например, хлорид, бромид или иодид) или фармацевтически приемлемый катион, "нейтрализующий" отрицательный заряд фосфатной группы или сульфогруппы (например, катионы натрия или калия).
В отдельном предпочтительном варианте выполнения настоящего изобретения лекарственное средство содержит тризамещенное соединение глицерина по формуле (I), где Х представляет собой фосфатную группу или сульфогруппу, R1 представляет собой -(СН2)17-СН3, R2 представляет собой СН3, R3 представляет собой Н, R4 представляет собой -(СН2)2- и R5 представляет собой СН3.
Лекарственное средство по настоящему изобретению может находиться в любой фармацевтической лекарственной форме, которая является терапевтически эффективной. Примерами таких фармацевтических лекарственных форм являются среди прочих таблетки, пилюли, капсулы, суспензии, эмульсии, растворы для инъекций или для вливания, настойки, порошки и тому подобное.
Лекарственные средства, применяемые в настоящем изобретении, содержат в себе по меньшей мере один фармацевтически приемлемый эксципиент. Под применяемым здесь термином «фармацевтически приемлемый эксципиент» понимается любое вещество, применяемое для приготовления фармацевтических лекарственных форм, такие как вещества для покрытия, пленкообразующие вещества, наполнители, дезинтегрирующие агенты, вещества, изменяющие высвобождение, вещества-носители, растворители, связывающие агенты и другие адьюванты, каждый из которых хорошо известен в области технике (см. ссылки, указанные ниже). Предпочтительно эксципиент, применяемый в изобретении, содержит по меньшей мере один наполнитель, по меньшей мере один связывающий агент, по меньшей мере один дезинтегрирующий агент, по меньшей мере один агент, контролирующий текучесть и по меньшей мере одно смазывающее вещество.
Лекарственное средство может вводиться любым парентеральным или непарентеральным путем введения. Парентеральные способы применения содержат, например, способы внутрикожных, подкожных, внутримышечных или внутривенных инъекций и вливаний. Непарентеральные способы введения включают, например, пероральное или местное введение. Более того, лекарственное средство может вводиться как местно, так и системно.
Предпочтительно, лекарственное средство, применяемое по настоящему изобретению, находится в твердой лекарственной форме, особенно предпочтительно в форме фармацевтического твердого препарата, подходящего для перорального применения. Примеры таких лекарственных форм включают среди прочих таблетки, пилюли, капсулы, горошки, гранулы, порошки, мультичастичные формы (например, шарики, гранулы или кристаллы) и драже. Стандартные дозы мультичастичных форм могут быть включены в фармацевтическую твердую лекарственную форму, например, посредством сжатия или формования в таблетки, или помещения необходимого количества компонентов внутрь желатиновой капсулы.
Все эти твердые лекарственные формы для перорального применения, так же как и способы их приготовления, хорошо известны в области технике (см., например, Gennaro, A.L. and Gennaro, A.R. (2000) Remington: The Science and Practice of Pharmacy, 20th Ed., Lippincott Williams & Wilkins, Philadephia, PA; Ritschet, W.A. & Bauer-Brandl, A. (2002) Die Tablette: Hand-buch der Ehtwicklung, Herstellung und Qualitatssicherung. Editio-Cantor Verlag, Auendorf, Germany; Crowder, T.M. et al (2003) A Guide to Pharmaceutical Particulate Science. Interpharm/CRC, Boca Raton, FL; Stricker, H. (2003) Arzneiformenentwicklung, Springer Verlag, Berlin, Germany; Niazi, S.K. (2004) Handbook of Pharmaceutical Manufacturing Formulations, CRC Press, Boca Raton, FL).
В предпочтительном варианте выполнения изобретения фармацевтическая твердая лекарственная форма выбирается из группы, состоящей из таблеток, пилюль, капсул и гранул, причем таблетки являются наиболее предпочтительными.
В другом предпочтительном варианте выполнения изобретения твердая лекарственная форма представляет собой энтеральную лекарственную форму. То есть лекарственная форма остается стабильной в желудке, то есть в сильнокислой среде, со значениями рН≤2.5. Это может достигаться путем применения твердой лекарственной формы, содержащей пленочное покрытие. Например, изобретенная лекарственная форма может быть в форме так называемой таблетки с пленочным покрытием.
Способы приготовления лекарственных форм с пленочным покрытием также хорошо известны в области технике (см., например, Gennaro, A.L. and Gennaro, A.R. (2000) Remington: The Science and Practice of Pharmacy, 20th Ed., Lippincott Williams & Wilkins, Philadephia, PA; Ritschet, W.A. & Bauer-Brandl, A. (2002) Die Tablette: Handbuch der Ehtwicklung, Herstellung und Qualitätssicherung. Editio-Cantor Verlag, Auendorf, Germany; Crowder, T.M. et al (2003) A Guide to Pharmaceutical Particulate Science. Interpharm/CRC, Boca Raton, FL; Stricker, H. (2003) Arzneiformenentwicklung, Springer Verlag, Berlin, Germany; Niazi, S.K. (2004) Handbook of Pharmaceutical Manufacturing Formulations, CRC Press, Boca Raton, FL). Более того, специалист в данной области также знает, как создать пленочные покрытия со специфическими свойствами, как, например, энтеросолюбильные покрытия, пленочные покрытия, которые растворяются при контакте с жидкостями организма, покрытия, контролирующие высвобождение лекарственного средства, покрытия, маскирующие вкус, и дезинтегрирующие покрытия. В особенно предпочтительном варианте выполнения изобретения твердая лекарственная форма изобретения содержит энтеросолюбильное покрытие.
По настоящему изобретению, необходимо понимать, что тризамещенное соединение глицерина присутствует в лекарственном средстве в любом количестве, эффективном для достижения желаемого фармацевтического эффекта, такого как остановка прогрессии опухоли или индуцирование апоптотического эффекта в опухолевых клетках при введении пациенту. Эффективные количества обычно выбираются по ряду факторов, например возраст, рост и общее состояние пациента, и медицинское состояние, подлежащее лечению, и определяются разнообразными средствами, например испытания по систематизации доз, хорошо известные и легко применяемые на практике специалистом в данной области технике.
Обычно количество тризамещенного соединения глицерина формулы (I) в лекарственном средстве по настоящему изобретению составляет менее 400 мкг, предпочтительней в интервале от 30 до 250 мкг и наиболее предпочтительно в интервале от 50 до 150 мкг. В отдельных вариантах выполнения данного изобретения количество тризамещенного соединения глицерина формулы (I) в лекарственном средстве составляет 75 и 100 мкг соответственно.
Суточная доза тризамещенного соединения глицерина в лекарственном средстве, вводимом пациенту, составляет менее 1200 мкг, обычно менее 900 мкг, предпочтительней в интервале от 30 до 600 мкг, еще более предпочтительно в интервале от 40 до 400 мкг и наиболее предпочтительно в интервале от 50 до 350 мкг. В специфических вариантах выполнения данного изобретения суточная доза составляет 75, 100, 150, 200, 225 и 300 мкг. Предпочтительно, чтобы суточная доза тризамещенного соединения глицерина вводилась как однократная доза в виде 1-4 таблеток или капсул. Однако также возможно вводить соединение в форме многократных доз, например двух или трех индивидуальных доз в течение дня, например утром, в обед и вечером.
Применяемый здесь термин «гематологические злокачественные опухоли» (или «гематологические неоплазмы») обозначает все разновидности рака, затрагивающие кровеносную систему, костный мозг или органы лимфатической системы. Гематологические злокачественные опухоли включают среди прочих лейкоз, лимфому, множественную миелому и миелодиспластический синдром.
Применяемый здесь термин «лейкоз» подразумевает под собой все разновидности рака кровеносной системы или костного мозга, характеризующиеся аномальной пролиферацией клеток крови, обычно белых кровяных телец (то есть лейкоцитов). В объеме данного изобретения этот термин включает в себя все острые и хронические формы лейкозов так же как или все формы лимфо- или миелолейкозов. Разновидности лимфолейкозов (или лимфоцитарных лейкозов) характеризуются воздействием на лимфоидные клетки (то есть агранулоциты), такие как лимфоциты и моноциты, в то время, как когда затронуты миелоидные клетки (то есть гранулоциты), такие как эозинофилы, нейтрофилы и базофилы, болезнь относят к миелолейкозам (или к миелогенным лейкозам). В предпочтительных вариантах выполнения изобретения лейкоз выбирается из группы, состоящей из острого миелолейкоза (ОМЛ), острого лимфолейкоза (ОЛЛ), хронического миелолейкоза (ХМЛ) и хронического лимфолейкоза (ХЛЛ).
Применяемый здесь термин «лимфома» подразумевает под собой все формы рака лимфоцитарного происхождения, которые включают в себя лимфому Ходжкина, характеризующуюся обычно происхождением от одного лимфатического узла и присутствием клеток Рида-Стернберга, так же как и все виды неходжкинских лимфом. В предпочтительных вариантах выполнения изобретения, гематологическая злокачественная опухоль выбирается из группы, состоящей из лимфомы Ходжкина и неходжкинской лимфомы.
Применяемый здесь термин «множественная миелома» (так же упоминаемая как «миелома» или «плазмоцитома») обозначает разновидность рака клеток плазмы, то есть клеток иммунной системы в костном мозге, продуцирующих антитела.
Применяемый здесь термин «миелодиспластический синдром» (прежде известный как «предлейкоз») обозначает отличное накопление гематологических состояний, объединенных неэффективным продуцированием клеток крови и различными видами риска трансформации в острый миелолейкоз. Часто присутствует анемия, требующая постоянного переливания крови. Не являясь действительной злокачественной неоплазмой, миелодиспластический синдром тем не менее классифицируется как относящийся к гематологическим неоплазмам.
Лекарственное средство по изобретению можно применять для лечения гематологических опухолей индивидуально или в комбинации с по меньшей мере одним другим фармацевтическим средством, содержащим по меньшей мере один дополнительный активный ингредиент. То есть, такое дополнение тоже находится в объеме настоящего изобретения, где лекарственное средство, содержащее тризамещенное соединение глицерина, применяется совместно с по меньшей мере одним другим фармацевтическим средством, содержащим один или более дополнительные активные ингредиенты, то есть активные ингредиенты, отличные от тризамещенных соединений глицерина, заявленных в пункте 1. В предпочтительных вариантах выполнения изобретения один или более дополнительные активные ингредиенты выбираются из группы, состоящей из антител к одному или более эпитопам на поверхности гематологических клеток (гематопоэтической клетки).
Применяемый здесь термин «антинеопластические агенты» (так же упоминаемый здесь как «цитостатические лекарственные средства») подразумевает под собой фармацевтические средства, которые действует на клеточный кариокинез (то есть митоз) и цитокинез (то есть деление клетки), в частности, в злокачественных клетках (то есть опухолевых клетках), в которых он вызывает замедление, задержку или угнетение вышеуказанных процессов. Также сюда включены цитостатические лекарственные средства, проявляющие еще и цитотоксический эффект, то есть фармацевтические средства, вызывающие гибель клетки путем воздействия на кариокинез и/или цитокинез.
Примерами антинеопластических агентов (цитостатических лекарственных средств), которые можно применять в настоящем изобретении, являются среди прочих алкилирующие агенты, антиметаболиты, растительные алкалоиды, антибиотики, ингибиторы топоизомераз I и/или II, ингибиторы тирозикиназ, ингибиторы протеасом и ДНК интеркалирующие агенты.
Применяемый здесь термин «алкилирующие агенты» обозначает соединения, способные присоединять алкильные группы к различным электроотрицательным группам, присутствующим в клеточных молекулах, таких как нуклеиновые кислоты или белки. Обычно эти соединения воздействуют на рост и прогрессию опухоли через поперечные сшивки гуанина в цепях ДНК. Такая модификация предотвращает раскручивание ДНК и разделение цепей и, следовательно, репликацию ДНК.
В предпочтительных вариантах выполнения изобретения алкилирующие агенты выбираются из группы, содержащей азотистые иприты, нитрозомочевины, производные платины и алкилсульфонаты. Примерами азотистых ипритов являются среди прочих хлорамбуцил (ХЛЛ), циклофосфамид (лимфомы), мелфалан (множественная миелома) и мехлоретамин (лимфомы Ходжкина). Примерами нитрозомочевин среди прочих являются кармустин (лимфомы) и карбоплатин (лимфомы, ОЛЛ). Примерами алкилсульфонатов являются среди прочих бусульфан (ХМЛ) и треосульфан (лимфомы).
Применяемый здесь термин «антиметаболиты» подразумевает под собой химические соединения со структурой, подобной соединению (метаболиту), которое требуется для клеточных биохимических реакций, однако достаточно отличающиеся для того, чтобы не воздействовать на нормальные клеточные функции.
В предпочтительных вариантах выполнения изобретения антиметаболиты выбираются из группы, состоящей из метотрексата (ОЛЛ), аналогов пурина и пиримидиновых аналогов. Примерами аналогов пурина являются среди прочих флударабин (Неходжкинская лимфома, ОМЛ), пентостатин (ХЛЛ) и кладрибин (ХЛЛ), а примерами пиримидиновых аналогов являются среди прочих цитарабин (лийкоз, неходжкинские лимфомы) и децитабин (миелодиспластический синдром).
Примерами растительных алкалоидов (то есть встречающихся в природе или полученных синтетическим путем растительные амины), которые могут быть применены в настоящем изобретении, являются среди прочих винкристин (неходжкинские лимфомы, ОЛЛ) и винбластин (лимфома Ходжкина). Примеры антибиотиков, которые могут быть применены в настоящем изобретении, включают среди прочих митоксантрон (ОМЛ), эпирубицин (лимфомы), доксорубицин (лимфома Ходжкина), даунорубицин (ОМЛ, ОЛЛ) и блеомицин (лимфома Ходжкина). Ингибиторы топоизомераз действуют на нормальную функцию топоизомераз типа I и/или типа II, то есть на ферменты, которые действуют на топологию ДНК. В объеме настоящего изобретения предпочтительным ингибитором топоизомеразы II является этопозид (лимфомы, ОМЛ, ХМЛ) или тенипозид (ОЛЛ).
Остальные антинеопластические агенты, которые необходимо использовать в изобретении, включают в себя среди прочих стероидный гормон дексаметазон (неходжкинские лимфомы), ингибитор тирозинкиназ иматиниб (ХМЛ), ингибитор протеасом бортезомиб (множественная миелома) и ДНК интеркалирующие агенты амсакрин (ОЛЛ, ОМЛ) и талидомид (множественная миелома).
Соответствующее первичное медицинское применение вышеупомянутых антинеопластических агентов в объеме настоящего изобретения указано в скобках. Однако это не препятствует применению любого из этих препаратов для лечения любых других гематологических злокачественных опухолей. Более того, также возможно применять сочетание двух или более этих препаратов для лечения любой гематологической злокачественной опухоли.
В отдельном предпочтительном варианте настоящего изобретения антинеопластические агенты выбираются из группы, состоящей из хлорамбуцила, циклофосфамида, мелфалана, мехлоретамина, кармустина, цисплатина, карбоплатина, бусульфана, треосульфана, метотрексата, флударабина, клофарабина, пентостатина, кладрибина, цитарабина, децитабина, винкристина, винбластина, митоксантрона, эпирубицина, доксорубицина, даунорубицина, блеомицина, этопозида, тенипозида, дексаметазона, иматиниба, бортезомиба, амсакрина и талидомида.
Антитела, применяемые в настоящем изобретении, включают моноклональные и поликлональные антитела к одному или более эпитопам на поверхности гематологических (гематопоэтической) клеток. Применяемый здесь термин «гематологические (гематопоэтические) клетки» обозначает все клетки гематопоэтического происхождения, включая клетки миелоидного и лимфоцитарного происхождения. Применяемый здесь термин «к одному или более эпитопам на поверхности клетки» подразумевает под собой тот факт, что антитело, применяемое в настоящем изобретении, может распознавать/связывать одну или более молекул клеточной поверхности (то есть эпитопов) гематологической клетки.
В предпочтительных вариантах выполнения изобретения антитело является моноклональным антителом, то есть антителом к специфическому антигену, которое производится популяцией В-лимфоцитов, которые все являются клонами одной первоначальной клетки, продуцирующей антитела. Антитело может быть человеческим или химерным (гуманизированным) антителом, например химерным антителом мыши/человека. Способы получения таких «сконструированных» моноклональных антител хорошо известны в области техники (см., например, Colligan, J.E. et al (2002) Current Protocols in Immunology, Wiley & Sons, Hoboken, NJ).
Примерами таких антител, которые могут быть применены в настоящем изобретении, являются среди прочих алемтузумаб (анти-CD52; ХЛЛ, лимфомы), ритуксимаб (анти-CD20; ХЛЛ, неходжкинская лимфома), гентузумаб озогамицин (анти-CD33, ОМЛ).
Во втором объекте настоящее изобретение относится к соответствующим способам для предотвращения и/или для лечения гематологических злокачественных опухолей, где способ содержит:
(a) введение пациенту лекарственного средства или комбинации лекарственных средств, как определено в изобретении.
Как схематически описано выше, лекарственное средство или комбинация лекарственных средств по настоящему изобретению могут вводиться любым парентеральным или непарентеральным путем. В случае применения комбинации лекарственных средств, индивидуальные фармацевтические средства могут вводиться одним и тем же или разными путями. Предпочтительно лекарственное средство, содержащее тризамещенное соединение глицерина, вводится перорально, и еще более предпочтительно, если лекарственное средство находится в твердой лекарственной форме. Более того, лекарственное средство предпочтительно вводится в виде однократной дозы в форме одной таблетки или одной капсулы в день. Однако также возможно вводить лекарственное средство в форме многократных доз, так, например, как две или три индивидуальные дозы в течение дня. В случае применения комбинации лекарственных средств (как, например, в форме набора из частей), индивидуальные фармацевтические средства (то есть лекарственное средство, содержащее тризамещенное соединение глицерина и по меньшей мере одно другое фармацевтическое средство) могут вводиться одновременно, отдельно или по очереди. Например, возможно вводить одно лекарственное средство во время еды, а другой через один или более часов.
В предпочтительном варианте выполнения изобретения, способ, кроме того, содержит:
(b) определение степени экспрессии гена Fas рецептора в одной или более злокачественных клетках у пациента, которому необходимо проводить курс лечения, перед введением лекарственного средства или комбинации лекарственных средств.
Как уже схематично описывалось выше, рецептор клеточной гибели Fas (так же известный как АРО-1 или CD95) был идентифицирован как клеточная мишень для 1-O-октадецил-1-O-метил-глицеро-3-фосфохолина (см., например, Gajate, С.et al (2004) J. Exp. Med. 200, 353-365; Nieto-Miguel, T. et al (2006) J. Biol. Chem. 281, 14833-14840). В объеме настоящего изобретения было обнаружено, что злокачественные гематологические клетки (то есть опухолевые клетки), гиперэкспрессирующие Fas рецептор, показывают увеличенную чувствительность к лечению лекарственным средством, как определено в формуле изобретения.
Применяемый здесь термин «экспрессия» или «экспрессия генов» подразумевает под собой сумму регуляторных сигнальных путей, превращающих информацию, закодированную в последовательности нуклеиновых кислот гена, в первую очередь, в матричную-РНК (мРНК), а затем в белок. Соответственно, экспрессия гена содержит его транскрипцию в первичную гетерогенную ядерную РНК (гяРНК), процессинг этой гяРНК в зрелую матричную РНК и трансляцию последовательности мРНК в соответствующую аминокислотную последовательность белка.
Применяемый здесь термин «гиперэкспрессирующий» подразумевает под собой уровень экспрессии, составляющий по меньшей мере 100% от уровня экспрессии у незлокачественных (нетуморогенных) клеток контроля (то есть клеток дикого типа). Соответственно, в одном из вариантов выполнения изобретения способ, кроме того, содержит сравнение результатов измерения, полученных на опухолевых клетках, с результатами, полученными на одной или более контрольных клеток здорового организма.
Термин «определение» подразумевает под собой любой способ для определения «продукта экспрессии гена». В объеме настоящего изобретения термин «продукт экспрессии гена» подразумевает не только белок, закодированный в гене, но и соответствующую мРНК, которую можно назвать «первым продуктом экспрессии гена» во время экспрессии генов. Эти способы содержат хорошо известные в области технике стандартные процедуры (см., например, Sambrook, J. et al (1989) Molecular Cloning: A Laboratory Manual. 2nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Ausubel, F.M. et al (2001) Current Protocols in Molecular Biology. Wiley & Sons, Hoboken, NJ). Примерами таких способов являются ОТ-ПЦР, тест, основанный на защите от РНКазы, Нозерн блоттинг, Вестерн блоттинг, иммуноферментный анализ, радиоиммунный анализ или флуоресцентное титрование.
Например, содержание мРНК можно определить путем гибридиза