Тризамещенные 1,2,4-триазолы
Иллюстрации
Показать всеОписываются новые тризамещенные 1,2,4-триазолы общей формулы (I)
(значения радикалов приведены в формуле изобретения), или их фармацевтически приемлемые соли, или гидраты, или сольваты и фармацевтическая композиция, их содержащая. Новые соединения относятся к потенциальным позитивным аллостерическим модуляторам никотиновых рецепторов ацетилхолина, которые проявляют способность увеличивать эффективность агонистов никотиновых рецепторов, и могут найти применение в медицине при лечении психических расстройств, снижений или нарушений интеллектуальной деятельности, воспалительных заболеваний или состояний. 2 н. и 7 з.п., 7 табл., 9 пр.
Реферат
Настоящее изобретение относится к замещенным производным 1-алкил-3-анилин-5-арилтриазола и к их фармацевтически приемлемым солям, способам их получения, содержащим их фармацевтическим композициям и к их применению в терапии. Изобретение относится к избирательным положительным аллостерическим модуляторам α7-никотинового рецептора ацетилхолина, обладающим способностью усиливать эффективность агонистов никотиновых рецепторов.
Предыдущий уровень техники в данной области
Европейский патент ЕР 1044970 описывает 3-алкиламино-1,2,4-триазолы в качестве лигандов рецептора нейропептида Y.
В статье автор Makara G.M. et al. (Organic Letters (2002) Vol. 4 (10); 1751-1754) описывает твердофазный синтез 3-алкиламино-1,2,4-триазолов и сообщает о безуспешном синтезе N-(4-метоксифенил)-1-метил-5-(4-метилфенил)-1Н-1,2,4-триазол-3-амина, и не указывается о возможных терапевтических применениях указанного выше соединения, в частности, по поводу его использования в качестве позитивного аллостерического модулятора α7-никотинового рецептора ацетилхолина.
Chen Chen et al. в Bioorganic & Medicinal Chemistry letters 11 (2001) 3165-3168 описывает синтез 1-алкил-3-амино-5-арил-1Н-[1,2,4]триазолов, в частности N-(2-метоксифенил)-1-метил-5-(2,4-дихлорфенил)-1Н-1,2,4-триазол-3-амина, и их использование в качестве антагонистов кортикотропин-релизинг-фактора-1 (CRF1).
Предпосылки к созданию изобретения
Как правило, холинергические рецепторы связываются с эндогенным нейротрансмиттером ацетилхолином (АХ, ACh), тем самым стимулируя открытие ионных каналов. Рецепторы АХ в центральной нервной системе млекопитающих можно разделить на мускариновые (мАХР, mAChR) и никотиновые (нАХР, nAChR) подтипы, основываясь на агонистических активностях мускарина и никотина соответственно. Никотиновые рецепторы ацетилхолина являются лиганд-управляемыми ионными каналами, состоящими из пяти субъединиц. Члены семейства генов субъединиц нАХР были разделены на две группы на основании кодируемых ими аминокислотных последовательностей; одна группа, содержащая так называемые β субъединицы, и вторая группа, содержащая α субъединицы. Было показано, что три типа α субъединиц, α7, α8 и α9, образуют функциональные рецепторы при экспрессии только одного типа, и, соответственно, предположили, что они образуют гомоолигомерные пентамерные рецепторы.
Модель н-АХР аллостерического переходного состояния нАХР была разработана, включает, по меньшей мере, состояние покоя, активированное состояние и “десенситизированное” состояние закрытого ионного канала, которое характеризуется тем, что рецепторы становятся нечувствительными к агонисту. Различные лиганды нАХР могут стабилизировать конформационное состояние рецептора, с которым они предпочтительно связываются. Например, агонисты АХ и (-)-никотина стабилизируют соответственно активные и десенситизированные состояния.
Изменения активности никотиновых рецепторов были отмечены в ряде заболеваний. Некоторые из них, например миастения гравис и аутосомно-доминантная ночная лобная эпилепсия (ADNFLE), ассоциированы со снижениями активности передачи сигнала посредством никотиновых рецепторов либо вследствие уменьшения числа рецепторов, либо вследствие повышения десенситизации.
Предполагается, что снижение числа никотиновых рецепторов опосредует когнитивные расстройства, наблюдаемые при заболеваниях, таких как болезнь Альцгеймера и шизофрения.
Эффекты никотина из табака также опосредуются никотиновыми рецепторами, и поскольку действие никотина заключается в стабилизации рецепторов в десенситизированном состоянии, повышенная активность никотиновых рецепторов может ослабить желание курить.
Соединения, связывающиеся с нАХР, были предложены для лечения ряда заболеваний, связанных со снижением холинергической функции, таких как дефицит научения, нарушение познавательной способности, расстройство внимания или потеря памяти. Модуляция активности α7-никотиновых рецепторов, как полагают, окажет благоприятное воздействие в ряде заболеваний, включающих болезнь Альцгеймера, деменцию, развивающуюся при болезни диффузных телец Леви, синдром гиперактивности с дефицитом внимания, тревогу, шизофрению, маниакальный синдром, биполярную депрессию, болезнь Паркинсона, болезнь Гентингтона, синдром Жиля де ля Туретта, травму головного мозга или другие неврологические, дегенеративные или психиатрические расстройства, при которых происходит потеря холинергических синапсов, включающие синдром смены часовых поясов, пристрастие к никотину, боль.
Однако лечение агонистами никотиновых рецепторов, которые оказывают воздействие у того же участка, что и АХ, является проблематичным, поскольку АХ не только активирует, но и блокирует активность рецепторов посредством механизмов, включающих десенситизацию и неконкурентную блокировку. Кроме того, продолжительная активация, по-видимому, вызывает длительную инактивацию. Поэтому можно предположить, что агонисты АХ снижают активность так же, как и усиливают ее.
В целом, у никотиновых рецепторов и особенно у α7-никотинового рецептора десенситизация ограничивает продолжительность действия используемого агониста.
Описание изобретения
К своему удивлению, авторы изобретения обнаружили, что некоторые новые соединения могут увеличивать эффективность агонистов у никотиновых рецепторов ацетилхолина. Соединения, обладающие указанным типом действия, называют как “позитивные аллостерические модуляторы”, и они, вероятно, пригодны для лечения состояний, ассоциированных со снижениями передачи сигнала посредством никотиновых рецепторов. При терапевтическом назначении такие соединения могут восстанавливать межневронную связь без воздействия на временный профиль активации. Кроме того, позитивные аллостерические модуляторы, как полагают, не производят продолжительной инактивации рецепторов, как можно увидеть после повторного или пролонгированного применения агонистов.
Позитивные модуляторы нАХР согласно настоящему изобретению пригодны для лечения или профилактики психических расстройств, снижений или нарушений интеллектуальной деятельности или воспалительных заболеваний или состояний, при которых модуляция α7-никотинового рецептора оказывает благоприятное воздействие.
Настоящее изобретение относится к замещенным производным 1-алкил-3-анилин-5-арилтриазола, проявляющим свойства позитивных аллостерических модуляторов, увеличивающим эффективность агонистов у α7-никотинового рецептора. Изобретение также относится к способам их получения и фармацевтическим композициям, содержащим указанные соединения. Изобретение также относится к соединениям формулы (I) для использования в лечении или предотвращении психических нарушений, снижений или нарушений интеллектуальной деятельности, воспалительных заболеваний или состояний, при которых модуляция α7-никотинового рецептора оказывает благоприятное воздействие. Изобретение также относится к использованию указанных производных для производства лекарственного препарата для лечения или профилактики психических нарушений, снижений или нарушений интеллектуальной деятельности, воспалительных заболеваний или состояний, при которых модуляция α7-никотинового рецептора оказывает благоприятное воздействие.
Соединения согласно настоящему изобретению отличаются по структуре от соединений предыдущего уровня техники в данной области и фармакологически по их активности как позитивных аллостерических модуляторов α7-никотинового рецептора ацетилхолина.
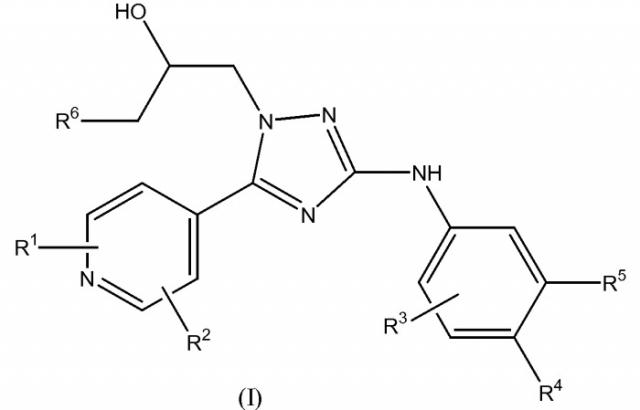
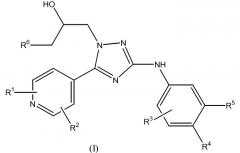
Настоящее изобретение относится к соединению формулы (I)
или к его стереоизомерной форме, где
R1 означает метил, этиламино или метоксиэтиламино;
R2 означает водород или метил;
R3 означает фтор, хлор, трифторметил или метил;
R4 означает водород или фтор;
R5 означает водород, фтор, хлор или метокси;
R6 означает С1-3алкил;
или его фармацевтически приемлемой соли, или гидрату, или сольвату.
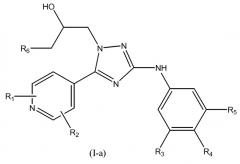
В первом варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I-a)
или к его стереоизомерной форме, где
R1 означает метил, этиламино или метоксиэтиламино;
R2 означает водород или метил;
R3 означает фтор, хлор, трифторметил или метил;
R4 означает водород или фтор;
R5 означает водород, фтор, хлор или метокси;
R6 означает С1-3алкил;
или его фармацевтически приемлемой соли, или гидрату, или сольвату.
Во втором варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I-a)
или к его стереоизомерной форме, где
R1 означает метил, этиламино или метоксиэтиламино;
R2 означает водород или метил;
R3 означает фтор, хлор, трифторметил или метил;
R4 означает водород или фтор;
R5 означает водород, фтор или метокси;
R6 означает С1-3алкил;
или его фармацевтически приемлемой соли, или гидрату, или сольвату.
В третьем варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I) или к его стереоизомерной форме, где
R1 означает 2-метил, 2-этиламино или 2-метоксиэтиламино;
R2 означает водород или 6-метил;
R3 означает фтор, хлор, трифторметил или метил;
R4 означает водород или фтор;
R5 означает водород, фтор, хлор или метокси;
R6 означает С1-3алкил;
или его фармацевтически приемлемой соли, или гидрату, или сольвату.
В четвертом варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I) или к его стереоизомерной форме, где
R1 означает 2-метил, 2-этиламино или 2-метоксиэтиламино;
R2 означает водород или 6-метил;
R3 означает фтор, хлор, трифторметил или метил;
R4 означает водород или фтор;
R5 означает водород, фтор, хлор или метокси;
R6 означает метил;
или его фармацевтически приемлемой соли, или гидрату, или сольвату.
В пятом варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I), имеющему полную R-конфигурацию.
В шестом варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I), имеющему полную S-конфигурацию.
В седьмом варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I), имеющему R3-замещение в орто-положении фенильного кольца.
В восьмом варианте осуществления настоящего изобретения изобретение относится к соединению согласно любому из предыдущих вариантов, где
R5 означает водород, фтор или метокси.
В девятом варианте осуществления изобретения соединение формулы (I) выбирают из группы, состоящей из
(S)-1-[3-(3,4-дифторфениламино)-5-(2,6-диметилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола,
(R)-1-[3-(3-хлорфениламино)-5-(2-этиламинопиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[5-(2,6-диметилпиридин-4-ил)-3-(3-метокси-5-трифторметилфениламино)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[3-(3-фтор-5-метоксифениламино)-5-(2-метилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола HCl-соли,
(S)-1-[3-(3-фтор-5-метоксифениламино)-5-(2-метилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[5-(2,6-диметилпиридин-4-ил)-3-(3-фтор-5-метоксифениламино)-[1,2,4]триазол-1-ил]бутан-2-ола HCl-соли,
(S)-1-[5-(2,6-диметилпиридин-4-ил)-3-(3-фтор-5-метоксифениламино)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[3-(4-фтор-3-метилфениламино)-5-(2-метилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола,
включая их любую стереохимически изомерную форму,
и их фармацевтически приемлемых аддитивных солей и сольватов.
В десятом варианте осуществления изобретения соединение формулы (I) выбирают из группы, состоящей из
(S)-1-[5-(2-метилпиридин-4-ил)-3-(2,3,4-трифторфениламино)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[5-(2,6-диметилпиридин-4-ил)-3-(2,3,4-трифторфениламино)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[5-(2,6-диметилпиридин-4-ил)-3-(2,3,4-трифторфениламино)-[1,2,4]триазол-1-ил]бутан-2-ола HCl-соли,
(S)-1-[3-(3-хлор-2-фторфениламино)-5-(2,6-диметилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[3-(3-хлор-2-фторфениламино)-5-(2,6-диметилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола HCl-соли,
включая их любую стереохимически изомерную форму,
и их фармацевтически приемлемых аддитивных солей и сольватов.
В другом варианте осуществления изобретения настоящее изобретение предпочтительно относится к (S)-1-[3-(3,4-дифторфениламино)-5-(2,6-диметилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-олу или (R)-1-[3-(3-хлорфениламино)-5-(2-этиламинопиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-олу.
Соединения формулы (I) и их аддитивные соли, гидраты и сольваты содержат один или более центров хиральности и существуют в виде стереохимически изомерных форм.
Термин “стереохимически изомерные формы”, используемый в описании, определяет все возможные стереоизомерные формы, в которых соединения формулы (I) и их аддитивные соли могут существовать. Если не указано иное, химическое обозначение соединений указывает на смесь всех возможных стереохимически изомерных форм, где указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры, в также каждую из индивидуальных изомерных форм формулы (I) и их соли, сольваты, в основном свободные, т.е. ассоциированные менее чем с 10%, предпочтительно менее чем с 5%, в частности менее чем с 2%, и наиболее предпочтительно менее чем с 1% других изомеров. Очевидно, стереохимически изомерные формы соединений формулы (I) предназначены быть включенными в объем настоящего изобретения.
Для терапевтического использования соли соединений формулы (I) являются такими солями, у которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, в получении или очистке фармацевтически приемлемого соединения. Все соли, являются ли они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения.
Фармацевтически приемлемые аддитивные соли кислоты и основания, представленные в описании, предназначены, чтобы включить типы терапевтически активных нетоксичных аддитивных солей кислоты и основания, которые соединения формулы (I) могут образовывать. Фармацевтически приемлемые кислотно-аддитивные соли могут быть получены подходящим образом путем обработки основной формы соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например хлористоводородная или бромистоводородная кислота, серная, азотная, фосфорная и тому подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и тому подобные кислоты. В свою очередь, указанные солевые формы могут быть превращены обработкой соответствующим основанием в свободную основную форму.
Термин «сольваты» относится к гидратам и алкоголятам, которые могут образовывать соединения формулы (I), а также их соли.
Некоторые из соединений формулы (I) также могут существовать в их таутомерной форме. Хотя такие формы прямо не указаны в представленной выше формуле, они предназначены быть включенными в объем настоящего изобретения.
Получение соединений
Соединение согласно изобретению обычно можно получать путем осуществления ряда последовательных стадий, каждая из которых известна специалисту в данной области. В частности, соединения в данной заявке на патент могут быть получены согласно одному или более следующим способам получения. На следующих схемах, и если не указано иное, все переменные элементы используют, как определено в формуле (I). L′ представляет собой радикал формулы
или или
и Q представляет собой
где R3, R4 и R5 являются такими, как определено выше.
Соединения согласно данному изобретению могут быть получены любым из нескольких стандартных способов синтеза, обычно используемых специалистами в области органической химии.
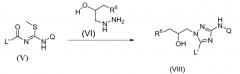
Схема 1
Значимые промежуточные соединения формулы (VIII) обычно можно получить согласно схеме 1 путем превращения N-ацил карбоимидотиокислоты, производного метилового эфира общей формулы (V), в 1,2,4-триазолы формулы (VIII), используя соответствующий гидразин (VI), при известных в данной области условиях. Данное превращение обычно осуществляют в протонном растворителе, таком как метанол или высший спирт, такой как, например, 2-метил-2-пропанол (t-BuOH), и для реакции требуется температура между комнатной температурой и 150°С. В отдельном варианте осуществления изобретения высшим спиртом является третичный бутиловый спирт и температура реакции составляет между 70°С и 120°С, наиболее предпочтительно 100°С. Для указанных реакций, где гидразин (VI) используют в виде HCl-соли, добавление стехиометрического количества основания является предпочтительным. Указанным основанием может быть неорганическое основание, такое как ацетат калия или карбонат калия, наиболее предпочтительно, однако, указанным основанием является третичный амин, такой как диизопропилэтиламин или тому подобное (схема 1). Все переменные элементы на схеме 1 являются такими, как определено выше.
Необязательно, свободная гидроксильная группа в промежуточных соединениях формулы (VIII) может быть защищена обычной защищающей группой (PG), обозначенной в описании (VIII-1), такой как, например, ацетильная группа. Указанный тип взаимодействия может быть осуществлен в присутствии этилацетата. Обычно катализатор, такой как, например, N,N-диметил-4-пиридинамин (DMAP), добавляют. Взаимодействие осуществляют при повышенной температуре, такой как, например, температура кипения с обратным холодильником.
Схема 2
Общее промежуточное соединение (V) в синтезе тризамещенных триазолов согласно настоящему изобретению обычно получают по протоколу, состоящему из 3 синтетических превращений (схема 2), исходным соединением является ацилхлорид общей формулы (II).
На первой стадии ацилирующий реагент, такой как ацилхлорид (II), смешанный или симметричный ангидрид, ацилфторид или тому подобное, взаимодействует с тиоцианатом одновалентного металла-катиона (MNCS на схеме 2), таким как, например, тиоцианат калия или тиоцианат аммония, с получением соответствующего ацилизотиоцианата. Данное взаимодействие обычно осуществляют с использованием ацетона в качестве растворителя и при температуре между 0°С и 70°С, предпочтительно при комнатной температуре.
Промежуточное соединение ацилизотиоцианат не выделяют, а обрабатывают в такой же реакционной среде соответствующим анилином (III) с получением N-ацилтиомочевины общей формулы (IV). Указанное превращение обычно осуществляют при температуре между 0°С и 70°С, предпочтительно при комнатной температуре.
На последней стадии S-метилирование N-ацилтиомочевины (IV) приводит к N-ацилкарбоимидотиокислоте, производному метиловому эфиру общей формулы (V). Для данного конечного превращения требуется присутствие основания, предпочтительно сильного неорганического основания, такого как NaH или карбонат калия, и реакцию осуществляют в апротонном растворителе, таком как, например, ДМФ, ТГФ (тетрагидрофуран) или тому подобное, при температуре, колеблющейся от -70°С до комнатной температуры, предпочтительно 0°С (схема 2).
Схема 3
Спирты-гидразины общей формулы VI могут быть получены из монозамещенного оксирана общей формулы (VII) при нагревании в избытке гидрата гидразина (схема 3). Предпочтительно температура реакции составляет 40-70°С и время реакции составляет 2 часа. Если оксиран (VII) доступен в оптически чистом виде, образовавшийся в результате спирт-гидразин (VI) получают с соответствующей стереохимической идентичностью и чистотой, такой как, например, когда R6=метил. В других примерах в настоящем изобретении указанный выше оксиран (VII) доступен в виде рацемической смеси, и поэтому соответствующие промежуточные соединения и конечные продукты получают в виде рацемических смесей. В таком случае конечные продукты можно получать в энантиомерно чистом виде путем разделения рацемической смеси при использовании хиральной хроматографии. В отдельном варианте осуществления изобретения указанную хиральную хроматографию осуществляют со сверхкритической СО2 в качестве подвижной фазы.
Схема 4
2-Этиламинопиридотриазол общей формулы (Ic) может быть получен путем обработки соответствующего хлорпиридильного предшественника (VIIIa) этиламином в спиртовом растворителе, таком как метанол или 1-бутанол или тому подобное, необязательно в присутствии сорастворителя, такого как ТГФ или тому подобное, и при нагревании при высоких температурах, предпочтительно в области между 140°С и 160°С, в микроволновой печи или при 160°С-180°С в автоклаве (схема 4). Указанное превращение может быть осуществлено в мягких условиях (более низкая температура, такая как между 100°С и 130°С) с использованием в качестве исходного соединения дихлорпиридильного соединения (VIIId) с получением промежуточного соединения общей формулы (VIIIb). Остающийся в (VIIIb) атом хлора может быть удален каталитически, в атмосфере водорода и с использованием Pd/C в качестве катализатора, в присутствии неорганического основания, такого как ацетат калия, или аминного основания, такого как триэтиламин, или тому подобное (схема 4). Альтернативно, когда заместитель Q содержит функциональности, которые несовместимы с условиями каталитического гидрирования, заданное соединение общей формулы (Ic) может быть получено из хлорпиридина общей формулы (VIIIb) путем обработки карбеноподобным катализатором, таким как Pd-катализатор [1,3-бис[2,6-бис(1-метилэтил)фенил]-2-имидазолидинилиден]хлор(η3-2-пропенил)палладий (CAS [478980-01-7]), в присутствии сильного основания, такого как метилат натрия, в протонном растворителе, таком как метанол или 2-пропанол, или тому подобное. Указанную реакцию можно осуществлять при повышенной температуре, такой как 100-120°С, в микроволновой печи (схема 4).
Схема 5
Монометилзамещенный пиридотриазол общей формулы (Ie) может быть получен путем обработки 2-хлорпиридильного предшественника (VIIIa) избытком (3-15 экв.) реагента Гриньяра MeMgBr в присутствии каталитического количества ацетилацетоната железа(III) в органическом растворителе или системе растворителей, состоящей из различных растворителей, такой как, например, смесь ТГФ/NMP. Обычные смеси ТГФ/NMP (1-метил-2-пирролидинон) содержат от 75% до 99% ТГФ и от 1% до 25% NMP по объему. Указанное превращение можно осуществлять в области температур между 0°С и 50°С, наиболее предпочтительно между 0°С и 25°С (схема 5).
Схема 6
Диметилзамещенный пиридотриазол общей формулы (If) может быть получен путем обработки 2,6-дихлорпиридильного предшественника (VIIId) избытком (10-15 экв.) реагента Гриньяра MeMgBr в присутствии каталитического количества ацетилацетоната железа(III) в органическом растворителе или системе растворителей, состоящей из различных растворителей, такой как смесь ТГФ/NMP. Обычные смеси ТГФ/NMP (1-метил-2-пирролидинон) содержат от 75% до 99% ТГФ и от 1% до 25% NMP по объему. Указанное превращение можно осуществлять в области температур между 0°С и 50°С, наиболее предпочтительно между 0°С и 25°С (схема 6).
Схема 7
Альтернативно, монометилзамещенный пиридотриазол общей формулы (Ie) и диметилзамещенный пиридотриазол общей формулы (If) могут быть получены через общее промежуточное соединение (VIIIg) (схема 7). Реакция с реагентом Гриньяра MeMgBr, катализируемая ацетилацетонатом железа(III), при использовании описанных выше условий приводит к конечному соединению (If) (схема 7). При каталитическом гидрировании промежуточного соединения (VIIIg) с использованием известных в данной области условий, описанных выше, образуется конечное соединение (Ie). Альтернативно, когда заместитель Q содержит функциональности, которые несовместимы с условиями каталитического гидрирования, заданное соединение общей формулы (Ie) может быть получено из хлорпиридина общей формулы (VIIIg) путем обработки карбеноподобным катализатором, таким как Pd-катализатор [1,3-бис[2,6-бис(1-метилэтил)фенил]-2-имидазолидинилиден]хлор(η3-2-пропенил)палладий (CAS [478980-01-7]), в присутствии сильного основания, такого как метилат натрия, в протонном растворителе, таком как метанол или 2-пропанол, или тому подобное. Указанную реакцию можно осуществлять при повышенной температуре, такой как 100-120°С, в микроволновой печи.
В случае когда промежуточное соединение (VIIIg) имеет защищенную гидроксильную группу, такую как, например, ацетат, соединение общей формулы (If) может быть получено путем взаимодействия с реагентом Гриньяра MeMgBr, катализируемого ацетилацетонатом железа(III), в присутствии органического растворителя или смеси органических растворителей, такой как, например, смесь NMP и ТГФ. Для облегчения удаления защитной группы (такой как, например, ацетильная группа), к реакционной смеси необязательно можно добавлять основание, такое как, например, NaOH.
Фармакология
Соединения согласно настоящему изобретению, как было обнаружено, являются позитивными аллостерическими модуляторами α7-никотинового рецептора. Никотиновый рецептор α7 (α7-нАХР) принадлежит к суперсемейству “cys-петельных”, ионотропных, лиганд-управляемых ионных каналов, которое включает семейства рецепторов 5-НТ3, GABAA и глицина. Никотиновый рецептор α7 активируется ацетилхолином и его продуктом расщепления холином, и основной характеристикой α7-нАХР является его быстрая десенситизация при постоянном присутствии агониста. Он является вторым наиболее распространенным подтипом рецептора в головном мозге и важным регулятором высвобождения многих нейротрансмиттеров. Он имеет дискретное распределение в некоторых структурах головного мозга, значимых для процессов внимания и познания, таких как гиппокамп и префронтальная кора головного мозга, и связанных с рядом психических и неврологических нарушений у человека. Он также вовлечен в холинергический воспалительный путь.
Генетическое доказательство его связывания с шизофренией представлено в виде прочной связи между признаком шизофрении (нарушение сенсорного регулирования) и локусом α7 на 15q13-14 и полиморфизмами в сердцевинной области промотора гена α7.
Свидетельством патологического состояния является потеря иммунореактивности α7 и α-Btx-связывания в гиппокампе, фронтальной и поясной коре головного мозга при шизофрении, при болезни Паркинсона и болезни Альцгеймера и в паравентрикулярном ядре и соединяющем ядре (nucleus reuniens) при аутизме.
Фармакологические данные, такие как выраженная привычка к курению у больных шизофренией по сравнению с нормальными людьми, интерпретировались как попытка больных посредством самолечения добиться недостаточности никотинергической трансмиссии рецептора α7. Преходящая нормализация нарушений сенсорного регулирования (доимпульсивное подавление PPI) как в модели животных, так и в модели человека, при введении никотина и временном восстановлении нормального сенсорного регулирования у шизофреников, когда холинергическая активность переднего мозга низкая (например, стадия 2 сна), была интерпретирована как результат преходящей активации α7-никотинового рецептора после десенситизации.
Таким образом, имеется основание предположить, что активация α7-нАХР будет оказывать терапевтически благоприятные воздействия при ряде нарушений ЦНС (психических и неврологических).
Как уже упоминалось, α7-нАХР быстро снижает свою чувствительность при постоянном присутствии природного трансмиттера ацетилхолина, а также экзогенных лигандов, таких как никотин. В десенситизированном состоянии рецептор остается связанным с лигандом, но функционально неактивным. Такое состояние не представляет собой проблему для природных трансмиттеров, таких как ацетилхолин и холин, поскольку они являются субстратами для эффективных механизмов расщепления (ацетилхолинэстераза) и выведения (холиновый транспортер). Указанные механизмы расщепления/выведения трансмиттеров, вероятно, позволяют сохранить баланс между активируемым и десенситизированным α7-нАХР в физиологически эффективной области. Однако синтетические агонисты, которые не являются субстратами для природных механизмов расщепления и выведения, рассматриваются как проявляющие потенциальную способность как для повышенной стимуляции, так и направляющие равновесие популяции α7-нАХР в сторону постоянного десенситизированного состояния, которое является нежелательным при нарушениях, где недостаточность экспрессии и функции α7-нАХР играет некоторую роль. Агонисты по своей природе должны таргетировать связывающий карман АХ, который является высококонсервативным у различных подтипов никотиновых рецепторов, что приведет к возможным неблагоприятным реакциям в результате неспецифической активации других подтипов никотиновых рецепторов. Поэтому, чтобы избежать указанных возможных недостатков, альтернативной терапевтической стратегией относительно агонизма α7 является усиление реактивности рецептора по отношению к природным агонистам с помощью позитивных аллостерических модуляторов (РАМ). РАМ определяют как агент, который связывается с участком, отличным от участка связывания агониста, и поэтому не следует ожидать, что он проявит свойства агониста или десенситизации, но он усиливает реактивность 7α-нАХР по отношению к природному трансмиттеру. Значение указанной стратегии заключается в том, что для заданного количества трансмиттера величина ответа α7-нАХР увеличивается в присутствии РАМ относительно уровня трансмиссии, возможной в его отсутствие. Что касается нарушений, при которых существует недостаток белка α7-нАХР, РАМ-индуцированное повышение трансмиссии никотинового холинергического рецептора α7 может оказаться благоприятным. Поскольку РАМ зависит от присутствия природного трансмиттера, возможность повышенной стимуляции ограничивается механизмами расщепления/выведения для природного трансмиттера.
Соединения согласно настоящему изобретению классифицируют как тип 1-4 на основании качественных кинетических характеристик, которые определяют методом фиксации напряжения целой клетки. Данная классификация основана на влиянии РАМ-соединения рецептора α7, как описано выше, на сигнал, вызванный используемым агонистом. В частности, указанным выше агонистом является холин при концентрации 1 мМ. В предпочтительных экспериментальных условиях указанные выше РАМ-соединение рецептора α7 и холин одновременно применяют к клетке, как представлено в описании ниже. Десенситизацию определяют как закрытие рецептора при активации в течение действия агониста применяемым в электрофизиологии методом фиксации напряжения целой клетки, о чем свидетельствует снижение уровня выходящего тока после первоначальной активации агонистом.
Определение типов РАМ 1-4 описано ниже:
| Тип 1 | соединения усиливают размерный эффект тока, вызванного 1 мМ холина, но минимально изменяют кинетику рецептора. В частности, скорость и степень десенситизации, вызванной агонистом, не изменяется. Соединение, модулирующее ответ к 1 мМ холина, поэтому, является близким к линейному изменению ответа к 1 мМ холина в отсутствие РАМ-соединения рецептора α7. |
| Тип 2 | соединения усиливают размерный эффект тока, вызванного 1 мМ холина, в то же время снижают скорость и/или степень десенситизации. |
| Тип 3 | соединения усиливают размерный эффект тока, вызванного 1 мМ холина. Когда соединения тестируют при более высоких концентрациях вплоть до 10 мкМ, они полностью ингибируют десенситизацию, в частности при использовании 1 мМ холина в течение 250 миллисекунд. |
| Тип 4 | соединения способствуют первоначальной десенситизации рецептора с последующим повторным открытием рецептора в течение действия агониста. При концентрациях соединения РАМ рецептора α7 с низкой потенциальной способностью, индуцированная агонистом активация, за которой следует десенситизация, может быть еще отделена от индуцированного соединением повторного открытия как первоначальный входящий ток-максимум. При более высокопотенциальных концентрациях РАМ-соединения рецептора α7 повторное открытие происходит быстрее, чем закрытие вследствие десенситизации, так что первоначальный ток-максимум исчезает. |
Таким образом, целью настоящего изобретения является предоставление способов лечения, которые включают введение либо позитивного аллостерического модулятора как единственного активного вещества, модулирующего активность эндогенных агонистов никотинового рецептора, таких как ацетилхолин или холин, либо введение позитивного аллостерического модулятора вместе с агонистом никотинового рецептора. В отдельном виде этого аспекта изобретения способ лечения включает лечение позитивным аллостерическим модулятором никотинового рецептора α7, как представлено в описании, и агонистом никотинового рецептора α7 или частичным агонистом. Примеры подходящих соединений с агонистической активностью никотинового рецептора α7 включают, но не ограничиваются ими:
- 1,4-диазабицикло[3.2.2]нонан-4-карбоновой кислоты 4-бромфениловый эфир моногидрохлорид (SSR180711A);
- (-)-спиро[1-азабицикло[2.2.2]октан-3,5′-оксазолидин]-2′-он;
- 3-[(2,4-диметокси)бензилиден]анабазеина дигидрохлорид (GTS-21);
- [N-[(3R)-1-азабицикло[2.2.2]окт-3-ил]-4-хлорбензамида гидрохлорид] (PNU-282987).
Положительные модуляторы нАХР согласно настоящему изобретению пригодны для лечения или профилактики психических расстройств, нарушений умственных способностей или заболеваний или состояний, при которых модуляция активности никотинового рецептора α7 является благотворной. Отдельный аспект способа изобретения составляет способ лечения дефицита научения, нарушения познавательной способности, расстройства внимания или потери памяти, модуляция активности никотинового рецептора α7, как предполагается, окажет благоприятный эффект в ряде заболеваний, включающих болезнь Альцгеймера, деменцию, развивающуюся при болезни диффузных телец Леви, синдром гиперактивности с дефицитом внимания, тревогу, шизофрению, маниакальный синдром, биполярную депрессию, болезнь Паркинсона, болезнь Гентингтона, синдром Жиля де ля Туретта, травму головного мозга или другие неврологические, дегенеративные или психические расстройства, при которых происходит потеря холинергических синапсов, включающие синдром смены часовых поясов, пристрастие к никотину, боль.
Соединения также могут найти терапевтическое использование в качестве противовоспалительных лекарственных средств, поскольку субъединица никотинового ацетилхолинового рецептора α7 является существенной для ингибирования цитокинового синтеза по холинергическому воспалительному пути. Примерами медицинских показаний, которые можно лечить соединениями, являются эндотоксемия, эндотоксический шок, сепсис, ревматоидный артрит, астма, рассеянный склероз, воспалительное заболевание кишечника, воспалительное заболевание желчного пузыря, болезнь Крона, панкреатит, сердечная недостаточность и отторжение аллотрансплантата.