Эффективные аналоги компстатина
Иллюстрации
Показать всеИзобретение относится к соединениям, содержащим пептиды и пептидомиметики, способные связывать белок С3 и ингибировать активацию комплемента. Указанные соединения проявляют значительно повышенную активность в ингибировании активации комплемента по сравнению с имеющимися в настоящее время соединениями. 15 з.п. ф-лы, 8 ил., 6 табл., 11 пр.
Реферат
Настоящая заявка испрашивает приоритет на основании предварительной заявки на выдачу патента США № 60/740205, поданной 28 ноября 2005, полное содержание которой включено в данное описание в виде ссылки.
Государственная поддержка
В соответствии с 35 U.S.C. §202(c), подтверждается, что правительство Соединенных Штатов может иметь определенные права на описанное в данной публикации изобретение, которое было осуществлено отчасти благодаря финансированию, предоставленному Национальными Институтами Здравоохранения по гранту № GM 62134.
Область техники, к которой относится изобретение
Настоящее изобретение относится к активации каскада комплемента в организме. В частности, настоящее изобретение относится к пептидам и пептидомиметикам, способным связывать белок C3 и ингибировать активацию комплемента.
Уровень техники
Различные публикации, включая патенты, опубликованные заявки, технические статьи и научные статьи, цитируются на протяжении всего описания. Каждая из цитируемых публикаций включена в данное описание в виде ссылки в полном объеме. Полные ссылки публикаций, не полностью цитированных в описании, указаны в конце описания.
Система комплемента является первой линией иммунологической защиты от чужеродных патогенов. Ее активация посредством классического, альтернативного или лецитинового путей приводит к образованию анафилатоксических пептидов C3a и C5a и образованию мембраноатакующего комплекса C5b-9. Компонент комплемента C3 играет центральную роль в активации всех трех путей. Активация C3-конвертазами C3-пути комплемента и его последующее связывание с поверхностью мишени приводит к сборке мембраноатакующего комплекса и, в конечном счете, к повреждению или лизису клеток-мишеней. C3 является уникальным, так как он имеет сложную структуру, которая обеспечивает многообразие разных участков связывания лигандов, которые важны для путей иммунологического надзора и иммунного ответа.
Несоответствующая активация комплемента может приводить к повреждению клетки-хозяина. Комплемент вносит вклад в несколько патологических состояний, включая различные аутоиммунные заболевания, и, как было обнаружено, вносит вклад в другие клинические состояния, такие как респираторный синдром взрослых, инфаркт миокарда, отторжение после ксенотрансплантации и ожоговые поражения. Также было обнаружено, что опосредованное комплементом повреждение ткани возникает в результате ситуаций биологической несовместимости, таких как ситуации, с которыми сталкиваются пациенты, подвергающиеся диализу или искусственному кровообращению.
Опосредованные комплементом повреждения тканей прямо опосредованы мембраноатакующим комплексом и косвенно - образованием C3a и C5a. Такие пептиды индуцируют повреждение благодаря их влиянию на различные клетки, включая нейтрофилы и тучные клетки. In vivo регуляция комплемента на стадиях активации C3 и C5 обеспечивается как плазматическими, так и мембранными белками. Плазматическими белками-ингибиторами являются фактор H и C4-связывающий белок, и регуляторными мембранными белками, расположенными на поверхности клеток, являются рецепторы комплемента 1 (CR1), фактор ускорения распада (DAF) и мембранный кофакторный белок (MCP). Указанные белки ингибируют конвертазы C3 и C5 (мультисубъединичные протеазы), стимулируя диссоциацию мультисубъединичных комплексов и/или инактивируя комплексы посредством протеолиза (катализируемого фактором I). В анализе in vitro идентифицировано несколько фармакологических средств, которые регулируют или модулируют активность комплемента, но в большинстве случаев, как было показано in vivo, они обладали низкой активностью или были токсичными.
До настоящего времени не существует ингибиторов активации комплемента, одобренных для применения в клинике, хотя существуют некоторые кандидаты для клинического применения, в частности, рекомбинантная форма рецептора комплемента 1, известная как растворимый рецептор комплемента 1 (sCR1), и гуманизированное моноклональное анти-C5-антитело (5G1.1-scFv). Показано, что оба указанных вещества супрессируют активацию комплемента в животных моделях in vivo (Kalli K.R. et al., 1994; и Wang et al., 1996). Однако каждое вещество обладает тем недостатком, что является белком с высокой молекулярной массой (240 кД и 26 кД, соответственно), который трудно производить и который необходимо вводить посредством инфузии. Соответственно, в последних исследованиях внимание акцентировано на разработке меньших по размеру активных агентов, которые легче доставлять, которые являются более стабильными и требуют меньших затрат при производстве.
В патенте США №6319897 Lambris et al. описано применение комбинаторных случайных библиотек пептидов в фаговом дисплее для идентификации состоящего из 27 остатков пептида, который связывается с С3 и ингибирует активацию комплемента. Такой пептид укоротили до состоящего из 13 остатков циклического фрагмента, который полностью сохраняет активность, который назван в данной области компстатином. Компстатин ингибирует расщепление С3 до C3a и C3b С3-конвертазами. Компстатин тестировали в серии экспериментов in vitro, in vivo, ex vivo и in vivo/ex vivo и показали, что он: (1) ингибирует активацию комплемента в сыворотке человека (Sahu A. et al., 1996); (2) ингибирует индуцированную гепарином/протамином активацию комплемента у приматов без существенных побочных эффектов (Soulika A.M. et al., 2000); (3) продлевает время жизни ксенотрансплантата от свиньи к человеку, перфузируемого кровью человека (Fiane A.E. et al., 1999a; Fiane A.E. et al., 1999b; и Fiane A.E. et al., 2000); (4) ингибирует активацию комплемента в моделях искусственного кровообращения, плазмафереза и экстракорпоральных контурах при диализе (Nilsson В. et al., 1998); и (5) обладает низкой токсичностью (Furlong S.T. et al., 2000).
Компстатин представляет собой пептид, содержащий последовательность ICVVQDWGHHRCT-NH2 (SEQ ID NO:1), где Cys2 и Cys1 образуют дисульфидный мостик. Его трехмерная структуоа определена с использованием гомоядерной 2D-ЯМР-спектроскопии в комбинации с двумя отдельными экспериментально ограниченными вычислительными методиками. Первая методика включает в себя метрическую геометрию, молекулярную динамику и моделирование отжига (Morikis D. et al., 1998; WO99/13899), а вторая методика включает в себя глобальную оптимизацию (Klepeis et al., J. Computational Chern., 20: 1344-1370, 1999). В структуре компстатина выявлена молекулярная поверхность, которая содержит полярный участок и неполярный участок. Полярный участок включает в себя β-поворот типа I, а неполярный участок содержит дисульфидный мостик. Кроме того, синтезировали серию аналогов с аланиновыми заменами (сканирование аланином) и тестировали в отношении активности, при этом выявили, что четыре остатка β-поворота и дисульфидный мостик с окружающим гидрофобным кластером вносят важный вклад в ингибиторную активность компстатина (Morikis et al., 1998; WO99/13899).
Используя анализ активности комплемента, включающий в себя измерение опосредованного альтернативным путем лизиса эритроцитов, измерили IC50 компстатина, составляющую 12 мкМ. Некоторые тестированные ранее аналоги показали активность, эквивалентную или более высокую, чем активность компстатина. В опубликованной международной заявке № WO2004/026328 описаны аналоги и миметики компстатина с изменениями на N- и C-концах и в положениях 4 и 9, которые придавали повышенную активность в указанном выше анализе. Для некоторых аналогов сообщалось о повышении вплоть до 99-кратного по сравнению с компстатином (см. также Mallik et al., 2005). Разработка аналогов или миметиков компстатина с более высокой активностью может привести к существенному прогрессу в данной области.
Сущность изобретения
Настоящее изобретение относится к аналогам и миметикам ингибирующего комплемент пептида, компстатина (НООС-ICVVQDWGHHRCT-NH2; SEQ ID NO:1), которые обладают улучшенной активностью, связанной с ингибированием комплемента, по сравнению с компстатином.
В одном аспекте отличительным признаком изобретения является соединение, которое ингибирует активацию комплемента, которое включает в себя пептид, имеющий последовательность:
Xaa1-Cys-Val-Xaa2-Gln-Asp-Xaa3-Gly-Xaa4-His-Arg-Cys-Xaa5 SEQ ID NO:26); где:
Xaa1 означает Ile, Val, Leu, Ac-Ile, Ac-Val, Ac-Leu или дипептид, содержащий Gly-Ile;
Xaa2 означает Trp или аналог Trp, при этом аналог Trp имеет более гидрофобный характер по сравнению с Trp, при условии, что если Хаа3 означает Trp, то Xaa2 означает аналог Trp;
Хаа3 означает Trp или аналог Trp, содержащий химическую модификацию в своем индольном цикле, при этом химическая модификация увеличивает потенциал водородной связи индольного цикла;
Хаа4 означает His, Ala, Phe или Trp;
Хаа5 означает L-Thr, D-Thr, Ile, Val, Gly, дипептид, содержащий Thr-Asn, или дипептид, содержащий Thr-Ala, или трипептид, содержащий Thr-Ala-Asn, при этом ОН на карбоксильном конце любой из аминокислот L-Thr, D-Thr, Ile, Val, Gly или Asn необязательно заменен -NH2; и два остатка Cys связаны дисульфидной связью.
В некоторых вариантах Xaa2 принимает участие в неполярном взаимодействии с C3. В других вариантах Xaa3 принимает участие в образовании водородной связи с C3. В других вариантах Xaa2 принимает участие в неполярном взаимодействии в C3, а Xaa3 принимает участие в образовании водородной связи с C3.
В других вариантах аналог Trp Xaa2 представляет собой галогенированный триптофан, такой как 5-фтор-1-триптофан или 6-фтор-1-триптофан. В других вариантах аналог Trp в положении Xaa2 содержит низший алкокси- или низший алкильный заместитель в положении 5, например, 5-метокситриптофан или 5-метилтриптофан. В других вариантах аналог Trp в положении Xaa 2 содержит низший алкильный или низший алкеноильный заместитель в положении 1, примерные варианты включают 1-метилтриптофан или 1-формилтриптофан. В других вариантах аналог Trp Xaa3 представляет собой галогенированный триптофан, такой как 5-фтор-1-триптофан или 6-фтор-1-триптофан.
В некоторых вариантах Xaa2 содержит низший алкеноильный или низший алкильный заместитель в положении 1 триптофана, Xaa3 необязательно содержит галогенированный триптофан, и Xaa4 содержит аланин. В конкретных вариантах Xaa2 означает 1-метилтриптофан или 1-формилтриптофан, и Xaa3 необязательно содержит 5-фтор-1-триптофан. Некоторые примерные соединения согласно изобретению содержат любую из последовательностей SEQ ID NO:15-25.
В некоторых вариантах соединение содержит пептид, полученный экспрессией полинуклеотида, кодирующего пептид. В других вариантах соединение получают, по меньшей мере, частично в результате синтеза пептидов. Также можно использовать комбинацию способов синтеза.
В некоторых вариантах предлагаются аналоги компстатина, в которых соединение пегилировано, примером является соединение, содержащее последовательность SEQ ID NO:36.
В других вариантах аналог компстатина, кроме того, содержит дополнительный пептидный компонент, который продлевает сохранение соединения in vivo. Например, дополнительным пептидным компонентом может быть пептид, связывающий альбумин. Один пример конъюгата компстатинсвязывающий альбумин пептид содержит последовательность SEQ ID NO:39.
Отличительным признаком другого аспекта изобретения является соединение, которое ингибирует активацию комплемента, содержащее непептидный или частичный пептидный миметик последовательности SEQ ID NO:26, или любой из других последовательностей аналогов и конъюгатов, описанных выше. Такие непептидные или частичные пептидные миметики предназначены для связывания C3 и ингибирования активации комплемента с активностью, по меньшей мере, в 100 раз более высокой, чем пептид, содержащий последовательность SEQ ID NO:1 в эквивалентных условиях анализа.
Аналоги, конъюгаты и миметики компстатина согласно изобретению имеют практическое применение для любых целей, для которых применим компстатин, которые известны в данной области и описаны более подробно в данной публикации. Некоторые из таких применений заключаются в приготовлении соединений в виде фармацевтических композиций для введения пациенту. Такие препараты могут содержать фармацевтически приемлемые соли соединений, а также один или несколько фармацевтически приемлемых разбавителей, носителей, эксципиентов и тому подобного, которые известны специалисту в данной области.
Различные отличительные признаки и преимущества настоящего изобретения будут понятны при обращении к подробному описанию, чертежам и примерам, которые следуют далее.
Краткое описание чертежей
Фиг.1. Активность экспрессированного компстатина и его аналогов. Графики зависимости ингибирования комплемента в процентах от концентрации пептида для Ac-V4W/H9A (SEQ ID NO:5) (квадраты) и экспрессированного компстатина с триптофаном (SEQ ID NO:15) (кружки), 5-фтортриптофаном (SEQ ID NO:16) (треугольники), 6-фтортриптофаном (SEQ ID NO:17 (звездочки), 5-гидрокситриптофаном (SEQ ID NO:27) (шестиугольники), 7-азатриптофаном (SEQ ID NO:28) (ромбы).
Фиг.2. Активность синтетических аналогов компстатина. Графики зависимости ингибирования комплемента в процентах от концентрации пептида для Ac-V4W/H9A (SEQ ID NO:5) (квадраты) и аналогов компстатина с включением 5-фтор-1-триптофана в положении 4 (SEQ ID NO:18) (кружки), положении 7 (SEQ ID NO:19) (треугольники), в обоих положениях 4 и 7 (SEQ ID NO:20) (ромбы).
Фиг.3. Активность дополнительных синтетических аналогов компстатина. Графики зависимости ингибирования комплемента в процентах от концентрации пептида для (A) Ac-V4W/H9A (SEQ ID NO:5) (треугольники) по сравнению с Ac-V4(5f-l-W)/H9A (SEQ ID NO:18) (перевернутые треугольники), Ac-V4(5-метил-W)/H9A (SEQ ID NO:22) (кружки), Ac-V4(1-метил-W)/H9A (SEQ ID NO:23) (ромбы), Ac-V4(2-Nal)/H9A (SEQ ID NO:7) (квадраты); (B) Ac-V4W/H9A (SEQ ID NO:5) (треугольники) по сравнению с Ac-V4W/W7(5f-l-W)/H9A (SEQ ID NO:19) (шестиугольники); и (C) компстатина (SEQ ID NO:1) (треугольники) по сравнению с Ac-V4(1-метил-W)/W7(5f-l-W)/H9A (SEQ ID NO:24) (треугольники, ориентированные влево).
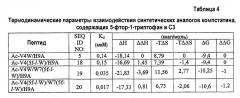
Фиг.4. Термодинамическая характеристика взаимодействия дополнительных аналогов компстатина с C3. Данные ITC, представляющие связывание (A) Ac-V4W/H9A (SEQ ID NO:5); (B) Ac-V4(5f-l-W)/H9A (SEQ ID NO:18); (C) Ac-V4(5-метил-W)/H9A (SEQ ID NO:22); (D) Ac-V4(1-метил-W)/H9A (SEQ ID NO:23); (E) Ac-V4(2-Nal)/H9A (SEQ ID NO:7); и (F) Ac-V4W/W7(5f-l-W)/H9A (SEQ ID NO:19) с C3. Графики получали подгонкой скорректированных исходных данных к модели «один набор участков» в Origin 7.0.
Фиг.5. Графики, показывающие зависимость между гидрофобностью аналогов, обозначенных log P, и константой ингибирования (A), энтропией, обозначенной -TΔS (B), и константой связывания (C).
Фиг.6. Активность дополнительного синтетического аналога компстатина. Графики зависимости ингибирования комплемента в процентах от концентрации пептида для Ac-V4(1-метил-W)/H9A (SEQ ID NO:23) (кружочки) и Ac-V4(1-формил-W)/H9A (SEQ ID NO:25) (квадраты).
Фиг.7. Активность пегилированного аналога компстатина. Графики зависимости ингибирования комплемента в процентах от концентрации пептида для Ac-V4(1-метил-W)/H9A (SEQ ID NO:23) (кружки) и Ac-V4(1-метил-W)/H9A-K-PEG 5000 (SEQ ID NO:36) (квадраты).
Фиг.8. Активность аналога компстатина, конъюгированного со связывающим альбумин белком. Графики зависимости ингибирования комплемента в процентах от концентрации пептида для Ac-V4(1-метил-W)/H9A (SEQ ID NO:23) (кружки) и слитого пептида (Ac- ICV(1MeW)QDWGAHRCTRLIEDICLPRWGCLWEDD-NH2) (SEQ ID NO:39) (квадраты).
Подробное описание иллюстративных вариантов
В описании и формуле изобретения используются различные термины, относящиеся к способам и другим аспектам настоящего изобретения. Таким терминам необходимо придавать их обычное в данной области значение, если не оговорено особо. Другие специально определенные термины необходимо рассматривать в таком смысле, который совместим с приведенным в данном описании определением.
Определения:
В описании и примерах могут быть использованы следующие сокращения: Ac - ацетильная группа; NH2 - амид; MALDI - лазерная десорбция-ионизация с использованием матрицы; TOF - время пролета; ITC - изотермическая титровальная калориметрия; ВЭЖХ - высокоэффективная жидкостная хроматография; NA - неактивный; dT - D-треонин; 2-Nal - 2-нафтилаланин; 1-Nal - 1-нафтилаланин; 2-Igl - 2-инданилглицин; Dht - дигидротриптофан; Bpa - 4-бензоил-L-фенилаланин; 5f-l-W - 5-фтор-l-триптофан; 6f-l-W - 6-фтор-l-триптофан; 5-OH-W - 5-гидрокситриптофан; 5-метокси-W - 5-метокситриптофан; 5-метил-W - 5-метилтриптофан; 1-метил-W - 1-метилтриптофан; для сокращенных названий аминокислот используют стандартную трех- или однобуквенную номенклатуру, например, Trp или W для триптофана.
Термин «примерно», который используют в данном описании по отношению к измеряемому значению, такому как количество, продолжительность во времени и тому подобное, охватывает вариации ±20% или ±10%, в некоторых вариантах ±5%, в некоторых вариантах ±1% и в некоторых вариантах ±0,1% от указанного значения, при этом такие вариации подходят для получения и применения описанных соединений и композиций.
Термины «фармацевтически активный» и «биологически активный» относятся к способности соединений согласно изобретению связывать C3 или его фрагменты и ингибировать активацию комплемента. Такую биологическую активность можно измерить одним или несколькими известными в данной области анализами, которые более подробно описаны в данной публикации.
В используемом в данном описании смысле «алкил» относится к необязательно замещенному насыщенному, имеющему неразветвленную цепь, разветвленную цепь или циклическому углеводороду, содержащему примерно от 1 до 10 атомов углерода (и все комбинации и подкомбинации диапазонов и конкретных количеств атомов углерода), при этом предпочтительно примерно от 1 до 7 атомов углерода. Алкильные группы включают без ограничения метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, циклопентил, изопентил, неопентил, н-гексил, изогексил, циклогексил, циклооктил, адамантил, 3-метилпентил, 2,2-диметилбутил и 2,3-диметилбутил. Термин «низший алкил» относится к необязательно замещенному насыщенному имеющему неразветвленную цепь, разветвленную цепь или циклический углеводород, содержащий примерно от 1 до 5 атомов углерода (и все комбинации и подкомбинации диапазонов и конкретных количеств атомов углерода). Низшие алкильные группы включают без ограничения метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, n-пентил, циклопентил, изопентил и неопентил.
В используемом в данном описании смысле «галоген» относится к F, Cl, Br или I.
В используемом в данном описании смысле «алканоил», который взаимозаменяемо может быть использован с термином «ацил», относится к необязательно замещенному, имеющему неразветвленную или разветвленную цепь алифатическому ацильному остатку, имеющему примерно от 1 до 10 атомов углерода (и все комбинации и подкомбинации диапазонов и конкретных количеств атомов углерода), при этом предпочтительно примерно от 1 до 7 атомов углерода. Алканоильные группы включают без ограничения формил, ацетил, пропионил, бутирил, изобутирил, пентаноил, изопентаноил, 2-метилбутирил, 2,2-диметилпропионил, гексаноил, гептаноил, октаноил и тому подобные. Термин «низший алканоил» относится к необязательно замещенному, имеющему неразветвленную или разветвленную цепь алифатическому ацильному остатку, содержащему примерно от 1 до 5 атомов углерода (и все комбинации и подкомбинации диапазонов и конкретных количеств атомов углерода). Низшие алканоильные группы включают без ограничения формил, ацетил, н-пропионил, изопропионил, бутирил, изобутирил, пентаноил, изопентаноил и тому подобные.
В используемом в данном описании смысле «арил» относится к необязательно замещенной, моно- или бициклической ароматической кольцевой системе, имеющей примерно от 5 до 14 атомов углерода (и все комбинации и подкомбинации диапазонов и конкретных количеств атомов углерода), при этом предпочтительно примерно от 6 до 10 атомов углерода. Неограничивающие примеры включают, например, фенил и нафтил.
В используемом в данном описании смысле «аралкил» относится к алкильным радикалам, несущим арильный заместитель, и имеет примерно от 6 до 20 атомов углерода (и все комбинации и подкомбинации диапазонов и конкретных количеств атомов углерода), при этом предпочтительно примерно от 6 до 12 атомов углерода. Аралкильные группы необязательно могут быть замещены. Неограничивающие примеры включают, например, бензил, нафтилметил, дифенилметил, трифенилметил, фенилэтил и дифенилэтил.
В используемом в данном описании смысле термины «алкоксигруппа» и «алкоксил» относятся к необязательно замещенной алкил-O-группе, в которой алкил имеет ранее определенное значение. Примеры алкоксигрупп и алкоксильных групп включают наряду с другими метокси-, этокси-, н-пропокси-, изопропокси-, н-бутокси- и гептоксигруппу.
В используемом в данном описании смысле «карбоксигруппа» относится к группе -C(=O)OH.
В используемом в данном описании смысле «алкоксикарбонил» относится к группе -C(=O)O-алкил, где алкил имеет определенное ранее значение.
В используемом в данном описании смысле «ароил» относится к -C(=O)-арильной группе, в которой арил имеет определенное ранее значение. Примеры ароильных групп включают бензоил и нафтоил.
Обычно замещенные химические остатки включают один или несколько заместителей, которые замещают водород в выбранных положениях на молекуле. Примеры заместителей включают, например, галоген, алкил, циклоалкил, аралкил, арил, сульфгидрил, гидроксил (-OH), алкоксил, цианогруппу (-CN), карбоксил (-COOH), ацил (алканоил: -C(=O)R), -C(=O)O-алкил, аминокарбонил (-C(O)NH2), -N-замещенный аминокарбонил (-C(=O)NHR”), CF3, CF2CF3 и тому подобные. Что касается указанных выше заместителей, то каждый остаток R” независимо может представлять собой, например, любой из H, алкила, циклоалкила, арила или аралкила.
В используемом в данном описании смысле «L-аминокислота» относится к любой из встречающихся в природе левовращающим альфа-аминокислотам, обычно присутствующих в белках, или сложным алкиловым эфирам таких альфа-аминокислот. Термин «D-аминокислота» относится к правовращающим альфа-аминокислотам. Если не оговорено особо, то все аминокислоты, упоминаемые в данном описании, являются L-аминокислотами.
«Гидрофобное» или «неполярное» используют в данном описании как синонимы, и термины относятся к любому межмолекулярному или внутримолекулярному взаимодействию, которое не характеризуется диполем.
В используемом в данном описании смысле «пи-характер» относится к способности компстатина принимать участие в образовании пи-связи с C3. Пи-связи образуются в результате бокового перекрывания двух параллельных p-орбиталей.
В используемом в данном описании смысле «потенциал водородной связи» относится к способности компстатина принимать участие в электростатическом притяжении с C3, в которое вовлечены электроотрицательные остатки на модифицированных остатках триптофана или аналогах триптофана в компстатине и атомы водорода на C3. Неограничивающим примером такого электроотрицательного остатка является атом фтора.
«Пегилирование» относится к реакции, в которой, по меньшей мере, один остаток полиэтиленгликоля (ПЭГ), независимо от размера, химически связан с белком или пептидом с образованием конъюгата ПЭГ-пептид. «Пегилированный» означает, что, по меньшей мере, один остаток ПЭГ, независимо от размера, химически связан с пептидом или белком. Термин ПЭГ обычно сопровождается числовым индексом, который указывает приблизительную среднюю молекулярную массу полимеров ПЭГ; например, ПЭГ-8000 относится к полиэтиленгликолю, имеющему среднюю молекулярную массу около 8000.
В используемом в данном описании смысле «фармацевтически приемлемые соли» относится к производным заявленных соединений, в которых исходное соединение модифицируют, получая соли кислоты или основания. Примеры фармацевтически приемлемых солей включают без ограничения соли неорганических или органических кислот основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как остатки карбоновых кислот; и тому подобные. Таким образом, термин «кислотно-аддитивная соль» относится к соответствующему производному в виде соли исходного соединения, которое было получено присоединением кислоты. Фармацевтически приемлемые соли включают обычные соли или соли четвертичного аммония исходного соединения, образованные, например, неорганическими или органическими кислотами. Например, такие обычные соли включают без ограничения соли, полученные с использованием неорганических кислот, таких как хлористоводородная, бромистоводородная, серная, сульфаминовая, фосфорная, азотная и тому подобные; и соли, полученные с использованием органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изэтиновая и тому подобные. Некоторые кислотные или основные соединения согласно настоящему изобретению могут существовать в виде цвиттерионов. Все формы соединений, включая свободную кислоту, свободное основание и цвиттерионы, входят в объем настоящего изобретения.
Описание:
Согласно настоящему изобретению информация о биологических и физико-химических свойствах компстатина была использована для конструирования аналогов компстатина, имеющих в значительной степени повышенную активность по сравнению с исходным пептидом компстатина. В некоторых вариантах аналоги имеют, по меньшей мере, в 50 раз более высокую активность, чем активность компстатина. В других вариантах аналоги имеют в 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125 или 130 раз более высокую активность, чем активность компстатина. В других вариантах аналоги имеют 135-, 140-, 145-, 150-, 155-, 160-, 165-, 170-, 175-, 180-, 185-, 190-, 195-, 200-, 205-, 210-, 215-, 220-, 225-, 230-, 235-, 240-, 245-, 250-, 255-, 260-, 265-кратную или более высокую активность, чем компстатин, при сравнении с использованием анализов, описанных в примерах.
Показано, что аналоги компстатина, синтезированные согласно другим способам, обладают немного улучшенной активностью по сравнению с исходным пептидом, т.е. примерно до 99-кратной (Mallik, B. et al., 2005, supra; WO2004/026328). Аналоги, полученные согласно настоящему изобретению, обладают еще более высокой активностью, чем исходный пептид или его аналоги, полученные до настоящего времени, как продемонстрировано в анализах in vitro, которые показаны в данном описании на фигурах и в примерах.
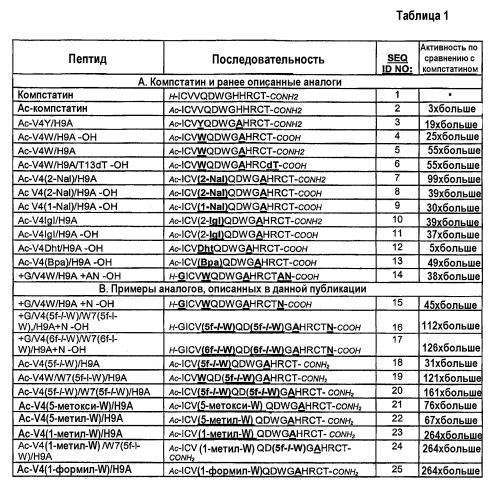
В таблице 1B показана аминокислотная последовательность и ингибирующие комплемент активности компстатина и выбранных аналогов, имеющих в значительной степени повышенную активность. Выбранные аналоги названы по конкретным модификациям требуемых положений (1-13) по сравнению с исходным пептидом, компстатином (SEQ ID NO:1) и с пептидами SEQ NO:2-14, показанными в таблице 1A, которые описаны в WO2004/026328. Пептиды SEQ ID NO:15-24 являются примерами модификаций, осуществленных согласно настоящему изобретению, приводящих к значительно более эффективным аналогам компстатина. Как описано более подробно ниже, будет понятно, что некоторые модификации, осуществленные в триптофане в положении 4, которые указаны в последовательностях SEQ ID NO:2-13, можно комбинировать с заменой аналогом триптофана в положении 7 с образованием дополнительных эффективных аналогов компстатина.
В данной таблице использованы следующие сокращения:
dT = D-треонин
2-Nal = 2-нафтилаланин
1-Nal = 1-нафтилаланин
2-Igl = 2-инданилглицин
Dht = дигидротриптофан
Bpa = 4-бензоил-L-фенилаланин
5f-l-W = 5-фтор-l-триптофан
6f-l-W = 6-фтор-l-триптофан
5-OH-W = 5-гидрокситриптофан
5-метокси-W = 5-метокситриптофан
5-метил-W = 5-метилтриптофан
1-метил-W = 1-метилтриптофан
1-формил-W = 1-формилтритофан
Модификации на N-конце. Ацетилирование N-конца обычно увеличивает ингибирующую комплемент активность компстатина и его аналогов, как можно видеть, в частности, при сравнении последовательностей SEQ ID NO:1 и SEQ ID NO:2. Соответственно, добавление ацильной группы на амино-конце пептида, включая без ограничения N-ацетилирование, является одним предпочтительным вариантом осуществления изобретения, особенно применимым, когда пептиды получают синтетически. Однако иногда преимущество имеет получение пептидов посредством экспрессии молекулы нуклеиновой кислоты, кодирующей пептид, в прокариотической или эукариотической системе экспрессии или транскрипцией и трансляцией in vitro. В случае таких вариантов можно использовать встречающийся в природе N-конец. Один пример аналога компстатина, подходящего для экспрессии in vitro или in vivo, представлен последовательностями SEQ ID NO:15-17, в которых ацетильная группа заменена немодифицированным глицином на N-конце. Последовательности SEQ ID NO:15-17, которые дополнительно содержат модификации в пептидах и на C-концах, которые обсуждаются ниже, примерно в 45 раз и примерно в 125 раз более активны, чем компстатин, в анализе ингибирования комплемента, описанного в данной публикации.
Модификация в пептиде. Используя вычислительные способы для оценки низкоэнергетических последовательностей, ранее было определено, что Tyr и Val являются наиболее вероятными кандидатами в положении 4 для поддержания стабильности и активности пептида (Klepeis J.L. et al., 2003). В WO2004/026328 обсуждалось, что Trp в положении 4, особенно в сочетании с Ala в положении 9, дает во много раз более высокую активность, чем активность исходного пептида (например, сравните активности последовательностей SEQ ID NO:4, 5 и 6 и активности последовательностей SEQ ID NO:2 и 3). В WO2004/026326 также описано, что все пептиды, содержащие аналоги триптофана, 2-нафтилаланин (SEQ ID NO:7, 8), 1-нафтилаланин (SEQ ID NO:9), 2-инданилглицин (SEQ ID NO:10, 11) или дигидротриптофан (SEQ ID NO:12) в положении 4 обладают повышенной ингибирующей комплемент активностью в диапазоне от 5-кратной до 99-кратной по сравнению с активностью компстатина. Кроме того, пептид, содержащий аналог фенилаланина, 4-бензоил-L-аланин в положении 4 (SEQ ID NO:13) имел в 49 раз более высокую активность, чем компстатин.
Согласно настоящему изобретению пептиды, содержащие 5-фтор-l-триптофан (SEQ ID NO:19) или 5-метокси-, 5-метил- или 1-метил-триптофан или 1-формилтриптофан (SEQ ID NO:21, 22, 23 и 25, соответственно) в положении 4 обладают в 31-264 раз более высокой активностью, чем компстатин. Включение 1-метил- или 1-формилтриптофана больше увеличивало активность и аффинность связывания по сравнению с другими аналогами. Предполагается, что опосредованная N индола водородная связь не является обязательной в положении 4 для связывания и активности компстатина. Отсутствие такой водородной связи или уменьшение полярного характера заменой водорода низшим алкилом, алканоилом или азотом индола в положении 4 усиливает связывание и активность компстатина. Не имея намерения ограничиться какой-либо конкретной теорией или механизмом действия, предполагают, что гидрофобное взаимодействие или влияние в положении 4 усиливает взаимодействие компстатина с C3. Соответственно, модификации Trp в положении 4 (например, изменение структуры боковой цепи согласно способам, известным в данной области) или замены аналогами Trp, которые сохраняют или усиливают указанное выше гидрофобное взаимодействие, предполагаются в настоящем изобретении для получения аналогов компстатина с еще более высокой активностью. Такие аналоги хорошо известны в данной области и включают без ограничения аналоги, приведенные в качестве примеров в данном описании, а также их незамещенные или альтернативно замещенные производные. Примеры подходящих аналогов можно найти в следующих публикациях и многих других: Beene, et al. (2002) Biochemistry 41: 10262-10269 (описаны наряду с прочими моногалогенированные и многократно галогенированные аналоги Trp); Babitzky and Yanofsky (1995) J. Biol. Chem. 270: 12452-12456 (описаны наряду с прочим метилированный и галогенированный Trp и другие аналоги Trp и индола); и патенты США 6214790, 6169057, 5776970, 4870097, 4576750 и 4299838. Аналоги Trp могут быть введены в пептид компстатина посредством экспрессии in vitro или in vivo или при синтезе пептидов, как известно в данной области, и более подробно описано в примерах.
В некоторых вариантах Trp в положении 4 компстатина заменяют аналогом, содержащим 1-алкильный заместитель, более конкретно - низший алкильный (например, C1-C5) заместитель, который определен выше. Такие аналоги включают без ограничения N(α)-метилтриптофан и 5-метилтриптофан. В других вариантах Trp в положении 4 компстатина заменяют аналогом, содержащим 1-алканоильный заместитель, более конкретно - низший алканоильный (например, C1-C5) заместитель, который определен выше. Кроме приведенных в качестве примеров аналогов к ним относятся без ограничения 1-ацетил-L-триптофан и L-β-гомотриптофан.
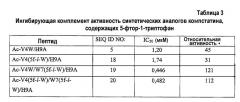
Термодинамические эксперименты показали, что включение 5-фтор-l-триптофана в положение 7 в компстатине увеличивало энтальпию взаимодействия между компстатином и C3 по сравнению с компстатином дикого типа, тогда как включение 5-фтортриптофана в положение 4 в компстатине снижало энтальпию такого взаимодействия. Не имея намерения быть связанными с каким-либо конкретным механизмом, полагают, что первые результаты показывают, что замена атомов водорода индола атомом фтора в остатке Trp в положении 7 компстатина может усиливать потенциал водородной связи индольного цикла, вводить новый потенциал водородной связи или опосредовать взаимодействие с C3 через молекулу воды в области контакта при связывании. (Katragadda M. et al., 2004). Следовательно, модификации Trp в положении 7 (например, изменение структуры боковой цепи согласно способам, известным в данной области) или замены аналогами Trp, которые сохраняют или усиливают указанный выше потенциал водородной связи, или опосредуют взаимодействие с C3 через молекулу воды в области контакта при связывании, предполагаются в настоящем изобретении для получения аналогов с еще более высокой активностью. В некоторых вариантах аналоги Trp, индольные циклы которых имеют модификации, которые приводят к повышенному потенциалу водородной связи или опосредуют взаимодействие с C3 через молекулу воды в области контакта при взаимодействии, могут быть введены в положение 7 пептида компстатина экспрессией in vitro или in vivo, или при пептидном синтезе. Обнаружено, что пептид, содержащий аналог триптофана, 5-фтортриптофан (SEQ ID NO:19) в положении 7 обладает в 121 раз повышенной активностью по сравнению с компстатином.
В другом варианте аналоги Trp вводят в оба положения 4 и 7 молекулы компстатина, а His в положении 9 компстатина необязательно заменяют Ala. Термодинамические эксперименты показали, что введение 5-фтортриптофана в положения 4 и 7 в компстатине увеличивало энтальпию взаимодействия между компстатином и C3 по сравнению с компстатином дикого типа. Соответственно, модификации Trp в положениях 4 и 7 (например, изменение боковой цепи согласно способам, хорошо известным в данной области) или замены аналогами Trp, которые сохраняют или усиливают указанное выше гидрофобное взаимодействие с C3 посредством положения 4 и сохраняют или усиливают указанный выше потенциал водородной связи с C3 посредством положения 7, или взаимодействие с C3 через молекулу воды в области контакта при связывании посредством положения 7, предполагаются в настоящем изобретении для получения аналогов компстатина с еще более высокой активностью. Такие модифицированные Trp или аналоги Trp могут быть введены в пептид компстатина в положениях 4 и 7 экспрессией in vitro или in vivo, или при синтезе пептидов. Обнаружено, что пептиды, содержащие аналог триптофана, 5-фтортриптофан (SEQ ID NO:16), и содержащие аналог триптофана, 6-фтортриптофан (SEQ ID NO:17) в положениях 4 и 7 обладают значительно повышенной активностью по сравнению с компстатином в диапазоне от 112- до 264-кратного увеличения активности. Кроме того, обнаружено, что пептиды, содержащие аналоги триптофана, 1-метилтриптофан в положении 4 и 5-фтортриптофан в положении 7 (SEQ ID NO:24) имеют 264-кратное увеличение активности по сравнению с компстатином.
Модификации на карбоксильном конце. Пептиды, полученные способами синтеза, обычно модифицируют на карбоксильном конце так, чтобы они содержали амид вместо кислоты; такую обычную модификацию можно видеть в таблице 1 в компстатине (SEQ ID NO:1) и нескольких аналогах. Действительно, в некоторых случаях определено, что пептиды, содержащие на конце амид, имеют более высокую активность, чем пептиды, содержащие на конце кислоту (сравни, например, последовательности SEQ ID NO:5 и 7 с последовательностями SEQ ID NO:4 и 8, соответственно).