Олигонуклеотидные праймеры для детекции и типирования генов -лактамаз патогенных буркхольдерий
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и генетике. Предложены олигонуклеотидные праймеры для проведения экспресс-оценки наличия детерминант устойчивости к β-лактамам у изолятов патогенных буркхольдерий методом полимеразной цепной реакции с одновременным определением принадлежности выявленных β-лактамаз к определенному молекулярному классу. Изобретение может быть использовано в медицине и генетике для детекции последовательностей генов хромосомных β-лактамаз патогенных буркхольдерий при расширенном молекулярно-генетическом исследовании штаммов и экспресс-оценки их возможной устойчивости к антибиотикам β-лактамного ряда. 7 ил., 2 табл., 3 пр.
Реферат
Изобретение относится к молекулярной биологии и генетике и может быть использовано для детекции нуклеотидных последовательностей генов хромосомных β-лактамаз патогенных буркхольдерий и определения их принадлежности к определенному молекулярному классу при расширенном молекулярно-генетическом исследовании штаммов данных микроорганизмов и экспресс-оценки их возможной устойчивости к антибиотикам β-лактамного ряда.
Возбудители особо опасных инфекций - сапа (Burkholderia mallei) и мелиоидоза (Burkholderia pseudomallei) - аэробные грамотрицательные не-ферментирующие бактерии, принадлежащие к роду Burkholderia β-подкласса протеобактерий семейства Burkholderiaceae. В настоящее время род Burkholderia включает более 50 видов микроорганизмов и представляет собой довольно гетерогенную таксономическую группу, объединяющую сапрофиты, фитопатогены и патогены теплокровных животных.
Мелиоидоз эндемичен для влажных тропических и субтропических регионов Юго-Восточной Азии, Северной Австралии, Западной Африки и Латинской Америки. Довольно большое число спорадических случаев заболевания, связанных с заносом из эндемичных регионов, в последнее время было отмечено для ряда стран умеренного климатического пояса. Возможность заноса возбудителя сапа с территорий, где он постоянно регистрируется у сельскохозяйственных животных (Монголия, Турция, Иран, Пакистан, Саудовская Аравия), также весьма вероятна. Оба микроорганизма относятся к агентам II группы патогенности, все работы с которыми строго регламентированы СП 1.3.1285-03 «Безопасность работы с микроорганизмами I-II групп патогенности (опасности)».
Характерным и важным биологическим свойством патогенных буркхольдерий и близких им микроорганизмов является высокая природная резистентность к широкому спектру антимикробных соединений. Наличие этого свойства создает значительные трудности для эффективного лечения вызываемых ими заболеваний. Необходимо отметить, что биологические основы полирезистентности у большинства видов Burkholderia на сегодняшний день являются мало исследованными.
Антибиотики β-лактамного ряда стандартно используются в терапии мелиоидоза и сапа. В геномах патогенных буркхольдерий первично аннотированы многочисленные последовательности β-лактамаз классов A, B и D. Исследование данных детерминант важно как в плане более полного понимания механизмов антибиотикоустойчивости буркхольдерий, так и в аспекте совершенствования схем лечения вызываемых ими инфекций, генодиагностики и молекулярно-эпидемиологического мониторинга полирезистентных штаммов.
Полимеразная цепная реакция (ПЦР) является прямым методом выявления ДНК и обладает высокой специфичностью и чувствительностью. В основе метода ПЦР лежит природный процесс репликации ДНК - комплементарное достраивание ДНК матрицы, осуществляемое с помощью фермента ДНК-полимеразы. Процесс удвоения нуклеиновых кислот можно использовать для получения копий фрагментов ДНК, специфичных для конкретных определенных типов генетических последовательностей, например, генов, ответственных за реализацию важных биологических свойств микроорганизмов, в число которых входят и гены антибиотикоустойчивости.
Для эффективного проведения ПЦР необходимы праймеры - синтетические олигонуклеотиды определенного размера, специфические для исследуемой генетической мишени. Праймеры комплементарны последовательностям ДНК на левой и правой границах детектируемого фрагмента и ориентированы таким образом, что достраивание новой цепи ДНК проходит только между ними. В результате ПЦР происходит многократное увеличение числа копий (амплификация) специфического участка гена, катализируемое ферментом ДНК-полимеразой. Выбор ДНК-мишени и подбор праймеров играет важнейшую роль в специфичности проведения амплификации.
Близкими аналогами можно считать олигонуклеотидные затравки, использованные в нескольких работах для амплификации, последующего клонирования и функциональной характеристики генов пенициллиназы (репА) и оксациллиназы (оха) возбудителя мелиоидоза [Niumsup P., Wuthiekanun V. Cloning of the class D β-lactamase gene from Burkholderia pseudomallei and studies on its expression in ceftazidime-susceptible and resistant strains // J. Antimicrob Chemother. - 2002. - Vol.50. - P.445-455; Ho P., Cheung Т., Yam W., Yuen K. Characterization of a laboratory-generated variant of BPS β-lactamase from Burkholderia pseudomallei that hydrolyses ceftazidime // J. Antimicrob Chemother. - 2002. - Vol.50. - P.723-726; Cheung Т., Ho P., Woo P., Yuen K., Chau P. Cloning and expression of class A β-lactamase gene blaABPS in Burkholderia pseudomallei // Antimicrob Agents Chemother. - 2002. - Vol.46. - P.1132-1135]. В данных работах были использованы праймеры, фланкирующие полную кодирующую последовательность соответствующих генов для их клонирования в гетерологичных системах и оценки характера мутационных изменений при формировании резистентности к ампициллину, оксациллину и цефтазидиму. Вместе с тем, единого набора олигонуклеотидных праймеров для детекции последовательностей β-лактамаз классов A (пенициллиназы), B (металло- β-лактамазы) и D (оксациллиназы, цефалоспориназы) у патогенных видов рода Burkholderia (B.pseudomallei, B.mallei) до настоящего времени предложено не было.
Целью настоящего изобретения является разработка олигонуклеотидных праймеров для проведения экспресс-оценки наличия детерминант устойчивости к β-лактамам у изолятов патогенных буркхольдерий методом полимеразной цепной реакции с одновременным определением принадлежности выявленных β-лактамаз к определенному молекулярному классу.
Цель достигается конструированием специфичных олигонуклеотидов для выявления фрагментов последовательностей генов β-лактамаз буркхольдерий, принадлежащих к молекулярным классам A, B и D по Ambler [Ambler R. The structure of β-lactamases // Philos Trans R Soc Lond (Biol.). - 1980. - Vol.289. - P.321-331].
Сконструированные олигонуклеотиды обладают активностью прямого и обратного праймеров в реакции амплификации и имеют следующую структуру:
Характеристика олигонуклеотидных праймеров и участков амплифицируемой ДНК.
На основе геномных сиквенсов микроорганизмов рода Burkholderia, представленных в общедоступных генетических базах данных (Genbank, EMBL, DDBJ), были подобраны пары праймеров, комплементарные фрагментам генов хромосомных β-лактамаз класса A (праймеры bm1F1-bm4R1), 3 типов металло-β-лактамаз класса B (праймеры bm1F2-bm14R2, bps1F3-bps1R3, bps3F5-bps8R5) и β-лактамаз класса D (праймеры bps1F4-bps8R4). Характеристика генетических мишеней для данного набора праймеров и ожидаемые размеры амплифицируемых фрагментов ДНК приведены в таблице 1.
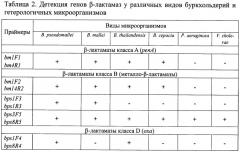
Оценка специфичности сконструированных праймеров была проведена на образцах геномной ДНК штаммов возбудителей мелиоидоза и сапа, родственных видов буркхольдерий (B.thailandensis, B.cepacia, B.cenocepacia, B.B.multivorans) и гетерологичных микроорганизмов (Pseudomonas aeruginosa, Vibrio cholera) коллекционного центра ФГУЗ ВолгоградНИПЧИ Роспотреб-надзора.
По результатам ПЦР (табл.2), ген penA (праймеры bm1F1-bm4R1) обнаруживается только у штаммов различных видов буркхольдерий. Вариант гена металло-β-лактамазы класса B (праймеры bm1F2-bm14R2) также характерен лишь для видов буркхольдерий. Вариант металло-β-лактамазы класса B (праймеры bps1F3-bps1R3) детектируется только в штаммах B.pseudomallei и B.mallei, тогда как другой вариант металло-β-лактамазы (праймеры bps3F5-bps8R5) обнаруживается как у различных видов буркхольдерий, так и видов отдаленной гетерологии. Ген β-лактамазы класса D (праймеры bps1F4-bps8R4) присутствует только в штаммах B.pseudomallei и B.thailandensis.
Примеры конкретного выполнения
Пример 1. Алгоритм конструирования олигонуклеотидных праймеров для детекции фрагментов последовательностей генов β-лактамаз патогенных буркхольдерий, принадлежащих к молекулярным классам A, B и D.
Выбор кодирующих последовательностей геномов Burkholderia, гомологичных известным генам β-лактамаз, был проведен на основе анализа девяти первично аннотированных геномов B.pseudomallei, B.mallei и близкородственного непатогенного вида B.thailandensis (Genbank access. СР000011, CP000545, CP000547, CP000525, CP000572, CP000124, CP000570, BX571965, CP000085), а также 12 частично аннотированных геномов штаммов данных видов микроорганизмов, представленных в GenBank NCBI (www.ncbi.nlm.nih.gov) и базе данных геномных проектов J. Craig Venter Institute (http://gsc.jcvi.org/projects).
Принадлежность генов буркхольдерий к различным молекулярным классам была проанализирована с помощью базы данных InterProScan (www.ebi.ac.uk/Tools/InterProScan). Определение консервативных и вариабельных фрагментов сиквенсов было проведено с использованием процедуры множественного выравнивания по алгоритму ClustalW [Thompson J., Higgins D., Gibson T. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice // Nucleic Acids Res. - 1994. - Vol.22. - P.4673-4680]. Консервативные аминокислотные мотивы β-лактамаз анализировали средствами сервера ТМНММ v.2.0 (www.cbs.dtu.dk/semses/TMHMM).
Всего было выбрано 118 кодирующих последовательностей β-лактамаз, формирующих 5 групп гомологии и относящихся к молекулярным классам A (1 группа), В (3 группы) и D (1 группа).
С помощью программы FastPCR v.6.1.72 (PrimerDigital Ltd.) было сгенерировано 42 пары олигонуклеотидных праймеров, комплементарных консервативным фрагментам нуклеотидных последовательностей генов β-лактамаз, входящих в обозначенные 5 групп гомологии. Далее была проведена оценка специфичности всех предварительных вариантов пар праймеров на последовательностях геномных сиквенсов бактерий с использованием алгоритма PrimerBLAST (http://www.ncbi.nlm.nih.gov/tools/primer-blast). В результате окончательно были подобраны 5 пар олигонуклеотидов, комплементарных фрагментам генов классов A, B и D буркхольдерий: пара праймеров bm1F1-bm4R1 для детекции генов β-лактамаз класса A (penA); 3 пары праймеров для детекции различных вариантов генов β-лактамаз класса B - пары праймеров bm1F2-bm14R2, bps1F3-bps1R3, bps3F5-bps8R5 и пара праймеров, специфичных генам β-лактамаз класса D-bps1F4-bps8R4.
Пример 2. Экспериментальная оценка специфичности сконструированных праймеров.
Экспериментальная оценка специфичности сконструированных праймеров была проведена на образцах геномной ДНК штаммов возбудителей мелиоидоза и сапа, родственных видов буркхольдерий и гетерологичных микроорганизмов.
Для выделения ДНК используется процедура протеиназного лизиса в присутствии неионного детергента Nonidet Р-40 [Comey С. et al. DNA extraction strategies for amplified fragment length polymorphism analysis // J. Forensic Sci. - 1994. - Vol.39. - P.1254-1257], позволяющая получать высокомолекулярную малофрагментированную геномную ДНК. Выделение ДНК проводят из 200 мкл бактериальной суспензии плотностью 2×109 микробных клеток в миллилитре.
Для постановки ПНР используется ДНК-амплификатор С1000 (Bio-Rad) с 96-луночным реакционным блоком. Программа амплификации для всех пар праймеров состоит из этапов начального прогрева проб 94°C 5 мин, 35 реакционных циклов (денатурация 94°C 30 с, отжиг праймеров 59.9°C 30 с, удлинение цепи 72°C 45 с) и финальной элонгации 72°C 1 мин.
Объем реакционной смеси на 1 пробу составляет 15 мкл. В состав реакционной смеси входят праймеры в конечной концентрации 15 пМ, 1 Ед. ДиаТак ДНК-полимеразы и 1×ПЦР-буфер с дНТФ и MgCl2 (ILS, Россия). Анализируемые препараты геномной ДНК вносят в реакционную смесь в объеме 3-5 мкл и наслаивают в каждую пробирку 1 каплю минерального масла.
Продукты ПНР анализируют электрофорезом в 1.5% агарозном геле и визуализируют окрашиванием бромистым этидием. Размер ампликона оценивают, сравнивая его подвижность с подвижностью полос маркерных фрагментов ДНК.
Результаты ПЦР-детекции последовательностей β-лактамаз различных молекулярных классов приводятся на рисунках 1-5. Фрагмент гена penА размером 680 п.н. (праймеры bm1F1-bm4R1) обнаружен в геномах всех исследованных штаммов B.pseudomallei, B.mallei, B.thailandensis и B.cepacia. Специфический участок гена металло-β-лактамазы класса B (праймеры bm1F2-bm14R2) размером 352 п.н. обнаружен также только у видов буркхольдерий. Фрагмент гена металло-β-лактамазы класса B (праймеры bps1F3-bps1R3) размером 727 п.н. отмечен только в штаммах B.pseudomallei и B.mallei. Вариант металло-β-лактамазы (праймеры bps3F5-bps8R5, размер ампликона 190 п.н.) обнаруживается как у видов буркхольдерий, так и видов отдаленной гетерологии (V.cholera, P.aeruginosa). Ген β-лактамазы класса D (праймеры bps1F4-bps8R4, размер ампликона 440 п.н.) был детектирован в штаммах B.pseudomallei и B.thailandensis.
Пример 3. Дифференциация между различными видами рода Burkholderia по набору генов β-лактамаз классов B и D в мультилокусной ПЦР.
Этапы выделения ДНК, аппаратура для проведения ПЦР, режимы амплификации, состав реакционных смесей и методы детекции ампликонов аналогичны описанным в примере 2.
Для проведения ПЦР в мультилокусном формате используют три пары праймеров (bps1F3-bps1R3, bps1F4-bps8R4 и bm1F2-bm14R2) в эквимолярном количестве (по 5 пМ).
Результаты ПЦР (рис.6) демонстрируют одновременную детекцию трех генетических локусов с праймерами bps1F3-bps1R3, bps1F4-bps8R4 и bm1F2-bm14R2 в штаммах B.pseudomallei, двух локусов с праймерами bps1F4-bps8R4 и bm1F2-bm14R2 в штаммах B.thailandensis, двух локусов с праймерами bps1F3-bps1R3 и bm1F2-bm14R2 в штаммах B.mallei и 1 генетического локуса с праймерами bm1F2-bm14R2 в штаммах B.cepacia.
Постановка мультилокусной ПЦР на широком наборе штаммов В. pseudomallei, В.mallei, В.thailandensis и штаммов различных геномоваров cepacia-комплекса (рис.7) подтверждает возможность дифференциации между различными видами рода Burkholderia по набору генов β-лактамаз классов B и D.
Подписи к рисункам
Олигонуклеотидные праймеры для детекции генов β-лактамаз патогенных буркхольдерий методом полимеразной цепной реакции с одновременным определением их принадлежности к молекулярным классам А, В и D, обладающие активностью прямого и обратного праймеров в реакции амплификации, имеющие следующую структуру:bm1F1 5'-TTCCCGCGATCCGCCTGATGA-3'bm4R1 5'-CTTGTTGCCGAGCATCCATGC-3'комплементарные фрагменту гена β-лактамазы класса А (штамм Burkholderia mallei 10247, Genbank access. CP000547 локус BMA10247_A1040);bm1F2 5'-ACGTTCCTCGGCGCGACGGAAAC-3'bm14R2 5'-CCGGATGATGTTTCGAGTAGCCGTG-3'комплементарные фрагменту гена β-лактамазы класса В (штамм Burkholderia mallei ATCC 23344, Genbank access. CP000011 локус BMA_A0168);bps1F3 5'-ACGGCAATTCCTCCATTGCGA-3'bps1R3 5'-CTCGTCAGGGTTGCGTCCGGAGT-3'комплементарные фрагменту гена β-лактамазы класса В (штамм Burkholderia pseudomallei 1106b, Genbank access. PRJNA16181 локус BURPS1106B_2313);bps1F4 5'-CGCATTCGTTTTGCTGGGTTGCAT-3'bps8R4 5'-TCTGCAGCGACGAGCCGATCCA-3'комплементарные фрагменту гена β-лактамазы класса D (штамм Burkholderia pseudomallei 1106b, Genbank access. PRJNA 16181 локус BURPS 1106B_2455);bps3F5 5'-TCTGTGGCTGCTGCGCGACGAGAT-3'bps8R5 5'-GCACAGCCAGTTCGCGAGTCCGA-3'комплементарные фрагменту гена β-лактамазы класса В (штамм Burkholderia pseudomallei 1106b, Genbank access. PRJNA16181 локус BURPS 1106B_A3704).