Фармакологическая композиция, предназначенная для интраназального введения с целью доставки в мозг фармакологически активного компонента, и способ ее получения
Иллюстрации
Показать всеЗаявляемая группа изобретений относится к фармакологической композиции, предназначенной для интраназального введения с целью доставки в мозг, и способу получения указанной композиции. Заявленная композиция содержит основу-контейнер, образованную пористыми частицами карбоната кальция или диоксида титана с размерами частиц 100-5000 нм, и фармакологически активный компонент - лоперамид. При этом поверхность контейнера модифицирована сурфактантами, выбранными из полисорбатов, или полимерами, выбранными из группы, включающей гликозаминогликаны и полипептиды, или их комбинацией. Способ получения фармакологической композиции заключается в получении основы-контейнера путем синтеза пористых частиц, сорбцию в объемах его пор лоперамида и модификацию поверхности контейнера полимерами и сурфактантами путем инкубации контейнера в их растворах. Изобретение обеспечивает получение фармакологической композиции, которая пригодна для доставки лоперамида в мозг при интраназальном введении. 2 н. и 3 з.п. ф-лы, 5 ил., 1 пр.
Реферат
Заявляемая группа изобретений относится к области фармакологии и медицины и предназначена для использования при лечении заболеваний, при которых требуется непосредственная доставка активного вещества в мозг, минуя гемато-энцефалический барьер (ГЭБ), например при лечении болезни Паркинсона.
Направленная доставка соединений в мозг - важнейшая проблема, принципиальная как с точки зрения фундаментальной науки, так и с точки зрения применения в медицине. Нерешенность этой проблемы существенно ограничивает разработку современных подходов к диагностике и лечению церебральных патологий. В настоящее время большой интерес исследователей вызывает интраназальный способ введения целого ряда препаратов (в первую очередь пептидной природы). Считается, что введенные интраназально вещества способны проникать непосредственно в центральную нервную систему (ЦНС) через обонятельную систему, минуя ГЭБ. Преимущества этого пути введения очевидны: введение неинвазивно, а биодоступное вещество быстро всасывается и начинает действовать уже через несколько минут, что актуально при экстренной помощи.
Однако не все вещества могут быть эффективно введены таким способом, поэтому расширение арсенала веществ, вводимых интраназально, безусловно, актуально и необходимо. Хорошей назальной биодоступностью обладают липофильные соединения с низкой молекулярной массой. Пептиды и белки с молекулярной массой больше 1000 Да способны преодолевать назальную мембрану только в малых количествах. При этом ярко выраженный защитный механизм - очищение реснитчатого эпителия - ограничивает время нахождения в полости носа как жидкостей, так и порошков, полупериод выведения составляет 15-30 мин [1]. Для снижения скорости очищения и повышения биодоступности препаратов используют специальные «усилители абсорбции». Их действие в основном заключается в изменении проницаемости эпителиальной клеточной мембраны путем модификации фосфолипидного бислоя, удаления протеинов из мембраны или даже удаления внешнего слоя слизистой оболочки. Использование таких вспомогательных соединений позволяет увеличить биодоступность многих препаратов, в том числе таких пептидов, как инсулин.
В настоящее время известно внутривенное введение композиций на основе наночастиц, содержащих активное вещество, при котором достигается преодоление ГЭБ.
Известна фармакологическая композиция, предназначенная для введения в мозг активного компонента с проникновением через ГЭБ, содержащая вещество-контейнер, фармакологически активный компонент и сурфактант (патент США №6117454, "Drag targeting to the nervous system by nanoparticles", МПК A61K 9/51, опубл. 12.09.2000).
Недостатками известной композиции являются:
- необходимость применения некоторых дорогостоящих компонентов, а именно цианоакрилатов, акриламидов, полилактатов, алкилцианоакрилатов, полиангидридов и др.;
- полимерные частицы механически непрочны, что может затруднять их хранение и транспортировку;
- высвобождение активного компонента происходит за счет деструкции полимерных частиц, тем самым ограничивая время высвобождения активного компонента временем разрушения частиц;
- одним из продуктов распада полиалкилцианоакрилатных частиц является формальдегид, обладающий токсичностью и оказывающий сильное отрицательное действие на центральную нервную систему.
Задачей предлагаемого технического решения является создание композиции, в которой используется недорогая основа-контейнер, а введение композиции осуществляется интраназально.
Техническим результатом является получение композиции, в которой применяются недорогие ингредиенты, не оказывающие вредного воздействия на организм человека.
Поставленные техническая задача и результат достигаются тем, что в фармакологической композиции, предназначенной для введения в мозг активного компонента, минуя ГЭБ, содержащей основу-контейнер и фармакологически активный компонент, в качестве основы-контейнера использованы пористые частицы неорганического вещества, а поверхность контейнера модифицирована сурфактантами, полимерами, или их комбинацией. Контейнеры из неорганического вещества имеют размер в диапазоне от сотен нанометров до десятков микрон (от 100 до 5000 нм). В качестве основы-контейнера возможно применение неорганических веществ, выбранных из группы солей или оксидов металлов, например карбоната кальция или оксида титана, в виде пористых частиц микронного или субмикронного размера. В качестве модифицирующего поверхность вещества могут быть применены сурфактанты, выбранные из группы полисорбатов, или полимеры, выбранные из группы, включающей гликозаминогликаны, полипептиды, или их комбинации.
Известен способ получения фармакологической композиции, предназначенной для введения в мозг активного компонента с проникновением через ГЭБ, включающий получение наночастиц с сорбцией фармакологически активного вещества и модификацию их поверхности (патент США №6117454, "Drag targeting to the nervous system by nanoparticles", МПК A61K 9/51, опубл. 12.09.2000). В качестве наночастиц в известном способе применяют синтетические полимерные наночастицы, например полиалкилцианоакрилатные, альбуминовые, полилактидные и др. частицы.
Недостатками известного способа являются:
- стерилизация полиалкилцианоакрилатных частиц представляет трудный процесс. Автоклавирование названных частиц приводит к значительному увеличению их размера. Препарат полиалкилцианоакрилатных частиц, полученный в результате лиофилизации, очень трудно ресуспендировать, что создает большие трудности для получения суспензии для инъекций;
- масштабирование способа получения полиалкилцианоакрилатных частиц может быть связано с трудностями, т.к. процессы центрифунгирования и диализа, проводимые при очистке полиалкилцианоакрилатных частиц в ходе синтеза, вызывают их агрегацию;
- получение полилактидных частиц связано с использованием органических растворителей (ацетон), что значительно ограничивает область их использования, в частности для биомедицинских целей;
- получение полимерных частиц связано с использованием трудоемких методов полимерной химии (эмульсионная полимеризация, полимеризация на поверхности и др.);
- при синтезе альбуминовых частиц используется глутаровый альдегид, который является токсичным веществом, вызывающим поражения слизистых оболочек глаз, носоглотки;
- при интраназальном введении высвобождение активного компонента из полиалкилцианоакрилатных частиц затруднено, т.к. они стабильны при кислых значениях рН (рН носовой полости составляет 4.5-6.0).
Задачей предлагаемого технического решения является создание способа, позволяющего преодолеть указанные недостатки известного способа.
Техническим результатом является разработка надежного и недорогого способа получения фармакологической композиции, предназначенной для интраназального введения в мозг фармакологически активного компонента.
Поставленные техническая задача и результат достигаются тем, что в способе получения фармакологической композиции, предназначенной для доставки в мозг фармакологически активного компонента, включающем получение основы-контейнера, сорбцию в объемах его пор фармакологически активного вещества и модификацию его поверхности, основу-контейнер синтезируют из неорганических веществ в виде пористых частиц микронного или субмикронного размера. Затем поверхность названных частиц дополнительно модифицируют полимерами, выбранными из группы гликозаминогликанов или полипептидов, или сурфактантами, выбранными из группы полисорбатов, или их комбинациями. Основа-контейнер может быть получена смешиванием водных растворов, содержащих ионы Ca2+ и CO3 2-, удалением несвязавшихся ионов путем промывания полученного осадка и сушкой сформированных микрочастиц. Возможно получение основы-контейнера взаимодействием порошка карбида титана с азотной кислотой. В качестве фармакологически активного вещества композиции можно использовать лоперамид. Модификация поверхности основы-контейнера может быть выполнена следующим образом: микрочастицы вещества, применяющегося в качестве основы-контейнера, помещают в раствор гиалуроновой кислоты в водном растворе NaCl, выдерживают при перемешивании в этом растворе, удаляют избыток гиалуроновой кислоты промыванием водным раствором NaCl, а затем сушат.
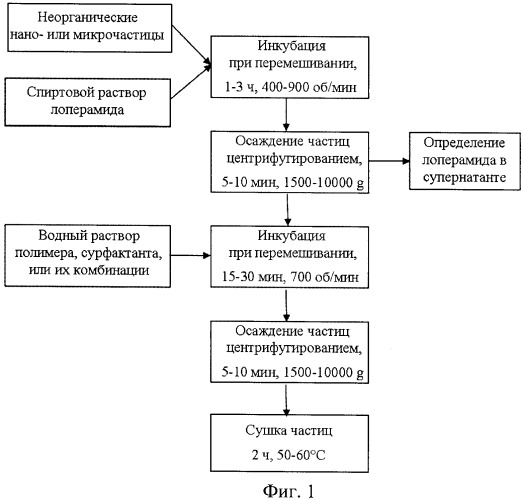
Существо предлагаемой группы изобретений поясняется схемами и фотографиями, представленными на фигурах:
на фиг.1 - схема способа получения фармакологической композиции;
на фиг.2 - изображение частицы карбоната кальция, полученное с помощью сканирующей электронной микроскопии;
на фиг.3 - изображения частиц диоксида титана, полученные с помощью просвечивающей электронной микроскопии;
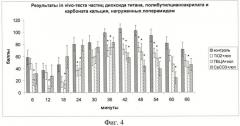
на фиг 4 - результаты in vivo-теста частиц диоксида титана, полибутилцианоакрилата и карбоната кальция, нагруженных лоперамидом:
* - достоверные отличия от группы контроль при р<0,05,
+ - достоверные отличия от группы контроль при р<0,1,
р - статистическая значимость результата в критерии Краскела-Уоллиса.
на фиг.5 - результаты in vivo-теста не модифицированных частиц карбоната кальция, нагруженных лоперамидом, и таких же частиц, покрытых гиалуроновой кислотой.
Схема операций по получению предлагаемой фармакологической композиции иллюстрируется фиг.1.
Первой операцией является синтез частиц, которые будут выполнять функцию контейнера, являющегося носителем активного вещества. В качестве таких частиц были сформированы пористые частицы карбоната кальция и диоксида титана.
Карбонат кальция
Формирование частиц карбоната кальция - предмет многочисленных научных исследований благодаря широкому использованию этого материала в различных областях промышленности, технологии, медицины. Для синтеза пористых CaCO3 микрочастиц был использован способ [2], который заключается в непосредственном смешивании растворов, содержащих ионы Ca2+ и CO3 2-. При этом сначала образуется аморфный осадок из наночастиц CaCO3, а затем в объеме их агрегатов возникают центры роста микрочастиц. Качество полученных частиц существенным образом зависит от экспериментальных условий, таких как тип используемых солей, их концентрация, рН, температура, скорость смешивания растворов и интенсивность перемешивания реакционной смеси. Частицы имели достаточно узкое распределение по размерам (от 4 до 5 мкм) и мезопористую каналоподобную структуру. Структура частиц видна на фотографии, представленной на фиг.2. Порошок CaCO3 хранили в сухой атмосфере, так как в присутствии влаги пористые микросферолиты, образованные ватеритом, постепенно переходят в ромбоэдрические кристаллы кальцита.
Диоксид титана
Мезоструктурированные частицы диоксида титана получали взамодействием порошка карбида титана с 5 М азотной кислотой [3]. По данным просвечивающей электронной микроскопии частицы образованы удлиненными нанокристаллитами (фиг.3). С помощью динамического светорассеяния было определено, что средний размер частиц составляет 1.5 мкм.
На полученные частицы карбоната кальция и диоксида титана адсорбировали лоперамид путем помещения навески названных частиц в спиртовой раствор лоперамида с последующим перемешиванием взвеси на шейкере. Количество лоперамида, включенного в контейнеры, определяли спектрофотометрически по разнице интенсивности пика поглощения супернатанта при 259 нм до и после адсорбции.
Для модификации поверхности контейнеров гиалуроновой кислотой частицы с включенным лоперамидом помещали в раствор гиалуроновой кислоты в водном растворе NaCl и выдерживали при перемешивании с помощью шейкера. По завершении процесса модификации частицы сушили и хранили в таком виде.
Для проведения сравнительных испытаний были изготовлены полибутилцианоакрилатные частицы с лоперамидом. Такие частицы были синтезированы с помощью эмульсионной полимеризации бутилцианоакрилата в присутствии лоперамида.
Пример конкретной реализации способа по получению композиции
Заранее сформированные неорганические нано- или микрочастицы инкубировали в спиртовом растворе лоперамида в течение 1-3 ч при перемешивании на шейкере (IKA-VIBRAX-VXR, IKA, Германия). После инкубации частицы осаждали центрифугированием (ROTINA 38/38R, Hettich, Германия) и отделяли супернатант. Определение концентрации лоперамида в супернатанте осуществляли на спектрофотометре (PerkenElmer Lambda 650, США).
Полученные нано- или микроконтейнеры помещали в водный раствор полимера, сурфактанта, или их комбинации и инкубировали в течение 15-30 мин при перемешивании на шейкере (IKA-VIBRAX-VXR, IKA, Германия). После инкубации контейнеры осаждали центрифугированием (ROTINA 38/38R, Hettich, Германия).
Полученные модифицированные контейнеры сушили в течение 2 ч при 50-60°С. Хранение композиции осуществляли в герметично закрытой пробирке при комнатной температуре.
Для проверки эффективности разработанной композиции был проведен "in-vivo" тест оценки доставки активного компонента в мозг. С этой целью был применен формалиновый тест с использованием лоперамида [4-6]. В качестве подопытных животных использовались крысы. Известно, что лоперамид не способен проникать через ГЭБ. Ранее целенаправленная доставка лоперамида в ЦИС мыши была успешно осуществлена с помощью внутривенного введения полибутилцианоакрилатных наночастиц. В проведенном сравнительном исследовании частицы полибутилцианоакрилата, содержащие лоперамид, вводили интраназально, и данные по эффективности введения лоперамида с помощью пористых частиц карбоната кальция и диоксида титана были сопоставлены с данными для частиц полибутилцианоакрилата.
Выводы о доставке лоперамида в ЦНС грызунов делались на основании изменения их болевой чувствительности. Суспензию загруженных лоперамидом частиц интраназально вводили крысам линии Вистар массой 200-250 г. Далее после подкожного введения формальдегида в лапу крысы животное помещали в прозрачный аквариум для наблюдения. После определенного промежутка времени фиксировали поведение и оценивали болевую чувствительность крысы по системе баллов. Все временные точки усредняли по группе, данные обрабатывали с помощью программы STATISTICA-7. В качестве контроля использовали раствор лоперамида в 5% растворе глюкозы без частиц, а также суспензии самих частиц без лоперамида.
Баллы в контрольных группах животных достоверно не различались между собой, поэтому их объединяли и для дальнейших расчетов брали усредненный контроль.
Все использованные частицы, нагруженные лоперамидом, снижали болевую чувствительность крыс (фиг.4). Это означает, что контейнеры на основе пористых неорганических частиц, так же как и полибутилцианоакрилатные частицы, обеспечивают доставку лоперамида в ЦНС крысы. Динамика снижения болевой чувствительности различна для разных типов частиц. Частицы диоксида титана, как и полибутилцианоакрилатные частицы, наиболее эффективны при малых временах действия, хотя быстрее начинают действовать полимерные контейнеры. Калицийкарбонатные частицы показали хорошую эффективность на больших временах действия (42-60 мин).
Модификация частиц мукоадгезивным соединением приводила к повышению эффективности действия контейнеров в начале теста и на больших временах (фиг.5). При использовании частиц карбоната кальция, покрытых гиалуроновой кислотой, болевая чувствительность крыс на 6-й минуте и с 48-й по 66-ю минуту снижается практически в два раза. С учетом того, что на больших временах частицы CaCO3 с лоперамидом действуют более эффективно, чем полибутилцианоакрилатные частицы, можно сделать вывод, что контейнеры на основе карбоната кальция, покрытые гиалуроновой кислотой, из исследуемых систем наиболее эффективны для доставки лоперамида в ЦНС крысы.
Таким образом, фармакологическая композиция и разработанный способ ее получения позволяют обеспечить доставку функциональных соединений в мозг при их интраназальном введении. Простота получения композиции в сочетании с преимуществами интраназального способа введения препаратов обеспечивают перспективность предложенной системы для медицинских применений.
Источники информации
1. Soane R.J., Frier M., Perkins A.C., Jones N.S., Davis S.S., Illum L. // Int. J. Pharm. 1999. V.178. P.55-65.
2. Volodkin D.V., Petrov A.I., Prevot M., Sukhorukov G.B. // Langmuir. 2004. V.20. P.3398-3406.
3. Shieh D.-L., Li Jr-Sh., Shieh M.-Jr, Lin J.-L. // Microporous and Mesoporous Materials. 2007. V.98. P.339-343.
4. Matthies B.K., Franklin K.B. // Pain. 1992. V.51. Р.199-206.
5. Matthies B.K., Franklin K.B. // Behav. Brain Res. 1995. V.67. P.59-66.
6. Rosland J.H., Tjolsen A., Maehle В., Hole K. // Pain. 1990. V.42. Р.235-242.
1. Фармакологическая композиция, предназначенная для интраназального введения с целью доставки в мозг фармакологически активного компонента, содержащая основу-контейнер, фармакологически активный компонент и модифицирующее поверхность вещество, отличающаяся тем, что в качестве контейнера использованы пористые частицы карбоната кальция или диоксида титана с размерами частиц 100-5000 нм, в качестве фармакологически активного компонента используется лоперамид, а поверхность контейнера модифицирована сурфактантом, выбранным из группы полисорбатов, или полимером, выбранным из группы гликозаминогликанов или полипептидов, или комбинацией этих сурфактантов и полимеров.
2. Способ получения фармакологической композиции по п.1, предназначенной для интраназального введения с целью доставки в мозг фармакологически активного компонента, включающий получение основы-контейнера путем синтеза пористых частиц из карбоната кальция или диоксида титана с размерами частиц 100-5000 нм, сорбцию в объемах его пор фармакологически активного вещества, представляющего собой лоперамид, и модификацию поверхности контейнера сурфактантом, выбранным из группы полисорбатов, или полимером, выбранным из группы гликозаминогликанов или полипептидов, или комбинацией вышеперечисленных сурфактантов и полимеров путем инкубации контейнеров в их растворах.
3. Способ получения фармакологической композиции по п.2, отличающийся тем, что основу-контейнер получают смешиванием водных растворов, содержащих ионы Ca2+ и CO3 2-, удалением несвязавшихся ионов путем промывания полученного осадка и сушкой сформированных микрочастиц.
4. Способ получения фармакологической композиции по п.2, отличающийся тем, что основу-контейнер получают взаимодействием порошка карбида титана с азотной кислотой.
5. Способ получения фармакологической композиции по п.2, отличающийся тем, что для модификации поверхности основы-контейнера микрочастицы названного вещества помещают в раствор гиалуроновой кислоты в водном растворе NaCl, выдерживают при перемешивании в этом растворе, удаляют избыток гиалуроновой кислоты промыванием водным раствором NaCl, а затем сушат.