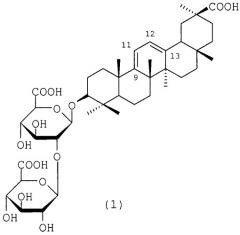
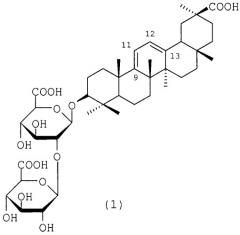
Средство, представляющее собой 3-o- -d-глюкуронопиранозил- -d-глюкуронопиранозид олеан-9( 11),12( 13)-диен-30-овой кислоты, проявляющее анти-вич-1 активность, и способ его получения
Иллюстрации
Показать всеВ настоящей заявке заявлено средство, представляющее собой 3-O-β-D-глюкуронопиранозил-β-D-глюкуронопиранозид олеан-9(11), 12(13)-диен-30-овой кислоты формулы (1) - аналог глицирризиновой кислоты (ГК), проявляющему противовирусную активность в отношении вируса иммунодефицита человека типа 1 (ВИЧ-1) активность, ингибируя накопление вирусспецифического белка р24, и превосходит ГК по индексу селективности (IS) в 4,8 раз. Предлагаемое средство - гликозид (1) является практически нетоксичным веществом для клеток, в 12 раз менее токсичен для клеток МТ-4, чем препарат сравнения ГК (97% чистоты) и с высокой эффективностью ингибирует РНК-зависимую ДНК-полимеразную активность обратной транскриптазы (ОТ) ВИЧ-1. Также в настоящем изобретении представлен способ получения 3-О-β-D-глюкуронопиранозил-β-D-глюкуронопиранозида олеан-9(11),12(13)-диен-30-овой кислоты (1), который заключается в восстановлении ГК 4,5-5,5-кратным избытком боргидрида натрия в смеси изопропанола-воды (1:1) при кипячении в течение 1-2 ч с последующей обработкой реакционной смеси 5% соляной кислотой (pH 1-2) при 20-22°С и экстракцией бутанолом с получением смеси гликозидов (1) и (4) в соотношении 2:1, которую подвергают обработке сильнокислыми катионитами (КУ-2-8, дауэкс-50, амберлит IR-120) в Н+-форме в 70-75% этаноле и разделению колоночной хроматографией на силикагеле с получением целевого продукта, 2 н.п. ф-лы, 3 пр., сх., табл.
Реферат
Изобретение относится к химико-фармацевтической промышленности, а именно к средству, представляющему собой 3-O-β-D-глюкуронопиранозил-β-D-глюкуронопиранозид олеан-9(11), 12(13)-диен-30-овой кислоты формулы (1) - аналогу глицирризиновой кислоты (ГК), проявляющему противовирусную активность в отношении вируса иммунодефицита человека типа 1 (ВИЧ-1) активность, и способу его получения.
Проблема поиска новых лекарственных средств для лечения и профилактики вирусных инфекций является одной из важнейших задач медицины, медицинской и органической химии по причине все более широкого распространения ВИЧ-инфекции, вирусных гепатитов В и С и появлением новых социально опасных вирусных инфекций, таких как атипичная пневмония (SARS), «птичий» и «свиной» гриппы, вызываемые вирусами инфлуэнцы A (H5N1 и H1N1), и др. Для лечения ВИЧ-инфекции применяются нуклеозидные ингибиторы протеазы и обратной транскриптазы (ОТ) ВИЧ (азидотимидин или зидовудин, ставудин, ритонавир и др.), клиническое применение которых ограничено в связи с возникновением резистентных к данным препаратам мутантных штаммов ВИЧ [Балтина Л.А., Кондратенко P.M., Балтина Л.А. (мл.), Плясунова О.А., Покровский А.Г., Толстиков Г.А. Перспективы создания новых противовирусных препаратов на основе глицирризиновой кислоты и ее производных. // Хим.-фарм. жур., 2009, 43, 3-12].
Новым подходом является поиск противовирусных средств нового поколения с новым механизмом действия среди доступных природных соединений и их модификантов. К числу природных соединений, представляющих большую ценность для медицины в качестве основы для создания новых противовирусных агентов, относится глицирризиновая кислота (ГК) (2) - основной тритерпеновый гликозид корней солодки (с.) голой (Glycyrrhiza glabra L.) и с.уральской (Gl. uralensis Fisher), являющийся одним из лидирующих природных соединений, пригодных для монотерапии ВИЧ-инфекции, вирусных гепатитов В и С, генитального герпеса [Балтина Л.А., Кондратенко P.M., Балтина Л.А. (мл.), Плясунова О.А., Покровский А.Г., Толстиков Г.А. Перспективы создания новых противовирусных препаратов на основе глицирризиновой кислоты и ее производных. // Хим.-фарм. жур., 2009, 43, 3-12}. Установлено, что монотерапия с помощью ГК эффективна для поддержания носителей ВИЧ инфекции в течение 20 и более лет и не приводит к возникновению лекарственной резистентности и другим побочным эффектам [Ikegami N., Kinoshita S., Kanesaki Т., Uno K., Akatani K., Kishida Т. Evalluation of long term treatment with glycyrrhizin and of combination therapy with glycyrrhizin and AZT or DDI on HIV-1 carries. // Antiviral Res., 1996, 30, А33]. ГК и ее производные обладают способностью потенцировать выработку гамма-интерферона in vivo, что делает их перспективными природными соединениями для применения в качестве стимуляторов неспецифического иммунитета для профилактики вирусных инфекций [Толстиков Г.А., Балтина Л.А., Шульц Э.Э., Покровский А.Г. Глицирризиновая кислота. // Биоорган, химия, 1997, 23, 691-709]. Химическая модификация ГК является перспективным путем для получения новых соединений с потенцированными свойствами и заданной биологической активностью [Baltina L.A. Chemical modification of Glycyrrhizic acid as a route to new bioactive compounds for medicine. // Curr. Med. Chem., 2003, 10, 155-171]. Основным недостатком ГК является ее малая эффективность как ингибитора обратной транскриптазы (ОТ) ВИЧ [О.А.Плясунова. Скрининг и изучение препаратов - ингибиторов вируса иммунодефицита человека. Дисс. канд. биол. наук в форме научного доклада. Кольцово, 1992. 55 с.].
Задача, на решение которой направлено заявленное техническое решение, заключается в расширении арсенала лекарственных средств на основе производных ГК для лечения ВИЧ инфекции. Поставленная задача решается средством, представляющим собой 3-О-β-D-глюкуронопиранозил-β-D-глюкуронопиранозид олеан-9(11),12(13)-диен-30-овой кислоты (1), проявляющем анти-ВИЧ-1 активность, и способом его получения.
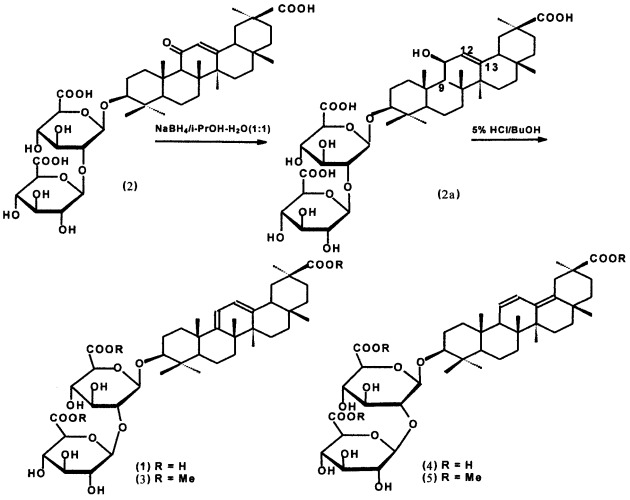
Известен способ получения гликозида (1) [Kitagawa I., Zhou J,L., Sakagami M., Uchida E., Yoshikawa M. Licorice-saponins F3, G2, H2, J2, and K2, five new oleanene-triterpene oligoglycosides from the root of Glycyrrhiza uralensis. // Chem. Pharm. Bull., 1991, 39(1), 244-246] путем восстановления ГК (2) боргидридом натрия в смеси этанола-воды (1:1) при 90°С с последующей обработкой образующегося 11β-окси-производного (2а) (схема 1) 2% водной соляной кислотой в диоксане (1:1) при нагревании, в результате чего была получена смесь гомо- и гетероаннулярного диеновых гликозидов (1) и (4) (1:1) (выход не указан), разделенных колоночной хроматографией (КХ) на силикагеле в виде триметиловых эфиров (3) и (5) после метилирования диазометаном. Гликозид (4) является природным гликозидом корней с.уральской, названный ликорис-сапонином С2 и являющийся аналогом ГК, содержащим 11(12),13(18)-диеновую систему в агликоне [Kitagawa L, Hori K., Tamniyama I., Zhou J.-L., Yoshikawa M.. Saponin and sapogenol. XLVII. On the constituents of roots of Glycyrrhiza uralensis Fisher from Northeastern China. 1. Licorice-saponins A3, B2 and С2. // Chem. Pharm. Bull., 1993, 41, 43-49]. Гликозид (1) с гомоаннулярной 9(11),12(13)-диеновой системой в агликоне в корнях солодки не обнаружен и является полусинтетическим аналогом ГК, биологические свойства которого в литературе не описаны.
Основным недостатком описанного выше способа получения аналога ГК (1) является необходимость применения дополнительной стадии обработки восстановленного гликозида (2а) 2% раствором соляной кислоты в диоксане при нагревании до 90-95°С для проведения дегидратации 11β-окси-гликозида (2а), протекающей с образованием смеси гликозидов (1) и (4) (схема 1).
В заявленном техническом решении синтез соединения (1) проводят путем восстановления ГК 4,5-5,5 избытком боргидрида натрия в смеси изопропанола-воды (1:1) при кипячении в течение 1-2 ч. Обработка реакционной смеси 5% соляной кислотой (pH 1-2) при 20-22°С и последующая экстракция бутанолом приводят к получению сырого продукта, представляющего собой смесь гликозидов (1) и (4) 2:1 (сырой гликозид) с выходами 98-100%. Последующая обработка сырого гликозида сильнокислыми катионитами в Н+-форме (КУ-2-8, дауэкс-50, амберлит IR-120) в 70-75%-ном этаноле приводит к дополнительной очистке продукта реакции от солей. Продукт представляет собой смесь гликозидов (1) и (4) с содержанием гликозида (1) 47,5-50,0% по данным ВЭЖХ. Разделение гликозидов проводят с помощью КХ на силикагеле при элюции смесью хлороформа-метанола-воды (ступенчатый градиент). Выход чистого гликозида (1) составляет 45-47%.
Гликозид (1) был охарактеризован ИК и ЯМР 13С спектрами, а также превращением в триметиловый эфир (3) (схема 1) путем обработки эфирным раствором диазометана в МеОН [Kitagawa L, Zhou J,L., Sakagami M., Uchida E., Yoshikawa M. Licorice-saponins F3, G2, H2, J2, and K2, five new oleanene-triterpene oligoglycosides from the root of Glycyrrhiza uralensis. // Chem. Pharm. Bull., 1991, 39(1), 244-246]. В ИК-спектре гликозида (1) отсутствует максимум поглощения сопряженного кетона (11-он-12-ена). Спектр ЯМР 13С характеризуется появлением новых сигналов олефиновых атомов С (С9, С11, С12, С13) в области слабого поля (115,9; 154,6; 121,7; 146,3 м.д.), что согласуется с литературными данными [Kitagawa I, Zhou J,L., Sakagami M., Uchida E., Yoshikawa M. Licorice-saponins F3, G2, H2, J2, and K2, five new oleanene-triterpene oligoglycosides from the root of Glycyrrhiza uralensis. // Chem. Pharm. Bull., 1991, 39, 244-246].
Схема 1
Отличительные признаки предлагаемого способа:
1. Восстановление ГК проводится в смеси изопропанол-вода (1:1), в то время как в способе-прототипе используют смесь этанол-вода (1:1).
2. Применяется более концентрированный 5% раствор соляной кислоты для обработки реакционной смеси и дегидратация образующегося 11(3-окси-производного (2а) проводится при 20-22°С. Последующая экстракция реакционной смеси бутанолом позволяет получать гликозиды (1) и (4) в соотношении 2:1 практически в одну стадию, тогда как в способе-прототипе используется еще дополнительная стадия нагревания продукта реакции (2а) после выделения в растворе 2% соляной кислоты в диоксане при 90°С.
3. В описанном способе проводилось также дополнительное метилирование продукта реакции (смеси гликозидов) диазометаном для разделения образующейся в ходе реакции смеси гликозидов (1) и (4) в виде их триметиловых эфиров (3) и (5). В предлагаемом способе разделение смеси гликозидов проводят без предварительного метилирования, вместо этого сырой продукт реакции обрабатывают сильнокислыми катионитами (КУ-2-8, дауэкс 50, амберлит IR 120) в 70-75% этаноле.
Цитотоксичность и анти-ВИЧ-1 активность гликозида (1) по ингибированию вирусспецифического белка р24 в культуре клеток МТ-4
Цитотоксичность и анти-ВИЧ-1 активность гликозида (1) были изучены на традиционной модели первично инфицированных ВИЧ лимфоидных клеток МТ-4 с использованием штамма ВИЧ-1/ЭВК по методике, описанной в работе [Кондратенко P.M., Балтина Л.А., Мустафина С.Р., Васильева Е.В., Помпеи Р., Дейдда Д., Плясунова О.А., Покровский А.Г., Толстиков Г.А. Синтез конъюгатов глицирризиновой кислоты с α-D-глюкозамином и некоторыми гликозиламинами и их противовирусная активность. // Биоорган, химия, 2004, 30, 308-315]. В качестве препарата сравнения использовали природную очищенную ГК (97% чистоты) в концентрации 100 мкг/мл.
Цитотоксичность гликозида (1) оценивали в культуре перевиваемых Т-лимфоцитов человека (линия МТ-4) в виде растворов в диметилсульфоксиде (ДМСО) в соответствующих разведениях в 96-луночных планшетах. По окончании инкубации при 37°С подсчитывали долю жизнеспособных клеток в камере Горяева после окрашивания трипановым синим. Строили дозозависимую кривую и определяли концентрацию препарата, вызывающую гибель 50% клеток - CD50 (цитотоксическая доза).
Анти-ВИЧ-1 активность соединения (1) оценивали в культуре клеток МТ-4 (концентрация 2×106 клеток/мл), инфицированных штаммом ВИЧ-1/ЭВК с множественностью заражения 0,2-0,5 инфекционных единиц на клетку. Ингибирующий эффект оценивали на 4-е сутки культивирования измерением количества вирусного антигена - вирусспецифического белка р24 в культуральной жидкости иммуноферментным методом. На основе полученных экспериментальных данных строили дозозависимые кривые и определяли количественные характеристики ингибирования: ID50 - концентрацию соединения, на 50% подавляющую продукцию вируса или обеспечивающую 50% защиту клеток от гибели вследствие инфекции; ID90 - концентрацию соединения, на 90% подавляющую продукцию вируса или обеспечивающую 90% защиту клеток от гибели вследствие инфекции; IS - индекс селективности - отношение цитотоксичной дозы CD50 к его эффективной дозе ID50. Результаты проведенных исследований приведены в таблице.
Анти-ВИЧ-1 активность гликозида (1) в культуре клеток МТ-4
| Таблица | |||
| Шифр препарата | CD50, мкг/мл | ID50, мкг/мл | IS |
| (1) | 24000 | 500 | 48,0 |
| ГК | 1950 | 125 | 10,3 |
Гликозид (1) в 12 раз менее токсичен для клеток МТ-4, чем ГК и является практически нетоксичным веществом. Кроме того, гликозид (1) проявляет выраженную анти-ВИЧ-1 активность, ингибируя накопление вирусспецифического белка р24, и превосходит природный гликозид (ГК) - препарат сравнения по индексу селективности (IS) в 4,8 раз (табл.).
Ингибирование РНК-зависимой ДНК полимеразной активности обратной транскриптазы ВИЧ-1
Изучено влияние гликозида (1) на РНК-зависимую ДНК полимеразную активность рекомбинантной ОТ ВИЧ-1 в присутствии (и в отсутствие) различных концентраций исследуемого препарата с использованием ОТ дикого типа, выделенной из экспрессируемого вектора p6HRT в культуре JM109 E.Coli согласно работе [Плясунова О.Ф., Ильина Т.В., Кисилева Я.Ю., Федюк Н.В., Балтина Л.А., Толстиков Г.А., Покровский А.Г. Анти-ВИЧ активность пента-о-никотината глицирризиновой кислоты. // Вестник РАМН, 2004, 11, 7-11}. Концентрацию очищенной ОТ определяли спектрофотометрически при 280 нм. Исследования показали, что гликозид (1) с высокой эффективностью ингибирует РНК-зависимую ДНК-полимеразную активность ОТ ВИЧ-1. Эффективная концентрация гликозида (1), ингибирующая 50% ОТ ВИЧ-1 (IC50), составила 3,1±1 мкг/мл. Препарат сравнения - ГК - не ингибирует ОТ ВИЧ-1 [Плясунова О.А., Егоричева И.Н., Федюк Н.В., Покровский А.Г., Балтина Л.А., Муринов Ю.И., Толстиков Г.А. Изучение анти-ВИЧ активности β-глицирризиновой кислоты. // Вопросы вирусол., 1992, 37, 235-238].
Таким образом, впервые выявлена высокая анти-ВИЧ-1 активность средства, представляющего собой 3-O-β-D-глюкуронопиранозил-β-D-глюкуронопиранозид олеан-9(11),12(13)-диен-30-овой кислоты (1) по ингибированию ОТ ВИЧ-1 в культуре клеток.
Сущность технического решения иллюстрируется следующими примерами.
Пример 1. Синтез 3-O-β-D-глюкуронопиранозил-β-D-глюкуронопиранозида олеан-9(11),12(13)-диен-30-овой кислоты (1)
1. 2 г (2,4 ммоль) ГК (85,0±0,5% чистоты) растворили в 40 мл смеси изопропанола-воды (1:1), прибавили 4,1 г (10,8 ммоль) боргидрида натрия и кипятили смесь 2 ч. После охлаждения до комнатной температуры (20-22°С) реакционную смесь подкислили 5% соляной кислотой до pH 1-2, добавили 50 мл воды и экстрагировали бутанолом (50 мл×3). Бутанольный экстракт промыли водой дважды, сушили MgSO4 и упарили досуха. Остаток растворили в 50 мл 70% этанола и обработали катионитом КУ-2-8 (Н+-форма). Катионит отфильтровали, промыли этанолом, фильтрат упарили. Получили 1,8 г сырого продукта в виде смеси гликозидов (1) и (4) в соотношении 2:1 с содержанием целевого гликозида 47,5% по данным ВЭЖХ (колонка Силасорб С18, подвижная фаза - ацетонитрил-вода-уксусная кислота, 55:44,4:0,6; детектор - λ 254 нм) в виде аморфного вещества, который растворили в 20 мл метанола, поместили на колонку с силикагелем КСК (фракция 50-150) (Сорбополимер) и элюировали смесью хлороформа-метанола-воды, 200:10:1, 100:10:1, 50:10:1, 25:10:1 (v/v, ступенчатый градиент) с контролем по ТСХ. Выход чистого гликозида (1) составил 0,90 г (45,0%).
2. 2,0 г (2,4 ммоль) ГК (87,0±0,5% чистоты) растворили в 50 мл смеси изопропанола-воды (1:1), прибавили 5,0 г (13,2 ммоль) боргидрида натрия и кипятили 1 ч. После охлаждения до комнатной температуры реакционную смесь подкислили 5% соляной кислотой (pH 1-2), добавили 50 мл воды и экстрагировали бутанолом (50 мл×3). Бутанольный экстракт промыли водой дважды, сушили MgSO4 и упарили досуха. Остаток растворили в 50 мл 75% этанола и обработали катионитом амберлит IR 120 (Н+-форма), как описано выше. Получили 2,0 г сырого гликозида в виде смеси изомеров (1) и (4) в соотношении 2:1 с содержанием целевого гликозида (1) 49,7% по данным ВЭЖХ, который разделили КХ, как описано выше. Выход чистого гликозида (1) составил 0,94 г (47,0%). Rf 0,46 (хлороформ-метанол-вода, 45:10:1).
[α]D 20+55±2° (с 0.1; МеОН). ИК-спектр, ν, см-1: 3600-3200 (ОН), 1708 (СООН). Спектр ЯМР 13С (Py-d5, δ, м.д.): 39,2 (С1); 27,8 (С2); 88,7 (С3); 40,3 (С4); 51,4 (С5); 19,0 (С6); 35,1 (С7); 43,8 (С8); 115,9 (С9); 37,7 (С10); 154,6 (С11); 121,7 (С12); 146,3 (С13); 42,5 (С14); 26,7 (С15); 26,3 (С16); 32,4 (С17); 46,4 (С18); 41,3 (С19); 43,0 (С20); 31,6 (С21); 38,2 (С22); 28,2 (С23); 16,3; 16,3 (С24; С25); 19,9 (С26); 20,6 (С27); 28,3 (С28); 28,5 (С29); 179,2 (С30); 104,4 (С1'); 83,7 (С2'); 77,3 (С3'); 72,5 (С4'); 77,0 (С5'); 171,7 (С6'); 106,2 (С1''); 76,2 (С2''); 77,3 (С3''); 72,7 (С4''); 77,7 (С5''); 172,2 (С6''). LS/MS [M+H]+ 809. C42H62O15. М.в. 807,9.
Триметиловый эфир 3-О-β-D-глюкуронопиранозил-β-D-глюкуронопиранозида олеан-9(11),12(13)-диен-30-овой кислоты (3)
К раствору 0,1 г гликозида (1) в 5 мл метанола прибавили эфирный раствор диазометана до устойчивой желтой окраски раствора. Растворители упарили, остаток перекристаллизовали из водного метанола. Выход эфира (3) 0,08 г (80%). Т.пл. 180-182°С. Лит.: т.пл 180°С (МеОН) [Kitagawa I., Zhou J,L., Sakagami M., Uchida E., Yoshikawa M. Licorice-saponins F3, G2, H2, J2, and K2, five new oleanene-triterpene oligoglycosides from the root of Glycyrrhiza uralensis. // Chem. Pharm. Bull., 1991, 39, 244-246].
Пример 2. Изучение цитотоксичности и анти-ВИЧ-1 активности гликозида (1) в культуре клеток МТ-4
Противовирусную активность гликозида (1) изучали на традиционной модели первично инфицированных ВИЧ (ВИЧ-1) перевиваемых Т-лимфоцитов человека (линия клеток МТ-4) с использованием штамма ВИЧ-1/ЭВК. В качестве препарата сравнения использовали очищенную ГК (97% чистоты).
Цитотоксичность исследуемого соединения оценивали в культуре клеток МТ-4. Препарат растворяли в ДМСО и в соответствующих разведениях вносили в лунки планшета (по три лунки на каждое разведение) при рассеве клеток. Посевная концентрация клеток составляла 0,5×106 клеток/мл. Конечная концентрация препарата в клеточной суспензии составляла от 1 мкг/мл до 2 мг/мл. Клетки культивировали в 96-луночных культуральных планшетах фирмы «Costar» (США) на ростовой питательной среде (среда RPMI-1640) с добавлением 10% сыворотки плода коровы, 0,06% L-глутамина, 100 мкг/мл гентамицина при 37°С в атмосфере 5% СО2 в течение 4-х суток.
По окончании инкубации подсчитывали долю жизнеспособных клеток в камере Горяева после окрашивания трипановым синим. Строили дозозависимую кривую и определяли цитотоксическую концентрацию препарата, вызывающую гибель 50% клеток - CD50.
Для оценки анти-ВИЧ-1 активности соединения (1) клетки МТ-4 (концентрация 2×106 клеток/мл) инфицировали штаммом ВИЧ-1/ЭВК с множественностью заражения 0,2-0,5 инфекционных единиц на клетку. После адсорбции вируса в течение 1 часа при 37°С инфицированные и контрольные клетки (без вируса) разводили ростовой культуральной средой до посевной концентрации 5×105 клеток/мл и вносили в лунки 96-луночных культуральных планшетов. Затем в соответствующие лунки вносили растворы исследуемого соединения в ДМСО (по три лунки на каждое разведение) и далее культивировали, как описано выше. Конечная концентрация исследуемых препаратов в клеточной суспензии составляла от 0,5 до 2,0%. В качестве препарата сравнения использовали ГК (97%) в концентрации 100 мкг/мл.
Ингибирующий эффект соединения (1) оценивали на 4-е сутки культивирования измерением количества вирусного антигена р24 иммуноферментным методом. Кроме того, определяли долю жизнеспособных клеток методом исключения трипановым синим. На основе полученных экспериментальных данных строили дозозависимые кривые и определяли количественные характеристики ингибирования: ID50-концентрацию соединения, на 50% подавляющую продукцию вируса или обеспечивающую 50% защиту клеток от гибели вследствие инфекции, ID90 - концентрацию соединения, на 90% подавляющую продукцию вируса или обеспечивающую 90% защиту клеток от гибели вследствие инфекции, IS - индекс селективности или терапевтический индекс - отношение токсичной дозы препарата CD50 к его эффективной дозе ID50. Результаты опытов приведены в табл.
Пример 3. Изучение влияния гликозида (1) на РНК-зависимую ДНК полимеразную активность обратной транскриптазы ВИЧ-1
В работе использовали рекомбинантную обратную транскриптазу (ОТ) ВИЧ-1, выделенную из экспрессируемого вектора p6HRT в культуре JM109 E.Coli согласно работе [Плясунова О.Ф., Ильина Т.В., Кисилева Я.Ю., Федюк Н.В., Балтина Л.А., Толстиков Г.А., Покровский А.Г. Анти-ВИЧ активность пента-о-никотината глицирризиновой кислоты. // Вестник РАМН, 2004, 11, 7-11]. Фермент, содержащий на N-конце 6 гистидиновых аминокислотных остатков, был очищен с помощью Ni-NTA агарозы, Qiagen, Hilden, Germany. Концентрацию очищенной ОТ определяли спектрофотометрически при 280 нм, используя коэффициент молярной экстинции 260450 M-1×cм-1 для гетеродимерной ОТ. В экспериментах по определению активности ОТ использовались [3H]-ТТР, Perkin Elmer Life Sciences (Boston, MA, USA) и поли(рибоА)-олиго(dT)12-18 в качестве матрицы-праймера, GE Healthcare (Pisataway, NJ, USA).
РНК-зависимую ДНК-полимеразную активность ОТ определяли в присутствии или в отсутствие различных концентраций исследуемого вещества с использованием 0,2 единицы/мл поли-(рибоА)-олиго(dT)12-18, 2 нМ ОТ, 5 мкМ [3H]ТТР в конечном объеме 50 мкл в буфере, содержащем 50 мМ трис-HCl (pH 8,0), 60 мкМ KCl и 10 мМ MgCl2. Образцы инкубировали в течение 20 мин при 37°С, реакцию останавливали добавлением 200 мкл охлажденной 10% трихлоруксусной кислоты (ТХУ), содержащей 20 мМ пирофосфата натрия. После 20 мин инкубации в ледяной бане образцы отфильтровывали через фильтр 1,2 мкм, содержащий стекловолокно типа С, в 96 луночные микропланшеты (Millipore, Bedford MA, USA). Фильтры промывали последовательно дважды 10% трихлоруксусной кислотой (ТХУ) и дважды 95% этанолом. Количество [3H]-TMP, включенной в осадок нуклеиновой кислоты, подсчитывали с помощью жидкостного сцинтилляционного спектрометра.
Исследования показали, что гликозид (1) с высокой эффективностью ингибирует РНК-зависимую ДНК-полимеразную активность ОТ ВИЧ-1. Эффективная концентрация (50% ингибирующая концентрация) гликозида (1) IC50 составила 3,1±1 мкг/мл. Препарат сравнения - ГК - не ингибирует ОТ ВИЧ-1 [Плясунова О.А., Егоричева И.Н., Федюк Н.В., Покровский А.Г., Балтина Л.А., Муринов Ю.И., Толстиков Г.А. Изучение анти-ВИЧ активности β-глицирризиновой кислоты. // Вопросы вирусол., 1992, 37, 235-238].
Таким образом, предлагаемое средство, представляющее собой 3-O-β-D-глюкуронопиранозил-β-D-глюкуронопиранозид олеан-9(11), 12(13)-диен-30-овой кислоты (1) - аналог ГК, является практически нетоксичным веществом и в 12 раз менее токсичен для клеток МТ-4, чем препарат сравнения - ГК (97% чистоты). Гликозид (1) проявляет выраженную анти-ВИЧ-1 активность, ингибируя накопление вирусспецифического белка р24, и превосходит ГК по индексу селективности (IS) в 4,8 раз. Гликозид (1) с высокой эффективностью ингибирует РНК-зависимую ДНК-полимеразную активность ОТ ВИЧ-1. Эффективная концентрация гликозида (1), ингибирующая 50% ОТ ВИЧ-1 (IC50), составила 3,1±1 мкг/мл. Препарат сравнения - ГК - не ингибирует ОТ ВИЧ-1.
1. Средство, представляющее собой 3-O-β-D-глюкуронопиранозил-β-D-глюкуронопиранозид олеан-9(11),12(13)-диен-30-овой кислоты формулы (1), проявляющее анти-ВИЧ-1 активность:
2. Способ получения 3-О-β-D-глюкуронопиранозил-β-D-глюкуронопиранозида олеан-9(11),12(13)-диен-30-овой кислоты (1) путем восстановления глицирризиновой кислоты боргидридом натрия в спиртоводной смеси (1:1) при нагревании с последующей обработкой реакционной смеси соляной кислотой, отличающийся тем, что в качестве спирта используют изопропанол, восстановление глицирризиновой кислоты проводят 4,5-5,5-кратным избытком боргидрида натрия при кипячении в течение 1-2 ч, обработку реакционной смеси проводят 5%-ной соляной кислотой (pH 1-2) при 20-22°С с последующей экстракцией бутанолом, приводящей к получению смеси гликозидов (1) и (4) в соотношении 2:1, которую подвергают обработке сильнокислыми катионитами в H+-форме в 70-75%-ном этаноле и разделению колоночной хроматографией на силикагеле с получением целевого продукта
3. Способ по п.2, отличающийся тем, что в качестве сильнокислых катионитов в Н+-форме используют КУ-2-8, дауэкс-50, амберлит IR-120.