Оптические агенты визуализации
Иллюстрации
Показать всеНастоящее изобретение относится к области медицины и фармацевтики и представляет собой агент визуализации, подходящий для оптической визуализации организма млекопитающего in vivo, который включает конъюгат пентаметинцианинового красителя с биологической молекулой-мишенью (RGD-пептид). Изобретение обеспечивает создание конъюгатов пентаметиновых цианиновых красителей, подходящих для исследований in vivo, характеризующихся пониженным неспецифическим связыванием in vivo, например, с белками плазмы. 7 н. и 19 з.п. ф-лы, 1 ил., 11 пр., 7 табл.
Реферат
Область изобретения
Настоящее изобретение относится к агентам визуализации, подходящим для оптической визуализации in vivo, которые включают конъюгаты пентаметинцианиновых красителей с пониженным неспецифическим связыванием, например, с белками плазмы. Этого достигают путем регулирования природы и положения сульфоновокислотных заместителей, в частности сульфоалкильных групп. Также раскрыты фармацевтические композиции и наборы, а также способы визуализации in vivo.
Предшествующий уровень техники
В патенте США 6083485 и его аналогах раскрыты способы оптической визуализации in vivo в ближней инфракрасной области спектра (NIR) с использованием цианиновых красителей, имеющих коэффициент распределения октанол-вода 2,0 или менее. Также раскрыты конъюгаты указанных красителей с "биологическими детектирующими субъединицами" молекулярной массы вплоть до 30 кДа, которые связываются со специфическими клеточными популяциями, либо избирательно связываются с рецепторами, либо накапливаются в тканях или опухолях. Красители согласно патенту США 6083485 могут быть также конъюгированы с макромолекулами, такими как полилизин, декстран или полиэтиленгликоль. Конкретные конъюгаты с красителем не раскрыты.
В WO 00/16810 раскрыты контрастные NIR флуоресцентные агенты, которые имеют 3 или более сульфоновокислотных групп в молекуле и имеют формулу А:
где:
R1 и R2 являются одинаковыми или разными и каждый представляет собой замещенный или незамещенный алкил;
Z1 и Z2 каждый представляет собой атом неметалла, необходимый для образования замещенного или незамещенного конденсированного бензокольца или конденсированного нафтокольца;
r равен 0, 1 или 2;
L1-L7 являются одинаковыми или разными и каждый представляет собой замещенный или незамещенный метин при условии, что, когда г равен 2, L6 и L7, которые присутствуют в двойном количестве, являются одинаковыми или разными;
Х и Y являются одинаковыми или разными и каждый представляет собой группу формулы -O-, -S-, -СН=СН- или -C(R3R4)-, где R3 и R4 являются одинаковыми или разными и каждый представляет собой замещенный или незамещенный алкил.
В WO 00/16810 раскрыто, что r из формулы А предпочтительно равен 1, то есть красители представляют собой гептаметинцианиновые красители, и что предпочтительные красители, имеющие 3 или более сульфоновокислотных групп в молекуле, представляют собой бензиндольные красители формулы В:
где R1, R2, L1-L7, Х и Y являются такими, как определено для формулы А, и
R5-R16 являются одинаковыми или разными и каждый представляет собой Н, сульфоновокислотную группу, карбоксильную группу, ОН, алкил(сульфоалкил)аминогруппу, бис(сульфоалкил)аминогруппу, сульфоалкоксильную группу, (сульфоалкил)сульфонильную группу или (сульфоалкил)аминосульфонильную группу за исключением некоторых конкретных соединений.
L1-L7 полиметиновая цепь согласно WO 00/16810 предпочтительно представлена формулой С:
где Z3 представляет собой атомы неметалла, необходимые для образования 5- или 6-членного кольца;
А представляет собой Н или одновалентную группу.
В WO 00/16810 раскрыто, что для превосходной водорастворимости количество сульфоновокислотных групп предпочтительно равно 4 или более, однако для легкости синтеза суммарное количество не должно превышать 10, предпочтительно не более чем 8. В WO 00/16810 также раскрыты предпочтительные положения сульфоновокислотных групп:
формула А - положения R1, R2, Z1 и/или Z2;
формула В - положения R1, R2, R5, R7, R11 и/или R13;
формула С - положение А через двухвалентную группу, такую как алкилен.
В WO 01/43781 раскрыты цианиновые красители с 7 метиновыми атомами углерода (то есть гептаметиновые или Cy7 красители), соответствующие r, равному 1 в формуле А выше. Красители из WO 01/43781 имеют 4-6 сульфоновокислотных заместителей.
В Licha et al. [Photochem. Photobiol., 72(3), 392-398 (2000)] сообщается, что цианиновые красители, имеющие по меньшей мере один гидрофильный глюкамидный или глюкозамидный заместитель, проявляют пониженное связывание с белками плазмы (РРВ) по сравнению с исходным красителем. Сказано, что два таких заместителя вместо одного еще больше снижают РРВ. Также сказано, что гидрофильные заместители улучшают фотофизические свойства красителя и изменяют фармакокинетические параметры, так что контраст между опухолью и нормальной тканью усиливается.
В патенте США 6977305 (Molecular Probes, Inc.) предложены соединения формулы:
где:
R2 и R12 независимо представляют собой алкил или сульфоалкил;
R3 представляет собой карбоксиалкил;
R4, R13 и R14 независимо представляют собой алкил;
R6-R9 и R16-R19 независимо представляют собой Н или сульфо; и
n равен 1, 2 или 3.
Также раскрыты активированные сложные эфиры красителей. В родственном патенте США 6974873 раскрыты способы окрашивания биологических образцов с использованием красителей, а также способы образования конъюгатов красителей с белками, пептидами или полимером нуклеиновой кислоты с использованием N-гидроксисукцинимидных сложных эфиров красителей.
В WO 2005/044923 раскрыты красители, подходящие для мечения и детектирования биологических материалов. Красители представляют собой триметиновые, пентаметиновые и гептаметиновые цианиновые красители (то есть n равен 1, 2 или 3) формулы D:
где:
R1 и R2 представляют собой C1-6алкил; бензил, незамещенный или замещенный сульфоновой кислотой или -(CH2)k-W;
где W представляет собой сульфоновую кислоту или фосфоновую кислоту, а k равен целому числу от 1 до 10;
R3-R6 представляют собой Н, SO3H или -E-F;
где Е представляет собой простую связь или спейсерную группу, имеющую цепь из 1-20 соединенных атомов, выбранных из С, N и О, и F представляет собой группу, связывающую мишень;
R11, R12, R13 и R14 представляют собой C1-6алкил или -(CH2)k-W;
Z1 и Z2 независимо представляют собой атомы углерода, необходимые для получения завершенной одно- или двухкольцевой ароматической системы; при условиях, что:
(1) один или более чем один из R11, R12, R13 и R14 независимо представляет собой -(CH2)k-W,
(2) по меньшей мере один из R1-R7 представляет собой -E-F.
Группа, связывающая мишень (F), из WO 2005/044923 предназначена для взаимодействия с функциональной группой целевого компонента (например белка, пептида, нуклеиновой кислоты или углевода). В WO 2005/044923 раскрыто, что присутствие одной или, предпочтительно, нескольких групп, придающих растворимость в воде, присоединенных по положению 3 индолиниевого кольца (то есть R11 или R12), уменьшает взаимодействия краситель-краситель, в частности, когда красители присоединены к компонентам, таким как нуклеиновые кислоты, белки, антитела и другие, и таким образом способствует минимизации потери интенсивности флуоресценции из-за межплоскостных взаимодействий краситель-краситель. В WO 2005/044923 раскрыто, что W предпочтительно представляет собой сульфоновую кислоту и что должно присутствовать по меньшей мере 2 группы -(CH2)k-W, которые предпочтительно выбраны таким образом, что одна из групп R11/R12 и одна из групп R13/R14 представляет собой -(CH2)k-W, а другая предпочтительно представляет собой -СН3. В WO 2005/044923 раскрыто, что W предпочтительно представляет собой сульфоновую кислоту и k предпочтительно равен 3 или 4. В дополнительном воплощении в WO 2005/044923 раскрыто, что красители предпочтительно замещены 3-5 сульфоновокислотными группами и что применение таких красителей для мечения биологических молекул-мишеней снижает потерю флуоресценции из-за агрегации краситель-краситель. В WO 2005/044923 также раскрыты способы мечения биологических молекул с красителями формулы D. WO 2005/044923 относится непосредственно к применениям красителя in vitro, и ничего не сказано о применениях in vivo.
В WO 2005/123768 раскрыты конъюгаты цианиновых красителей (которые представляют собой карбацианины, оксацианины, тиацианины или азацианины) с пептидами RGD-типа для оптической визуализации ангиогенеза in vivo. Цианиновые красители из WO 2005/123768 предпочтительно представляют собой пентаметиновые или гептаметиновые красители и предпочтительно имеют ноль, один или два сульфоновокислотных заместителя. Сказано, что уменьшение количества сульфонатных групп по сравнению с цианиновыми красителями предшествующего уровня техники дает пониженное связывание с белками плазмы (РРВ) и тем самым пониженный неспецифический захват in vivo. В Примере 5 в WO 2005/123768 предложены данные по РРВ конъюгатов с пентаметиновыми цианиновыми красителями, имеющими 1, 2 и 4 сульфоновокислотных группы. Было обнаружено, что РРВ возрастает с увеличением количества сульфоновокислотных групп (РРВ 17, 21 и 45% соответственно).
В Bullok et al. [Biochem., 46(13), 4055-4065 (2007)] раскрыт апоптозный зонд TcapQ547, который содержит эффекторную последовательность распознавания каспазы (тетрапептид DEVD), конъюгированную с: (1) мембранным транспортерным пептидом (Tat-пептид); (2) гасителем дальнего красного спектра (QSY 21) и (3) цианиновым красителем флуорофором Alexa Fluor™ 647. Интактный зонд проявляет очень малую флуоресценцию из-за гашения QSY 21. После расщепления каспазами по сайтам каспазной активности расщепленный пептид проявляет флуоресценцию ввиду того факта, что конъюгированный Alexa Fluor™ 647 теперь находится в другой молекуле относительно гасителя. Эта статья относится к исследованиям как с использованием разделенных интактных клеток, так и с использованием животной модели in vivo.
В Strong et al. [Eur. Cytokine Netw., 17, 49-59 (2006)] раскрыты хемокиновые белки, модифицированные с Alexa Fluor™ 647 по конкретным положениям их последовательностей. Оценивали специфичность клеточного окрашивания in vitro, что привело авторов к выводу о том, что соединения могут быть полезны в анализах хемокинового рецептора на основе интактных клеток.
Настоящее изобретение
В настоящем изобретении предложены агенты визуализации, подходящие для оптической визуализации in vivo, которые содержат конкретный класс пентаметинового цианинового красителя с конкретной картиной сульфонирования и конъюгированы с биологической группировкой-мишенью (ВТМ). Авторы настоящего изобретения обнаружили, что для пентаметиновых красителей сульфоалкильные группы проявляют важную роль в снижении связывания с белками плазмы (РРВ). Это является важным как для in vivo, так и для in vitro применений, так как способствует подавлению неспецифического связывания. Предполагается, что это происходит благодаря более трехмерной пространственной, или "объемной", природе таких модифицированных красителей в противоположность по существу двухмерным (или "плоскостным") арильным сульфонированным красителям (например Cy5 и Cy5.5).
Авторы настоящего изобретения обнаружили, что даже в пределах когерентного ряда пентаметиновых цианиновых красителей при конъюгировании с биологическими молекулами-мишенями (например, RGD-пептидами) имеются значительные вариации в биологических характеристиках, в частности в неспецифическом связывании. Это вносит вклад в нежелательный фоновый захват in vivo и тем самым пониженный контраст изображения и более медленный фоновый клиренс, требующий нежелательной задержки перед визуализации. В дополнение и как не рассматривается в уровне техники, неспецифическое связывание с коллагеном (которое широко распространено в организме млекопитающего) варьирует в значительной степени. В настоящем изобретении предложен конкретный подкласс пентаметиновых цианиновых красителей, которые имеют предпочтительные характеристики в отношении визуализации in vivo.
Подробное описание изобретения
В первом аспекте настоящего изобретения предложен агент визуализации, подходящий для оптической визуализации организма млекопитающего in vivo, включающий конъюгат формулы I:
где:
ВТМ представляет собой биологическую молекулу-мишень;
CyD представляет собой цианиновый краситель формулы II:
где:
Y1 и Y2 независимо представляют собой -O-, -S-, -NR6- или -CR7R8- и выбраны таким образом, что по меньшей мере один из Y1 и Y2 представляет собой -CR7R8-;
R1 и R2 независимо представляют собой Н, -SO3M1 или Ra, где М1
представляет собой Н или Bc,
и Bc представляет собой биосовместимый катион;
R3 представляет собой Н, С1-5алкил, С1-6карбоксиалкил или группу Ra;
R4-R6 независимо представляют собой С1-5алкил, C1-6карбоксиалкил или Rа;
R7 представляет собой C1-3алкил;
R8 представляет собой Ra или C1-6карбоксиалкил;
Ra представляет собой С1-4 сульфоалкил;
L представляет собой синтетическую линкерную группу формулы -(А)m-, где каждый А независимо представляет собой -CR2-, -CR=CR-, -C≡C-, -CR2CO2-, -CO2CR2-, -NRCO-, -CONR-, -NR(C=O)NR-, -NR(C=S)NR-, -SO2NR-, -NRSO2-, -CR2OCR2-, -CR2SCR2-, -CR2NRCR2-, С4-8циклогетероалкиленовую группу, C4-8циклоалкиленовую группу, С5-12ариленовую группу или С3-12гетероариленовую группу, аминокислоту, сахар или монодисперсную полиэтиленгликолевую (PEG) структурную единицу;
каждый R независимо выбран из Н, С1-4алкила, С2-4алкенила, С2-4алкинила, С1-4алкоксиалкила или С1-4гидроксиалкила;
m равен целому числу от 1 до 20;
n равен целому числу 0 или 1;
при условиях, что:
(1) цианиновый краситель содержит по меньшей мере одну группу Ra и суммарно от 3 до 6 сульфоновокислотных заместителей из групп R1, R2 и Ra;
(2) агент визуализации не содержит гасителя флуоресценции.
Термин "агент визуализации" означает соединение, подходящее для оптической визуализации интересующей области целого (то есть интактного) организма млекопитающего in vivo. Предпочтительно, млекопитающее представляет собой человека. Визуализация может быть инвазивной (например, интраоперационной или эндоскопической) или неинвазивной. Визуализация возможно может быть использована для облегчения биопсии (например, через канал для биопсии в эндоскопическом оборудовании) или резекции опухоли (например, во время интраоперационных процедур посредством определения границ резекции опухоли).
В то время как конъюгат формулы I является подходящим для визуализации in vivo, его также можно использовать для in vitro применений (например, анализы количественного определения ВТМ в биологических образцах или визуализация ВТМ в тканевых образцах). Предпочтительно, агент визуализации используют для визуализации in vivo.
Термин "сульфоновокислотный заместитель" означает заместитель формулы -SO3M1, где M1 представляет собой Н или Bc, и Bc представляет собой биосовместимый катион. Заместитель -SO3M1 ковалентно связан с атомом углерода, и этот атом углерода может быть арильным (таким, как группы R1 или R2) или алкильным (то есть группа Ra). Термин "биосовместимый катион" (Bc) означает положительно заряженный противоион, который образует соль с ионизированной отрицательно заряженной группой (в данном случае сульфонатной группой), где указанный положительно заряженный противоион является также нетоксичным и поэтому подходящим для введения в организм млекопитающего, особенно в организм человека. Примеры подходящих биосовместимых катионов включают: щелочные металлы натрий и калий; щелочноземельные металлы кальций и магний и ион аммония. Предпочтительные биосовместимые катионы представляют собой натрий и калий, наиболее предпочтительно натрий.
Термин "гаситель флуоресценции" означает группировку, которая подавляет флуоресценцию CyD, так что ВТМ, имеющая присоединенные гаситель и CyD, будет иметь минимальную флуоресценцию. Молекулы гасителей известны в данной области техники [Johansson, Meth. Mol. Biol., 335, 17-29 (2006) и Bullok et al. (выше)]. Таким образом, конъюгаты агента визуализации по настоящему изобретению соответственно уже являются флуоресцентными благодаря присутствию CyD и не нуждаются в метаболической активации для отделения CyD от гасителя. Это имеет преимущество в том, что ВТМ не имеет конъюгированной с ней дополнительной молекулы, которая может влиять на способность ВТМ взаимодействовать с его биологическим сайтом распознавания in vivo ввиду, например, стерического препятствия или изменения конформации из-за взаимодействия между гасителем и CyD, или гасителем и ВТМ, или гасителем и линкерной группой. В дополнение, необходимость в гасителе ограничивает ВТМ до одной, которая представляет собой субстрат для биологической мишени (то есть ферментативно расщепляемой) или которая подвергается значительному конформационному изменению при связывании. Отсутствие гасителя дает возможность использования большего численного диапазона ВТМ, что в свою очередь обеспечивает возможность диагностики более широкого ряда болезненных состояний. Какие-либо проявления токсичности из-за гасителя также исключены.
Термин "биологическая группировка-мишень" (ВТМ) означает соединение, которое после введения избирательно захватывается или локализуется в конкретном сайте организма млекопитающего. Такие сайты могут, например, быть вовлечены в конкретное болезненное состояние, показывая как функционирует орган или метаболический процесс. Биологическая группировка-мишень предпочтительно включает: 3-100-мерные пептиды, аналоги пептидов, пептоиды или миметики пептидов, которые могут представлять собой линейные пептиды или циклические пептиды или их комбинации; или субстраты ферментов, антагонисты ферментов, или ингибиторы ферментов; синтетические рецептор-связывающие соединения; олигонуклеотиды или фрагменты олиго-ДНК или олиго-РНК.
Термин "пептид" означает соединение, содержащее две или более аминокислот, как определено выше, связанных пептидной связью (то есть амидной связью, присоединяющей амин одной аминокислоты к карбоксилу другой аминокислоты). Термин "миметик пептида" или "миметик" относится к биологически активным соединениям, которые имитируют биологическую активность пептида или белка, но более не являются пептидными по химической природе, то есть они более не содержат никаких пептидных связей (то есть амидных связей между аминокислотами). Здесь термин «миметик пептида» используют в более широком смысле для включения молекул, которые более не являются полностью пептидными по природе, таких как псевдопептиды, полупептиды и пептоиды. Термин "аналог пептида" относится к пептидам, содержащим один или более чем один аналог аминокислоты, как описано ниже. См. также "Synthesis of Peptides and Peptidomimetics", M.Goodman et al. Houben-Weyl E22c, Thieme.
Термин "аминокислота" означает L- или D-аминокислоту, аналог аминокислоты (например, нафтилаланин) или миметик аминокислоты, которые могут быть естественного происхождения или получены тонким синтезом и могут быть оптически чистыми, то есть в виде индивидуального энантиомера и поэтому хиральными, или в виде смеси энантиомеров. Для обозначения аминокислот в данном описании использованы общепринятые 3-буквенные или однобуквенные сокращения. Предпочтительно, аминокислоты по настоящему изобретению являются оптически чистыми. Термин "миметик аминокислоты" означает синтетические аналоги существующих в природе аминокислот, которые являются изостерами, то есть разработаны так, чтобы имитировать стерическую и электронную структуру природного соединения. Такие изостеры хорошо известны специалистам в данной области техники и включают депсипептиды, ретро-инверсо-пептиды, тиоамиды, циклоалканы или 1,5-дизамещенные тетразолы, но не ограничены ими [см. M.Goodman, Biopolymers, 24, 137, (1985)].
Подходящие субстраты ферментов, антагонисты или ингибиторы включают глюкозу и аналоги глюкозы такие как фтордезоксиглюкоза; жирные кислоты или эластазу, ингибиторы ангиотензина II или металлопротеиназы. Предпочтительный непептидный антагонист ангиотензина II представляет собой лосартан. Подходящие синтетические рецептор-связывающие соединения включают эстрадиол, эстроген, прогестин, прогестерон и другие стероидные гормоны; лиганды для рецептора дофамина D-1 или D-2 или транспортер дофамина, такой как тропаны; и лиганды для рецептора серотонина.
Цианиновый краситель (CyD) формулы II представляет собой флуоресцентный краситель или хромофор, который способен к прямому или опосредованному детектированию в процедуре оптической визуализации с использованием длин волн в области спектра от зеленой до ближней инфракрасной (500-1200 нм, предпочтительно 600-1000 нм). Предпочтительно CyD имеет флуоресцентные свойства.
Предусмотрено, что одна из ролей линкерной группы -(А)m- формулы I заключается в том, чтобы отдалять CyD от активного сайта ВТМ. Это особенно важно, так как CyD является относительно объемной, так что возможны неблагоприятные стерические взаимодействия. Этого можно достичь комбинацией гибкости (например, простые алкильные цепи), так что CyD имеет свободу для саморасположения вдали от активного сайта, и/или жесткости, такой как циклоалкильный или арильный спейсер, который ориентирует CyD вдали от активного сайта. Природа линкерной группы может также быть использована для модификации биораспределения агента визуализации. Таким образом, например, включение сложноэфирных групп в линкер будет способствовать минимизации связывания с белками плазмы. Когда -(А)m- содержит полиэтиленгликолевую (PEG) структурную единицу или пептидную цепь из 1-10 аминокислотных остатков, линкерная группа может иметь функцию модифицирования фармакокинетических параметров и скорости клиренса из крови агента визуализации in vivo. Такие "биомодифицирующие" линкерные группы могут ускорять клиренс агента визуализации из фоновой ткани, такой как мышечная или печеночная, и/или из крови, тем самым давая лучшее диагностическое изображение вследствие меньших фоновых помех.
Биомодифицирующая линкерная группа может также быть использована для того чтобы способствовать конкретному пути экскреции, например, через почки в противоположность пути через печень.
Термин "сахар" означает моно-, ди- или трисахарид. Подходящие сахара включают: глюкозу, галактозу, мальтозу, маннозу и лактозу. Возможно сахар может быть функционализирован, чтобы обеспечить легкое сочетание с аминокислотами. Таким образом, например, глюкозаминное производное аминокислоты может быть конъюгировано с другими аминокислотами через пептидные связи. Глюкозаминное производное аспарагина (имеющееся в продаже от NovaBiochem) является одним из таких примеров:
Формула I означает, что группировка -(L)nCyD] может быть присоединена по любому подходящему положению ВТМ. Такие подходящие положения для группировки -(L)n[CyD] следует выбирать по положениям вдали от той части ВТМ, которая ответственна за связывание с активным сайтом in vivo. Группировка [BTM]-(L)n- формулы I может быть присоединена по любому подходящему положению CyD формулы II. Группировка [BTM]-(L)n- либо занимает место имеющегося заместителя (например, одной из групп R1-R8), либо ковалентно присоединена к имеющемуся заместителю CyD. Группировка [BTM]-(L)n- предпочтительно присоединена через карбоксиалкильный заместитель CyD.
Предпочтительные признаки
Молекулярная масса агента визуализации составляет подходящим образом вплоть до 30000 дальтон. Предпочтительно, молекулярная масса находится в диапазоне от 1000 до 20000 дальтон, наиболее предпочтительно от 2000 до 18000 дальтон, особенно предпочтительно от 2500 до 16000 дальтон.
ВТМ может быть синтетического или природного происхождения, но предпочтительно является синтетической. Термин "синтетический" имеет свое общепринятое значение, то есть искусственный в противоположность выделенному из натуральных источников, например из организма млекопитающего. Такие соединения имеют преимущество в том, что их производство и уровень примесей можно полностью контролировать. Моноклональные антитела и их фрагменты природного происхождения таким образом не входят в объем термина "синтетический", как он использован здесь.
ВТМ предпочтительно выбрана из: 3-100-мерного пептида, субстрата фермента, антагониста фермента или ингибитора фермента. ВТМ наиболее предпочтительно представляет собой 3-100-мерный пептид или аналог пептида. Когда ВТМ представляет собой пептид, он предпочтительно представляет собой 4-30-мерный пептид и наиболее предпочтительно 5-28-мерный пептид.
В формуле II Y1 и Y2 предпочтительно оба независимо представляют собой -CR7R8-. В формуле II R3 предпочтительно представляет собой Н или группу Ra и наиболее предпочтительно представляет собой Н. R7 предпочтительно представляет собой СН3.
Группировка [BTM]-(L)n- формулы I предпочтительно присоединена по положениям R3, R4, R5, R6, R7 или R8 CyD формулы II, более предпочтительно по R3, R4 или R5, наиболее предпочтительно по R4 или R5. Присоединение ВТМ по положению R3 имеет преимущество в том, что:
(1) становятся доступными дополнительные предпочтительные сайты для локализации сульфоалкильных групп (Ra);
(2) объемность красителя увеличивается, способствуя тем самым снижению РРВ.
Цианиновый краситель (CyD) предпочтительно имеет суммарно 4 сульфоновокислотных заместителя, выбранных из групп R1, R2 и Ra. Две группы Ra предпочтительно локализованы по положениям Y2, R3, R4 или R5, наиболее предпочтительно по R5 вместе с Y2=-CR7Ra- или R4=Ra. В формуле II группы Ra предпочтительно имеют формулу -(СН2)kSO3M1, где М1 представляет собой Н или Bc, k равен целому числу от 1 до 4, и Вс представляет собой биосовместимый катион (как определено выше), k предпочтительно равен 3 или 4.
В формуле II R1 и R2 оба предпочтительно представляют собой SO3M1. Когда R1 и R2 оба представляют собой SO3M1, эти заместители SO3M1 предпочтительно находятся в положении 5 индольных/индолениновых колец.
Особенно предпочтительные красители представлены формулой III:
где:
Rb независимо представляет собой группу Ra или С1-6карбоксиалкил;
R9-R12 независимо представляют собой С1-5алкил или группу Rb и выбраны таким образом, что
либо R9 и R10 оба представляют собой Rc, либо R11 и R12 оба представляют собой Rc, где Rc представляет собой С1-2алкил;
Ra и М1 являются такими, как определено выше для формулы II.
Группы Ra формулы III предпочтительно независимо представляют собой -(СН2)kSO3M1, где k равен целому числу от 1 до 4, и k предпочтительно равен 3 или 4. Предпочтительно красители формулы III имеют C1-6карбоксиалкильный заместитель для обеспечения легкого ковалентного присоединения к ВТМ.
Предпочтительные красители формулы III выбраны таким образом, что один из R9-R12 представляет собой группу Rb, а каждый из остальных представляет собой группы Rc, наиболее предпочтительно каждый представляет собой СН3. Особенно предпочтительные красители формулы III представлены формулой IIIa, где один из R9-R12 представляет собой группу Ra, а каждый из остальных представляет собой группы Rc, наиболее предпочтительно каждый представляет собой СН3. Предпочтительные красители формулы IIIa имеют одну из групп Rb, выбранную из C1-6карбоксиалкила.
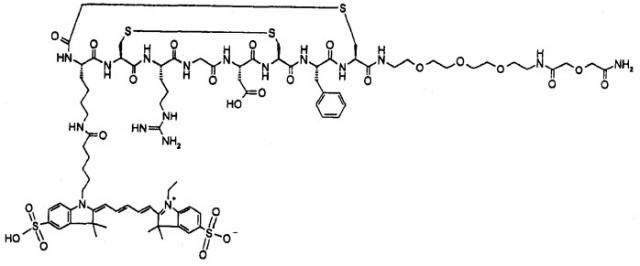
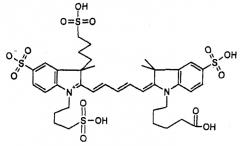
Наиболее предпочтительные конкретные красители формул III и IIIa соответственно представляют собой Alexa Fluor™ 647 и Cy5**, причем Cy5** является наиболее подходящим:
Когда ВТМ представляет собой пептид, предпочтительные такие пептиды включают:
- соматостатин, октреотид и аналоги,
- пептиды, которые связываются с рецептором ST, где ST относится к термостабильному токсину, продуцируемому E.coli и другими микроорганизмами;
- фрагменты ламинина, например YIGSR, PDSGR, IKVAV, LRE и KCQAGTFALRGDPQG,
- N-формилпептиды для сайтов-мишеней аккумуляции лейкоцитов,
- фактор тромбоцитов 4 (PF4) и его фрагменты,
- RGD (Arg-Gly-Asp)-содержащие пептиды, которые могут, например, нацеливаться на ангиогенез [R.Pasqualini et al. Nat Biotechnol. 1997 Jun; 15(6):542-6]; [E.Ruoslahti, Kidney Int. 1997 May; 51(5):1413-7];
- пептидные фрагменты α2-антиплазмина, фибронектина или бета-казеина, фибриногена или тромбоспондина. Аминокислотные последовательности α2-антиплазмина, фибронектина, бета-казеина, фибриногена и тромбоспондина можно найти в следующих ссылках: предшественник α2-антиплазмина [M.Tone et al. J.Biochem, 102, 1033, (1987)]; бета-казеин [L.Hansson et al. Gene, 139. 193, (1994)]; фибронектин [A.Gutman et al. FEBS Lett., 207, 145, (1996)]; предшественник тромбоспондина-1 [V.Dixit et al. Proc. Natl. Acad. Sci., USA, 83, 5449, (1986); R.F.Doolittle, Ann. Rev. Biochem., 53, 195, (1984)];
- пептиды, которые являются субстратами или ингибиторами ангиотензина, такие как:
ангиотензин II Asp-Arg-Val-Tyr-Ile-His-Pro-Phe (Е.С.Jorgensen et al, J. Med. Chem., 1979, Vol 22, 9, 1038-1044);
[Sar, Ile] ангиотензин II: Sar-Arg-Val-Tyr-Ile-His-Pro-Ile (R.K.Turker et al., Science, 1972, 177, 1203);
- ангиотензин I: Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu.
Когда ВТМ представляет собой пептид, один из обоих концов пептида, предпочтительно оба, конъюгированы с группой, ингибирующей метаболизм (MIG). Наличие обоих пептидных концов, защищенных таким образом, является важным для применений в визуализации in vivo, так как в противном случае следует ожидать быстрый метаболизм с последующей потерей аффинности избирательного связывания в отношении ВТМ-пептида. Термин "группа, ингибирующая метаболизм" (MIG), означает биосовместимую группу, которая ингибирует или подавляет действие фермента, особенно пептидазы, такой как карбоксипептидаза, метаболизм ВТМ-пептида либо по амино-концу, либо по карбокси-концу. Такие группы особенно важны для применения in vivo и хорошо известны специалистам в данной области техники и выбраны подходящим образом для амино-конца пептидов из: N-ацилированных групп -NH(C=O)RG, где ацильная группа -(С=O)RG имеет RG, выбранный из: C1-6алкила, С3-10арильных групп, или содержит полиэтиленгликолевую (PEG) структурную единицу. Подходящие группы PEG описаны ниже для линкерной группы (L). Предпочтительные такие группы PEG являются биомодификаторами формул Bio1 или Bio2 (ниже). Предпочтительные такие аминоконцевые группы MIG представляют собой ацетил, бензилоксикарбонил или трифторацетил, наиболее предпочтительно ацетил.
Подходящие группы, ингибирующие метаболизм, для пептидного карбоксильного конца включают: карбоксамид, трет-бутиловый эфир, бензиловый эфир, циклогексиловый эфир, аминоспирт или полиэтиленгликолевую (PEG) структурную единицу. Подходящая группа MIG для карбоксильного концевого аминокислотного остатка ВТМ-пептида является такой, где концевая аминогруппа аминокислотного остатка N-алкилирована C1-4алкильной группой, предпочтительно метильной группой. Предпочтительные такие группы MIG представляют собой карбоксамид или PEG, наиболее предпочтительные такие группы представляют собой карбоксамид.
Когда один или оба конца пептида защищены группой MIG, группировка -(L)n[CyD] возможно может быть присоединена к группе MIG. Предпочтительно, по меньшей мере один конец пептида не имеет группы MIG, так что присоединение группировки -(L)n[CyD] по тому положению дает соединения формул IVa или IVb соответственно:
где:
Z1 присоединен к N-концу ВТМ-пептида и представляет собой Н или MIG;
Z2 присоединен к С-концу ВТМ-пептида и представляет собой ОН, OBc или MIG,
где Bc представляет собой биосовместимый катион (как определено выше).
В формуле IVa и IVb, Z1 и Z2 предпочтительно оба независимо представляют собой MIG. Предпочтительные такие группы MIG для Z1 и Z2 являются такими, как определено выше для концов пептида. Хотя ингибирование метаболизма ВТМ-пептида по одному из концов пептида может также быть достигнуто путем присоединения группировки -(L)n[CyD] таким способом, что сама -(L)n[CyD] не входит в определение MIG по настоящему изобретению.
ВТМ-пептид возможно может содержать по меньшей мере один дополнительный аминокислотный остаток, имеющий боковую цепь, подходящую для легкой конъюгации CyD, и образует часть А остатков линкерной группы (L). Подходящие такие аминокислотные остатки включают остатки Asp или Glu для конъюгации с красителями CyD, функционализированными аминогруппами, или остаток Lys для конъюгации с красителем CyD, функционализированным карбоксигруппами или активным сложным эфиром. Дополнительный(е) аминокислотный(е) остаток(ки) для конъюгации CyD подходящим образом расположен(ы) вдали от связывающего участка ВТМ-пептида и предпочтительно расположен(ы) по С- или N-концу. Предпочтительно, аминокислотный остаток для конъюгации представляет собой остаток Lys.
Когда присутствует синтетическая линкерная группа (L), она предпочтительно содержит концевые функциональные группы, которые облегчают конъюгацию с [ВТМ] и CyD. Подходящие такие группы (Qa) описаны в пятом аспекте (ниже). Когда L содержит пептидную цепь из 1-10 аминокислотных остатков, эти аминокислотные остатки предпочтительно выбраны из глицина, лизина, аргинина, аспарагиновой кислоты, глутаминовой кислоты и серина. Когда L содержит группировку PEG, она предпочтительно содержит структурные единицы, полученные при олигомеризации монодисперсных PEG-подобных структур формул Bio1 или Bio2:
17-амино-5-оксо-6-аза-3,9,12,15-тетраоксагептадекановая кислота формулы Bio1, где р равен целому числу от 1 до 10. Альтернативно, может быть использована PEG-подобная структура на основе производного пропионовой кислоты формулы Bio2:
где р является таким, как определено для формулы Bio1, и q равен целому числу от 3 до 15.
В формуле Bio2 р предпочтительно равен 1 или 2, и q предпочтительно равен числу от 5 до 12.
Когда линкерная группа не содержит PEG или пептидную цепь, предпочтительные группы L имеют основную цепь соединенных атомов, образующих группировку -(А)m- из 2-10 атомов, наиболее предпочтительно из 2-5 атомов, особенно предпочтительно из 2 или 3 атомов. Минимальная линкерная группа с основной цепью из 2 атомов дает преимущество в том, что CyD хорошо отделена, так что какое-либо нежелательное взаимодействие минимизировано.
ВТМ-пептиды, которые не имеются в продаже, могут быть синтезированы твердофазным пептидным синтезом, как описано в Р.Lloyd-Williams, F.Albericio and E.Girald; Chemical Approaches to the Synthesis of Peptides and Proteins, CRC Press, 1997.
Агенты визуализации могут быть получены следующим образом.
С целью облегчения конъюгации CyD с ВТМ CyD подходящим образом присоединена к ней реакционно-способной функциональной группой (Qa). Эта группа Qa предназначена для взаимодействия с комплементарной функциональной группой ВТМ, тем самым образуя ковалентную связь между CyD и ВТМ. Комплементарная функциональная группа ВТМ может представлять собой внутреннюю часть ВТМ или может быть включена при использовании дериватизации с бифункцион