Гибридная и тандемная экспрессия белков нейссерий
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению иммуногенов из Neisseria meningitides, и может быть использовано в медицине. Предложен белок, на 80% и более идентичный аминокислотной последовательности SEQ ID NO:19, а также иммуногенная композиция с указанным белком. Изобретение позволяет примененять указанный белок для эффективной профилактики или лечения бактериального менингита. 2 н. и 4 з.п. ф-лы, 5 ил., 28 табл.
Реферат
Все процитированные в данном описании документы включены в виде ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к области экспрессии белков. В частности, изобретение относится к экспрессии белков из Neisseria (например, N. gonorrhoeae или, предпочтительно, N. meningitidis).
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В публикациях 1 и 2 раскрыты альтернативные и усовершенствованные способы экспрессии белков нейссерий, описанных в публикациях 3-6. Один из таких способов состоит в получении «гибридных» белков, при котором два или более белков нейссерий экспрессируются в виде одной полипептидной цепи. Указанный способ предоставляет два преимущества. Во-первых, белок, который может быть нестабильным или плохо экспрессируется сам по себе, может быть получен с помощью добавления подходящего партнера в гибриде, чтобы преодолеть данную проблему. Во-вторых, упрощается коммерческое производство, так как требуется использование только одной экспрессии и очистки, чтобы получить два отдельно применяемых белка.
Задачей данного изобретения являются новые альтернативные и улучшенные способы экспрессии белков нейссерий.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Гибридные белки
Таким образом, изобретение относится к способу одновременной экспрессии двух или более (например, 3, 4, 5, 6 или более) белков нейссерий, при котором указанные два или более белков связаны так, чтобы они транслировались в виде одной полипептидной цепи. В общем, гибридные белки согласно изобретению можно представить формулой: NH2-A-[-X-L-]n-B-COOH, где Х означает аминокислотную последовательность, L означает необязательную аминокислотную последовательность линкера, А означает необязательную N-концевую аминокислотную последовательность, В означает необязательную С-концевую аминокислотную последовательность и n является целым числом, большим 1.
Значение n находится в пределах от 2 до x, а значение x обычно равно 3, 4, 5, 6, 7, 8, 9 или 10. Предпочтительно n равно 2, 3 или 4; более предпочтительно 2 или 3; наиболее предпочтительно n=2.
Составляющие -X-
Существует две основных группы гибридных белков согласно изобретению. Указанные две группы не являются взаимоисключающими.
В первой группе каждая составляющая -Х- представляет собой:
(a) аминокислотную последовательность orf1, orf4, orf25, orf40, orf46.1, orf83, NMB1343, 230, 233, 287, 292, 594, 687, 736, 741, 907, 919, 936, 953, 961 или 983;
(b) аминокислотную последовательность, обладающую идентичностью последовательности с аминокислотной последовательностью согласно (а); или
(c) аминокислотную последовательность, содержащую фрагмент аминокислотной последовательности согласно (а).
Предпочтительной подгруппой (а) являются: orf46.1, 230, 287, 741, 919, 936, 953, 961 и 983. Более предпочтительной подгруппой (а) являются: orf46.1, 287, 741 и 961. На фиг.3 показаны предпочтительные гибридные белки.
Во второй группе гибридный белок содержит первую составляющую -Х- (-Ха-) и вторую составляющую -Х- (-Хb-). Составляющая -Ха- имеет одну из следующих аминокислотных последовательностей:
(d) 446 четных SEQ ID (т.е. 2, 4, 6, …, 890, 892), представленных в публикации 3;
(e) 45 четных SEQ ID (т.е. 2, 4, 6, …, 88, 90), представленных в публикации 4;
(f) 1674 четных SEQ ID NO:2-3020, четных SEQ ID NO:3040-3114 и все SEQ ID NO:3115-3241, представленные в публикации 5;
(g) 2160 аминокислотных последовательностей с NMB0001 по NMB2160 из публикации 7; или
(h) аминокислотная последовательность, представленная в публикации 1 или публикации 2.
Составляющая -Хb- является родственной -Ха- при условии, что: (i) -Хb- обладает идентичностью последовательностей с -Ха- и/или (j) -Хb- содержит фрагмент -Ха-.
Примеры указанного второго типа гибридного белка включают белки, в которых две или более составляющих -Х- являются идентичными или в которых они являются вариантами одного и того же белка, например, две полиморфные формы одного и того же белка могут экспрессироваться в виде -Хa-Хb-, и три полиморфные формы могут экспрессироваться в виде -Хa-Хb-Хc- и т.д.
Составляющие -Ха- и -Хb- могут быть расположены в любом порядке от N-конца к С-концу.
Составляющая -Ха- предпочтительно представляет собой аминокислотную последовательность orf1, orf4, orf25, orf40, orf46.1, orf83, NMB1343, 230, 233, 287, 292, 594, 687, 736, 741, 907, 919, 936, 953, 961 или 983. Более предпочтительно составляющая -Ха- является аминокислотной последовательностью orf46.1, 230, 287, 741, 919, 936, 953, 961 или 983. Наиболее предпочтительно составляющая -Ха- является аминокислотной последовательностью orf46.1, 287, 741 или 961.
В случае белков, где каждый из n составляющих -Х- проявляет идентичность последовательностей с каждой другой составляющей -Х-, белок называют «тандемным белком». Предпочтительны тандемные белки, в которых n=2.
Степень «идентичности последовательностей» в отношении (b) и (1) предпочтительно составляет более 50% (например, 60%, 70%, 80%, 90%, 95%, 99% или более, до 100%). Это относится к мутантам, гомологам, ортологам, аллельным вариантам и т.д. [например, см. ссылку 8]. Идентичность предпочтительно определяют с помощью алгоритма поиска гомологии Смита-Ватермана, который выполняется в программе MPSRCH (Oxford Molecular), с использованием поиска аффинных гэпов с параметрами: штраф за открытие гэпа=12 и штраф за продолжение гэпа=1. Обычно идентичность, составляющая 50% или более, между двумя белками считается показателем функциональной эквивалентности.
«Фрагмент» по отношению к (с) и (j) должен состоять, по меньшей мере, из m следующих друг за другом аминокислот из аминокислотной последовательности из (a), (d), (е), (f), (g) или (h) и в зависимости от конкретной последовательности m равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200 или более).
Предпочтительно фрагмент содержит эпитоп из аминокислотной последовательности из (а), (d), (е), (f), (g) или (h). Предпочтительными фрагментами являются фрагменты, описанные в публикациях 9 и 10.
Предпочтительными (с)- и (j)-фрагментами являются усеченные на С- и/или N-конце фрагменты (например, Δ1-287, Δ2-287 и т.д.).
В предпочтительные последовательности (b), (с), (i) и (j) не включены полиглициновые последовательности. Обнаружено, что это способствует экспрессии [ссылка 2]. Полиглициновые последовательности могут быть представлены в виде (Gly)g, где g≥3 (например, 4, 5, 6, 7, 8, 9 или более). Если составляющая -Х- содержит полиглициновую последовательность в своей форме дикого типа, предпочтительно исключить указанную последовательность в гибридных белках согласно изобретению. Это можно осуществить путем нарушения или удаления (Gly)g - посредством делеции (например, CGGGGS-CGGGS, CGGS, CGS или CS), замены (например, CGGGGS-CGXGGS, CGXXGS, CGXGXS и т.д.) и/или вставки (например, CGGGGS→CGGXGGS, CGXGGGS и т.д.). Предпочтительна делеция (Gly)g и делеция N-концевой части белка до и включая полиглициновую последовательность (например, делеция остатков 1-32 в SEQ ID NO:1) обозначается в данном описании «ΔG». Удаление полиглицина, в частности, применимо в случае белков 287, 741, 983 и Tbp2 (ΔG287, ΔG741, ΔG983 и ΔGTbp2 - ссылки 1 и 2).
В предпочтительных (с)- и (j)-фрагментах исключены целые белковые домены. В частности, это применимо в случае белка 961, 287 и ORF46. В том случае, если белок условно разделен на домены, в (с)- и (j)-фрагментах могут быть исключены один или несколько указанных доменов (например, 287В, 287С, 287ВС, ORF461-433, ORF46434-608, 961с - ссылка 2; фигуры 4 и 5 в данном описании).
Белок 287 условно разделен на три домена, названных А, В и С (см. фигуру 5 в публикации 2). Домен В выравнивается с протеазами IgA, домен С выравнивается с белками, связывающими трансферрин, и не наблюдается строгого выравнивания домена А с последовательностями в базе данных. Выравнивание полиморфных форм 287 описано в публикации 8.
ORF46 условно разделен на два домена - первый домен (аминокислоты 1-433; ORF46.1), который высококонсервативен среди видов и серогрупп, и второй домен (аминокислоты 434-608), который не является высоко консервативным. Второй домен предпочтительно делегируют, оставляя ORF46.1. Выравнивание полиморфных форм ORF46 описано в публикации 8.
Белок 961 условно разделен на несколько доменов (фиг.4).
Если составляющая -Х- имеет последовательность лидерного пептида в своей форме дикого типа, она может быть включена или опущена в гибридных белках согласно изобретению. Когда лидерный пептид исключен, последовательность является предпочтительным примером аминокислотной последовательности по (с) и (j). В одном варианте лидерные пептиды будут делегированы, за исключением случая, когда составляющая -Х- расположена на N-конце гибридного белка, т.е. лидерный пептид X1 будет сохранен, а лидерные пептиды Х2…Хn будут удалены. Это эквивалентно делегированию всех лидерных пептидов и использованию лидерного пептида X1 в виде составляющей -А-.
В том случае, когда n=2, предпочтительными парами составляющих -Х- являются: ΔG287 и 230; ΔG287 и 936; ΔG287 и 741; 961с и 287; 961с и 230; 961с и 936; 961cL и 287; 961cL и 230; 961cL и 936; ORF46.1 и 936; ORF46.1 и 230; 230 и 961; 230 и 741; 936 и 961; 936 и 741. В том случае, когда n=2, предпочтительными парами составляющих -Х- для тандемных белков являются: ΔG741 и 741; ΔG287 и 287. Более конкретно в случае, когда n=2, предпочтительными являются следующие комбинации X1 и Х2:
| X1 | X2 | X1 | X2 | |
| ΔG287 | 230 | 230 | ΔG287 | |
| ΔG287 | 936 | 936 | ΔG287 | |
| ΔG287 | 741 | 741 | ΔG287 | |
| ΔG287 | 961 | 961 | ΔG287 | |
| ΔG287 | ORF46.1 | ORF46.1 | ΔG287 | |
| ΔG287 | 919 | 919 | ΔG287 | |
| ΔG287 | 953 | 953 | ΔG287 | |
| 961с | 287 | 287 | 961с | |
| 961с | 230 | 230 | 961с | |
| 961с | 936 | 936 | 961с | |
| 961с | 741 | 741 | 961с | |
| 961с | 983 | 983 | 961с | |
| 961с | ΔG983 | ΔG983 | 961с | |
| 961с | ORF46.1 | ORF46.1 | 961с | |
| 961 | ORF46.1 | ORP46.1 | 961 | |
| 961cL | 287 | 287 | 961cL | |
| 961cL | 230 | 230 | 961cL | |
| 961cL | 936 | 936 | 961cL | |
| ORF46.1 | 936 | 936 | ORF46.1 | |
| ORF46.1 | 230 | 230 | ORF46.1 | |
| ORF46.1 | 741 | 741 | ORF46.1 | |
| ORF46.1 | ΔG741 | ΔG741 | ORF46.1 | |
| ORF46.1 | 983 | 983 | ORF46.1 | |
| ORF46.1 | ΔG983 | ΔG983 | ORF46.1 | |
| 230 | 961 | 961 | 230 | |
| 230 | 741 | 741 | 230 | |
| 230 | ΔG741 | ΔG741 | 230 | |
| 936 | 961 | 961 | 936 | |
| 936 | 741 | 741 | 936 | |
| 936 | ΔG741 | ΔG741 | 936 | |
| ΔG741 | 741 | ΔG287 | 287 | |
| ORF46.1 | 983 | 983 | ORF46.1 | |
| ΔG741 | ORF46.1 | ORF46.1 | ΔG741 | |
| ΔG741 | 983 | 983 | ΔG741 | |
| ΔG741 | 961 | 961 | ΔG741 | |
| ΔG741 | 961с | 961с | ΔG741 | |
| ΔG983 | ORF46.1 | ORF46.1 | ΔG983 | |
| ΔG983 | 961 | 961 | ΔG983 | |
| ΔG983 | 961с | 961с | ΔG983 |
В том случае, когда 287 используют в полноразмерной форме, он предпочтительно находится на С-конце гибридного белка; если его необходимо использовать на N-конце, то предпочтительно используют ΔG-форму 287. Подобным образом, в том случае, когда 741 используют в полноразмерной форме, он предпочтительно расположен на С-конце гибридного белка; если его необходимо использовать на N-конце, то предпочтительно используют ΔG-форму 741.
Составляющие -L-
Для каждого n случая [-X-L-] линкерная аминокислотная последовательность -L- может присутствовать или отсутствовать. Например, когда n=2 гибрид может представлять собой NH2-X1-L1-X2-L2-COOH, NH2-X1-X2-COOH, NH2-X1-L1-X2-COOH, NH2-X1-X2-L2-COOH и т.д.
Линкерная аминокислотная последовательность(ти) -L- обычно будет(будут) короткой(короткими) (например, 20 или меньше аминокислот, т.е. 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают короткие пептидные последовательности, которые облегчают клонирование, полиглициновые линкеры (т.е. Glyn, где n=2, 3, 4, 5, 6, 7, 8, 9, 10 или более) и гистидиновые метки (т.е. HiSn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие линкерные аминокислотные последовательности будут очевидны для специалистов в данной области. Применим линкер GSGGGG (SEQ ID NO:27), при этом дипептид Gly-Ser образован из сайта рестрикции BamHI, таким образом, способствуя клонированию и манипуляциям, а тетрапептид Gly4 является типичным полиглициновым линкером.
Если Xn+1 является белком ΔG и Ln является глициновым линкером, это может быть эквивалентно случаю, когда Xn+1 не является ΔG-белком, а Ln отсутствует.
Составляющая -А-
-А- является необязательной N-концевой аминокислотной последовательностью. Обычно она является короткой (например, 40 или меньше аминокислот, т.е. 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают лидерные последовательности для направленного перемещения белков или короткие пептидные последовательности, которые облегчают клонирование или очистку (например, гистидиновые метки, т.е. Hisn, где n=3, 4, 5, 6, 1, 8, 9, 10 или более). Другие подходящие N-концевые аминокислотные последовательности будут очевидны для специалистов в данной области. Если X1 не содержит на своем N-конце метионин, -А- может быть остатком метионина.
Составляющая -В-
-В- является необязательной С-концевой аминокислотной последовательностью. Обычно она является короткой (например, 40 или меньше аминокислот, т.е. 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают последовательности для направленного перемещения белков, короткие пептидные последовательности, которые облегчают клонирование или очистку (например, содержащие гистидиновые метки, т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более), или последовательности, которые повышают стабильность белка. Другие подходящие С-концевые аминокислотные последовательности будут очевидны специалистам в данной области.
Полиморфные формы белков
В изобретении можно использовать аминокислотные последовательности из любых штаммов N. meningitidis. Ссылка на конкретный белок (например, «287» или «ORF46.1») таким образом включает в себя такой белок из любого штамма. Вариации последовательностей между штаммами включены в (b), (с), (i) и (j).
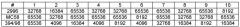
Опубликованные последовательности из N. meningitidis серогруппы В включают:
| Белок | Ссылка | Белок | Ссылка | |
| orf1 | Ref.3, SEQ ID 650 | orf4 | Ref.3, SEQ ID 218 | |
| orf25 | Ref.3, SEQ ID 684 | orf40 | Ref.4, SEQ ID 4 | |
| orf46 | Ref.6, SEQ ID 1049 | orf83 | Ref.3, SEQ ID 314 | |
| NMB1343 | Ref.7, NMB1343 | 230 | Ref.5, SEQ ID 830 | |
| 233 | Ref.5, SEQ ID 860 | 287 | Ref.5, SEQ ID 3104 | |
| 292 | Ref.5. SEQ ID 1220 | 594 | Ref.5, SEQ ID 1862 | |
| 687 | Ref.5, SEQ ID 2282 | 736 | Ref.5, SEQ ID 2506 | |
| 741 | Ref.5, SEQ ID 2536 | 907 | Ref.5, SEQ ID 2732 | |
| 919 | Ref.5, SEQ ID 3070 | 936 | Ref.5, SEQ ID 2884 | |
| 953 | Ref.5, SEQ ID 2918 | 961 | Ref.5, SEQ ID 940 | |
| 983 | Ref.7, NMB1969 |
В публикации 8 описаны полиморфные формы белков ORF4, ORF40, ORF46, 225, 235, 287, 519, 726, 919 и 953. Полиморфные формы 961 описаны в публикациях 11 и 12. Любую из указанных полиморфных форм можно использовать согласно данному изобретению.
Приведенный в данном описании список последовательностей включает полиморфные формы белков 741 (SEQ ID 1-22) и NMB1343 (SEQ ID 23-24), которые были идентифицированы.
Серогруппы и штаммы
Предпочтительные белки согласно изобретению содержат составляющие -Х-, имеющие аминокислотную последовательность, обнаруженную в N. meningitidis серогруппы В. В одном белке согласно изобретению отдельные составляющие -Х- могут быть из одного или нескольких штаммов. Например, когда n=2, Х2 может быть из того же самого штамма, что и X1, или из другого штамма. Когда n=3, штаммы могут быть (i) Х1=Х2=Х3, (ii) Х1=Х2≠Х3, (iii) Х1≠Х2=Х3, (iv) Х1≠Х2≠Х3 или (v) X1=X3≠X2 и т.д.
В серогруппе В предпочтительные составляющие -Х- получены из штаммов 2996, МС58, 95N477 или 394/98. Штамм 95N477 иногда в данном описании называют «ЕТ37», это его электрофоретический тип. Штамм 394/98 иногда в данном описании называют «nz», так как это новозеландский штамм.
В том случае, когда используют форму 287, она предпочтительно получена из штамма 2996 или из штамма 394/98.
В том случае, когда используют форму 741, предпочтительно она получена из штаммов серогруппы В МС58, 2996, 394/98 или 95N477 или из штамма серогруппы С 90/18311.
В том случае, когда используют форму 961, предпочтительно она получена из штамма 2996.
Штаммы указаны подстрочным индексом, например, 741мс58 означает белок 741 из штамма МС58. Если не оговорено особо, указанные в данном описании белки (например, без подстрочного индекса) из штамма 2996 N. meningitidis, который может быть принят в качестве «эталонного» штамма. Однако будет понятно, что изобретение в общем не ограничено штаммом. Как указано выше, можно полагать, что общая ссылка на белок (например, «287», «919» и т.д.) включает такой белок из любого штамма. Обычно он будет обладать идентичностью последовательностей с 2996, равной 90% или более (например, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более).
Основанная на доменах экспрессия белка 961
В публикациях 1 и 2 описано, как можно условно разделить белок на домены и как можно осуществлять манипуляции с белком на основе указанных доменов. В данном изобретении расширено применение данного способа по отношению к белку 961 (также, известный как «NadA» [11, 12]).
У штамма 2996 N. meningitidis серогруппы В NadA содержит 405 аминокислот. Указанный белок условно разделен на следующие девять доменов (фиг.4):
| Название домена | Аминокислоты | Название домена | Аминокислоты |
| 961-1 'L' | 1-23 | 961-6 | 269-286 |
| 961-2 | 24-87 | 961-7 | 287-330 |
| 961-3 | 88-143 | 961-8 | ЗЗТ-350 |
| 961-4 | 144-180 | 961-9 | 351-405 |
| 961-5 | 181-268 |
Приведенную информацию можно использовать для локализации таких же доменов в других формах 961.
Указанные домены были делегированы из 961 штамма 2996 различными способами (фиг.5). В предпочтительных фрагментах 961 исключен один или несколько из указанных девяти доменов, например, следующие:
- с 961-2 по 961-5 («961а»)
- с 961-6 по 961-9 («961b»)
- с 961-1 по 961-8 («961cL»)
- с 961-2 по 961-8 («961с»)
- с 961-2 по 961-6 и аминокислоты 287-325 из домена 961-7 («961d»)
- с 961-2 по 961-8 и аминокислоты 351-383 из домена 961-9 («961Δ1»)
- с 961-1 по 961-8 и аминокислоты 351-383 из домена 961-9 («961Δ1L»)
- с 961-1 по 961-7 и аминокислоты 331-343 из домена 961-8 («961cL-Δaro»)
- с 961-1 по 961-6 и аминокислоты 287-315 из домена 961-7 («961cL-Δcc»)
- с 961-1 по 961-5 («961aL»)
- с 961-1 по 961-4 («961aL-Δ1»)
- с 961-1 по 961-3 («961aL-Δ2»)
- с 961-1 по 961-2 («961aL-Δ3»)
Указанные тринадцать фрагментов (и их подфрагментов, в которых отсутствуют 1, 2, 3, 4 или 5 аминокислот на любом из концов или на обоих концах) являются предпочтительными (с)- и (j)-фрагментами, но они также могут быть экспрессированы сами по себе, т.е. не в форме гибридного белка согласно изобретению. Таким образом, изобретение относится к белку, содержащему один из указанных фрагментов, при условии, что белок не является полноразмерным 961 и не является белком, конкретно описанным в публикации 1 или 2. Данный белок может быть слитым белком (например, слиянием с GST или слиянием с His-меткой).
Последовательности
Изобретение также относится к белку, имеющему аминокислотную последовательность из SEQ ID 1-24. Изобретение также относится к белкам и нуклеиновой кислоте, имеющим последовательности, идентичные указанным. Как описано выше, степень «идентичности последовательностей» предпочтительно выше 50% (например, 60%, 70%, 80%, 90%, 95%, 99% или выше).
Изобретение также относится к нуклеиновой кислоте, кодирующей такие белки.
Кроме того, изобретение относится к нуклеиновой кислоте, которая может гибридизоваться с данной нуклеиновой кислотой предпочтительно в условиях «высокой жесткости» (например, при 65°С в растворе 0,1×SSC, 0,5% SDS).
Изобретение также относится к нуклеиновой кислоте, кодирующей белки согласно изобретению.
Следует понимать, что изобретение относится к нуклеиновой кислоте, содержащей последовательности, комплементарные последовательностям, описанным выше (например, используемым в качестве антисмысловых или в виде зондов).
Нуклеиновую кислоту согласно изобретению, конечно, можно получить множеством способов (например, в результате химического синтеза, из библиотеки геномной или кДНК, из самого организма и т.д.), и она может принимать различные формы (например, однонитевую, двунитевую, векторы, зонды и т.д.).
Кроме того, термин «нуклеиновая кислота» включает ДНК и РНК, а также их аналоги, такие как аналоги, содержащие модифицированные остовы, а также пептидонуклеиновые кислоты (ПНК) и т.д.
Смеси
Изобретение также относится к композиции, содержащей два или более (например, 2, 3, 4, 5, 6 или 7) из следующих белков:
(1) 287
(2) 741
(3) ORF46.1
(4) 961
(5) NH2-A-[-X-L-]n-B-COOH, где n=2, X1=287, X2=953
(6) NH2-A-[-X-L-]n-B-COOH, где n=2, X1=287, X2=919
(7) NH2-A-[-X-L-]n-B-COOH, где n=2, X1=287, X2=961
Смесь может содержать один или оба из следующих белков либо в комбинации с двумя или большим количеством белков (1)-(7), либо в комбинации только с одним из белков (1)-(7):
(8) NH2-A-[-X-L-]n-B-COOH, где n=2, X1=287, X2=741
(9) NH2-A-[-X-L-]n-B-COOH, где n=2, X1=936, Х2=741
В том случае, когда в смесь включены белки 287 и 741 (т.е. в случае белка 1, 2, 5, 6, 7 или 8), они могут быть в форме «ΔG». В том случае, когда включен белок 961, он предпочтительно находится в форме «961с», в которой отсутствуют N-концевой лидер и С-концевой мембранный якорь [например, см. ссылки 1, 2 и 11].
Предпочтительная смесь содержит следующие три белка:
(1) 961с, предпочтительно 961с2996 (например, SEQ ID NO:31, приведенная в данном описании);
(2) NH2-A-[-X-L-]n-B-COOH, где n равно 2, -X1- означает ΔG287 (предпочтительно ΔG287NZ), -Х2- означает 953 (предпочтительно 9532996), не содержащий своего лидерного пептида, -L1- означает GSGGGG и -А- содержит N-концевой метионин (например, -А- является М или МА) (например, SEQ ID NO:28 и 29, приведенные в данном описании); и
(3) NH2-A-[-X-L-]n-B-COOH, где n=2, X1=936 (предпочтительно 9362996), X2=ΔG741 (предпочтительно ΔG741MC58), L1=GSGGGG (например, SEQ ID NO:30, приведенная в данном описании).
Смеси также могут содержать пузырьки наружной мембраны N. meningitidis.
Гетерологичный хозяин
Хотя экспрессия белков согласно изобретению может иметь место в Neisseria, в данном изобретении предпочтительно используется гетерологичный хозяин. Гетерологичный хозяин может быть прокариотическим (например, бактерией) или эукариотическим. Предпочтительно хозяином является Е.coli, но другие подходящие хозяева включают Bacillus subtilis, Vibrio cholerae, Salmonella typhi, Salmonella typhimurium, Neisseria lactamica, Neisseria cinerea, Mycobacteria (например, М. tuberculosis), дрожжи и т.д.
Векторы и др.
Изобретение относится к (а) нуклеиновой кислоте, кодирующей описанные выше белки, (b) векторам, содержащим указанные последовательности нуклеиновых кислот, (с) клеткам-хозяевам, содержащим указанные векторы, (d) композициям, содержащим белки или нуклеиновые кислоты согласно изобретению, которые могут быть подходящими в качестве иммуногенных композиций (например, вакцин) или в качестве диагностических реагентов, (е) указанным композициям для применения в качестве лекарственных средств (например, в качестве вакцин) или в качестве диагностических реагентов, (f) применению указанных композиций в производстве (1) лекарственного средства для лечения или профилактики инфекций, обусловленных бактериями нейссериями, (2) диагностического реагента для выявления наличия бактерий нейссерий или антител, выработанных против бактерий нейссерий, и/или (3) реагента, который может вызывать образование антитела против бактерий нейссерий, и (g) к способу лечения пациента, предусматривающему введение пациенту терапевтически эффективного количества указанных композиций.
Осуществление изобретения, как правило, будет включать в себя основные стадии: получение первой нуклеиновой кислоты, кодирующей первый белок; получение второй нуклеиновой кислоты, кодирующей второй белок; и лигирование первой и второй нуклеиновых кислот. Полученную в результате нуклеиновую кислоту можно встраивать в экспрессирующий вектор, или она уже может быть частью экспрессирующего вектора.
Чтобы повысить растворимость, очистка гибридных белков может включать в себя способы рефолдинга, описанные в данной заявке.
Иммуногенные композиции и лекарственные средства
Композиции согласно изобретению предпочтительно являются иммуногенными композициями и более предпочтительно композициями вакцин. Значение рН композиции предпочтительно составляет от 6 до 7. рН можно поддерживать с использованием буфера. Композиция может быть стерильной.
Вакцины согласно изобретению могут быть либо профилактическими (т.е. для того, чтобы предотвращать инфекцию) или терапевтическими (т.е. для того, чтобы лечить инфекцию), но, как правило, будут профилактическими.
Изобретение также относится к композиции согласно изобретению для применения в качестве лекарственного средства. Лекарственное средство предпочтительно способно вызывать иммунный ответ у млекопитающего (т.е. является иммуногенной композицией) и наиболее предпочтительно является вакциной.
Изобретение также относится к применению композиции согласно изобретению в производстве лекарственного средства, вызывающего иммунный ответ у млекопитающего. Лекарственное средство предпочтительно является вакциной.
Изобретение также относится к способу, позволяющему вызвать иммунный ответ у млекопитающего, включающему в себя стадию введения эффективного количества композиции согласно изобретению. Иммунный ответ предпочтительно является защитным. Способ может вызывать вторичный иммунный ответ.
Млекопитающим предпочтительно является человек. В том случае, когда вакцина предназначена для профилактического применения, человек предпочтительно является ребенком (например, ребенком раннего или младшего возраста); в том случае, когда вакцина предназначена для терапевтического применения, человек предпочтительно является взрослым. Вакцину, предназначенную для детей, также можно вводить взрослым, например, чтобы оценить безопасность, дозу, иммуногенность и т.д.
Указанные применения и способы предпочтительно предназначены для профилактики и/или лечения заболевания, вызванного Neisseria (например, менингита, заражения крови, гонореи и т.д.). Предпочтительна профилактика и/или лечение бактериального менингита.
Дополнительные компоненты композиции
Композиция согласно изобретению, как правило, кроме указанных выше компонентов будет содержать один или несколько «фармацевтически приемлемых носителей», которые включают любой носитель, который сам по себе не индуцирует продукции антител, вредных для индивидуума, принимающего композицию. Подходящие носители обычно являются крупными, медленно метаболизирующими макромолекулами, такими как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, трегалоза (WO 00/56365) и липидные аггрегаты (такие как капельки масла или липосомы). Такие носители хорошо известны специалистам в данной области. Вакцины также могут содержать разбавители, такие как вода, физиологический раствор, глицерин и т.д. Дополнительно могут присутствовать вспомогательные вещества, такие как увлажняющие или эмульгирующие агенты, буферные вещества для поддержания рН и тому подобные. Подробное обсуждение фармацевтически приемлемых эксципиентов имеется в Remington's Pharmaceutical Sciences.
Иммуногенные композиции, используемые в качестве вакцин, содержат иммунологически эффективное количество антигена, а также при необходимости любой другой из вышеуказанных компонентов. Под «иммунологически эффективным количеством» подразумевается, что введение этого количества индивидууму либо в однократной дозе, либо в виде части серии доз является эффективным для лечения или профилактики. Данное количество варьирует в зависимости от состояния здоровья и физического состояния индивидуума, которого необходимо лечить, возраста, таксономической группы индивидуума, которого необходимо лечить (например, примат, отличный от человека, примат и т.д.), способности иммунной системы индивидуума синтезировать антитела, степени требуемой защиты, приготовления препарата вакцины, оценки лечащим врачом медицинского случая и других факторов, имеющих к этому отношение. Предполагается, что количество будет находиться в относительно широких пределах, которые можно определить посредством обычных испытаний. Режим дозирования может представлять собой схему на основе однократной дозы или схему с использованием многократных доз (например, включая повторные дозы). Вакцину можно вводить вместе с другими иммунорегулирующими агентами.
Композиция может содержать другие адъюванты в дополнение (или вместо) соли алюминия. Предпочтительные адъюванты для усиления эффективности композиции включают, но не ограничены указанным: (1) эмульсионные препараты типа «масло-в-воде» (в присутствии или без других специфичных иммуностимулирующих агентов, таких как мурамилпептиды (см. ниже) или компоненты клеточной стенки бактерий), такие как, например, (a) MF59™ (WO 90/14837; глава 10 в ссылке 13), содержащий 5% Сквален, 0,5% Твин 80 и 0,5% Спан 85 (необязательно содержащий МТР-РЕ), приготовленный в виде субмикронных частиц с использованием микрофлюидизатора, (b) SAF, содержащий 10% Сквалан, 0,4% Твин 80, 5% блок-сополимер полиоксиэтилена и полиоксипропилена L121 и thr-MDP, либо микрофлюидизированный до субмикронной эмульсии, либо подвергнутый встряхиванию для образования эмульсии с частицами более крупного размера, и (с) адъювантная система Ribi™ (RAS) (Ribi Immunochem, Hamilton, MT), содержащая 2% Сквален, 0,2% Твин 80 и один или несколько компонентов клеточной стенки бактерий из группы, состоящей из монофосфориллипида A (MPL), димиколата трегалозы (TDM) и скелета клеточной стенки (CWS), предпочтительно MPL+CWS (Detox™); (2) можно использовать адъюванты на основе сапонина, такие как QS21 или Stimulon™ (Cambridge Bioscience, Worcester, MA), или частицы, созданные на их основе, такие как ISCOM (иммуностимулирующие комплексы), и указанные ISCOM могут не содержать дополнительного детергента, например, WO 00/07621; (3) полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA); (4) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 (WO 99/44636), и т.д.), интерфероны (например, гамма-интерферон), колониестимулирующий фактор макрофагов (M-CSF), фактор некроза опухолей (TNF) и т.д.; (5) монофосфориллипид А (MPL) или 3-O-деацилированный MPL (3dMPL), например, GB-2220221, ЕР-А-0689454; (6) комбинации 3dMPL, например, с QS21 и/или эмульсиями типа «масло-в-воде», например, ЕР-А-0835318, ЕР-А-0735898, ЕР-А-0761231; (7) олигонуклеотиды, содержащие CpG-мотивы [Krieg, Vaccine 2000, 19, 618-622; Krieg Curr. opin. Mol. Ther. 2001, 3: 15-24; Roman et al., Nat. Med., 1997, 3, 849-854; Weiner et al., PNAS USA, 1997, 94, 10833-10837; Davis et al., J. Immunol., 1998, 160, 870-876; Chu et al., J. Exp. Med., 1997, 186, 1623-1631; Lipford et al., Eur. J. Immunol., 1997, 27, 2340-2344; Moldoveanu et al., Vaccine, 1988, 16, 1216-1224, Krieg et al., Nature, 1995, 374, 546-549; Klinman et al., PNAS USA, 1996, 93, 2879-2883; Ballas et al., J. Immunol., 1996, 157, 1840-1845; Cowdery et al., J. Immunol., 1996, 156, 4570-4575; Halpern et al., Cell. Immunol., 1996, 167, 72-78; Yamamoto et al., Jpn. J. Cancer Res., 1988, 79, 866-873; Stacey et al., J. Immunol., 1996, 157, 2116-2122; Messina et al., J. Immunol., 1991, 147, 1759-1764; Yi et al., J. Immunol., 1996, 157, 4918-4925; Yi et al., J. Immunol., 1996, 157, 5394-5402; Yi et al., J. Immunol., 1998, 160, 4755-4761; и Yi et al., J. Immunol., 1998, 160, 5898-5906; международные заявки на выдачу патентов WO 96/02555, WO 98/16247, WO 98/18810, WO 98/40100, WO 98/55495, WO 98/37919 и WO 98/52581], т.е. содержащие, по меньшей мере, один динуклеотид CG, при этом необязательно вместо цитозина используют 5-метилцитозин; (8) простой полиоксиэтиленовый эфир или сложный полиоксиэтиленовый эфир, например, WO 99/52549; (9) поверхностно-активное вещество сложный эфир полиоксиэтиленсорбитана в комбинации с октоксинолом (например, WO 01/21207) или поверхностно-активное вещество простой или сложный эфир полиоксиэтиленалкила в комбинации, по меньшей мере, с одним дополнительным неионогенным поверхностно-активным веществом, таким как октоксинол (например, WO 01/21152); (10) иммуностимулирующий олигонуклеотид (например, CpG-олигонуклеотид) и сапонин, например WO 00/62800; (11) иммуностимулятор и частица соли металла, например, WO 00/23105; (12) сапонин и эмульсия типа «масло-в-воде», например, WO 99/11241; (13) сапонин (например, QS21)+3dMPL+IL-12 (необязательно+стерол), например, WO 98/57659; (14) другие вещества, которые действуют как иммуностимулирующие агенты, чтобы повысить эффективность композиции.
Мурамилпептиды включают N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-[1',2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (МТР-РЕ) и т.д.
Дополнительные антигены
Дополнительные антигены, которые можно включать в композицию согласно изобретению, включают:
- препарат пузырьков наружной мембраны (OMV) из N. meningitidis серогруппы В, такой как препараты, описанные в ссылках 14, 15, 16, 17 и т.д.,
- сахаридный антиген из N. meningitidis серогруппы А, С, W135 и/или Y, такой как олигосахарид, описанный в публикации 18, из серогруппы С [см. также ссылку 19], или олигосахариды, описанные в публикации 20,
- сахаридный антиген из Streptococcus pneumoniae [например, ссылки 21, 22, 23],
- белковый антиген из Helicobacter pylori, такой как СаgА [например, 24], VacA [например, 24], NAP [например, 25], НорХ [например, 26], HopY [например, 26] и/или уреаза,
- антиген вируса гепатита А, такой как инактивированный вирус [например, 27, 28],
- антиген вируса гепатита В, такой как поверхностный и/или коровый антигены [например, 28, 29],
- антиген вируса гепатита С [например, 30],
- антиген из Bordetella pertussis, такой как голотоксин коклюша (РТ) и филаментный гемагглютинин (FHA) В. pertussis, необязательно также в комбинации с пертактином и/или агглютиногенами 2 и 3 [например, ссылки 31 и 32],
- дифтерийный антиген, такой как дифтерийный токсоид [например, глава 3, ссылка 33], например, мутант CRM197 [например, 34],
- антиген столбняка, такой как токсоид столбняка [например, глава 4 в ссылке 33],
- сахаридный антиген из Haemophilus influenzae В [например, 19],
- антиген из N. gonorrhoeae [например, 3, 4, 5],
- антиген из Chlamydia pneumoniae [например, 35, 36, 37, 38, 39, 40, 41],
- антиген из Chlamydia trachomatis [например, 42],
- антиген из Porphyromonas gingivalis [например, 43],
- антиген(ы) полиовируса [например, 44, 45], такого как IPV или OPV,
- антиген(ы) вируса бешенства [например, 46], такие как лиофилизованный инактивированный вирус [например, 47, RabAvert™],
- антигены кори, свинки и/или краснухи [например, главы 9, 10 и 11, ссылка 33],
- антиген(ы) гриппа [например, глава 19 в ссылке 33], такие как поверхностные белки гемагглютинин и/или нейраминидаза,
- антиген из Moraxella catarrhalis [например, 48],
- белковый антиген из Streptococcus agalactiae (стрептококк группы В) [например, 49, 50],
- сахаридный антиген из Streptococcus agalactiae,
- антиген из Streptococcus pyogenes (стрептококк группы А) [например, 50, 51, 52],
- антиген из Staphylococcus aureus [например, 53].
Композиция может содержать один или несколько из указанных дополнительных антигенов.
В том случае, когда используют сахаридный или углеводный антиген, он предпочтительно конъюгирован с белком-носителем для того, чтобы повысить иммуногенность [например, ссылки 54-63]. Предпочтительными белками-носителями являются бактериальные токсины или токсоиды, такие как токсоиды дифтерии или столбняка. Токсоид дифтерии CRM197 является особенно предпочтительным. Другие подходящие белки-носители включают белок наружной мембраны N. meningitidis [например, ссылка 64], синтетические пептиды [например, 65, 66], белки теплового шока [например, 67], белки коклюша [например, 68, 69], белок D из Н. influenzae [например, 70], токсин А или В из С.difficile [например, 71] и т.д. В том случае, когда смесь содержит капсульные сахариды как А-, так и С-серогруппы, предпочтительно, чтобы отношение (мас./мас.) сахарид МеnА: сахарид МеnС было более 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или более). Сахариды из разных серогрупп N. meningitidis можно конъюгировать с одним и тем же или с разными белками-носителями.
Можно использовать любую подходящую реакцию конъюгации с любым подходящим линкером в случае необходимости.
Токсичные белковые антигены в случае необходимости можно подвергнуть детоксикации (например, детоксикация токсина