Иммортализованная клеточная линия птиц
Иллюстрации
Показать всеИзобретения относятся к области генетической инженерии, в частности к иммортализованным эмбриональным клеткам птиц. Иммортализованная эмбриональная клетка птиц или клетки, имеющие происхождение от нее, содержит нуклеиново-кислотную последовательность Е1А для репликации вируса или для продуцирования целевого вещества или вируса. Иммортализованную эмбриональную клетку получают способом, включающим стадию трансфекции этой клетки невирусным вектором, содержащим указанную нуклеиново-кислотную последовательность Е1А и нуклеиново-кислотную последовательность, кодирующую рекомбинантную обратную транскриптазу теломеразы. Причем клетки, имеющие происхождение от указанной клетки, представляют собой клетки, которые развиваются или дифференцируются из нее или имеют ее в качестве предка. Клетки согласно изобретению, в частности, полезны для продуцирования рекомбинантных вирусных векторов. 7 н. и 30 з.п. ф-лы, 10 ил., 4 пр.
Реферат
Данное изобретение относится к иммортализованным клеточным линиям птиц и к применению этих клеток для продуцирования вирусов. Клетки в соответствии с изобретением, в частности, полезны для продуцирования рекомбинантных вирусных векторов, которые можно применять для получения терапевтических и/или профилактических композиций для лечения животных и более конкретно людей.
Эукариотические клеточные линии являются основополагающими для промышленного получения вирусных вакцин и многих продуктов биотехнологии. Биологические препараты, продуцируемые в клеточных культурах, включают ферменты, гормоны, иммунобиологические препараты (моноклональные антитела, интерлейкины, лимфокины) и противораковые агенты. Хотя многие более простые белки можно продуцировать, используя бактериальные клетки, более сложные белки, которые являются гликозилированными, в настоящее время должны быть получены в эукариотических клетках.
Клетки птиц много лет используют для продуцирования вирусных векторов. Например, вирус осповакцины, применяемый для получения профилактической композиции для лечения оспы, культивировали на эмбриональных фибробластах цыпленка (CEF). Клетки птиц особенно полезны, поскольку многие вирусы, применяемые в фармацевтической композиции, способны реплицироваться на них. Более примечательно, что различные вирусы способны расти только на клетках птиц. Это имеет место, например, в случае вируса млекопитающих Анкара (MVA), который неспособен расти на клетках млекопитающих. Этот поксвирус, который имеет происхождение от вируса осповакцины, путем более чем 500 пассажей на CEF использовали в ранние семидесятые годы для вакцинации людей с иммунодефицитом против оспы. Теперь MVA, в основном, применяют в качестве вектора для целей генотерапии. Например, MVA применяют в качестве вектора для гена MUC1 для вакцинации пациентов против опухоли, экспрессирующей этот антиген (Scholl et al., 2003, J Biomed Biotechnol., 2003, 3, 194-201). MVA, несущий ген, кодирующий антигены HPV, также применяют в качестве вектора для терапевтического лечения карциномы яичника. Недавно MVA стал вектором первого выбора для получения профилактического лечения против вновь возникших заболеваний или вероятного биологического оружия, как, например, вирус Западного Нила и сибирская язва.
В связи с этим существует возрастающая потребность в продуцировании вирусов. К настоящему времени чаще всего используемый способ продуцирования MVA включает стадию репликации вируса на CEF. Однако использование CEF связано с различными трудностями. Во-первых, получение CEF включает много стадий, которые приходится осуществлять вручную.
Кроме того, данный способ продуцирования вируса зависит от доступности яиц, которые могут быть полностью разрушены в случае заражения производителей. Эта проблема является все более релевантной в связи с распространением птичьего гриппа.
Кроме того, многие CEF обладают обратнотранскриптазной активностью (ОТ). ОТ представляет собой фермент, необходимый для воспроизведения ретровирусов. Ретровирусы обнаружены во многих различных видах. ОТ не является инфекционной у людей или животных, и не было показано, что она вызывает какие-либо вредные эффекты для здоровья у людей. С использованием анализа на основе высокочувствительной полимеразной цепной реакции (ПЦР) активность ОТ обнаружена в ничтожно малых количествах в вакцинах, полученных с эмбриональными фибробластами цыпленка. Источником фермента, вероятно, является частичный вирусный геном, кодирующий ОТ, который, по-видимому, интегрировал в клетки цыпленка сотни или тысячи лет назад. Неизвестно, чтобы ретровирусы птиц, которые продуцируют эту ОТ, поражали людей. Хотя вирус иммунодефицита человека (ВИЧ, вирус, который приводит к СПИДу), представляет собой ретровирус, активность ОТ, обнаруженная в вакцинах, определенно не имеет происхождения от ВИЧ. Кроме того, присутствие ОТ не подтверждает присутствия ретровируса. Тем не менее, клеточная линия без эндогенной активности ОТ представляла бы интерес.
С целью освобождения способа продуцирования вируса от использования CEF существует возрастающая потребность в клеточной линии птиц, которая дала бы возможность репликации и продуцирования вируса. Иммортализованные клеточные линии можно поддерживать или замораживать от партии к партии на месте продуцирования, и они всегда доступны для нового процесса продуцирования. Кроме того, поскольку они ограничены промышленным предприятием, они меньше подвергаются заражению экзогенным загрязнителем. Их применение дает возможность резкого уменьшения ручных манипуляций, необходимых для способа продуцирования. Все эти свойства приводят к снижению стоимости и продолжительности процесса продуцирования, а также к сведению к минимуму потенциального заражения.
Наконец, клеточные линии могут быть полностью охарактеризованы и, таким образом, полностью согласуются со стандартами добросовестной лабораторной практики и требованиями различных медицинских учреждений.
Различные клеточные линии птиц уже описаны. Например, DF1 (US 5879924) представляет собой спонтанно иммортализованную линию клеток цыпленка, имеющую происхождение от яиц 10-суточного возраста линии East Lansing Line (ELL-0). Эти клетки полезны в качестве субстратов для размножения вирусов, экспрессии рекомбинантных белков и продуцирования рекомбинантных вирусов. Однако эта клеточная линия чувствительна к различным вирусам, таким как вирус герпеса Meleagrid 1 (вирус герпеса индюков), вирус оспы птиц, реовирус, вирус саркомы и лейкемии птиц и вирус саркомы Рауса.
Иммортализованные клетки птиц могут быть также получены из эмбриональных стволовых клеток путем прогрессирующего отделения от факторов роста и фидерного слоя, сохраняя, таким образом, признаки роста и бесконечную продолжительность жизни, характерные для недифференцированных стволовых клеток. Единственной доступной клеточной линией птиц, полученной данным способом, является клеточная линия кур Ebx (WO 2005007840), которая находилась в контакте с фидерными слоями мышиного происхождения, что вызывало дополнительные вопросы регулирующих органов, такие как заражение мышиными вирусами и присутствие эндогенных ретровирусных последовательностей в куриных клетках. Кроме того, эти клеточные линии описаны при некоторых условиях как нестабильные и склонные к дифференциации.
Также основана постоянная клеточная линия эмбрионов утки, свободная от эндогенных ретровирусов птиц. Клеточная линия, обозначенная как DEC 99 (Ivanov et al. Experimental Pathology and Parasitology, 4/2000 Bulgarian Academy of Sciences), прокультивирована в течение 140 последовательных пассажей и не является канцерогенной для птиц. Клеточная линия DEC 99 представляет собой стандартную систему клеточной культуры, которая использована для исследования и может быть применена для нужд биотехнологии. Эта клеточная линия является подходящей моделью для исследований в области клеточной биологии, вирусологии, иммунологии, токсикологии и для получения диагностик и вакцин. Исследована чувствительность постоянной клеточной линии эмбриона утки (CL) DEC 99 к инфекции вакцинными штаммами поксвируса птиц (APV), адаптированными к эмбрионам (Ivanov et al. Experimental Pathology and Parasitology, 4/6 2001 Bulgarian Academy of Sciences). Использованы вакцинные штаммы FK и Dessau происхождения от домашней птицы и голубей соответственно. Проводили последовательные пассажи штаммов вирусов (13 пассажей) на первичных клеточных культурах эмбрионов утки (СС). Проводили дальнейшие пассажи адаптированных вирусных штаммов (12 пассажей) в СС клеточной линии DEC 99, где наблюдали типичный цитопатический эффект (ЦПЭ). Продуцирование инфекционных вирионов проверяли путем заражения 11-суточных эмбрионов белых леггорнов, где образовывались типичные разрастания оспы на хориоаллантоисных мембранах (ХАМ). В клетках DEC 99 штамм FK вызывал ранний ЦПЭ по сравнению со штаммом Dessau и достигал титра 10625 CCID50/мл. Вирусные штаммы, адаптированные к DEC 99, индуцировали типичные кожные положительные реакции после вакцинации двухмесячных цыплят. Таким образом, DEC 99 в качестве стандартной СС системы оказалась пригодной для получения вакцин против оспы птиц. Тем не менее, данная конкретная клеточная линия является медленно растущей после пассажа 40 и неспособна расти в суспензии.
Нуклеиново-кислотные последовательности из ранней области аденовируса 5 человека уже использованы для трансформации некоторых специфичных человеческих клеток in vitro (клеточные линии 293 и PER.C6; Fallaux, F.J. et al., Hum. Gene Ther. 9: 1909-17 (1998); Graham, F.L. et al., J. Gen. Virol. 36: 59-74 (1977)).
В целом аденовирусный геном состоит из двунитевой линейной молекулы ДНК длиной примерно 36 кб, которая содержит последовательности, кодирующие более 30 белков. На каждом из ее концов присутствует короткая инвертированная последовательность из 100-150 нуклеотидов в зависимости от серотипов, обозначенная ИКП (инвертированный концевой повтор). ИКП вовлечены в репликацию аденовирусного генома. Область капсидации примерно из 300 нуклеотидов локализована на 5' конце генома сразу после 5' ИКП.
Ранние гены распределены на 4 области, которые дисперсно распределены в аденовирусном геноме, обозначенные Е1-Е4 (Е обозначает "early, ранний"). Ранние области включают по меньшей мере шесть транскрипционных единиц, которые обладают собственными промоторами. Экспрессия ранних генов является самостоятельно регулируемой, причем некоторые гены экспрессируются раньше других. Три области, Е1, Е2 и Е4, соответственно, являются существенными для репликации вируса. Таким образом, если аденовирус является дефектным по одной из этих функций, то есть если он не может продуцировать по меньшей мере один белок, кодируемый одной из этих областей, этот белок должен быть предоставлен ему в транс-положении.
Ранняя область Е1 локализована на 5' конце аденовирусного генома и содержит 2 вирусные транскрипционные единицы, Е1А и Е1В, соответственно. Эта область кодирует белки, которые очень рано участвуют в вирусном цикле и существенны для экспрессии почти всех других генов аденовируса. В частности, транскрипционная единица Е1А кодирует белок, который транс-активирует транскрипцию других вирусных генов, включая транскрипцию с промоторов областей Е1В, Е2А, Е2В и Е4.
Guilhot et al. (Guilhot, C. et al., Oncogene 8: 619-24(1993)) было показано, что ретровирусная трансдукция белка 12S Е1А из Ad5 может привести к иммортализации клеток перепела. Однако в WO 2005042728 раскрыто, что невозможно иммортализировать клетки птиц, когда ген Е1А вводят путем трансфекции депротеинизированной ДНК вместо ретровирусной инфекции. В WO 2005042728, кроме того, указано: "что крайне эффективная и стабильная трансдукция посредством ретровирусной инфекции создает клеточный пул, достаточно большой, чтобы содержать индивидуальные клетки со спонтанными геномными изменениями, которые обладают блокированным апоптозом, который обычно индуцируется при инактивации ретинобластомы" (с.10).
Присутствие ретровирусных последовательностей в клетках, полученных Guilhot et al., затрудняет использование таких клеток для получения биологического препарата и более конкретно для терапевтических соединений.
Авторы изобретения неожиданно обнаружили, что клетки птиц и, более конкретно, клетки Cairina moschata могут быть эффективно иммортализованы путем трансфекции Е1А невирусным вектором.
С целью решения различных проблем, связанных с использованием CEF и/или с использованием ранее доступных клеточных линий, в настоящем изобретении предложена иммортализованная клетка птиц, содержащая нуклеиново-кислотную последовательность Е1А, характеризующаяся тем, что клетку получают способом, включающим стадию трансфекции клетки невирусным вектором, включающим нуклеиново-кислотную последовательность Е1А, и где клетка не содержит нуклеиново-кислотную последовательность Е1В.
Настоящее изобретение также относится к способу иммортализации клетки птиц, включающему стадию трансфекции клетки невирусным вектором, включающим нуклеиново-кислотную последовательность Е1А, и где указанный способ не включает стадию трансфекции клетки включающим нуклеиново-кислотной последовательностью Е1В.
Иммортализованная клетка, как используют здесь, относится к клетке, способной расти в культуре в течение более чем 35 пассажей.
Термин "число пассажей" относится к числу раз, сколько раз клеточная популяция извлечена из культурального сосуда и претерпела процесс субкультивирования (пассажа), с целью поддержания клеток при достаточно низкой плотности для стимуляции дальнейшего роста.
Как используют на протяжении всей заявки, термины в единственном числе используют в том смысле, что они означают "по меньшей мере один", "по меньшей мере первый", "один или более чем один" или "множество" компонентов или стадий, на которые ссылаются, если контекст не требует иного. Например, термин "клетка" включает множество клеток, включающее их смеси.
Термин "и/или" при использовании здесь включает значение "и", "или" и "все или любая другая комбинация элементов, связанных указанным термином".
Как используют здесь, термин "содержащий" предназначен для обозначения, что продукты, композиции и способы включают компоненты или стадии, на которые ссылаются, но не исключают другие. "Состоящий по существу из" при использовании для определения продуктов, композиций и способов должен подразумевать исключение других компонентов или стадий какой-либо существенной значимости. Таким образом, композиция, состоящая по существу из перечисленных компонентов, не должна исключать следовые примеси и фармацевтически приемлемые носители. "Состоящий из" должен подразумевать исключение более чем следовых элементов других компонентов или стадий.
Как используют здесь, термин "нукпеиново-кислотная последовательность Е1А" относится к нуклеиново-кислотной последовательности продуктов всех генов области Е1А аденовируса, включая нуклеиново-кислотную последовательность, кодирующую две основные РНК: 13S и 12S.
Предпочтительно термин "нуклеиново-кислотная последовательность Е1А" относится к нуклеиново-кислотной последовательности, включающей нуклеиново-кислотную последовательность, которая имеет по меньшей мере 60% идентичности нуклеиново-кислотной последовательности с SEQ ID №:1. В более предпочтительной форме осуществления изобретения Е1А относится к нуклеиново-кислотной последовательности, включающей нуклеиново-кислотную последовательность, которая имеет по меньшей мере 70%, предпочтительно по меньшей мере 80% и даже более предпочтительно по меньшей мере 90% идентичности нуклеиново-кислотной последовательности с SEQ ID №:1. В более предпочтительной форме осуществления Е1А относится к нуклеиново-кислотной последовательности, приведенной в SEQ ID №:1.
Как используют здесь, термин "нуклеиново-кислотная последовательность Е1В" относится ко всей нуклеиново-кислотной последовательности области Е1В аденовируса, включающей нуклеиново-кислотную последовательность, кодирующую 3 основных полипептида 19 кДа и 55 кДа.
Как используют здесь, термин "по существу такая же нуклеиново-кислотная последовательность" относится к молекуле нуклеиновой кислоты, обладающей достаточной идентичностью со сравнительным полинуклеотидом, чтобы гибридизоваться со сравнительным полинуклеотидом в умеренно жестких условиях гибридизации. В одной форме осуществления молекула нуклеиновой кислоты имеет по существу такую же нуклеотидную последовательность, как сравнительная нуклеотидная последовательность, представленная в SEQ ID №:1.
Гибридизация относится к связыванию комплементарных нитей нуклеиновой кислоты (то есть смысловой и антисмысловой нитей или зонда и ДНК-мишени) друг с другом посредством водородных связей, подобных связям, которые имеют место в природе в хромосомной ДНК. Уровни жесткости, используемые для гибридизации данного зонда с ДНК-мишенью, может легко варьировать специалист в данной области техники.
Выражение "жесткая гибридизация" используют здесь как относящееся к условиям, при которых гибриды полинуклеиновой кислоты стабильны. Как известно специалистам в данной области техники, стабильность гибридов отражена в температуре плавления (Tm) гибридов. Как правило, стабильность гибрида является функцией концентрации иона натрия и температуры. Типично реакцию гибридизации проводят в условиях более низкой жесткости с последующими отмывками варьирующей, но более высокой жесткости. Ссылка на жесткость гибридизации относится к таким условиям отмывки.
Как используют здесь, выражение "умеренно жесткая гибридизация" относится к условиям, которые позволяют ДНК-мишени связываться с комплементарной нуклеиновой кислотой, которая обладает примерно 60% идентичностью, предпочтительно примерно 75% идентичностью, более предпочтительно примерно 85% идентичностью с ДНК-мишенью; где более чем примерно 90% идентичность с ДНК-мишенью особенно предпочтительна. Предпочтительно умеренно жесткие условия представляют собой условия, эквивалентные гибридизации в 50% формамиде, 5× растворе Денхардта, 5× SSPE, 0,2% ДСН при 42°C с последующей отмывкой в 0,2× SSPE, 0,2% ДСН при 65°C.
Как используют здесь, выражение "невирусный вектор" особенно относится к вектору плазмидного происхождения, и, может быть, такой вектор комбинируют с одним или более чем одним веществом, улучшающим эффективность трансфекции, и/или стабильность вектора и/или защиту вектора in vivo от иммунной системы организма-хозяина. Эти вещества широко документированы в литературе, которая доступна специалистам в данной области техники (см., например, Felgner et al., 1987, Proc. West. Pharmacol. Soc. 32, 115-121; Hodgson and Solaiman, 1996, Nature Biotechnology 14, 339-342; Remy et at., 1994, Bioconjugate Chemistry 5, 647-654). Для иллюстрации, но без ограничения, они могут представлять собой полимеры, липиды, в частности катионные липиды, липосомы, ядерные белки или нейтральные липиды. Эти вещества можно использовать отдельно или в комбинации. Примеры таких соединений, в частности, приведены в патентных заявках WO 98/08489, WO 98/17693, WO 98/34910, WO 98/37916, WO 98/53853, EP 890362 или WO 99/05183. Комбинацией, которая может быть рассмотрена, является плазмидный рекомбинантный вектор, объединенный с катионными липидами (DOGS, DC-CHOL, спермин-холином, спермидин-холином и подобными) и нейтральными липидами (DOPE).
Выбор плазмид, которые можно использовать в контексте настоящего изобретения, широк. Они могут представлять собой клонирующие и/или экспрессионные векторы. В целом они известны специалистам в данной области техники, и ряд их имеется в продаже, но также возможно сконструировать или модифицировать их с помощью методов генной инженерии. Можно упомянуть в качестве примеров плазмиды, имеющие происхождение от pBR322 (Gibco BRL), pUC (Gibco BRL), pBluescript (Stratagene), pREP4, pCEP4 (Invitrogene) или p Poly (Lathe et al., 1987, Gene 57, 193-201). Предпочтительно плазмида, используемая в контексте настоящего изобретения, содержит точку начала репликации, обеспечивающая инициацию репликации в продуцирующей клетке и/или в клетке-хозяине (например, точка начала репликации Со1Е1 может быть выбрана для плазмиды, предназначенной для продуцирования в Е. coli, а система oriP/EBNA1 может быть выбрана, если желательно, чтобы она автономно реплицировалась в клетке-хозяине млекопитающего (Lupton and Levine, 1985, Mol. Cell. Biol. 5, 2533-2542; Yates et al., Nature 313, 812-815). Она может содержать дополнительные элементы, улучшающие ее поддержание и/или стабильность в данной клетке (последовательность cer, которая стимулирует поддержание плазмиды в мономерном состоянии (Summers and Sherrat, 1984, Cell 36, 1097-1103, Sequences for integration into the cell genome).
Термин "невирусный вектор" исключает вирусные векторы, такие как, например, вектор, имеющий происхождение от поксвируса (вирус осповакцины, в частности, MVA, вирус оспы канареек и тому подобное), от аденовируса, от ретровируса, от вируса герпеса, от альфавируса, от пенистого вируса или от аденоассоциированного вируса.
Настоящее изобретение также относится к клеткам, имеющим происхождение от клетки согласно изобретению. Как используют здесь, термин "имеющий происхождение" относится к клеткам, которые развиваются или дифференцируют из клетки согласно изобретению или имеют ее в качестве предка.
Термин "число пассажей" относится к числу раз, сколько раз клеточная популяция извлечена из культурального сосуда и претерпела процесс субкультивирования (пассажа), с целью поддержания клеток при достаточно низкой плотности для стимуляции дальнейшего роста.
Как используют здесь, термин "трансфицированный" относится к стабильной трансфекции или транзитной трансфекции клетки по изобретению.
Термин "стабильная трансфекция" или "стабильно трансфицированный" относится к введению и интеграции чужеродной нуклеиново-кислотной последовательности в геном трансфицированной клетки. Термин "стабильный трансфектант" относится к клетке, в геномную ДНК которой стабильно интегрирована чужеродная ДНК.
Согласно предпочтительной форме осуществления изобретения клетка птиц по изобретению имеет происхождение от клетки семейства Anatidae или семейства Phasianidae. Среди Anatidae клетки, принадлежащие к родам Cairina или Anas особенно предпочтительны. Даже более предпочтительно клетки согласно изобретению принадлежат к виду Cairina moschata или Anas platyrhynchos.
Предпочтительно клетка согласно изобретению получена из эмбрионального организма. Способы, дающие возможность выделения клеток из живого организма, хорошо известны специалистам в данной области техники. Например, можно использовать способы, раскрытые в примере 2. Согласно предпочтительной форме осуществления изобретения первичную клетку выделяют из эмбриона, принадлежащего к семейству Anatidae, возраст которого составляет между 0 и 20 сутками, более предпочтительно между 5 и 15 сутками и даже более предпочтительно между 11 и 14 сутками.
Согласно предпочтительной форме осуществления изобретения нуклеиново-кислотную последовательность Е1А встраивают в последовательность ДНК-мишени клетки согласно изобретению.
Как используют здесь, "последовательность ДНК-мишени" представляет собой предопределенную область в пределах генома клетки, которая является мишенью для модификации путем гомологичной рекомбинации с вектором. Последовательности ДНК-мишеней включают структурные гены (то есть последовательности ДНК, кодирующие полипептиды, включающие в случае эукариот интроны и экзоны), регуляторные последовательности, такие как энхансерные последовательности, промоторы и тому подобное, а также другие области в пределах интересующего генома. Последовательность ДНК-мишени может также представлять собой последовательность, которая, когда она является мишенью вектора, не обладает эффектом на функцию генома-хозяина.
Как используют здесь, "встроенный в последовательность ДНК-мишени" в широком смысле означает, что процесс гомологичной рекомбинации, который приводит к инсерции иммортализующего гена, вводит делецию или прерывание в последовательность ДНК, являющуюся мишенью.
Для получения иммортализованной клетки птиц, где нуклеиново-кислотная последовательность Е1А встроена в последовательность ДНК-мишени, вектор, используемый в способе согласно изобретению, может дополнительно содержать две гомологичные последовательности, способные к гомологичной рекомбинации с областью последовательности ДНК-мишени, нативной для генома указанной клетки.
Присутствие этих гомологичных последовательностей дает возможность сайт-специфической инсерции молекулы нуклеиновой кислоты по изобретению в последовательность ДНК-мишени посредством гомологичной рекомбинации.
Термин "гомологичная рекомбинация" относится к обмену фрагментов ДНК между двумя молекулами ДНК в сайте по существу идентичных нуклеотидных последовательностей. Согласно данной конкретной форме осуществления изобретения внутри вектора находятся последовательности, которые гомологичны с участками последовательности, содержащейся внутри последовательности ДНК-мишени. В предпочтительной форме осуществления изобретения гомологичные последовательности в векторе переноса на сто процентов гомологичны области последовательности-мишени. Однако можно использовать более низкую гомологию последовательности. Таким образом, можно использовать столь низкую гомологию последовательности, как примерно 80%.
Гомологичные последовательности в векторе переноса содержат по меньшей мере 25 п.о. Предпочтительны более длинные участки, по меньшей мере 500 п.о., и более предпочтительно по меньшей мере 5000 п.о.
Согласно более предпочтительной форме осуществления изобретения молекула нуклеиновой кислоты окружена гомологичными последовательностями в векторе.
Как используют здесь, "окружены" означают, что одна из гомологичных последовательностей локализована выше молекулы нуклеиновой кислоты по изобретению, и что одна из гомологичных последовательностей локализована ниже молекулы нуклеиновой кислоты по изобретению. Как используют здесь, "окружены" не обязательно означает, что две гомологичные последовательности непосредственно сшиты с 3' или с 5' концом иммортализующего гена, и иммортализующий ген и гомологичные последовательности могут быть разделены неограниченным числом нуклеотидов.
Специалист в данной области техники способен выбрать подходящие гомологичные последовательности для направления на конкретную последовательность ДНК в геноме клетки, подлежащей иммортализации. Например, одна гомологичная последовательность может быть гомологична участку последовательности-мишени, где другая гомологичная последовательность гомологична последовательности ДНК, локализованной выше или ниже последовательности-мишени. Согласно другому примеру, одна из гомологичных последовательностей может быть гомологична последовательности ДНК, локализованной выше последовательности ДНК-мишени, где другая гомологичная последовательность гомологична последовательности ДНК, локализованной ниже последовательности ДНК-мишени. В другом примере обе гомологичные последовательности гомологичны последовательностям, локализованным внутри последовательности ДНК-мишени.
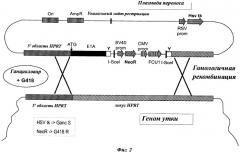
Согласно предпочтительной форме осуществления изобретения последовательность ДНК-мишени представляет собой ген HPRT (гипоксантингуанинфосфорибозилтрансферазы).
Геномная последовательность, включающая промотор HPRT и ген HPRT Cairina moschata, приведена в SEQ ID №:2. Последовательность, кодирующая HPRT, начинается в кодоне ATG в положении 8695 нуклеиново-кислотной последовательности, приведенной в SEQ ID №:2, где последовательность выше этого ATG кодона представляет собой промоторную последовательность HPRT.
Специалист в данной области техники способен выбрать гомологичные последовательности, необходимые для интеграции нуклеиново-кислотной последовательности Е1А в ген HPRT. Поскольку между различными членами семейства геномные последовательности, кодирующие HPRT, высоко гомологичны, специалист в данной области техники также способен сконструировать гомологичные последовательности, необходимые для направления в ген HPRT клеток каждой птицы.
Согласно более предпочтительной форме осуществления изобретения гомологичные последовательности приспособлены для встраивания нуклеиново-кислотной последовательности Е1А ниже промотора HPRT клетки. В данной конкретной форме осуществления молекула нуклеиновой кислоты по изобретению оперативно сцеплена с эндогенным промотором HPRT клетки. Под "оперативно сцепленной" подразумевают, что нуклеиново-кислотная последовательность Е1А сцеплена с промотором таким образом, что дает возможность ее экспрессии в клетке.
Согласно данной конкретной форме осуществления гомологичная последовательность слева от молекулы нуклеиновой кислоты по изобретению предпочтительно имеет нуклеиново-кислотную последовательность, которая гомологична по меньшей мере 500 непрерывных п.о. и более предпочтительно по меньшей мере 5000 непрерывных п.о. нуклеиново-кислотной последовательности, начинающейся с нуклеотида в положении 1 и заканчивающейся нуклеотидом в положении 8694 нуклеиново-кислотной последовательности, приведенной в SEQ ID №:2, при условии, что эта гомологичная последовательность не гомологична нуклеиново-кислотной последовательности, начинающейся с нуклеотида в положении 8695 и заканчивающейся нуклеотидом в положении 26916 нуклеиново-кислотной последовательности, приведенной в SEQ ID №:2. Кроме того, эта левая гомологичная последовательность предпочтительно непосредственно сшита со стартовым кодоном нуклеиново-кислотной последовательности Е1А. Согласно еще более предпочтительной форме осуществления изобретения гомологичная последовательность слева от молекулы нуклеиновой кислоты по изобретению состоит из нуклеиново-кислотной последовательности, начинающейся с нуклеотида в положении 1 и заканчивающейся нуклеотидом в положении 8694 нуклеиново-кислотной последовательности, приведенной в SEQ ID №:2. Гомологичная последовательность справа от нуклеиново-кислотной последовательности Е1А предпочтительно имеет нуклеиново-кислотную последовательность, которая гомологична по меньшей мере 500 непрерывных п.о. и более предпочтительно по меньшей мере 5000 непрерывных п.о. нуклеиново-кислотной последовательности, начинающейся с нуклеотида в положении 10580 и заканчивающейся нуклеотидом в положении 18009 нуклеиново-кислотной последовательности, приведенной в SEQ ID №:2. И более предпочтительно гомологичная последовательность справа от нуклеиново-кислотной последовательности Е1А состоит из нуклеиново-кислотной последовательности, начинающейся с нуклеотида в положении 10580 и заканчивающейся нуклеотидом в положении 18009 нуклеиново-кислотной последовательности, приведенной в SEQ ID №:2.
Соответственно, настоящее изобретение также относится к клетке птиц, содержащей нуклеиново-кислотную последовательность Е1А, характеризующейся тем, что эта клетка получена способом, включающим стадию трансфекции клетки невирусным вектором, включающим нуклеиново-кислотную последовательность Е1А, где клетка не содержит нуклеиново-кислотную последовательность Е1 В, и где нуклеиново-кислотная последовательность Е1А оперативно сцеплена с эндогенным промотором HPRT клетки.
Согласно предпочтительной форме осуществления вектор, используемый в способе согласно изобретению, включает первый селективный маркер, где этот первый селективный маркер представляет собой положительный селективный маркер, и где первый селективный маркер окружен гомологичными последовательностями, содержащимися в векторе. В этом отношении процесс гомологичной рекомбинации, который происходит между вектором и геномом клетки, приводит к интеграции нуклеиново-кислотной последовательности Е1А и первого селективного маркера. Когда вектор переноса является кольцевым, "окружен" означает, что первый селективный маркер и нуклеиново-кислотная последовательность Е1А расположены в одном и том же участке вектора, где этот участок ограничен гомологичными последовательностями.
Как используют здесь, термин положительный селективный маркер исключительно относится к гену, кодирующему продукт, который дает возможность только клеткам, которые несут этот ген, выживать и/или расти в определенных условиях. Типичные селективные маркеры кодируют белки, которые придают устойчивость к антибиотикам или другим токсинам, например, к ампициллину, неомицину, метотрексату или тетрациклину, восполняют ауксотрофные недостаточности или обеспечивают критические нутриенты, недоступные из комплексной среды. В предпочтительной форме осуществления согласно изобретению первый селективный маркер кодирует белок, который придает устойчивость к антибиотикам.
Интеграция первого селективного маркера дает возможность селекции клеток, в которые встроена нуклеиново-кислотная последовательность Е1А. Соответственно, способ согласно изобретению может дополнительно включать стадию, где указанные клетки культивируют в среде, которая дает возможность роста только клеток, в которые встроен первый селективный маркер, например, в среде, которая содержит антибиотик.
Согласно более предпочтительной форме осуществления изобретения первый селективный маркер в векторе окружен последовательностями, дающими возможность его супрессии. Эти последовательности, дающие возможность супрессии первого селективного маркера, не окружают нуклеиново-кислотную последовательность Е1А. Когда вектор является кольцевым, последовательности, дающие возможность супрессии первого селективного маркера, первый селективный маркер и нуклеиново-кислотная последовательность Е1А расположены в одном и том же участке вектора переноса, где этот участок ограничен гомологичными последовательностями.
Последовательности, дающие возможность супрессии фрагмента нуклеиновой кислоты, хорошо известны специалистам в данной области техники (Nunes-Duby, S. et al. (1998) Nucleic Acids Res. 26:391-406). Эти последовательности могут распознаваться одним или более чем одним специфичным ферментом, который индуцирует супрессию нуклеиновой кислоты, содержащейся между указанными последовательностями, где эти ферменты называют "рекомбиназой". Например, эти хорошо известные рекомбиназы, дающие возможность супрессии фрагмента нуклеиновой кислоты, представляют собой рекомбиназы FLP, ISCE1 и Cre.
Типичной сайт-специфической рекомбиназой является рекомбиназа Cre. Cre представляет собой 38-кДа продукт гена cre (рекомбинация циклизации) бактериофага Р1 и представляет собой сайт-специфическую ДНК рекомбиназу семейства Int, Sternberg, N. et al. (1986) J. Mol. Biol. 187: 197-212. Cre распознает 34-п.о. сайт генома Р1, называемый loxP (локус кроссинговера Р1) и эффективно катализирует реципрокную консервативную рекомбинацию ДНК между парами сайтов loxP. Сайт loxP состоит из двух 13-п.о. инвертированных повторов, фланкирующих 8-п.о. не палиндромную сердцевинную область. Cre-опосредованная рекомбинация между двумя прямо повторяющимися сайтами loxP приводит в результате к эксцизии ДНК между ними в виде ковалентно замкнутого кольца. Cre-опосредованная рекомбинация между парами сайтов loxP в инвертированной ориентации приведет к инверсии находящейся между ними ДНК вероятнее, чем к эксцизии. Разрыв и воссоединение ДНК ограничены дискретными положениями внутри сердцевинного участка и протекает на нитях одновременно путем транзитной связи фосфотирозин-ДНК-белок с ферментом.
Другой сайт-специфической рекомбиназой является I-Scel. Другую эндонуклеазу хоминга интронов, например, I-Tlil, I-Ceul, I-Crel, I-Ppol и PI-Pspl, можно также заменять I-Scel в способе согласно изобретению. Многие перечислены Belfort and Roberts ((1997) Nucleic Acids Research 25:3379-3388). Многие из этих эндонуклеаз имеют происхождение из геномов органелл, в которых паттерн использования кодонов отличается от стандартного ядерного паттерна использования кодонов. Чтобы использовать такие гены для ядерной экспрессии их эндонуклеаз, может быть необходимо изменение кодирующей последовательности для совпадения с последовательностью ядерных генов. I-Scel является двунитевой эндонуклеазой, которая расщепляет ДНК внутри ее сайта распознавания. I-Scel генерирует 4 п.о. зигзагообразный разрыв с выступающими 3'ОН группами.
Фермент I-Scel имеет известный сайт распознавания. Сайт распознавания I-Scel представляет собой несимметричную последовательность, которая продолжается более 18 п.о.
5' TAGGGATAACAGGGTAAT3'
3' ATCCCTATTGTCCCATTA5'
Другой сайт-специфической рекомбиназой является FLP рекомбиназа. Flp рекомбиназа распознает определенный сайт минимум 34 п.о., который выдерживает только ограниченную вырожденность его последовательности распознавания (Jayaram, 1985; Senecoffet al., 1988). Исследовано взаимодействие между рекомбиназой Flp и последовательностью FRT (Panigrahi et al., 1992). Примеры вариантов последовательности FRT приведены Jayaram (1985) и Senecoff et al. (1988), и анализ на Flp-опосредованную рекомбинацию на различных субстратах описан Snaith et al. (1996).
Соответственно, способ согласно изобретению может дополнительно включать стадию, состоящую в супрессии первого селективного маркера из генома указанной первичной клетки. В целях супрессии первого селективного маркера клетку трансфицируют геном, кодирующим рекомбиназу, специфичную для последовательностей, дающих возможность супрессии первого селективного маркера. Способы и векторы, способные трансфицировать указанный ген в клетку, хорошо известны специалистам в данной област