Способ получения деиноксантина - каротиноида микроорганизма deinococcus radiodurans
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано для выделения каротиноидов, в частности деиноксантина, который применяется для разработки новых антиоксидантных и радиопротекторных препаратов для повышения адаптационных возможностей человека и животных, профилактики и лечения заболеваний. Способ предусматривает проведение экстракции каротиноидов из бактериальной массы Deinococcus radiodurans смесью ацетон: этанол (в соотношении 1:1). Разделение каратиноидов с выделением деиноксантина на препаративных колонках жидкостного хроматографа низкого давления, где в качестве сорбента используют гидроксиаппатит, а в качестве элюента - этанол. Изобретение позволяет повысить количество и качество выделяемого деиноксантина. 2 ил., 1 табл., 4 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области продуцируемых микробами каротиноидных соединений и направлено на выделение каротиноидов, в частности деиноксантина, который может применяется для разработки новых антиоксидантных и радиопротекторных препаратов для повышения адаптационных возможностей человека и животных, профилактики и лечения заболеваний, из микроорганизма Deinococcus radiodurans.
Уровень техники
Известен способ выделения кристаллического каротиноидного соединения из микробной каротиноидсодержащей биомассы (RU 2235783) (1), в котором производят разрушение микробных клеточных стенок в микробной каротиноидсодержащей биомассе, отделение клеточного дебриса в микробной каротиноидсодержащей биомассе от каротиноидсодержащего остатка, промывание каротиноидсодержащего остатка растворителем, подходящим для удаления липида, суспендирование полученного каротиноидсодержащего остатка в воде с целью флотирования каротиноидного соединения, выделение кристаллического каротиноидного соединения и дальнейшую очистку кристаллического каротиноидного соединения. Данный способ предназначен для выделения кристаллов каротина из микроорганизмов, содержащих каротиноиды внутри клеток в виде кристаллов, но непригоден для выделения каротиноидов, содержащихся в клетках в растворенном состоянии.
Непатогенный микроорганизм Deinococcus radiodurans известен устойчивостью к дозам радиации, в десятки раз превышающим летальные для изученных к настоящему времени микроорганизмов. Одной из характерных биохимических особенностей этого микроорганизма является синтез каротиноидов, в частности деиноксантина, придающего колониям характерную розово-оранжевую окраску. Это вещество обладает уникально высокой антиоксидантной активностью. Деиноксантин способен значительно эффективнее, чем β-каротин и α-токоферол, перехватывать синглетный кислород и гидроксильный радикал (наиболее опасные виды активных форм кислорода). Этот каротиноид представляет особый интерес с точки зрения разработки новых антиоксидантных и радиопротекторных препаратов для повышения адаптационных возможностей человека и животных, профилактики и лечения заболеваний. В целях получения препарата деиноксантина необходимо решить ряд задач. В первую очередь это разработка недорогих способов разделения каротиноидов Deinococcus radiodurans.
Впервые деиноксантин был выделен из ацетон-метанольных экстрактов микробактерий Deinococcus radiodurans (Lemee L, Peuchant E. and Clerc M. Deinoxanthin: A New Carotenoid Isolated from Deinococcus radiodurans // Tetrahedron. 1997. V.53. т.3. Р.919-9260) (2). Способ включает центрифугирование и экстракцию бактериальной массы Deinococcus radiodurans смесью ацетон-метанол, вакуумное выпаривание растворителя, реэкстракцию сухого остатка этилацетом с последующей промывкой этилацетной фазы водой и ее сушкой над сульфатом магния. Разделение первичного экстракта осуществляется с помощью флэш - хроматографии на силикагеле (жидкая фаза: ацетон - петролейный эфир - триэтиламин; 20:80:1). Полученные фракции проверяются методами тонкослойной хроматографии (ТСХ) и обращенно-фазовой (ВЭЖХ). Фракция, содержащая целевой компонент, далее разделяется с использованием полупрепаративной обращенно-фазовой хроматографии. Окончательную очистку препарата выполняют, применяя обычную полупрепаративную ВЭЖХ. Недостатками данного способа являются трудоемкость, длительность, многостадийность, что влечет за собой потери каротиноидов, необходимость приобретения сложного дорогостоящего оборудования, использование больших количеств дорогостоящих реактивов и, как следствие, неэкономичность.
Наиболее близким к предлагаемому изобретению является способ выделения деиноксантина (Лысенко B.C. и др. Разделение и масс-спектрометрическая идентификация каротиноидов радиорезистентных бактерий Deinococcus radiodurans. - журнал Масс-спектрометрия, 2010, т.7 №4, с.278-273) (3), принимаемый авторами настоящего изобретения в качестве прототипа, в котором суспензию микробактерий Deinococcus radiodurans экстрагируют гексаном, затем дополнительно экстрагируют ацетонитрилом, двухфазную смесь отстаивают, отбрасывают верхний гексановый слой, имеющий слабую желтую окраску, ацетонитрильную фазу упаривают в токе азота до получения сухого остатка, который реэкстрагируют безводным ацетоном. Пробы наносят на препаративные пластины для тонкослойной хроматографии, покрытые слоем силикагеля с 2% крахмала. В качестве подвижной жидкой фазы для тонкослойной хроматографии используют смесь петролейный эфир-хлороформ-метанол (3:1:1). После хроматографирования окрашенные участки сорбента отделяют от пластины, экстрагируют ацетонитрилом и анализируют на масс-спектрометре. Недостатком способа является токсичность растворителей, используемых при экстракции и разделении каротиноидов Deinococcus radiodurans, что влечет за собой нежелательные последствия при использовании деиноксантина как в качестве фармакологического препарата, так и в качестве красителя для пищевого производства. Для достижения желаемой чистоты требуются последующие дополнительные этапы очистки деиноксантина, что может приводить к потерям, а также значительно повысит себестоимость получения деиноксантина. С другой стороны, избавление от растворителей приводит к значительным потерям деиноксантина. Кроме того, тонкослойная хроматография, используемая в известном способе, не позволяет брать для разделения вещества в препаративных количествах. Типичные количества разделяемых веществ для тонкослойной хроматографии составляют 10-7-10-2 г, что недостаточно для его практического применения. При этом препаративные пластины для тонкослойной хроматографии одноразовые, что удорожает способ.
Раскрытие изобретения
Задачей изобретения является повышение качества и количества полученного деиноксантина, а также уменьшение его потерь в процессе выделения из биомассы микробактерий, за счет подбора менее токсичного растворителя, оптимального носителя и более производительного режима хроматографического разделения.
Техническим результатом изобретения является снижение себестоимости выделенного деиноксантина, повышение его качества и возможность получения в количестве, достаточном для практического применения.
Указанный технический результат достигается тем, что в известном способе получения деиноксантина - каротиноида микроорганизма Deinococcus radiodurans, включающем экстракцию каратиноидов из суспензии микробактерий Deinococcus radiodurans, разделение каротиноидов на сорбенте и элюирование с выделением деиноксантина, согласно изобретению, экстракцию проводят ацетон-этанолом, разделение каротиноидов производят на препаративных колонках жидкостного хроматографа низкого давления, где в качестве сорбента используют гидроксиаппатит, а в качестве элюента - этанол.
Использование в предлагаемом способе малотоксичных экстрагента и элюэнта повышает качество выделенного деиноксантина и уменьшает его потери в процессе получения.
Разделение каротиноидов на препаративных колонках жидкостного хроматографа низкого давления позволяет брать вещества в более значительных количествах, чем в прототипе, что значительно увеличит количество выделенного деиноксантина. (Типичные количества разделяемых веществ для жидкостной хроматографии низкого давления составляют 10-4-102 г). Кроме того, препаративные колонки многоразовые, что удешевляет способ.
Неизвестно использование ацетон-этанола и этанола в качестве растворителей для выделения деиноксантина из суспензии микробактерий Deinococcus radiodurans, и разделение каротиноидов с помощью препаративной жидкостной хроматографии низкого давления, где в качестве сорбента используется гидроксиаппатит, что является отличительными признаками предлагаемого способа.
Краткое описание чертежей
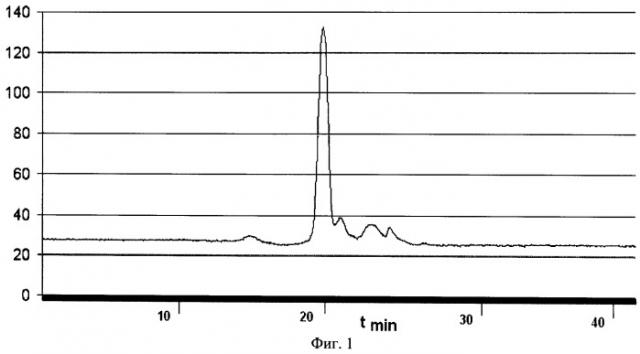
На фиг.1 приведен график хроматографического профиля каротиноидов Deinococcus radiodurans, полученных заявленным способом (носитель - гидроксиаппатит, элюэнт - этанол).
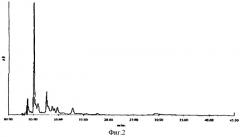
На фиг.2 приведен график хроматографического профиля каротиноидов Deinococcus radiodurans, полученных методом ВЭЖХ в экспериментах LeMee с соавт. (1997) (носитель - силикагель, элюэнт - ацетон - петролейный эфир - триэтиламин; 20:80:1).
Осуществление изобретения
Способ осуществляется следующим образом:
Эксперименты проводились на хроматографе низкого давления <Хроматографическая система BioLogic LP> фирмы <Bio-Rad>. Для получения бактериальной массы Deinococcus radiodurans с целью экстракции каротиноидов и их дальнейшего разделения был использован непатогенный штамм Deinococcus radiodurans ВКПМ В-8209, приобретенный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП <ГосНИИГенетика>. Выращивание культуры Deinococcus radiodurans ВКПМ 8209 проводили в 250-мл широкогорлых колбах Эрленмейера с 50 мл среды TGY следующего состава (г/л): триптон - 5,0; глюкоза - 1,0; дрожжевой экстракт - 3,0; вода дистиллированная - 1,0 л. Колбы с посевами инкубировали на круговой качалке при 30°С и 150 об/мин в течение 48 часов. Суспензию бактерий экстрагировали смесью ацетон-этанол (1:1) - 3-6 мл на 1 г сырой массы бактерий с выделением каротиноидов. Далее проводили разделение каротиноидов и элюирование с выделением деиноксантина на хроматографе низкого давления в препаративном варианте. В качестве сорбента использовали гидроксиаппатит, в качестве элюэнта - этанол 96%. Для выбора оптимальных и наименее токсичных растворителей был проведен ряд экспериментов. Оценку эффективности системы растворителей определяли по двум доминирующим пикам хроматограммы гексанового экстракта D. radiodurans как Rf1-Rf2, где Rf - индексы удерживания соответственно основного (преобладающего) и второго по амплитуде пика. Полученная зависимость от типа растворителя показана в табл.1.
Пример 1
Выделение деиноксантина из суспензии бактерий Deinococcus radiodurans проводили способом, описанным в прототипе. Суспензию бактерий центрифугировали 10 мин при 2000 g, осадок экстрагировали ацетоном - 10 мл на 1 г сырой массы бактерий. Экстракт смешивали с насыщенным раствором NaCl до концентрации ацетона 50 об. %, добавляли 2 мл гексана и интенсивно перемешивали. Отделившийся после отстаивания верхний гексановый слой извлекали из смеси и центрифугировали 10 мин при 3000 g. Дальнейшую обработку полученного гексанового экстракта осуществляли следующим образом. К 10 мл полученного гексанового экстракта добавляли 2 мл ацетонитрила. Полученную двухфазную смесь встряхивали, переносили в делительную воронку и оставляли на 30 мин для отстаивания. Нижний слой (ацетонитрил), окрашенный в интенсивно красный цвет, отделяли и использовали для дальнейшего анализа и очистки. Верхний гексановый слой, имеющий слабую желтую окраску, отбрасывали. Ацетонитрильную фазу, содержащую небольшую примесь воды, упаривали в токе азота до получения сухого остатка, который реэкстрагировали 50-100 мкл безводного ацетона. Пробу наносили на препаративные пластины покрытых слоем толщиной 0,5 мм силикагеля с 2% крахмала. В качестве подвижной жидкой фазы использовали смесь петролейный эфир-хлороформ-метанол (3:1:1). После хроматографирования и высушивания пластинки фотографировали. Полученные цифровые графические файлы в формате JPEG анализировали средствами программного пакета ImageJ. Изображение конвертировали в формат 8-bit BMP, инвертировали по яркости и выделяли интересующий участок изображения (полосу, соответствующую хроматограмме индивидуальной пробы). Получали хроматографический профиль и соответствующий файл численных данных (*.xsl). Затем осуществляли количественную оценку индивидуальных разделяемых компонентов по площади пиков хроматографического профиля, используя ранее полученный файл численных данных и программный пакет Origin 8.0. Данные приведены в табл.1.
Пример 2
Аналогично примеру 1 был проведен опыт, в котором экстракцию с выделением каротиноидов, разделение каротиноидов и оценку относительного выхода фракций проводили так же, как в примере 1. Использовали гексановый экстракт, в качестве носителя - силикагель с 2% крахмала, и другой элюэнт - ПЭ-хлороформ-этанол 3:1:1. Данные приведены в таблице 1.
Из таблицы 1 видно, что при носителе - силикагель с 2% крахмала, максимальная эффективность разделения была выявлена в примере 1, где в качестве растворителя была использована система ПЭ-хлороформ-метанол 3:1:1. Однако используемые в примере 1 растворители токсичны, что требует дополнительных этапов очистки для достижения желаемой чистоты деиноксантина. Это неэкономично, т.к. требует дополнительных затрат. Кроме того, неизбежны потери деиноксантина.
Пример 3
Аналогично примеру 1 был проведен опыт с недорогим и нетоксичным растворителем - 96% этанолом. Использовали гексановый экстракт. В качестве носителя был использован силикагель с 2% крахмала. Экстракцию с выделением каратиноидов, разделение каратиноидов и оценку относительного выхода фракций проводили так же, как в примере 1. Полученные данные приведены в таблице 1. Результаты опыта показали, что разделения каротиноидов D. radiodurans не произошло. На пластине все каротиноиды D. radiodurans регистрируются в виде одного окрашенного пятна. Следовательно, деиноксантин не был выделен. Т.е., на силикагеле при использовании этанола в качестве элюента разделение экстракта и выделение деиноксантина не происходит.
Пример 4
Были проведены исследования, в котором использовали малотоксичный экстрагент - ацетон-этанол (1:1) и элюент - этанол 96%, в качестве сорбента - гидроксиаппатит. Суспензию бактерий центрифугировали 10 мин при 2000 g, осадок экстрагировали смесью ацетон-этанол (1:1) - 3-6 мл на 1 г сырой массы бактерий. Экстракт центрифугировали 10 мин при 3000 g. Далее проводили колоночную хроматографию на хроматографе низкого давления <Biologic LP> фирмы <Bio-Rad>. Условия хроматографического разделения: колонка - диаметр 2 см, длина 3 см, поток элюента - 0,7 мл/мин (0,2-0,3 мл/мин на 1 см2). Нанесение экстракта бактериальной массы Deinococcus radiodurans на колонку такого размера составляет - 3-5 мл. Хроматография осуществлялась в препаративном варианте. Для хроматографии в качестве сорбента использовали гидроксиаппатит, в качестве элюента - этанол 96%.
Далее методом тонкослойной хроматографии (ТСХ) в препаративном варианте анализировали хроматограмму выделенных каротиноидов. Результаты анализа показали, что каротиноиды Deinococcus radiodurans разделились в процессе хроматографии на две фракции - в первой выходит преимущественно деиноксантин, во второй - остальные каротиноиды и продукты распада деиноксантина. В первой фракции на пластине регистрируется одно основное пятно, соответствующее деиноксантину, и небольшое количество окрашенных минорных компонентов; во второй фракции - множество окрашенных пятен, содержащих другие каротиноиды, липиды и продукты их распада. Полученные данные приведены в таблице 1.
| Таблица 1 | ||||
| Эффективность разделения каротиноидов D.radiodurans в различных растворителях и носителях. | ||||
| №/№ | Носитель | Растворитель | Эффективность разделения | Rf доминирующего компонента |
| 1 | силикагель с 2% крахмала | ПЭ-хлороформ-метанол 3:1:1 | 0,15 | 0,36 |
| 2 | силикагель с 2% крахмала | ПЭ-хлороформ-этанол 3:1:1 | 0,07 | 0,27 |
| 3 | силикагель с 2% крахмала | Этанол | 0 | 0,18 |
| 4 | гидроксиаппатит | Этанол | 0,14 | 0,13 |
| 1 - В препаративном варианте |
Из таблицы 1 видно, что при носителе - гидроксиаппатите, эффективность разделения приблизительно такая же, как и в системе ПЭ-хлороформ-метанол 3:1:1. Однако в примере 4 для экстракции суспензии бактерий использовали малотоксичный эстрагент - ацетон-этанол (1:1), и далее для разделения выделенных каротиноидов - растворитель - этанол 96%. Выделенный таким способом деиноксантин не требует дополнительной очистки от токсичных веществ, что уменьшает потери его, а также удешевляет способ его получения.
После разделения каротиноидов колонку регенерировали следующим образом: промывка - 3-5 объемов деионизированной воды, регенерация - 5-7 объемов 500 mМ натрий-фосфатного буфера, снова 3-5 объемов деионизированной воды, затем колонка уравновешивалась 96% этанолом.
Хроматограмма каротиноидов на ТСХ-пластинах примера 4 после разделения на гидроксиаппатите (фиг.1) в основном совпадала с хроматограммой, полученной методом ВЭЖХ в экспериментах LeMee (фиг.2).
Однако предлагаемый способ позволяет более простым и дешевым способом выделить деиноксантин из Deinococcus radiodurans.
Связано это с тем, что в колоночной хроматографии на гидроксиаппатите используется дешевый малотоксичный растворитель (этанол), который позволяет применять выделенный препарат деиноксантина без дальнейшей очистки, что является экономически более эффективным.
Разделение каротиноидов проводят на препаративных колонках, размеры которых можно в значительной степени варьировать. Соответственно будет меняется и площадь сечения сорбента, и количество пропускаемого через колонку вещества, что позволит значительно увеличить количество выделяемого деиноксантина. Препаративные колонки после каждого использования регенерируются для дальнейшего их использования.
Разработанный способ выделения деиноксантина позволяет обеспечить, по сравнению с известными способами, экономически более эффективную наработку препаративных количеств деиноксантина без применения токсичных органических растворителей в достаточных количествах для проведения дальнейших фармакологических исследований и практического его применения.
Источники информации
1. Патент РФ №2235783, МПК 7 С12Р 23/00, С12N 1/14, С07С 403/24.
2. Lemee L, Peuchant E. and Clerc M. Deinoxanthin: A New Carotenoid Isolated from Deinococcus radiodurans // Tetrahedron. 1997. V.53. №3. P.919-9260.
3. Лысенко B.C. и др. Разделение и масс-спектрометрическая идентификация каротиноидов радиорезистентных бактерий Deinococcus radiodurans. - журнал Масс-спектрометрия, 2010, т.7. №4, с.278-273 (прототип).
Способ получения деиноксантина - каротиноида микроорганизма Deinococcus radiodurans, включающий экстракцию каротиноидов из бактериальной массы Deinococcus radiodurans, разделение каротиноидов на сорбенте и элюирование с выделением деиноксантина, отличающийся тем, что экстракцию каротиноидов проводят смесью ацетон-этанол (1:1), разделение каротиноидов проводят на препаративных колонках жидкостного хроматографа низкого давления, в котором в качестве сорбента используют гидроксиаппатит, а в качестве элюента - этанол.